трабекулярный отек костного мозга большеберцовой кости
Трабекулярный отек
Трабекулярный отек – это острый, патологически сложный процесс, характеризующийся изменением структуры костной ткани (трабекул костного мозга), возникающий при сильном воспалении, переломе, вывихе и травмах костей любого отдела скелета. Проще говоря, это разрушение костной ткани суставов. Такое явление может, например, проявляться при артрите и остеопорозе колена, а также диспластических процессах в позвоночном отделе скелета.
Зачастую отечность локализуется в тазобедренной кости, коленном суставе (большеберцовая или бедренная кости), позвоночнике (спинной мозг) и других костях (череп, шейный отдел). Сегодня существует система по лечению отеков любой сложности и чтобы снизить риск осложнений необходимо пройти обследование, в том числе МРТ и МКТ костной ткани.
Причины
Трабекулярный отек возникает чаще у лиц, склонных к постоянному травматизму, например, спортсмены, те, кто ведет активный образ жизни, а также людей пожилого возраста, у которых отек выражается после получения травмы или при хронической патологии суставов.
Врачи выделяют такие факторы развития заболевания:
Остановка движения и скапливание костной жидкости в трабекулах может говорить об ушибе или растяжении, например, связок или позвонков. Его можно наблюдать у пациентов с артритом колена и остеохондрозом позвоночника. В связи с этим лишняя жидкость внутри костного мозга приводит к нарушению кроветворных процессов
Трабекулярный отек происходит чаще всего при патологиях, которые локализуются в самом центре поражения костного мозга или вблизи него. Это заболевание развивается из-за нарушения состава и целостности хряща (сухожилий, связок).
Костный мозг колена
Повреждения и травмы колена чаще всего случаются у спортивных и активных людей, а также лиц пожилого возраста вследствие спортивных травм, нагрузок, неудачных приземления с высоты. Последствия такого рода повреждений чаще поверхностные (переломы, ушибы, вывихи), но нередко травма коленного сустава может быть с внутрикостным разрушением (костного мозга).
Симптомы трабекулярного отека коленного сустава: постоянная ноющая боль внутри кости, либо синдром «чешущейся» кости, опухание в области повреждения, боль при пальпации воспаленного участка.
Последствия длительного отека:
Терапия отека колена включает как медикаментозное, так и оперативное лечение, в зависимости от степени проявления симптомов повреждения костной ткани.
Спинной мозг
Отек спинного отдела может возникнуть вследствие новых или застарелых травм и заболеваний позвоночника, опухолей, нарушений кровообращения. Подразделяют локальный и общий отек. Первый наблюдается, например, при точечной травме или вывихе позвоночника или позвонков, поэтому возникает опухоль (или покраснение) только в том месте, где произошло повреждение.
Общий отек спинного мозга возникает у пациентов с тяжелыми формами заболеваний (остеохондроз, спондилез, дисплатические процессы), а также бытовых травм (падение с высоты, поднятие тяжестей, ДТП), при которых чаще возникает отек всего спинного отдела.
Поражение костного мозга позвоночника может проявляться по-разному, в зависимости от поврежденного участка: шейный отдел – нарушаются функции рук и ног, грудной отдел – туловище и нижние конечности, поясничный – нарушение функций нижней части туловища.
Симптомы:
Лечение
Основным методом лечения отека является медикаментозная терапия, но иногда требуется хирургическое вмешательство, когда необходимо устранить опухолевые процессы и даже дисплазии.
Медикаментозное (консервативное) лечение в первую очередь необходимо для уменьшения болевого синдрома, нормализации кровообращения и метаболических процессов, восстановления структуры костной ткани. Также по назначению врача требуется прохождение процедур лечебной физкультуры. Средний срок восстановления при таком лечении занимает от 6 до 12 месяцев. 
Хирургическое лечение назначается только опытным специалистом и после прохождения полного обследования, когда консервативное лечение не дало результата.
Методы хирургического лечения:
Сроки восстановления после операций варьируются от полугода до нескольких лет, но эффективность оперативного метода больше, чем консервативного.
Отек костного мозга из простой опухоли может перерасти в хроническое состояние, поэтому ранняя диагностика и лечение позволит пациенту избежать серьёзных заболеваний и даже инвалидности. Нежелательно откладывать лечение данной патологии, чтобы не лишать себя полноценной жизни.
Артроскопия (видео)
Трабекулярный отек костного мозга большеберцовой кости
ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия
ФГБУ «Центральный научно-исследовательский институт травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия
Постартроскопический остеонекроз мыщелков бедренной и большеберцовой костей
Журнал: Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4): 113-118
Торгашин А. Н., Родионова С. С. Постартроскопический остеонекроз мыщелков бедренной и большеберцовой костей. Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4):113-118.
Torgashin A N, Rodionova S S. Postarthroscopic osteonecrosis of femoral and tibial condyles. N.N. Priorov Journal of Traumatology and Orthopedics. 2018;(4):113-118.
https://doi.org/10.17116/vto201803-041113
ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия
Остеонекроз мыщелков бедренной и большеберцовой костей — серьезное заболевание, приводящее к тяжелой форме артроза/артрита и требующее эндопротезирования сустава. Постартроскопический остеонекроз является довольно редким осложнением артроскопического вмешательства на коленном суставе по поводу разрыва мениска. Ввиду редкости этого осложнения пациенты и хирурги часто оказываются не готовы к его развитию. В обзоре рассмотрены типичные случаи развития асептического остеонекроза мыщелков бедренной и большеберцовой костей после проведенной артроскопии, определены возможные факторы риска, описаны особенности диагностики и тактики лечения.
ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия
ФГБУ «Центральный научно-исследовательский институт травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия
Введение. Остеонекроз — тяжелое полиэтиологическое заболевание, связанное с гибелью остеоцитов в определенном участке костной ткани и быстро приводящее к развитию вторичного артроза/артрита прилежащего сустава.
Мыщелки бедренной и большеберцовой костей являются второй по распространенности локализацией асептического некроза после головки бедренной кости [1]. Чаще поражаются мыщелки бедренной кости (впервые описано S. Ahlbäck и соавт. в 1968 г.) [2], реже — плато большеберцовой кости (описано G. d’Angelijan и соавт. в 1976 г.) [3].
Выделяют спонтанный (первичный, идиопатический) остеонекроз мыщелков бедренной и большеберцовой костей, выявляемый преимущественно у женщин старше 65 лет, и вторичный, характерный для более молодых пациентов, который развивается на фоне приема глюкокортикоидов, злоупотребления алкоголем, лучевой терапии, аутоиммунных заболеваний и коагулопатий. По некоторым данным [4], распространенность спонтанного остеонекроза составляет 3,4% у пациентов старше 50 лет и 9,4% у пациентов старше 65 лет. Несколько реже встречается вторичная форма, характеризующаяся двусторонним поражением костей суставов и образованием множественных очагов.
В настоящее время в отдельную нозологическую форму выделяют такое, казалось бы, «неожиданное» осложнение хирургического вмешательства на коленном суставе, как постартроскопический остеонекроз. Как правило, это осложнение развивается после частичного удаления мениска, а также после пластики передней крестообразной связки [5, 6].
Многие травматологи, занимающиеся артроскопией, не учитывают возможность возникновения этой патологии, пока не столкнутся с ней в клинической практике.
В настоящей статье рассмотрены типичные случаи развития асептического некроза мыщелков бедренной и большеберцовой костей после проведенной артроскопии с определением возможных факторов риска, особенностей диагностики и тактики лечения.
Постартроскопический некроз мыщелков бедренной и большеберцовой костей
На остеонекроз мыщелков бедренной и большеберцовой костей после артроскопической операции впервые обратили внимание S. Brahme и соавт. в 1991 г. [7]. Позже в литературе патологию описывали как «постартроскопический остеонекроз» [8], «постменискэктомический остеонекроз» [9, 10] и «остеонекроз в прооперированном коленном суставе» [11].
С учетом большого количества проводимых артроскопических вмешательств во всем мире создается впечатление, что остеонекроз в послеоперационном периоде встречается довольно редко. Однако его частота, по всей видимости, занижена, поскольку проблема недостаточно известна оперирующим хирургам и, как следствие, выявление таких пациентов ограничено. Так, N. Santori и соавт. [12] указали, что по результатам более чем 2000 артроскопий, проведенных в больнице в течение 10 лет, было зарегистрировано всего 2 (0,1%) случая остеонекроза, которые были выявлены на ранней стадии. Однако исследователи подчеркнули, что могли быть и незарегистрированные случаи. V. Pruès-Latour и соавт. [13] сообщили уже о 9 (1,5%) случаях после 585 артроскопических менискэктомий у пациентов старше 50 лет.
В одном из самых крупных исследований, посвященных этой проблеме, был проведен анализ 47 случаев постартроскопического остеонекроза [11], который показал, что встречаемость этого осложнения одинакова у мужчин и женщин, средний возраст которых составил 58 лет. В то же время спонтанным остеонекрозом, возникающим без оперативного вмешательства, с которым проводилось сравнение, чаще страдают женщины в возрасте старше 65 лет. Авторами было отмечено, что из 47 пациентов у 41 (87%) имелось повреждение медиального мениска и у 6 (13%) — латерального. При этом медиальный мыщелок бедра был поражен в 39 (83%) случаях, латеральный — в 4 (8,5%), латеральный мыщелок большеберцовой кости — в 2 (4,3%), медиальный — также в 2 (4,3%) случаях. Несмотря на то что частота остеонекроза мыщелков большеберцовой кости была значительно меньше, чем бедренной, прогноз в таких случаях считается менее благоприятным [14, 15]. Практически всегда асептический некроз развивается непосредственно в том отделе сустава, в котором проводилось оперативное вмешательство, что может свидетельствовать о ятрогенном характере патологии. Многие авторы связывают его развитие с агрессивной техникой операции и непреднамеренным контактом артроскопического инструмента с поверхностью хряща и субхондральной костью [16].
Однако так бывает не всегда, и постартроскопический остеонекроз, особенно плато большеберцовой кости, повредить которое во время операции практически невозможно, требует исключения и других причин [13].
Все чаще обсуждается [17] роль изменения биомеханики сустава из-за повышения нагрузки на субхондральную кость в раннем послеоперационном периоде. Высказываются предположения, что это приводит к травматизации хряща, появлению микропереломов, проникновению синовиальной жидкости в субхондральную зону с дальнейшим развитием остеонекроза. При наличии дефектов хряща еще до операции процесс усугубляется попаданием жидкости в субхондральную область во время операции из-за повышения внутрисуставного давления [18].
Имеется точка зрения [19], что развитие отека мыщелков в послеоперационном периоде следует рассматривать не как истинный остеонекроз, а лишь как транзиторное состояние, связанное с переломом трабекул субхондральной кости. Однако, по современным представлениям, именно перелом субхондральной кости [20] считается основным фактором риска развития остеонекроза мыщелков бедренной и большеберцовой костей у пациентов на фоне общего снижения минеральной плотности костной ткани вне зависимости от наличия оперативного вмешательства в анамнезе.
В этом плане показательно исследование H. Higuchi и соавт. [21], в котором после артроскопии у 29 (21,3%) из 136 пациентов отмечался отек костной ткани, выявленный с помощью МРТ. Всем 29 пациентам было проведено консервативное лечение, которое у 6 оказалось неэффективным: ухудшалась клиническая и рентгенологическая картина, что потребовало тотального эндопротезирования сустава. У 4 из них была диагностирована II стадия асептического некроза по классификации Koshino, у 2 — III стадия. При гистологическом исследовании материала пациентов со II стадией заболевания были выявлены признаки микропереломов кости субхондральной области, тогда как у пациентов с III стадией — картина остеонекроза. Эти данные подтверждают мнение о том, что микропереломы субхондральной кости являются предшествующим этапом развития остеонекроза.
При этом известно, что у пациентов старше 60 лет разрыв мениска уже сам по себе может стать причиной развития остеонекроза даже без наличия в анамнезе артроскопического вмешательства [22]. Так, по данным исследования [23], встречаемость повреждения или дегенеративного изменения мениска у пациентов со спонтанным остеонекрозом мыщелков бедренной и большеберцовой костей (без хирургического вмешательства) может варьировать от 50 до 91%.
Обсуждается связь развития остеонекроза с применением во время операции различных инструментов и аппаратов. Например, не доказана связь развития остеонекроза с использованием ирригационной помпы или жгута [8, 9, 22].
Неоднозначно расценивают роль радиочастотной абляции в возникновении послеоперационных изменений, хотя ее негативное воздействие, обусловленное тепловым эффектом, изучается на протяжении многих лет [24–27], в том числе есть указания на значительную гибель хондроцитов, особенно в области прямого действия аблятора [28]. О сомнительности этой гипотезы свидетельствуют данные о снижении числа пациентов с остеонекрозом в послеоперационном периоде после частичной хондропластики с помощью радиочастотного аблятора [29]. Более того, предложено использовать радиочастотную абляцию для обработки хондромаляции суставного хряща II и III стадии [30, 31], что по сравнению с механической обработкой приводит к меньшей гибели хондроцитов [32], сокращению времени операции [33, 34] и создает более гладкую поверхность в отличие от шейвера, после которого остается неровная поверхность контакта и теряется толщина хряща от 300 до 800 мкм [35]. Кроме того, при использовании радиочастотной абляции пациенты реже испытывали боль в послеоперационном периоде [35].
В то же время замечена разница между результатами использования биполярной и монополярной радиочастотных систем [36]. По мнению автора, более агрессивное воздействие оказывали биполярные абляторы, которые проникают на значительную глубину, составлявшую от 78 до 92% толщины хряща.
Таким образом, взгляды ученых на характер влияния радиочастотного аблятора на гиалиновый хрящ и подлежащую субхондральную кость расходятся, однако большинство исследователей не находят прямой связи его применения с развитием остеонекроза мыщелков бедренной и большеберцовой костей [25].
Лечение
Прогноз постартроскопического остеонекроза считается неблагоприятным. Так, в исследовании [11], из 47 пациентов с подтвержденным диагнозом «остеонекроз» у 44 (93,6%) прооперированных длительно сохранялись изменения на МРТ или же наблюдалось прогрессирование заболевания вплоть до коллапса субхондральной кости. Потребовалось дальнейшее оперативное лечение 17 (36%) пациентам: тотальное эндопротезирование было выполнено в 9 случаях, корригирующая остеотомия большеберцовой кости — в 2 и повторная артроскопия — в 6.
В отличие от спонтанного остеонекроза мыщелков, где размер поражения может считаться прогностическим фактором [37–39], при постартроскопическом остеонекрозе не было отмечено корреляции прогрессирования заболевания с размером изначального поражения [11], даже относительно небольшие изменения в костной ткани после операции могут стать причиной развития и прогрессирования остеонекроза.
Тактика лечения пациентов с постартроскопическим остеонекрозом во многом совпадает с ведением пациентов со спонтанным остеонекрозом мыщелков бедренной и большеберцовой костей, возникшим без оперативного вмешательства, однако прогноз в первом случае менее благоприятный. Считается, что консервативное лечение предпочтительнее, нежели выполнение повторного оперативного вмешательства, после которого не исключено прогрессирование заболевания [11]. Начинать следует с разгрузки сустава не менее чем на 3 мес с использованием костылей или ортезов с жесткой боковой фиксацией [40].
Целесообразным, как было показано ранее [41], считается ношение функционального вальгизирующего (при поражении внутренних мыщелков) или варизирующего (при поражении наружных мыщелков) ортеза. В большинстве случаев уже этого достаточно для снижения выраженности болевого синдрома. Однако при сохранении боли рекомендуется дополнительное применение нестероидных противовоспалительных препаратов [40].
Патогенетическим лечением остеонекроза, направленным на сохранение костной ткани в области мыщелков и снижение локальной костной резорбции, является остеотропная терапия. Она включает «базовую» терапию из кальцийсодержащих препаратов с активными метаболитами витамина D [42] в комбинации с антирезорбтивными препаратами. При подборе дозировок опираются на исходные значения показателей гомеостаза кальция (см. таблицу). 
В качестве антирезорбтивных препаратов наиболее часто используются бисфосфонаты [43, 44]. Их эффективность доказана при лечении асептического некроза как головки бедра [45], так и мыщелков бедренной и большеберцовой костей [42].
Наибольшее распространение получили внутривенные формы азотсодержащих бисфосфонатов, например золедроновая кислота. Аккумулируясь в костной ткани, она способствует снижению костной резорбции и препятствует потере минеральной плотности [46]. Учитывая однократное внутривенное капельное введение препарата в дозе 5 мг, имеет 100% комплаентность.
Значимость физиотерапии или применения других медикаментозных средств (вазодилататоры, статины, антикоагулянты) как монотерапии не доказана, хотя их используют в комплексной терапии совместно с патогенетическим лечением [47, 48]. Как показывают исследования [43, 49], применение подобной комбинации остеотропных, сосудистых препаратов и физиотерапии довольно эффективно и может достигать 89% при лечении ранних стадий спонтанного асептического некроза мыщелков бедренной и большеберцовой костей, однако ее эффективность при постартроскопическом остеонекрозе требует дальнейшего изучения.
Дополнение консервативного лечения хирургическим вмешательством в связи с сохранением болевого синдрома или прогрессированием заболевания рекомендуется не ранее чем через 3 мес после начала лечения и только в случае отсутствия значимого эффекта [37]. Целью операции является отсрочка тотального эндопротезирования, особенно у пациентов молодого возраста [50], поэтому предпочтение следует отдавать сохраняющим сустав операциям.
Артроскопическая санация сустава как при спонтанном, так и при постартроскопическом остеонекрозе малоэффективна, поскольку основные изменения затрагивают субхондральную кость. В связи с этим ее выполнение возможно лишь в случае образования свободных внутрисуставных тел.
Более привлекательной считается антеградная декомпрессия очага остеонекроза под контролем электронно-оптического преобразователя. Эта процедура особенно эффективна при сохраненном гиалиновом хряще над поверхностью очага остеонекроза, т. е. при I–II стадии по классификации Koshino [51].
Реваскуляризирующая декомпрессионная остеоперфорация достаточно широко стала применяться с 1989 г. [52]. Однако эффективность методики в качестве монотерапии исследователями оценивается неоднозначно. В связи с этим для улучшения результата лечения рекомендуется сочетание операции с введением аутогенной или аллогенной костной ткани, костнопластических материалов, концентрированного аспирата костного мозга или выделенных из него полипотентных колониеобразующих клеток [53–55].
В случае поражения одного из мыщелков бедренной кости и сохранения суставной поверхности другого хороший результат и отсрочку эндопротезирования может дать использование высокой корригирующей остеотомии большеберцовой кости с изменением механической оси и перераспределением нагрузки на здоровый отдел сустава [56].
При коллапсе субхондральной кости корригирующую остеотомию совмещают с мозаичной остеохондропластикой [57], что позволяет надеяться на восстановление хрящевого покрытия мыщелка и более длительный клинический эффект [50, 58]. Однако перед операцией для снижения вероятности рассасывания костно-хрящевых столбиков важно добиться уменьшения отека костной ткани пораженного мыщелка как одного из признаков активности резорбции.
В случае неэффективности консервативных методик и суставосохраняющих операций принимается решение об эндопротезировании коленного сустава. В зависимости от индивидуальных особенностей самого пациента и сохранности второго мыщелка бедренной и большеберцовой костей выбор делают между одномыщелковым и тотальным эндопротезированием.
Заключение. Постартроскопический остеонекроз мыщелков бедренной и большеберцовой костей — редкая форма остеонекроза, которая часто бывает неожиданным осложнением как для пациента, так и для оперирующего хирурга. Знания о возможном возникновении и тактике лечения подобных состояний важны всем ортопедам-травматологам, выполняющим артроскопические операции.
И хотя в случае постартроскопического остеонекроза не исключается ятрогенный фактор, большинство авторов склонны считать, что, как и при возникновении спонтанного остеонекроза, — это непредсказуемый процесс и необходимо ориентироваться лишь на предрасполагающие факторы [10, 13, 59]. Это могут быть нарушение метаболизма костной ткани в дооперационном периоде, наличие остеопороза в анамнезе, возраст старше 50 лет, имеющееся до операции повреждение хряща. Не исключено, что более тщательное предоперационное обследование пациентов (особенно старше 50 лет) с оценкой качества костной ткани (рентгеновская денситометрия) и костного ремоделирования (анализы на маркеры костной резорбции и костеобразования) поможет в прогнозировании развития последующего остеонекроза, а своевременная коррекция костного метаболизма снизит риск его развития. Однако этот вопрос требует дальнейшего изучения.
По мнению ряда авторов, возрастные пациенты с повреждением мениска должны быть предупреждены о возможности такого осложнения после операции [8]. А в случае сохранения болевого синдрома через 2–3 мес после артроскопической менискэктомии следует выполнить МРТ для исключения постартроскопического остеонекроза [10]. При выявлении отека костной ткани мыщелков, который, по данным D. Muscolo и соавт. [22], встречается у 34% пациентов, следует назначить консервативное лечение, несмотря на то, что, по заявлению V. Pruès-Latour [13], отек может бесследно исчезать без какого-либо лечения. На практике же отличить отек костной ткани (по данным МРТ) и начальную стадию асептического некроза практически невозможно, а поздно начатое лечение может стать причиной прогрессирования заболевания и необходимости тотального эндопротезирования.
Симптомы и лечение отеков бедренной и большеберцовой кости
Человеческий организм представляет собой единое целое, не существует органов и систем, которые функционировали бы отдельно друг от друга. Особенно тесная взаимосвязь становится очевидной после перенесенных травм и болезней.
Общие нарушения либо локальные повреждения у людей выражаются определенными признаками, одним из первых является отек. Нельзя считать его отдельным заболеванием: он является симптомом, сопровождающим другие болезни и образующимся за счет избыточного скопления жидкости в органах и межклеточном пространстве.
Костный мозг (КМ) занимает важное место в кроветворной и иммунной системе человека. Располагается внутри трубчатых костей, грудине, ребрах, позвонках, в тканях таза и черепа. Любые его отклонения от нормальной работы сказываются на общем состоянии.
Отек КМ характеризуется увеличением жидкости в ткани, развивается как ответная реакция на травму, инфекцию и нарушение кровообращения.
Причины

Факторы, способствующие образованию отека:
Клиническая картина
Следует знать, что отек не всегда сопровождается болью и дисфункцией поврежденной части тела.
При длительных структурных изменениях наблюдается припухлость и умеренные болевые ощущения.
Диагностика
Объективными и необходимыми методами обследования больных считают МРТ (магнитно-резонансная томография) и КТ (компьютерная томография).
МРТ ─ применение магнитных полей и радиоволн дает возможность получить качественное изображение, во время процедуры пациент не подвергается радиоактивному облучению, поэтому данное обследованием является безопасным для человеческого организма.
КТ ─ предполагает многослойное применение рентгеновских лучей, на получаемом снимке можно рассмотреть обследуемую область со всех сторон с особой точностью – до миллиметра.
Артроскопия ─ минимальный инвазивный способ, назначается при дегенеративных процессах в суставах. Через небольшие разрезы вводится артроскоп, позволяющий хирургу на экране увидеть всю структуру отделов поврежденного сустава.
Пункция сустава (артродез) ─ метод используется в медицине с диагностической целью и лечебным назначением. С помощью прокола берут на исследование суставную жидкость, выявляя возбудителя инфекционного процесса.
При переломах конечностей показана рентгенография, также для уточнения диагноза рекомендуют сдать биохимический анализ мочи на СТХ-II (фрагменты коллагена II типа, основные составляющие хрящевой ткани), общие лабораторные анализы крови и мочи.
Перечисленные методы обследования назначаются исключительно врачом, учитывается состояние больного, т.к. некоторые виды диагностики имеют противопоказания.
Виды отеков
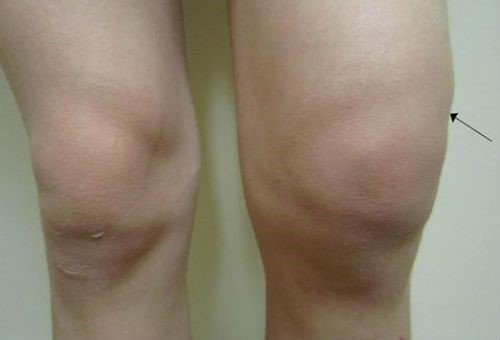
При классификации обращают внимание на причины возникновения, особенности патогенеза и течение болезни.
По причинам появления выделяют отеки:
По происхождению различают отеки:
В зависимости от течения заболевания разделяют на следующие разновидности:
Трабекулярный отек костного мозга
Трабекулы представлены содержанием тяжей, пластин и перегородок, формируются из соединительной ткани, включая коллагеновое вещество, служат укрепляющей основой скелета.
Трабекулярный отек коленного сустава провоцирует артроз или артрит, поэтому для снятия воспаления и выведения застойной жидкости нужно непосредственно лечить заболевание.
Субхондральный отек
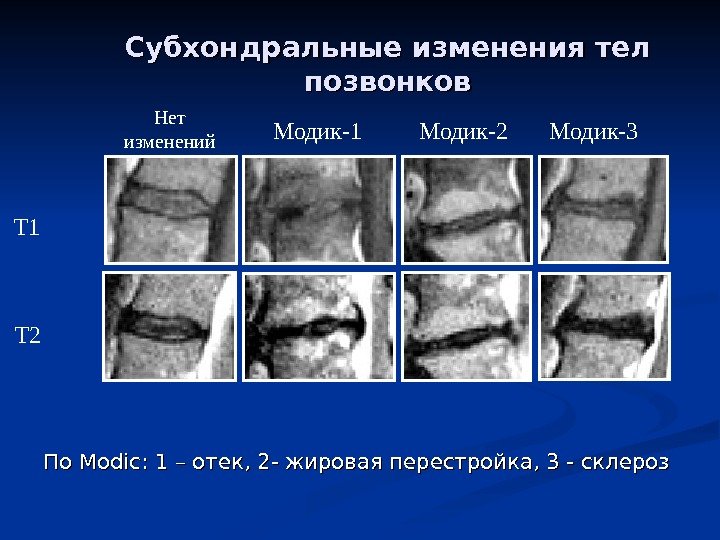
Образуется в результате повреждений хрящевой ткани – хрупкой составляющей костного скелета. Ее нарушения приносят непоправимый вред человеческому здоровью. Динамика заболевания характеризуется быстрым течением: всего за 3 месяцев происходит разрушение хряща, поэтому важно не затягивать лечение. Обследование заключается в МРТ и анализе мочи на СТХ-II.
Асептический отек
Начинается в области тазобедренного сустава, уже при первом осмотре доктор определяет патологические изменения.
Наблюдается покраснение, припухлость, повышенная температура тела, боль, возможно дисфункция конечности. Эффективное лечение предполагает благоприятный исход заболевания.
Реактивный отек
Возникает после хирургического вмешательства, сопровождается болевым синдромом. Для устранения отека к реабилитационному периоду подключают умеренные нагрузки в виде чередуемых физических упражнений и физпроцедур.
Отек КМ большеберцовой кости
Нарушения наблюдаются в области медиальных мыщелок бедренной и большеберцовой кости. Внешние симптомы аналогичны остеосклерозу, повреждения в суставной щели могут не проявляться.
Контузионный отек
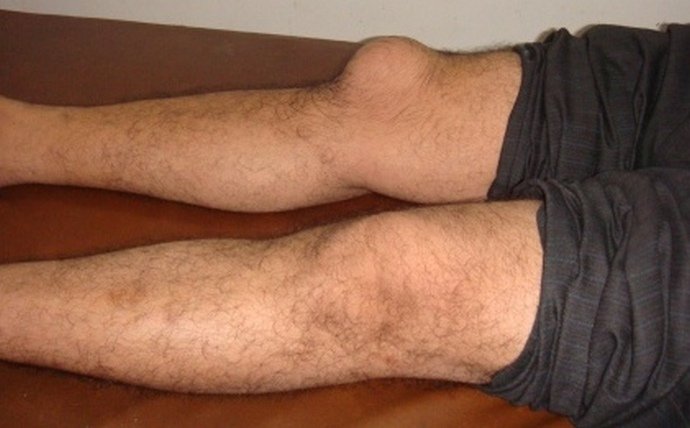
Патологический процесс возникает в колене после травм, сопровождающихся разрывом передней крестообразной связки. При постановке диагноза врач учитывает внешние симптомы и данные МРТ, в некоторых ситуациях требуется артроскопическая аутопластика.
Перифокальный отек
В результате скопления жидкости, образующейся из-за повреждения нервных клеток, происходит увеличение межклеточного пространства. Отек возникает в зоне поражения размером до 1 см.
КМ колена
К развитию дегенеративных изменений рассматриваемого сустава приводят чрезмерные физические нагрузки, чаще страдают таким недугом люди, ведущие активный образ жизни. При неудачном приземлении всерьез не воспринимается полученная травма, но довольно часто случаются повреждения с разрушением надколенника, вследствие чего возникает отек костного мозга коленного сустава.
При трабекулярном отеке колена ощущается боль, наблюдается припухлость. Если отек сохраняется продолжительное время, у больного снижается длина бедра и берцовой кости, происходит уменьшение хрящевой ткани, на фоне этого возникает хромота.
Лечение отека костного мозга коленного сустава представляет комплексную терапию, включающую глюкокортикоидные, кровоостанавливающие препараты.
Отек костного мозга бедренной кости

Возникает при остеомиелите, присоединяется гнойный процесс, который затрагивает рассматриваемую часть опорно-двигательного аппарата и мозг. Диагноз устанавливают с помощью МРТ. Лечить комплексной терапией.
Отек развивается от полученных открытых травм, когда возбудитель попадает в рану. Гематогенным путем инфекция заносится из внутренних гнойных очагов воспаления, провоцируя заболевание остеомиелит.
Течение начинается остро: повышается температура тела, появляется боль без конкретной локализации, движения становятся ограниченными, происходит самопроизвольный поворот конечности вовнутрь. Образуются флегмоны с дальнейшим отмиранием костной ткани, к 3-4 недели на снимках видны ограниченные омертвевшие участки, которые впоследствии требуют хирургического удаления.
Отек костного мозга медиального мыщелка большеберцовой кости
Возникает от повреждения целостности кости. Ощущается сильная боль ниже колена, визуально отмечается отечность мягких тканей, присутствует чувство давления в кости, невозможно при ходьбе становиться на ногу.
Отек костного мозга большеберцовой кости коленного сустава часто является симптомом ушиба мозга и синовиального воспаления колена, подобные травмы случаются при неосторожных движениях, болевые ощущения могут отсутствовать.
Терапия

Лечение заключается в снижении болевого синдрома, предотвращении разрушения КМ, восстановлении функций поврежденного участка и нормализации кровообращения.
Терапевтические мероприятия должны иметь комплексный подход и включать лекарственные препараты разного действия:
Реабилитационный период до полного выздоровления длится несколько месяцев. Важно соблюдать все предписания врача, чтобы избежать серьезных осложнений, имеющих необратимый характер.
