нобелевская премия по химии 2020 за что
Черные дыры и гепатит: за что дали Нобелевские премии в 2020 году
Лауреатами Нобелевской премии по медицине стали американцы Харви Олтер и Чарльз Райс и англичанин Майкл Хаутон за открытие вируса гепатита С. Первым новый вид гепатита описал Олтер в 1989 году. Хаутон в 1989 и 1990 годах выпустил статьи о выявлении антител к вирусу, а в 2013 году вместе с коллегами представил вакцину против вирусов гепатита. Райс подтвердил, что выделенный Олтером и Хаутоном вирус действительно является гепатитом C
На фото: Харви Олтер
Нобелевскую премию по физике второй год подряд присуждают за открытия в астрофизике, на этот раз за исследование черных дыр. Половина премии отдана британцу Роджеру Пенроузу за расчеты 1965 года, как пояснили в комитете, ученый доказал, «что образование черных дыр служит надежным подтверждением общей теории относительности». Вторую половину премии поделили американские астрофизики Райнхард Генцель и Андреа Гез за открытие сверхмассивного компактного объекта в центре галактики Млечный Путь
На фото: Роджер Пенроуз
Нобелевскую премию по химии получили американка Дженнифер Дудна и француженка Эмманюэль Шарпантье за развитие метода редактирования генома. Созданные лауреатами «генетические ножницы» помогают относительно быстро и с высокой точностью изменять ДНК растений, животных и микроорганизмов. Ученые считают, что этот инструмент поможет разработать лечение для тяжелых заболеваний, в том числе рака. Это первый случай в истории Нобелевской премии по химии, когда ее получили сразу две женщины
На фото: Эмманюэль Шарпантье (слева) и Дженнифер Дудна
Нобелевскую премию по литературе получила американская поэтесса Луиза Глюк «за безошибочно узнаваемый поэтический голос, который своей строгой красотой делает индивидуальное существование универсальным». Глюк — лауреат многих литературных премий, ей в разные годы были присуждены премия Американской академии поэтов (1968), Национальная книжная премия общества критиков (1985), Пулитцеровская премия (1993) и Боллингенская премия (2001)
Нобелевскую премию мира получила Всемирная продовольственная программа (World Food Programme, WFP). Это гуманитарная организация ООН, созданная для борьбы с голодом еще в 1960-е. В Нобелевском комитете отметили, что угроза голода в отдельных регионах возросла в 2020 году из-за пандемии COVID-19. В 2019 году Всемирная продовольственная программа помогла почти 100 млн человек в 88 странах. В этом году сообщалось, что на Нобелевскую премию мира выдвигали президентов России и США Владимира Путина и Дональда Трампа, а также основателя Фонда борьбы с коррупцией Алексея Навального
На фото: раздача продуктов беженцам из Южного Судана в лагере в Уганде, 2017 год
Премия по экономике памяти Альфреда Нобеля присуждена американцам Полу Милгрому и Роберту Уилсону. Они удостоились награды «за усовершенствование теории аукционов и изобретение новых форматов аукционов»
Хронология событий
Нобелевскую премию мира получила Всемирная продовольственная программа
Лауреатом Нобелевской премии мира 2020 года стала Всемирная продовольственная программа ООН.
Нобелевская премия по литературе присуждена поэтессе Луизе Глюк
Нобелевскую премию по литературе за 2020 год присудили американской поэтессе, профессору английского языка в Йельском университете Луизе Глюк «за ее безошибочный поэтический голос, который простой красотой делает индивидуальный опыт универсальным».
Нобелевскую премию по химии присудили за метод редактирования генома
Нобелевский комитет оценил систему генетического редактирования CRISPR/Cas9 как метод и заявил о революционном влиянии генетического инструмента на фундаментальную науку, а также отметил, что он приведет к революционным новым методам лечения.
Нобелевскую премию по физике присудили за исследования черных дыр
Нобелевскую премию по физике 2020 года получили Роджер Пенроуз «за открытие того, что образование черной дыры является надежным предсказанием общей теории относительности», а также Рейнхард Генцель и Андреа Гез «за открытие сверхмассивного компактного объекта в центре нашей галактики».
Премия в этом году составит 10 млн шведских крон. Половину денежной премии получит англичанин Пенроуз, вторую половину поделят поровну немец Генцель и американка Гез.
Нобелевскую премию по медицине присудили за открытие вируса гепатита С
Нобелевской премии по медицине и физиологии в 2020 году удостоились британский ученый Майкл Хоутон, Харви Альтер и Чарльз Райс. Премию присудили за исследования вируса гепатита С.
В Швеции стартует Нобелевская неделя
В Швеции и Норвегии в понедельник начинается Нобелевская неделя, в ходе которой определятся лауреаты этой престижной премии за 2020 год.
Наконец, 12 октября, в столице Швеции определится лауреат Нобелевской премии в сфере экономики.
Путина выдвинули на Нобелевскую премию мира
Писатель Сергей Комков отправил заявку на номинацию президента РФ Владимира Путина на Нобелевскую премию мира. Между тем в Кремле индифферентно относятся к тому, будет ли Путину вручена Нобелевская премия мира, или нет.
В Швеции впервые с 1944 года не будут лично вручать Нобелевские премии
Традиционная церемония вручения Нобелевских премий в Стокгольме с личным участием лауреатов отменена из-за пандемии коронавируса COVID-19, сообщили организаторы.
Европейские СМИ отмечают, что церемонию вручения наград отменили впервые с 1944 года, когда премии не вручали из-за Второй мировой войны.
Церемонию вручения Нобелевской премии мира перенесут в Университет Осло
Церемония вручения Нобелевской премии мира состоится по традиции 10 декабря, но пройдет менее широкомасштабно из-за эпидемии COVID-19, сообщил во вторник в эфире норвежской телерадиокомпании NRK глава Нобелевского института Олав Нельстад.
В частности, по его словам, церемония пройдет не в главном зале мэрии Осло, рассчитанном на прием тысячи гостей, а в основной аудитории Университета Осло, где могут разместиться сто человек. Банкет в честь нобелевского лауреата будет отменен.
В Белом доме сочли, что Трамп заслуживает Нобелевской премии мира
Норвежский парламентарий предложил дать Трампу Нобелевскую премию мира
Член норвежского парламента Кристиан Тибринг-Гедде считает, что президент США Дональд Трамп заслуживает Нобелевской премии мира за вклад в решение затянувшихся конфликтов.
Об этом сообщает телеканал Fox News. Тибринг-Гедде направил письмо Нобелевскому комитету, в котором сообщил, что администрация Трампа, в частности, сыграла ключевую роль в установлении отношений между Израилем и ОАЭ.
Нобелевскую премию по химии присудили за метод редактирования генома CRISPR/Cas
Лауреатами Нобелевской премии по химии 2020 года стали Эммануэль Шарпантье (Emmanuelle Charpentier) и Дженнифер Дудна (Jennifer Doudna), премия присуждена им за развитие метода редактирования генома CRISPR/Cas. За церемонией объявления победителей можно следить в прямом эфире на сайте Нобелевского комитета. Подробнее об исследованиях ученых и их заслугах можно прочитать в пресс-релизе на том же сайте.
До недавнего времени существовало два способа внести изменения в геном живого организма: собрать его с нуля (как делали с некоторыми бактериями) или встроить внутрь вирусный вектор. Второй метод помог получить первые генетически модифицированные организмы, но оставался достаточно сложным и неточным: чтобы удостовериться в том, что вектор оказался в нужном участке генома, нужно было ставить сразу множество проб и отбирать единственную удачную. Кроме того, с помощью вирусного вектора сложно внести тонкие изменения в геном — например, заменить одну «букву» в тексте ДНК или удалить последовательность из нескольких нуклеотидов.
Эти проблемы смогли решить системы генетического редактирования — так называемые «молекулярные ножницы». Это системы из ферментов, которые нацеливаются на конкретную последовательность ДНК и разрезают ее в условленном месте. Они позволили избирательно удалять участок из генома или заменять его на другой — если предварительно снабдить клетку шаблоном для замены.
Эммануэль Шарпантье и Дженнифер Дудна
Nobel Media / Niklas Elmehed
В случае CRISPR/Cas9 нуклеаза всегда работает одинаково, а специфичность достигается за счет гидовой, или направляющей РНК — которая наводит нуклеазу на необходимый участок. Это связано с тем, что CRISPR/Cas9 — система бактериального происхождения, это механизм, с помощью которого бактерии избавляются от вирусных вставок в своем геноме (в 2016 году мы писали о ней в материале «Запомните эти буквы» — теперь самое время их вспомнить).
CRISPR/Cas9 появилась в заголовках научных статей довольно давно, но захватила внимание научного сообщества менее 10 лет назад — когда Эммануэль Шарпантье и Дженнифер Дудна выяснили, как именно эта система работает у бактерий, и научились применять ее для внесения нужных изменений в геном. С тех пор эта система стала самым популярным методом генетического редактирования. Она породила множество модификаций: сейчас мы умеем не только вырезать последовательности из ДНК, но также редактировать РНК и заменять отдельные нуклеотиды, не повреждая геном.
CRISPR/Cas9 начали использовать для создания ГМО нового поколения и лечения редких болезней, эта система поучаствовала в самом громком научном скандале последних лет — появлении генетически измененных детей в Китае. Споры о том, в каком случае применение этой системы на людях оправдано и этично, продолжаются и сейчас. Но тем более показательно, что Нобелевскую премию за нее присудили не в области физиологии или медицины, а в области химии. Сегодня Нобелевский комитет оценил систему генетического редактирования как метод. Возможно, это не последняя Нобелевская премия, связанная с CRISPR/Cas9 — но, по всей видимости, время оценить ее значимость для медицины еще не пришло.
По предсказаниям Clarivate Analytics, основанным на наукометрических данных, фаворитами на получение премии по химии считались Хён Тэ Хван, Кристофер Мюррей и Маунги Бавенди за разработку нанокристаллов и квантовых точек. Альтернативные кандидатами считались Стивен Бухвальд и Джон Хартвиг за их вклад в органометаллическую химию, а также Макото Фудзита, работающий в области супрамолекулярной химии.
В 2019 году Нобелевскую премию по химии получил Джон Гуденаф (John Goodenough), Стэнли Уиттингем (Stanley Whittinhgham) и Акира Ёсино (Akira Yoshino) «за разработку литий-ионных батарей». Подробнее можно прочитать в тексте «Заряженный „Нобель“». Нобелевскую премию по химии 2018 года вручили Фрэнсис Арнольд (Frances Arnold) за направленную эволюцию ферментов, а также Джорджу Смиту (George Smith) и Грегори Винтеру (Gregory Winter) за фаговый дисплей пептидов и антител, читайте об этих работах в нашем материале «Игра в Бога».
РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020
РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020
Эммануэль Шарпантье и Дженнифер Дудна, лауреаты Нобелевской премии по химии в 2020 году
Автор
Редакторы
Не секрет, что Нобелевская премия за разработку системы редактирования геномов CRISPR/Cas9 была лишь вопросом времени. Работы Эммануэль Шарпантье и Дженнифер Дудны послужили началом взрывного роста популярности CRISPR-системы. Метод так называемых молекулярных ножниц значительно расширил потенциал генной инженерии, на практике показал свою эффективность и даже успел стать предметом громкого скандала «за биоэтику». Эти и другие относящиеся к теме редактирования геномов вопросы неоднократно освещались в материалах «Биомолекулы». Так что сегодня мы радуемся как за CRISPR-систему, так и за двух прекрасных лауреатов, отмеченных Нобелевским комитетом.
Как водится, «пули свистели над головой» (с) идеи витали в воздухе. Стремительно развивающиеся методы секвенирования ДНК и РНК, а также цифровой обработки этих данных, значительно подстегнули все исследования, касающиеся белков и их функций. К 2012 году наука уже довольно много знала о CRISPR/Cas-системе [1]. О ее чрезвычайно широкой распространенности среди архей и бактерий [2]. О ее основной функции — адаптивном (приобретенном) иммунитете к бактериальным вирусам [3]. Были известны два типа CRISPR/Cas-системы и то, что они состоят из двух основных блоков: специфически устроенной CRISPR-кассеты (clustered regularly interspaced short palindromic repeats) и прилегающего к ней кластера генов cas, кодирующих белки нуклеазы, основной функцией которых является разрезание фаговой ДНК. А также что CRISPR-кассета хранит в себе генетические «фотографии» побежденных в прошлом фагов и по этим «фотографиям» вовремя устанавливает и устраняет новые заражения. Разумеется, с того момента, как обнаружилось, что Cas-белки «режут» не РНК, как ожидалось, а ДНК, участь CRISPR/Cas как будущего инструмента генной инженерии была предрешена [1], [4], [5].
А также последовавшие за этим «патентные бои» — «CRISPR-эпопея и ее герои» [1]. — Ред.
Шарпантье и возглавляемая ею научная группа занимались изучением генной регуляции патогенной бактерии Streptococcus pyogenes. Исследования позволили им обнаружить последний недостающий фрагмент так называемой CRISPR-системы II типа. Этим фрагментом оказалась tracrРНК (trans-activating CRISPR RNA), молекула-ассистент для crРНК (CRISPR RNA), того самого «шаблона», по которому нуклеазы Cas определяли, кого на этот раз «резать». «Маленькая, да удаленькая», tracrРНК умудрялась играть значительную роль и в «созревании» crРНК, и в непосредственной работе белков Cas.
В свою очередь, исследовательская группа Дудны занималась изучением регуляции генов с помощью РНК-интерференции (подробнее об РНК-интерференции вы можете прочитать в статье «Обо всех РНК на свете, больших и малых» [6]). В этой связи в их сферу внимания попала система CRISPR/Cas, механизм действия которой был пока не ясен, но косвенные признаки указывали на его схожесть с РНК-интерференцией [7]. Однако если последняя наблюдалась у эукариот и служила для уничтожения и деактивации нежелательных генных продуктов (РНК или белков), то CRISPR/Cas должна была аналогичным образом «крошить» вирусов прокариот.
Объединив свои наработки и сфокусировав усилия на более простой и компактной CRISPR/Cas-системе S. pyogenes, Шарпантье и Дудна впервые собрали в пробирке «полный рабочий комплект» редактирования генома. И даже оптимизировали его: сшили две РНК-участницы (tracrРНК и crРНК) в одну, тем самым заметно упростив методику (рис. 1) [1].
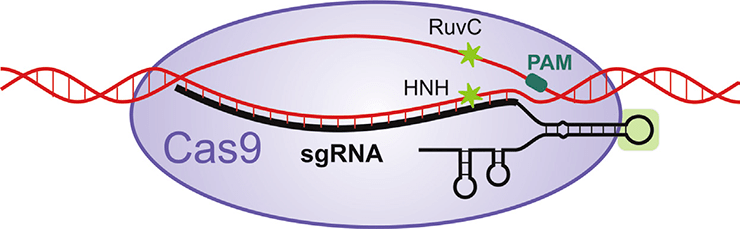
Рисунок 1. Работа системы CRISP/Cas9 в методе геномного редактирования, разработаном коллективами Шарпантье и Дудны. tracrРНК и crРНК объединяются в одну молекулу sgРНК. Эта объединенная молекула исполняет роль одновременно связывания Cas9-белка и поиска ДНК мишени. После обнаружения целевой последовательности ДНК происходит ее «плавление» и разрезание вблизи PAM-мотива — особой короткой последовательности ДНК. За разрезание отвечает белок Cas9, а точнее, его RuvC- и HNH-домены.
О биоэтике в вопросах использования рекомбинантных ДНК и редактирования генома рассказывает отдельная глава статьи «12 методов в картинках: генная инженерия. Часть I, историческая» [18]. — Ред.
Впрочем, это не омрачает исследовательского оптимизма и позитивных надежд на то, что однажды мы действительно сможем прицельно и точно искоренять многие наследственные заболевания.
Не первые в своем роде
Человеческие мечты о возможности предсказуемо влиять на генетические программы нашли отражение в цепочке Нобелевских премий прошлых лет.
В 1978 году — Нобелевская премия по физиологии или медицине за обнаружение рестрикционных ферментов, сыгравших огромную роль в буме клонирования ДНК. В 1993-м — Нобелевская премия по химии за разработку олигонуклеотидного направленного мутагенеза. Напомним, что в том же 1993 году свою Нобелевскую премию получил Кэрри Мюллис, автор метода ПЦР [15], без которого сегодня не обходится ни одна биологическая лаборатория. А в 2007 году Нобелевскую премию вручают авторам методики нокаутирования генов мышей с использованием эмбриональных стволовых клеток [9], [14].
С каждым таким шагом растет точность, эффективность, простота и скорость манипуляций с ДНК. С начала 2000-х годов активно развиваются методы редактирования геномов, основанные на внесении двухцепочечных разрывов в строго определенных сайтах ДНК [5], [8]. Пытаясь починить такие разрывы, клетка берет кусочек хромосомы с гомологичной последовательностью. И в этот ответственный момент можно «подманить» ее частичной гомологией и подсунуть немного измененную ДНК. Идея, разумеется, не нова. Ряд методов генотерапии, а также, например, предшествующий «нобеленосный» метод нокаутирования генов с помощью эмбриональных стволовых клеток [8], тоже полагаются на гомологичную репарацию хозяйской ДНК с «подселенным» к ней ДНК-вектором. Однако в отсутствии возможности внести точные разрезы в ДНК-мишени приходится ждать, когда это произойдет само собой. Такое положение дел значительно ограничивает эффективность процедур, увеличивает фронт работ и, соответственно, влияет на скорость исследований.
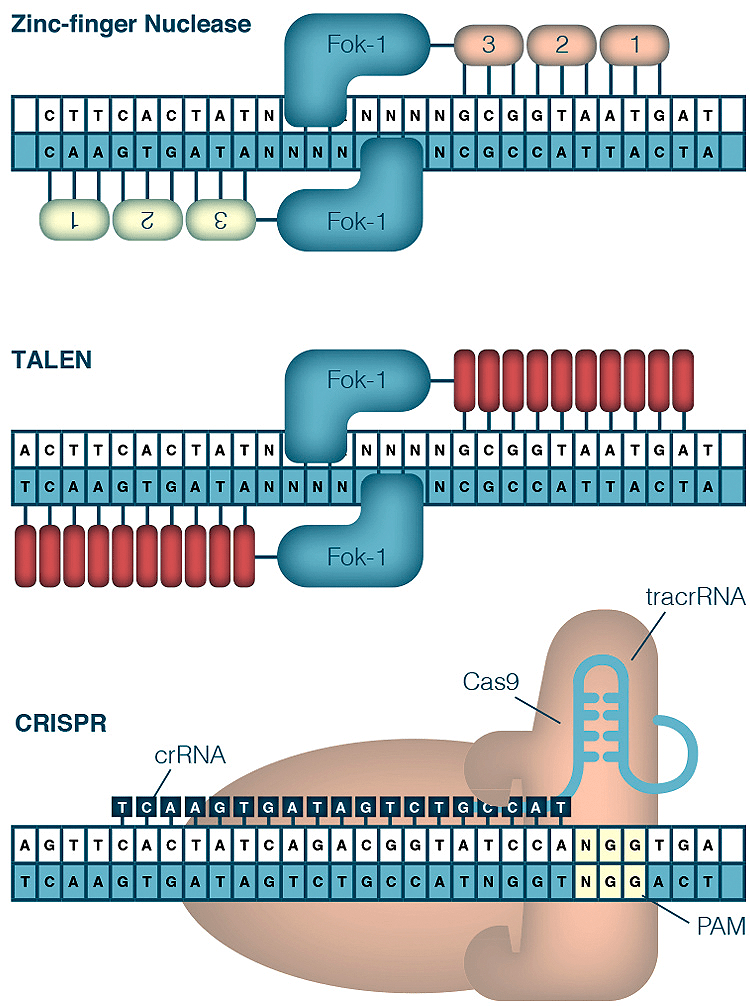
Сейчас известно четыре типа методов редактирования генома с использованием четырех разных специфически спроектированных нуклеаз: мегануклеаз, ZF-нуклеаз, TALE-нуклеаз и, наконец, системы CRISPR/Cas (рис. 2) [5], [9].
Рисунок 2. Устройство наиболее известных систем редактирования геномов: ZFN, TALEN и CRISPR. Первые две системы опираются на специфичность структуры белка, избирательно связывающегося с определенной последовательностью ДНК, тогда как CRISPR не требует специального дизайна нуклеазы для каждой конкретной последовательности. Достаточно подобрать комплементарную crРНК.
CRISPR/Cas отличается от остальных своей универсальностью и относительной простотой применения. Так, если в случае первых трех систем мы должны для каждой конкретной мишени изменять структуру белка, выполняющего функцию «молекулярных ножниц», то для работы системы CRISPR/Cas достаточно синтезировать новую РНК с необходимой последовательностью [4].
Впрочем, одним из главных вызовов в этой области по-прежнему остается недостаточная точность в определении мишеней, недостаточная аккуратность встраивания необходимой ДНК и недостаточная эффективность его применения in vivo. А значит, CRISPR/Cas все еще недостаточно хороша для полноценного генотерапевтического использования [17].
Так что. следим за развитием событий и ждем новых прорывов!
«Генетические ножницы». За что присуждена Нобелевская премия по химии
«Они получили все возможные на лице Земли премии»
«Генетические ножницы» — очень молодая работа. Сама система CRISPR/Cas-9 известна давно, но ее использование для прицельного разрезания генома и введения в него нужных участков Шарпантье и Дудна разработали и описали всего восемь лет назад. Однако за это время технология завоевала и лаборатории, и стартапы, и промышленность, и медицину. И успела, хотя и без участия ее создательниц, всегда подчеркнуто осторожных и сдержанных, поставить мир перед этической дилеммой улучшения человека.
На момент открытия Шарпантье — француженка — работала в Швеции в Университете Умео. Следует также отметить, что это не ситуация параллельного открытия: лауреатки плотно сотрудничали, хотя Дудна работала и работает в десятки часовых поясов от Европы в Университете Калифорнии в Беркли.
«Эту премию никак нельзя назвать неожиданной. Лауреатки уже получили все возможные на лице Земли премии, поэтому логично было предположить, что они получат и эту. Однако Нобелевская премия — очень старая, уважаемая и особенная. Никто не воспринимает ее получение как что-то само собой разумеющееся. Я не говорил сегодня с профессором Дудна, однако профессор Шарпантье была по-настоящему счастлива и тронута», — сказал председатель Нобелевского комитета по химии Клос Густафссон, отвечая на вопрос, ожидали ли победительницы присуждения премии.
Агентство Clarivate Analytics, каждый год оглашающее «лауреатов цитирования» — самых влиятельных ученых, «предсказало» им Нобелевскую премию еще в 2015 году. Таков был резонанс, вызванный их работами всего за три года (кстати, в том же году были названы в кандидатах на нобелевку прошлогодние лауреаты-химики — создатели литий-ионных аккумуляторов Джон Гуденаф и Стэнли Уиттингэм).
Довершает картину то, что лауреатки, по нобелевским меркам, чрезвычайно молоды — Дудна 56 лет, Шарпантье — 51 год. Подводя итог: уже несколько лет было совершенно ясно, что их «нобелевка» — вопрос времени. Только какого? Гуденафу пришлось ждать до 97 лет, а создательницам «генетических ножниц», к счастью, повезло куда больше.
Ножницы из бактерий
«Генетические ножницы» не созданы человеком с нуля — они подсмотрены в природе. CRISPR-системы изучаются порядка 20 лет — это часть очень необычно работающего иммунитета бактерий. Поскольку бактерии — это целые клетки, они могут также болеть вирусами, как и мы, клетки нашего организма.
Такие вирусы называются бактериофагами, а вот «лечатся» — вернее, приобретают иммунитет, — бактерии очень необычно. Они «запоминают врага» внутри себя. Короткие фрагменты ДНК бактериофага (длиной 30 пар нуклеотидов) встраиваются в специальный участок бактериальной хромосомы (это и есть CRISPR-локус). Клетки с модифицированным таким образом геномом (и их «дети» — геном наследуем) становятся устойчивыми к повторному заражению бактериофагом. Впоследствии бактерия «сверяет» геномы подбирающихся к ней вирусов с тем, что есть в ее «базе данных» и при совпадении носитель опознанной ДНК уничтожается.
Этот механизм очень интересен с точки зрения фундаментальной науки, однако среди его применений еще 10 лет назад рассматривался только мир бактерий — как бы получше убивать ненужных и защищать нужных микробов. Гениальной была идея увидеть в этом явлении не объект изучения, а потенциальный метод — ведь бактерия умудряется очень точно разрезать свой геном, вставить в него участок, а затем сшить.
Именно так посмотрели на вопрос Дудна и Шарпантье. Они собрали систему из ферментов, которые точно прицеливаются в определенную точки ДНК и разрезают ее. Так можно избирательно удалять участок генома или заменять его на нужный вам. Этот метод — CRISPR/Cas9 — не первый метод генетической модификации, но революционный. Старые методы не позволяли добиться точности «прицеливания» и были дорогие и сложные.
А вот генетические ножницы оказались очень точны и доступны. Теперь с их помощью в лабораториях создают модели для исследований лекарств, ученые в сфере сельского хозяйства экспериментируют с новыми сельхозкультурами, а медики — пытаются разработать надежные терапии генетических заболеваний. Это последнее применение, конечно, самое известное и спорное (хотя далеко не самое массовое, как исследовательский инструмент CRISPR/Cas9 куда популярнее).
Хотя китайский ученый Хэ Цзянькуй и обеспечил два года назад появление на свет двух ГМ-детей, устойчивых к ВИЧ, эта работа не встретила понимания и в научном сообществе, ни в обществе. Вкратце проблема в следующем: что годится для лабораторных исследований, далеко не всегда годится для больниц и жизни.
Ученым-химикам предстоит доработать метод до 100-процентной надежности, а обществу вместе с учеными-этиками и философами — понять, готовы ли мы к нему и на каких условиях. Конечно, редактирование генома человека не остановить, но его правила и нормы пишутся у нас на глазах, и сегодняшние лауреаты неизменно призывают к осторожности и широкому общественному диалогу в этих вопросах.
Кругом наши
Нобелевскую премию могут получить не более трех человек, но работают над «нобелевской» тематикой всегда гораздо большее число ученых в разных уголках Земли. Так, в исследованиях CRISPR/Cas9 серьезен вклад российской научной школы.
«Активную роль в истории CRISPR сыграли наши соотечественники, работающие за рубежом — Евгений Кунин, Александр Болотин, и, наконец, Виргис Шикшнис, выпускник МГУ, защитивший кандидатскую под руководством Карела Мартинека. Виргис и показал, что CRISPR-Cas9 работает как единая ферментная система, реконструировав его в другом организме. Виргис, будучи химиком-энзимологом также продемонстрировал, что эта система может быть реконструирована и может расщеплять ДНК «в пробирке». Независимо от Виргиса, Шарпантье и Дудна пришли к таким же выводам, что фермент можно использовать для коррекции генов и провели реконструкцию», — рассказал профессор Университета Северной Каролины в Чапел-Хилл Александр Кабанов, выпускник химфака МГУ и президент Ассоциации русскоязычных ученых в США RASA-America
Виргис Шикшнис в 2018 году разделил премию Кавли с Дудна и Шарпантье.