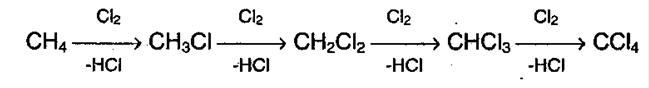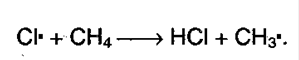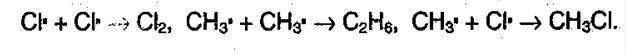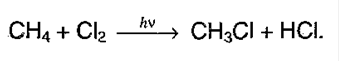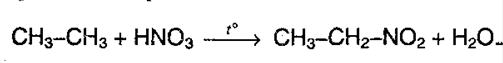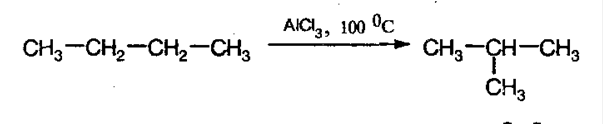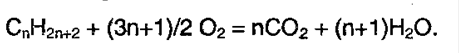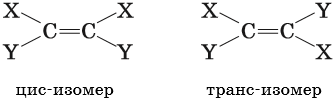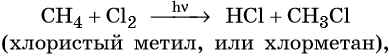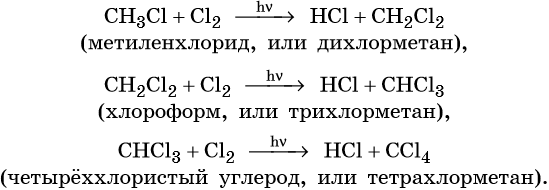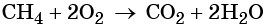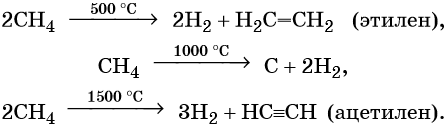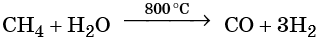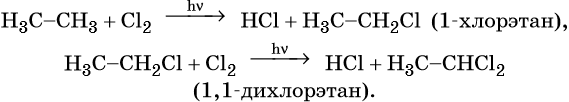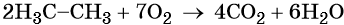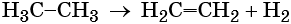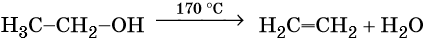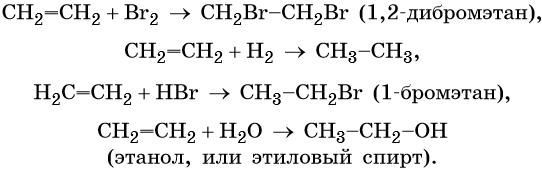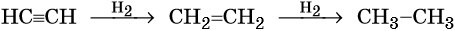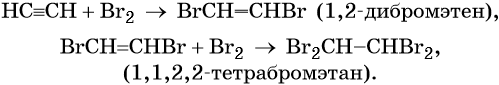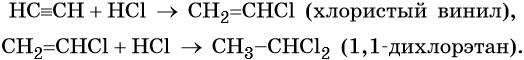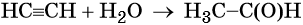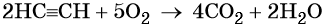непредельные и предельные углеводороды чем отличаются
Углеводороды, виды и их классификация
Углеводороды, виды и их классификация.
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Они служат фундаментальной основой органической химии
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация и виды углеводородов:
При систематизации (классификации) углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
В зависимости от строения углеродного скелета углеводороды подразделяют на ациклические и карбоциклические.
Ациклические соединения (ациклические углеводороды) – класс органических соединений, в молекулах которых отсутствуют циклы (кольца), и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи.
Ациклические соединения также в литературе называются алифатическими соединениями.
Карбоциклические соединения (карбоциклические углеводороды) – класс органических соединений, характеризующихся наличием колец (циклов) из атомов углерода. Карбоциклические соединения отличаются от гетероциклических соединений отсутствием в кольцах каких-либо других атомов, помимо атомов углерода.
В зависимости от кратности углерод-углеродных связей ациклические углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены) углеводороды. Предельные ациклические углеводороды также называются насыщенными, а непредельные – ненасыщенными.
В свою очередь циклические углеводороды в зависимости от кратности углерод-углеродных связей подразделяются на алициклические (циклоалканы, циклоалкены, циклоалкины) и ароматические (арены) углеводороды.
Предельные (насыщенные) ациклические углеводороды:
Насыщенными алканы называются потому, что они содержат максимально возможное число атомов водорода для заданного числа атомов углерода.
Непредельные (ненасыщенные) ациклические углеводороды:
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Связи C=C представляют собой π-связи. Длина связи C=C составляет 0,134 нм.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены образуют гомологический ряд, также называемый рядом этилена. К алкенам относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10, гексен C6H12, гептен C7H14, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены, число атомов углерода в которых больше двух (т.е. кроме этилена), имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкины (также именуемые ацетиленовые углеводороды) – ациклические непредельные углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный плоский угол 180°. Таким образом у алкинов связь С≡С линейна (угол 180°) и находится в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Алкины образуют гомологический ряд, также называемый рядом ацетилена. К алкинам относятся: этин (ацетилен) C2H2, пропин C3H4, бутин C4H6, пентин C5H8, гексин C6H10, гептин C7H12, октин C8H14, нонин C9H16, децин C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины, число атомов углерода в которых больше трех (т.е. кроме ацетилена и пропина), имеют изомеры. Для алкинов характерны изомерия углеродного скелета, положения тройной связи и межклассовая. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Диены (именуемые также алкадиены) – ациклические непредельные углеводороды, содержащие две двойных связи между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы:
– сопряжённые диены, в которых двойные связи разделены одинарной (1,3-диены)
– аллены с кумулированными двойными связями (1,2-диены)
– диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
По номенклатуре IUPAC названия диенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-диен»; положение двух двойных связей указывается двумя арабскими цифрами.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации. Связи C=C представляют собой π-связи. В сопряженных диенах длина связи C=C составляет 0,137 нм, а C-C – 0,146 нм.
Диены образуют гомологический ряд. К диенам относятся: пропадиен (С3Н4), бутадиен (С4Н6), пентадиен (С5Н8), гексадиен (С6Н10), гептадиен (С7Н12), октадиен (С8Н14), нонадиен (С9Н16), декадиен (С10Н18) и т.д., которые имеют формулу CnH2n-2.
Диены, число атомов углерода в которых больше четырех (т.е. кроме пропадиена и бутадиена), имеют изомеры. Для диенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная, цис-транс-изомерия). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алициклические углеводороды:
Алициклические углеводороды – циклические углеводороды, молекулы которых содержат замкнутые кольца из атомов углерода (но не имеющие ароматического кольца), которые являются частично или полностью насыщенными. Алициклические соединения классифицируют по числу атомов в кольце, по числу колец, по наличию или отсутствию кратных связей.
К алициклическим углеводородам относятся циклоалканы, циклоалкены, циклоалкины.
Алициклические углеводороды имеют изомеры. Для них характерны изомерия углеродного скелета (кольца и боковых цепей), положения заместителей в цепи, положения двойной или тройной связи, межклассовая и геометрическая (пространственная, оптическая, цис-транс-изомерия, конформационная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Циклоалканы (именуемые также полиметиленовые углеводороды, нафтены, цикланы, циклопарафины) – насыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n (n⩾3).
По номенклатуре IUPAC названия циклоалканов образуются от названий соответствующих алканов добавлением приставки «цикло-».
Атомы углерода при С-С связи находятся в состоянии sp 3 гибридизации.
Циклоалканы образуют гомологический ряд. К циклоалканам относятся: циклопропан C3H6, циклобутан C4H8, циклопентан C5H10, циклогексан C6H12, циклогептан C7H14, циклооктан C8H16, циклононан C9H18, циклодекан C10H20 и т.д., которые имеют формулу CnH2n.
Циклоалкены (также именуемые циклоолефины) – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну двойную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-2 (n⩾3).
По номенклатуре IUPAC названия циклоалкенов образуются от названий соответствующих алкенов добавлением приставки «цикло-».
Циклоалкены образуют гомологический ряд. К циклоалкенам относятся: циклопропен C3H4, циклобутен C4H6, циклопентен C5H8, циклогексен C6H10, циклогептен C7H12 и т.д., которые имеют формулу CnH2n-2.
Циклоалкины – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну тройную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-4 (n⩾5).
По номенклатуре IUPAC названия циклоалкинов образуются от названий соответствующих алкинов добавлением приставки «цикло-».
Циклоалкины образуют гомологический ряд. К циклоалкинам относятся: циклопентин C5H6, циклогексин C6H8, циклогептин C7H10 и т.д., которые имеют формулу CnH2n-4.
Ароматические углеводороды:
Ароматические углеводороды (арены) – циклические углеводороды, которые имеют в своём составе ароматическую систему.
Ароматическая система – это электронная система молекулы, содержащая (в кольце), в соответствии с правилом Хюккеля, 4n+2 электронов (где n = 0, 1, 2, …).
Различают бензоидные (арены и структурные производные аренов, которые содержат бензольные ядра) и небензоидные (все остальные) ароматические углеводороды.
Состав аренов с одним бензольным кольцом отвечает общей формуле CnH2n-6 (n⩾6).
Атомы углерода в бензольном кольце находятся в состоянии sp 2 гибридизации и имеют валентный угол 120°. Каждый атом углерода образует 3 σ-связи. Бензольное кольцо имеет плоскую форму и образуют шестигранник. У каждого атома есть негибридная р-обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости и поэтому все 6 π-электронов образует единую π-электронную систему. Длина связи между атомами углерода в бензольном кольце составляет 0,139 нм.
Ароматические углеводороды имеют множество изомеров.
ПРЕДЕЛЬНЫЕ И НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Цель работы: ознакомление с предельными и непредельными углеводородами; особенностями строения и химических свойств алканов, алкенов и алкинов и их производных; проведение химических реакций для подтверждения строения и свойств изучаемых соединений.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Предельные углеводороды, алканы
Общие сведения, номенклатура предельных углеводородов
Таблица 4. Гомологический ряд алканов.
Физические свойства алканов
Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля:
или по реакции Фишера-Тропша :
К лабораторным способам получения алканов относят:
1. Гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd):
2. Взаимодействие воды с металлоорганическими соединениями:
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl
3. Электролиз карбоновых кислот:
4. Реакция декарбоксилирования:
и многие другие способы.
Химические свойства алканов
Предельные углеводороды не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
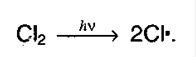
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:
Реакция идет по цепному механизму, в которой различают:
а) Инициирование цепи:
Суммарно можно представить в виде:
2. Нитрование(реакция М.И.Коновалова)алканов. Реакция протекает при 140 °С при действии 12-14% азотной кислоты:
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомеризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:
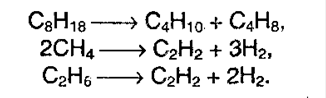
4. Крекинг алканов. При действии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:
5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:
Дата добавления: 2018-05-13 ; просмотров: 3067 ; Мы поможем в написании вашей работы!
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
Ниже приводятся основные термины, используемые в органической химии.
Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.
Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:
При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
На воздухе этан горит слабо светящимся пламенем:
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
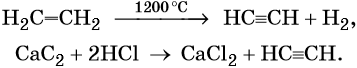
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С. Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта. Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
Для ацетилена прежде всего характерны реакции присоединения.
В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии
2) это низкокипящая жидкость, хорошо растворимая в воде
3) это низкокипящий газ, плохо растворимый в воде
4) является основным компонентом природного газа
5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха
2) это бесцветный газ, немного тяжелее воздуха
3) при его взаимодействии с водой образуется этиловый спирт
4) при его дегидрировании образуется этилен
5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными
2) не реагирует с гидроксидом натрия
3) реагирует с серной кислотой
4) реагирует с метаном
5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации
2) плотность паров этилена равна плотности паров азота
3) не реагирует с водой
4) не сгорает в кислороде
5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде
2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации
3) взаимодействует с водой с образованием уксусной кислоты
4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха
2) при нормальных условиях это газ, пары которого тяжелее воздуха
3) не реагирует с бромом
4) реагирует с водой с образованием этанола
5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения: