Что такое диаграмма состояния
Проектирование диаграммы состояний UML (Statechart Diagram)
Программные решения для бизнеса
В данном занятии демонстрируется построение диаграммы состояний заявки клиента. Основные шаги построения диаграммы состояний:
Каждый переход имеет метку, состоящую из следующих необязательных частей:
Триггер-идентификатор — единственное событие, способное вызвать изменение состояния. Пропуск этой части означает, что переход происходит немедленно
Защита — логическое условие, выполнение которого обязательно для осуществления перехода. Пропуск защиты означает, что в ответ на инициирующее событие переход всегда осуществляется
Активность — поведение системы во время перехода. Пропуск активности означает, что в процессе перехода ничего не происходит
Внутренние активности (internal activities) используются для описания действий объекта, совершаемых без перехода. Список основных действий включает следующие значения:
диаграмма состояния
Полезное
Смотреть что такое «диаграмма состояния» в других словарях:
ДИАГРАММА СОСТОЯНИЯ — [phase equilibrium diagram) графическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием… … Металлургический словарь
ДИАГРАММА СОСТОЯНИЯ — диаграмма равновесия, фазовая диаграмма, графич. изображение равновесных состояний (см. Равновесие термодинамическое) в ва в виде точек в n мерном пространстве, по осям координат к рого отложены п независимых параметров состояния рассматриваемой… … Большой энциклопедический политехнический словарь
ДИАГРАММА СОСТОЯНИЯ — (фазовая Диаграмма) графическое изображение соотношения между параметрами состояния термодинамически равновесной системы (температурой, давлением, составом и др.). Диаграмма состояния позволяет определить, сколько и каких конкретно фаз образуют… … Большой Энциклопедический словарь
ДИАГРАММА СОСТОЯНИЯ — (диаграмма равновесия, фазовая диаграмма), геом. изображение равновесных состояний термодинамич. системы при разных значениях параметров, определяющих эти состояния: темп ры Т, давления р, состава системы (концентраций компонентов xi), мольного… … Физическая энциклопедия
Диаграмма состояния — диаграмма равновесия, фазовая диаграмма, графическое изображение соотношений между параметрами состояния физико химической системы (температурой, давлением и др.) и её составом. В простейшем случае, когда система состоит только из одного… … Большая советская энциклопедия
ДИАГРАММА СОСТОЯНИЯ — (фазовая диаграмма) графическое изображение равновесных состояний вещества в виде точек в n мерном пространстве, по осям координат которого отложены n независимых параметров состояния (объём, давление, температура, (см.), концентрации веществ и… … Большая политехническая энциклопедия
Диаграмма состояния — (фазовая) – графическое изображение всех возможных фазовых состояний термодинамической системы в пространстве основных параметров состояния – температуры, давления, объема или состава для многокомпонентных систем. [Ушеров Маршак А. В … Энциклопедия терминов, определений и пояснений строительных материалов
диаграмма состояния — Геометрическое изображение фазовых равновесий при разных значениях термодинамич. параметров: темп ры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газ. фазу, слабым влиянием давления на фазовые равновесия обычно… … Справочник технического переводчика
диаграмма состояния — [phase equilibrium diagram] геометрическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием… … Энциклопедический словарь по металлургии
ДИАГРАММА СОСТОЯНИЯ — (фазовая диаграмма), графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния т ры Т, давления ри состава х(обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем,… … Химическая энциклопедия
State & Transition Diagram — что это и как применять
State & Transition Diagram (сокращенно S&T) — схема состояний и переходов. Техника для визуализации ТЗ. Она наглядно показывает, как некий объект переходит из одного состояния в другое.
Вот объект находился в состоянии А, потом произошло какое-то действие, и он попал в состояние В. Потом он попадет в состояние С и другие. Принцип не меняется, было одно состояние, стало другое.
кружочки — состояния объекта;
стрелочки — то, благодаря чему из состояния А в состояние В. Это действие, но его может совершить не только пользователь, но и система сама. Например, задача запустилась автоматически в 10 часов вечера.
Такая схема позволяет нам сразу визуально оценить, какие переходы вообще возможны и что надо протестировать. Ведь нам надо протестировать и эту стрелку, и эту. Так что стрелочки — это наши готовые тест-кейсы!
Схема состояний и переходов относится к техникам тест-дизайна. Значит, про неё спрашивают на собеседованиях. И поэтому я сделаю небольшой цикл статей по таким техникам в помощь начинающим тестировщикам. Чтобы ознакомиться с каждой техникой:
State & Transition Diagram (схема состояний и переходов) — текущая статья
Сегодня поговорим про State & Transition Diagram:
Как рисовать диаграмму
Очень важно: S&T рисуется на объект! Один объект. В идеале — на объект, имеющий аналог в базе данных продукта.
Шаг 1. Вы выбираете объект в своём проекте (рабочем или учебном, не суть).
Шаг 2. Думаете, какие у него состояния. Они не должны пересекаться, то есть: объект не может быть разом в двух состояниях, и при этом он всегда хоть в каком-то одном есть
Шаг 3. Рисуете эти состояния кружочками.
Шаг 5. Смотрите, что получилось и анализируете, есть ли у объекта другие состояния? А другие действия между текущими состояниями? Переход на шаг 2.
Кто не будет выполнять эту последовательность шагов, очень рискует вместо S&T нарисовать схему вышивки крестиком)))
Чтобы начать, задайте себе вопросы:
Какой конкретно объект вы выбрали? Как он называется? (только один!)
Какие у этого объекта есть состояния?
Основное определение состояния — «набор доступных и недоступных действий с объектом». Продукт всегда должен знать, в каком состоянии каждый его объект. Вообще, когда будете думать об объектах и состояниях, старайтесь представлять их аппаратную реализацию.
Объект — это практически всегда строка в базе данных, старайтесь абстрагироваться от интерфейса вообще, и представляйте те действия, которые вы могли бы делать с объектом прямыми запросами в базу.
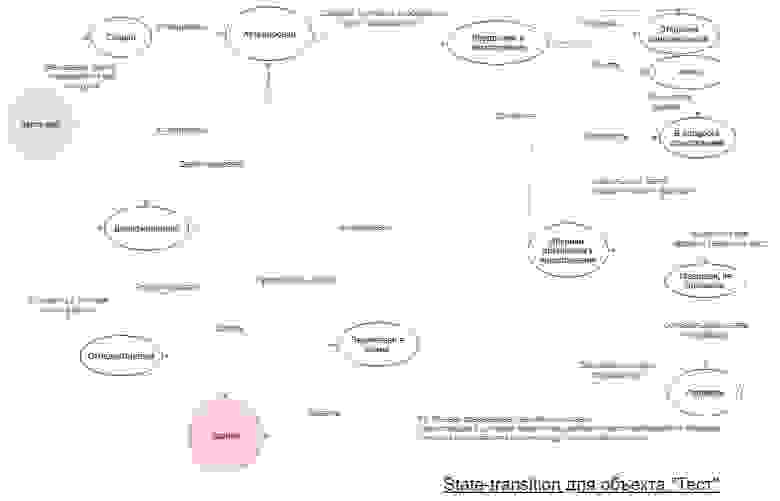
Вот пример хорошей диаграммы:
State Transition на примере тортика!
В чатике моей школы для тестировщиков был очень интересный диалог по поводу рисования State Transition. Студентка рисует его для просмотра сериала и пытается разобраться, как это сделать:
— В ДЗ получила фидбэк, что сделала не схему состояний и переходов, а некую инструкцию по просмотру сериала, по факту показывающую одно его состояние — в процессе просмотра. Но суть как раз в том, что сериал из непросмотренного может быть перемещен в другие состояния, отраженные в виде разделов в личном кабинете, с помощью четырех кнопок, которые на схеме являются действиями. Больше никаких действий с сериалом пользователю не доступно (загрузка, редактирование и т.д.)
— Ну смотрите, Вы продолжаете описывать и смотреть на вещи, как пользователь, а надо как тестировщик. Сериалы из пустоты не берутся. Кто-то их закачивает. Значит, все же связка «сериала не существует» и «сериал загружен на сайт» — уже есть)
— Да, конечно, есть, но выполнять ее может очень ограниченный круг лиц, и я в процессе тестирования не могу. (студенты выбирают любой общедоступный проект и тестируют его. Разумеется, доступа в админку у них нет)
— По-хорошему у тестировщиков на это есть права) и им дают необходимый доступ.
— То есть важны состояния только по отношению к сайту, а что там с этим сериалом происходит в аккаунте уже считается как одно — просмотр? Тестировщик я без году неделя, а пользователь — много лет 🙂 Поэтому и прошу постановки мозгов.
Тут моя коллега решила объяснить рисование карты на примере. Тортика! Дальнейший диалог был просто потрясающий, не могу не поделиться им с вами (разумеется, с разрешения коллеги, все же это ее идея, а не моя). Итак, приступаем:
— Вот смотрите. Торт любите? Или другую еду какую-нибудь)
Чтобы приготовить торт, нам нужны ингредиенты, правильно? Это то, из чего он состоит. Как и наши объекты из параметров, но только в граммах.
Так вот, от того, что какого-то ингредиента будет больше/меньше, состояние торта не изменится. Он будет по-прежнему «не существует».
Чтобы его состояние изменилось — надо начать что-то с ними делать. Например, смешать, залить в форму и отправить в духовку. Тогда состояние будет «В процессе готовки».
Потом, когда бисквит испечется, мажем его кремом и украшаем. Он становится у нас «Торт украшен».
Но сразу есть его нельзя, мы ставим в холодильник, чтобы украшение застыло, а только потом мы можем его есть. После холодильника состояние становится «Торт готов». А вот дальше — разнообразие)
Мы можем съесть торт, тогда он станет «Торт съеден».
Возможно, мы уедем и не съедим торт, пока его можно есть. Тогда он станет «Торт испорчен».
Кстати, в процессе приготовления могли быть и другие ответвления. Например:
— передержали бы бисквит, состояние изменилось бы на «Торт испорчен»;
— не стали бы украшать бисквит и корж испортился бы → «Торт испорчен»;
— Ну тут-то я, получается, покупаю готовый торт. И уже размышляю, что с ним делать.
— Ок, изначально торта у Вас не было. Потом у Вас появилось состояние «Торт куплен». А дальше то, что происходит после «Торт готов» ¯\_(ツ)_/¯
Торт может быть съеден, может стать испорченным, может быть подарен, а только потом его уже съедят/не съедят, может быть выброшен. Все зависит от системы.
— То есть, я правильно понимаю?
2. Поставила в холодильник на потом
3. Передумала, достала, надкусала
4. Снова передумала, решила съесть целиком, осилила половину
5. Расстроилась и решила не доедать вообще и выкинуть
Это всё не важно и состояние торта не меняется, пока он не съеден или не стух?)
— Ну он же еще является тортом? Если его начали есть, но не закончили — можно ввести промежуточное состояние «В процессе уничтожения» =))
1-2 это торт куплен
3-4 это в процессе уничтожения
— Тогда чем это отличается от
1. Купила — добавлен на сайт/загружен на сайт/находится на сайте
2. Поставила в холодильник на потом — сохранен, чтобы посмотреть позже
5. Расстроилась и решила не доедать вообще и выкинуть — просмотр прерван/торт в помойке
— 5-е он еще в процессе.
У сериалов обычно прогресс есть, и его просто так не убрать 🙂
— либо он в процессе просмотра
Примеры S&T
Примеры диаграмм можно посмотреть в конфлюенсе (доступ открытый без авторизации). Туда я выношу хорошие работы своих студентов. Их там сильно больше, чем в этом разделе статьи + обычно там можно и сам исходник скачать, чтобы внимательно всё рассмотреть. Welcome =)
Вот некоторые из этих работ:
Ольга (объект — тест)
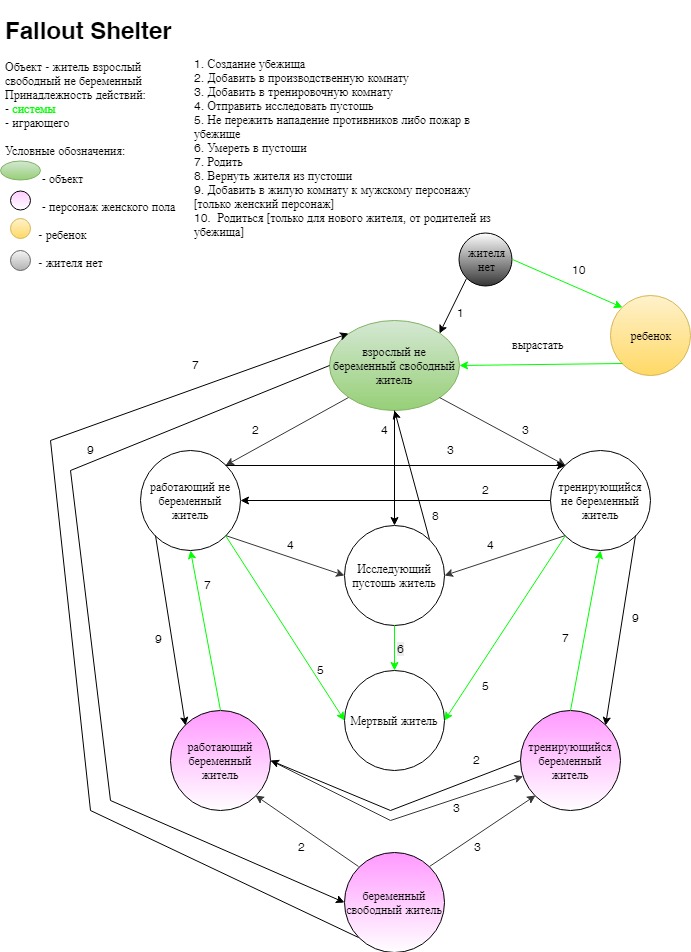
Кристина (Fallout Shelter)
Fallout Shelter — игра под iOS, Android. В постапокалиптическом мире несколько людей было выбрано для создания светлого будущего. Их поместили в небольшое убежище, уходящее под землю. Это убежище необходимо развивать, защищать от угроз из внешнего мира, увеличивать количество жителей, производить ресурсы, выполнять квесты.
State Transition для пина в Pinterest
Типовые ошибки при составлении карты
На примере своих студентов мы собрали несколько типовых ошибок, которые допускают тестировщики, впервые рисуя карту:
1. Вместо объекта — GUI
Очень важно: S&T рисуется на объект! Это не зарисовка графического интерфейса «открыта страница такая, открыта страница сякая». Если вы описываете разные странички GUI — это уже не S&T.
Зарисовывать страницы смысла обычно нет. Это как при рисовании майнд-карты — мы не рисуем графический интерфейс, мы описываем функционал. То, зачем пользователь вообще пришел на сайт. Это намного полезнее!
Другой вариант той же ошибки: искать билет — (результаты поиска) — открыть форму покупки — (форма открыта) — ввести данные кредитной карты — (данные введены).
2. Несколько объектов в одной карте
На прошлой картинке у нас несколько объектов: результаты поиска, форма, данные. И все — плохие. Потому что там мы явно что-то покупаем, вот это «что-то» и есть объект!
Но когда мы описываем покупку, тоже легко скатиться в несколько объектов в одной карте: «пицца в корзине», «заказ оформлен».
Товар тоже очень часто путают, потому что есть два варианта:
как на авито — продается конкретная вещь: «Нет на сайте», «Продается», «Продан».
просто «товарная позиция», как какие-нибудь носки в магазине одежды: «Отсутствует», «В наличии», «Ожидается поступление» и так далее.
Если речь о сайте типа авито, то объект лучше выбрать «объявление», будет логичнее. А вот если мы покупаем пиццу — это будет товарной позицией.
3. Несколько одинаковых состояний
Вспомните пример с тортиком:
Поставила в холодильник на потом.
Передумала, достала, надкусала.
Снова передумала, решила съесть целиком, осилила половину.
Расстроилась, решила не доедать вообще и выкинуть.
Половину пунктов можно объединить. Ведь состояние торта не меняется от того, купили вы его только что или час назад, сидите любуетесь на него, переставляете с места на место или убираете в холодильник:
1-2 это торт куплен;
3-4 в процессе уничтожения;
Другой пример — объект «пин»:
пин перенесен другим пользователем себе на доску.
Но, когда пин откомментирован или сдублирован — это тоже самое, когда он просто создан. Состояние самого пина не меняется!
товар найден при поиске
Одно и то же с точки зрения товара. Он как был, так и есть.
Плюсы подхода
Плюс рисования — это визуализация ТЗ, которая:
Позволяет увидеть, что мы упустили
На входе унылая стена текста, а мы красиво зарисовали, при этом разными цветами — вот данные попали туда, вот сюда. В итоге наглядно видим весь маршрут нашего объекта.
И пока мы рисуем его маршрут, мы можем сразу же заметить, что «Ага! Вот из этого состояния, наверное, можно вернуться ещё вот в это», то есть мы можем понять, что упускаем. А если бы не нарисовали, то даже не додумались бы до такого теста!
Минусы подхода
Не всегда визуализация делает ТЗ понятнее. И тогда начинаем думать, как это решать:
Слишком насыщенная карта — разбиваем на несколько маленьких.
Сложно поддерживать — нужна ли она вообще?
Если на диаграмме куча всего — это плохо, ведь ее главная фишка — понятность. И если мы на нее смотрим и просто теряемся в этом объеме стрелочек — значит, схема нам не помогает.
Поэтому если схема насыщенная — разбиваем на мелкие. Которые, возможно, ссылаются друг на друга. То есть вот есть верхнеуровневая схема, а вот на каждое действие есть уровни подетализированнее.
Не стоит рисовать все-все-все стрелочки. Из любого состояния можно закрыть браузер, но не надо рисовать это. Просто держите в уме, что есть кнопка «закрыть», а еще может интернет пропасть, или сервер упадет, или еще какая катастрофа случится.
На диаграмме же показываем все важные стрелочки. Если их слишком много, то придумываем, как уменьшить их количество, чтобы не переборщить, потеряв наглядность.
Инструменты для рисования
Xmind (freemind, etc)
Основной инструмент — ручка и бумага, или маркер и доска. Потому что если вам надо просто обсудить, что будет, «если из этого состояния перейти в это, и как должна система реагировать, если происходит вот то», то вполне достаточно нарисовать это от руки.
К тому же от руки получается быстрее, а иногда еще и красивее. Почему? Потому что когда мы начинаем использовать инструмент, то он нас ограничивает. Вот, нам надо нарисовать стрелочку, так, а как нам это сделать. Мы начинаем думать в стиле инструмента. Это как когда мы создаем презентации в power point, то вместо мыслей о докладе думаем, как бы назвать новый слайд.
А если бумажка рядом, можно спокойно генерить в голове идеи и условия. Что придумал? Зарисовал кое-как. Если очень хочется, потом перерисовал красиво. А, может, и так сойдет.
В любом случае смотрите сами. Если удобен какой-то инструмент — используйте его! Хорошо получаются такие схемы в Xmind или Yed, или в гуглодокументах. Попробуйте использовать несколько разных инструментов, а потом выберите тот, что больше по душе. Но в целом бумага и ручка вполне себе вариант!
Итого
Рисунок — мощнейший инструмент визуализации. Вот вы открываете статью с картинками, типа этой. На что вы смотрите в первую очередь — на картинку или на текст? Правильно, на картинку.
Поэтому я за то, что рисовать! Нарисовали? Добавили в ТЗ! Всем удобнее, даже заказчику. Ведь с картинками текс становится понятнее.
Настоятельно рекомендую рисовать диаграмму состояний и переходов. Пусть даже одноразово, маркером на доске, чтобы обсудить новое ТЗ, которое пришло от аналитиков.
Зарисовали, позвали аналитика и стали обсуждать:
— А вот смотрите, вот эта стрелочка. может нам стоит сделать еще вот это?
— А что будет, если вот так?
Кстати, лайфхак. Если зарисовали маркером и жалко свое творчество (уж больно продуктивное общение с командой вышло) — сфотографируйте и выложите в конфлюенс рисунок! Не обязательно тратить время на перерисовку =)
См также (напомню ссылочки):
Как составлять вариант использования — вариант оформления требований без рисований.
диаграмма состояния
ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма)
графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния температуры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем, состоящих из многих фаз и компонентов, построение Д. с. является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния. Каждое реально существующее состояние системы на Д. с. изображается т. наз. фигуративной точкой; областям существования одной фазы отвечают участки пространства (на трехмерных Д. с.) или плоскости (на двухмерных Д. с.), условиям сосуществования фаз — соотв. поверхности или линии; изменение фазового состояния системы рассматривается как движение фигуративной точки на Д. с. Анализ относит. расположения объемных участков, поверхностей, линий и точек, которые образуют Д. с., позволяет однозначно и наглядно определять условия фазового равновесия, появления в системе новых фаз и хим. соед., образования и распада жидких и твердых растворов и т. п. Д. с. используют в материаловедении, металлургии, нефтепереработке, хим. технологии (в частности, при разработке методов разделения веществ), производствах электронной техники и микроэлектроники и т. п. С ее помощью определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы сплавов и т. п. Теоретич. основами построения и интерпретации Д. с. равновесных систем являются: 1) условие фазового равновесия, согласно которому хим. потенциалы mi каждого i-го компонента во всех фазах при равновесии равны; 2) условие химического равновесия, согласно которому сумма хим. потенциалов вступающих в реакцию веществ при равновесии равна аналогичной сумме для продуктов реакции; 3) фаз правило Гиббса, согласно которому число компонентов К, число фаз Ф и вариантность системы v ( т. е. число независимых параметров состояния, которые можно в определенных пределах изменять без изменения числа и природы фаз) связаны соотношением: v = К — Ф + 2. Цифра 2 означает, что учитываются только два интенсивных параметра состояния — температура и давление. Если учитываются и др. параметры, напр., напряженности электромагнитного или гравитационного полей, вариантность системы соотв. увеличивается. Различают нонвариантные (v = 0), моновариантные (v = 1), дивариантные (v = 2) и т. д. состояния (равновесия); 4) правило о соприкасающихся пространствах состояния, согласно которому если два разных пространства состояния (поля в случае плоской диаграммы) соприкасаются по линии, то они различаются между собой на одну фазу, если поля соприкасаются в точке, то состояния различаются на две фазы. Для построения Д. с. расчетным путем необходимо знать зависимости хим. потенциалов всех компонентов системы от Т, р и состава фаз. Приближенные методы расчета с применением ЭВМ интенсивно развиваются, в частности, для многокомпонентных сплавов. Однако пока Д. с. строят на основе эксперим. данных, получаемых гл. обр. термическим анализом, который позволяет определять зависимости температур плавления или кристаллизации от состава, а также изучением равновесий жидкость — пар и жидкость — жидкость. Широко используют рентгеновский фазовый анализ, данные о микроструктуре затвердевших расплавов, измерения физ. свойств фаз ( см. диаграмма состав-свойство). Изучение Д. с. составляет осн. содержание физико-химического анализа.
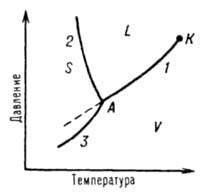
Однокомпонентные системы. Однокомпонентной системой является любое простое вещество или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Д. с. обычно строят на плоскости в координатах Температур (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т. е. допускают одновременное изменение двух параметров состояния — Т и р.
Рис. 1. Диаграмма состояния однокомпонентной системы. S, L и V — соотв. области существования твердой, жидкой и паровой фаз; 1, 2 и 3 кривые кипения (испарения), плавления и возгонки (сублимации) соотв., К критич. точка; А тройная точка.
Двухфазное равновесие между жидкостью и паром изображается кривой кипения (или испарения) 1, между жидкостью и кристаллами — кривой плавления 2, между кристаллами и паром — кривой возгонки (или сублимации) 3. Все двухфазные равновесия моновариантны, т. е. не нарушаются при произвольном изменении только одного из параметров, Т или р; при этом значение другого определяется из Д. с. Кривая кипения 1 характеризует зависимость давления насыщенного пара вещества от температуры или зависимость температуры кипения вещества от внеш. давления. Со стороны повышенных T и р эта кривая заканчивается в критич. точке К, где исчезает различие в свойствах между жидкостью и ее паром (подробнее см. ст. Критическое состояние). Жидкость может находиться в переохлажденном состоянии (пунктирная линия на рис. 1). Аналогично кривая плавления характеризует зависимость температуры плавления от внеш. давления, кривая возгонки — температурную зависимость давления насыщенного пара над твердым веществом. На рис. 1 ход кривой плавления соответствует повышению температуры плавления с ростом давления, однако возможно и понижение температуры плавления с давлением ( см. Клапейрона — Клаузиуса уравнение). Все три кривые моновариантных фазовых равновесий сходятся в тройной точке А, отвечающей параметрам состояния, при которых находятся в нонвариантном равновесии три фазы. Д. с. усложняется, если вещество в твердом состоянии может существовать в разл. кристаллич. модификациях. Каждой модификации отвечает свое фазовое поле. Линии моновариантных равновесий, разграничивающие эти поля, наз. кривыми превращений.
Двойные системы. Состояние двойной системы определяется тремя независимыми параметрами — Т, р и содержанием х одного из компонентов, поэтому Д. с. такой системы трехмерна. Обычно принимают постоянными Т или р и рассматривают соответствующие плоские сечения Д. с., называемые соотв. изотермич. (р — х) или изобарными (Т — х)Д. с. В конденсир. системах роль давления сравнительно невелика и в качестве параметров состояния обычно выбирают Т и состав (концентрацию одного из компонентов).
Д и а г р а м м ы п л а в к о с т и. Такие Д. с. служат для установления условий равновесия между твердыми и жидкими фазами. Рассмотрим их осн. типы. Простейший вариант соответствует случаю, когда компоненты А и В образуют одну жидкую фазу (расплав или раствор), при охлаждении которой только выделяются (кристаллизуются) индивидуальные вещества (не образуются ни твердые растворы, ни хим. соед.).
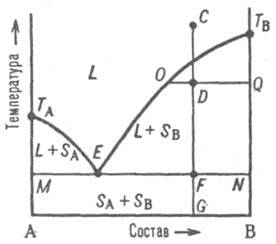
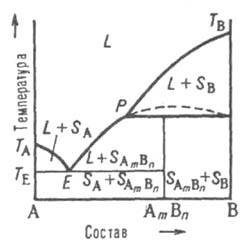
Рис. 2. Диаграмма плавкости двойной системы, компоненты которой А и В не образуют твердых растворов. L — область существования жидкости (расплава), (L + SA) и (L + SB) области сосуществования жидкой фазы и твердых А и В соотв.; (SA + SB) область существования мех. смеси твердых А и В. ТАETВ и MEN — линии ликвидуса и солидуса соотв., E-эвтектич. точка. С, D, F, G, О и Q фигуративные точки (пояснения в тексте).
На Д. с. (рис. 2) линия, изображающая зависимость от состава температуры начала выделения из жидкой фазы твердого компонента (начала равновесной кристаллизации), наз. линией ликвидуса. Она состоит из двух ветвей ТАЕ и ТВЕ, отграничивающих фазовое поле жидкости L от полей сосуществования жидкой фазы с твердыми А и В соотв. (поля L + SA и L + SB). Линия, изображающая зависимость от состава температуры окончания равновесной кристаллизации при охлаждении (или начала плавления при нагр.), наз. линией солидуса. Ниже нее расположено фазовое поле SA + SB твердого состояния системы, отвечающее условиям сосуществования двух твердых фаз. Происходящие в системе фазовые изменения описываются след. образом. При охлаждении жидкой фазы, напр., из начального состояния С, фигуративная точка системы в целом движется вниз вдоль прямой CG. В точке ее пересечения с линией ликвидуса начинается кристаллизация компонента В, система становится двухфазной и дивариантной или, поскольку давление фиксировано, условно моновариантной. По мере кристаллизации В жидкость обогащается компонентом А, ее состав изменяется по ветви ликвидуса и по достижении системой состояния, изображаемого, напр., фигуративной точкой D, жидкой и твердой фазам соответствуют фигуративные точки О и Q. Прямые, соединяющие фигуративные точки двух находящихся в равновесии фаз, наз. нодами (или коннодами); горизонтальные ноды, подобные OQ, можно провести через любые точки фазовых полей, отвечающих гетерог. состояниям системы. При выражении состава в массовых (молярных) долях отношение отрезков OD и DQ пропорционально отношению масс (чисел молей) твердой и жидкой фаз ( т. наз. правило рычага). Оно позволяет рассчитать по Д. с. относительные количества фаз при любой температуре, чтобы, напр., определить полноту кристаллизации или степень извлечения данного компонента из жидкой фазы в твердую. В точке F пересечения прямой CG с линией солидуса начинается кристаллизация компонента А. Система становится трехфазной (жидкость и две твердые фазы А и В) и моновариантной (условно нонвариантной), т. е. при постоянном давлении совместная кристаллизация двух твердых фаз ( т. наз. эвтектич. кристаллизация) протекает при постоянных температуре и составе жидкой фазы, отвечающих координатам эвтектич. точки Е. После завершения эвтектич. кристаллизации система состоит из двух твердых фаз и является дивариантной (условно моновариантной). В обсуждаемом случае система после затвердевания состоит из относительно крупных кристаллов В и мелкодисперсной смеси совместно возникших при эвтектич. кристаллизации кристаллов А и В; такую смесь наз. эвтектикой. Если исходная жидкость имела эвтектич. состав, продукт ее затвердевания — мелкодисперсная эвтектика без примеси крупных кристаллов к.-л. из компонентов. При нагр. смеси твердых А и В описанные явления протекают в обратной последовательности: изотермич. образование жидкости эвтектич. состава вплоть до исчерпания к.-л. из твердых компонентов и растворение в жидкости оставшегося твердого компонента при дальнейшем повышении температуры, которое завершается по достижении фигуративной точкой системы линии ликвидуса. Второй тип диаграммы характерен для случая ограниченной растворимости компонентов в твердом состоянии. Твердый раствор В в А (обозначается α-раствор) образуется лишь до определенной концентрации В, твердый раствор А в В (β-раствор) — лишь до определенной концентрации А. Для таких систем возможны два случая трехфазного равновесия: 1) эвтектич. равновесие жидкого расплава состава Е, твердого раствора α, концентрация которого соответствует точке М, и твердого раствора β, концентрация которого соответствует точке N, при эвтектич. температуре, которая, как правило, ниже температур плавления TA и ТB обоих компонентов (рис. 3).
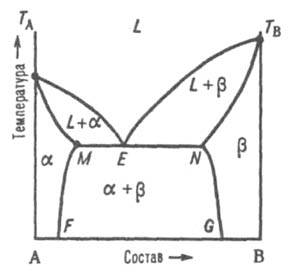
Рис. 3. Диаграмма плавкости двойной системы эвтектич. типа с ограниченными твердыми растворами. L, α и b — области существования жидкой фазы (расплав) и твердых растворов В в А и А в В соотв.; (L + α) и (L + β) — области сосуществования жидкой фазы и твердых растворов α и β соотв.; (α + β) — область сосуществования двух твердых растворов. ТАЕТВ и MEN — линии ликвидуса и солидуса соотв., E — эвтектич. точка.
При охлаждении затвердевшей смеси ниже линии солидуса MN происходит изменение концентраций твердых растворов α и β соотв. по линиям MF и NG, которые дают температурную зависимость растворимости в твердом состоянии В в А и А в В. 2) Равновесие при температуре Тр, которая является промежуточной между температурами плавления ТА и ТB. Если, напр., температура начала кристаллизации расплава с высоким содержанием А выше ТА (рис. 4), а с высоким содержанием В — ниже ТB, линия ликвидуса состоит из двух ветвей ТАР и ТВР, соответствующих кристаллизации твердых растворов α и β.
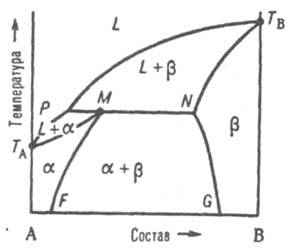
Рис. 4. Диаграмма плавкости двойной системы перитектич. типа. Р — перитектич. точка, остальные обозначения те же, что и на рис. 3.
Эти ветви пересекаются в т. наз. перитектич. точке Р — фигуративной точке жидкой фазы, которая может равновесно сосуществовать одновременно с двумя твердыми растворами α и β, составы которых определяются точками М и N. Линия солидуса состоит из трех ветвей: ТAМ, MN и NTB. При охлаждении двухфазной системы (L + β) до перитектич. температуры Тр в системе появляется третья фаза — раствор α. При протекании перитектич. превращения (фазовой реакции) жидкость (расплав) + твердый раствор b D твердый раствор α система моновариантна, или условно нонвариантна, т. е. при данном давлении равновесие возможно лишь при постоянных температуре и составах каждой из фаз. Если после окончания перитектич. реакции остается избыток жидкой фазы, система переходит в двухфазное поле (L + α). При дальнейшем охлаждении происходит кристаллизация твердого α-раствора. Послед. понижение температуры (ниже линии МF) приводит к тому, что однородный твердый α-раствор становится неустойчивым и, распадаясь, выделяет некоторое количество р-раствора, состав которого отвечает линии NG. Если после окончания перитектич. реакции полностью исчезает жидкая фаза, система переходит в двухфазное поле α + β; по мере снижения температуры составы α- и β-растворов изменяются в соответствии с ходом линий MF и NG. Возможны и др. трехфазные равновесия, напр., при наличии у одного из компонентов полиморфных модификаций, когда все три сосуществующие фазы являются твердыми. Полиморфная модификация γ может участвовать в т. наз. эвтектоидном превращении γ ⇄ α + β или в перитектоидном превращении γ + α ⇄ β, в принципе аналогичных рассмотренным выше эвтектич. и перитектич. превращениям. При метатектическом превращении модификация γ при охлаждении распадается на твердую и жидкую фазы: γ ⇄ α + L. Третий тип диаграммы описывает состояния двойной системы, компоненты которой А и В образуют устойчивое хим. соед., которое не разлагается вплоть до температуры плавления и переходит в жидкую фазу того же состава, т. е. плавится конгруэнтно.
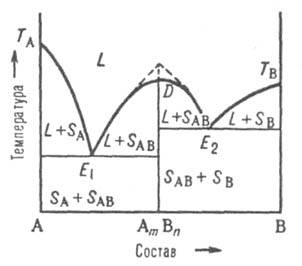
Рис. 5. Диаграмма плавкости двойной системы, компоненты которой А и В образуют конгруэнтно плавящееся хим. соед. АmВn. D — сингулярный максимум, Е1 и Е2 — эвтектич. точки; остальные обозначения те же, что и на рис. 3 и 4.
В точке плавления, соответствующей стехиометрич. составу АmВn, на линии ликвидуса имеется сингулярный максимум (рис. 5); это значит, что линия D — АmВn разделяет систему на две подсистемы. На диаграмме максимуму отвечает излом (показан пунктиром на рис. 5). В каждой из подсистем взаимод. между компонентами, соотв. А и АmВn, В и АmВn, может быть представлено диаграммами эвтектич. или перитектич. (или любого другого) типа. Если соед. AmBn частично диссоциировано в жидкой фазе, максимум на кривой ликвидуса несколько сглажен в соответствии со степенью диссоциации. Если соед. АmВn диссоциирует и в твердом состоянии, то сглаженный максимум будет и на линии солидуса. Однако независимо от вида максимума, общий характер фазового равновесия в системе определяется характером взаимод. соед. АmВn с компонентами А и В.
Рис. 6. Диаграмма плавкости двойной системы, компоненты которой А и В образуют инконгруэнтно плавящееся хим. соед. АmВn, обозначения те же. что и на рис. 4 и 5.
Четвертый тип диаграмм. Компоненты А и В образуют хим. соед., разлагающееся ниже температуры плавления ( т. наз. инконгруэнтное плавление). Например, при охлаждении жидкости (расплава) до некоторой температуры Тр (рис. 6) кристаллизуется только компонент В; при Тр происходит перитектич. реакция с образованием хим. соед. АmВn в твердом состоянии, т. е. реакция твердая фаза SВ + расплав перитектич. состава D твердая фаза SА(m)В(n). Если при этом в твердой фазе компонент В имеется в избытке, в результате перитектич. реакции исчезает жидкая фаза и при дальнейшем охлаждении ниже Тр остается смесь двух твердых фаз SB и SА(m)B(n). Если же в твердой фазе компонента В недостает, в результате реакции исчезают кристаллы В и жидкость при дальнейшем охлаждении выделяет кристаллы соед. АmВn, изменяя свой состав по линии ликвидуса РЕ. При температуре ТЕ происходит эвтектич. кристаллизация AmBn и А. Возможны и др. варианты диаграммы. Описанные типы диаграмм плавкости могут усложняться из-за полиморфизма как компонентов А и В, так и соед. АmВn.
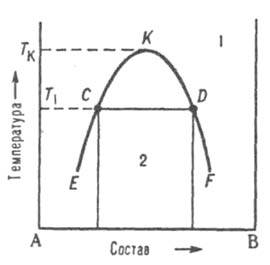
Диаграммы растворимости. При отсутствии в системе твердых фаз Д. с. состоит из области существования одной жидкой фазы ( т. наз. области гомогенности) и области сосуществования двух насыщенных жидких растворов разного состава, образующих несмешивающиеся друг с другом слои (рис. 7). Кривая, разделяющая эти области, наз. бинодалью. Так, при температуре Т1 в равновесии находятся раствор компонента В в А (его состав отвечает точке С) и раствор А в В (его состав отвечает точке D). Если однородный раствор 1 охладить до температуры Т1, он распадется на две жидкие фазы.
Рис. 7. Диаграмма растворимости двойной системы, компоненты которой А и В ограниченно растворимы друг в друге; 1 область существования однородного раствора, 2 область сосуществования двух насыщенных растворов; ECKDF — бинодаль, CD — нода, К — верхняя критич. точка растворимости.
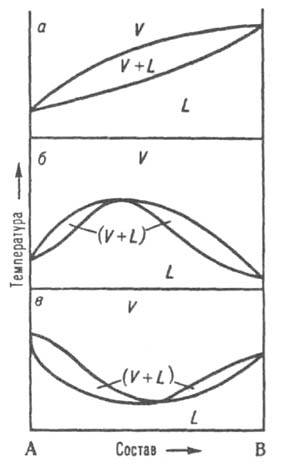
Обычно при повышении температуры взаимная растворимость жидкостей увеличивается, поэтому по своим свойствам оба насыщенных раствора, составы которых изменяются по отрезкам бинодали ЕК и KF, сближаются. Наконец, при температуре Tк различие между ними исчезает; эта температура наз. критической температурой растворимости (смешения), выше нее может существовать лишь одна жидкая фаза. Большинство систем с расслоением растворов характеризуются только одной критич. температурой растворимости, чаще всего верхней, т. е. на Д. с. имеют незамкнутую снизу бинодаль. Если в таких системах не образуются хим. соед., область сосуществования двух жидких фаз ограничена снизу кривой кристаллизации одного из компонентов при температуре превращения жидкая фаза 1 ⇄ жидкая фаза 2 + твердая фаза. Такое трехфазное равновесие наз. монотектическим; оно по своей термодинамич. природе аналогично эвтектическому или эвтектоидному. При синтектическом трехфазном равновесии две жидкие фазы взаимодействуют с образованием твердого соед. Такое равновесие аналогично перитектическому. В некоторых системах бинодаль имеет форму замкнутой кривой (овал), т. е. система имеет две температуры смешения верхнюю и нижнюю. Диаграмма равновесия жидкость-пар. При р = const каждому составу жидкой смеси отвечает определенная температура равновесия с паром и определенный состав пара, отличающийся, как правило, от состава жидкой смеси. На Д. с. (рис. 8, а) кривые кипения и конденсации изображают зависимости температур начала кипения и конденсации от состава и отделяют поля жидкости L и пара V от поля (L + V) гетерог. состояний жидкость-пар. На кривой кипения м. б. экстремум: максимум (рис. 8, б) или минимум (рис. 8, в); в этих точках кривая кипения касается кривой конденсации, т. е. составы равновесных жидкости и пара совпадают Жидкие смеси такого состава полностью выкипают, подобно чистым жидкостям, при постоянной температуре без изменения состава ( см. азеотропные смеси). Д. с., описывающие равновесия двухкомпонентных твердых растворов с жидкими растворами и жидких растворов с паром, подобны.
Рис. 8. Диаграммы состояния, двойной системы, описывающие равновесие жидкость — пар. L и V области существования жидкости и пара соотв.. (L + V) область сосуществования жидкой и паровой фаз; а система без азеотропной точки; б и в два типа азеотропных смесей
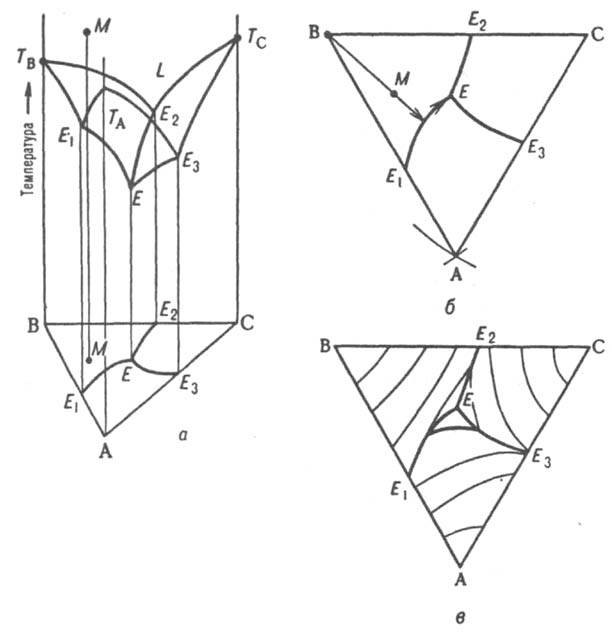
Тройные системы. Состояния тройных систем однозначно определяются четырьмя независимыми параметрами: Т, р и молярными (массовыми) долями двух компонентов (доля третьего компонента определяется из условия равенства единице суммы долей всех компонентов). Поэтому при построении Д. с. тройных систем один из независимых параметров (р или Т) или два (р и T) фиксируют и рассматривают пространственные изобарные или изотермич. диаграммы или плоские изобарно-изотермич. диаграммы, соответствующие одному из сечений пространственной Д. с. Каждому составу тройной смеси отвечает определенная точка на плоскости составов. Область возможных составов тройных систем наз. композиционным треугольником или треугольником составов. В системе прямоугольных координат он представляет собой прямоугольный равнобедренный треугольник, вершины которого отвечают компонентам А, В и С, а стороны — двойным смесям АВ, ВС и СА. Более распространено использование равностороннего композиц. треугольника. В этом случае все компоненты равноправны, а за начало координат можно с равным основанием принять любую из его вершин ( см. многокомпонентные системы). Для построения пространств. изобарной или изотермич. Д. с. по координатной оси, перпендикулярной композиц. треугольнику, откладывают соотв. T или р. При этом фигуративные точки системы в целом и ее трехкомпонентных фаз оказываются расположенными внутри трехгранной призмы, грани которой изображают двойные системы, ребра — однокомпонентные системы. На рис. 9, а изображена простейшая диаграмма плавкости тройной системы, компоненты которой А, В и С не образуют друг с другом твердых растворов и (или) хим. соед. и не расслаиваются в жидком состоянии (неограниченно взаимно растворимы). Поверхность температур начала кристаллизации тройных расплавов (поверхность ликвидуса) состоит из трех полей -ТAЕ1ЕЕ3, TBE1EE2 и ТCE2EE3, отвечающих кристаллизации А, В и С соотв. и разделенных тремя пограничными кривыми E1E, E2E и E3E. Ортогональные проекции пограничных линий на композиц. треугольник образуют т. наз. плоскую диаграмму плавкости тройной системы (рис. 9, б) с тремя полями кристаллизации компонентов AE1EE3, ВE1EE2, СE2EE3 Более полную информацию о системе дает плоская диаграмма с нанесенными на ней изотермами проекциями кривых пересечения поверхности ликвидуса равноотстоящими плоскостями (рис. 9, в). Рассмотрим с помощью Д. с. процессы, происходящие при охлаждении жидкого расплава, первоначальное состояние которого изображается, напр., фигуративной точкой М. Поскольку вертикальная прямая, проходящая через М, пересекает поле кристаллизации В (на плоской диаграмме проекция точки М находится в поле кристаллизации В), первым начинает кристаллизоваться именно этот компонент.
Рис. 9. Диаграмма плавкости тройной системы эвтектического типа: а — пространственная диаграмма, б плоская диаграмма, в плоская диаграмма с нанесенными на ней изотермами. ТА, ТB, ТC температуры плавления компонентов А, В и С соотв., L область существования жидкой фазы; E1, E2, E3 эвтектич. точки двойных систем АВ, ВС и СА соотв., Е тройная эвтектич. точка; М фигуративная точка системы.
Первоначально однофазная и четырехвариантная (условно трехвариантная) система становится двухфазной и трехвариантной (условно дивариантной). Соотношение количеств А и С в расплаве при кристаллизации В не изменяется, поэтому состав жидкости в ходе кристаллизации В изменяется вдоль прямой (луча кристаллизации), проходящей через точки М и В в направлении удаления от вершины В. В точке пересечения луча кристаллизации с пограничной кривой Е1Е начинает кристаллизоваться еще и А, система становится трехфазной (условно моновариантной). При дальнейшем охлаждении фигуративная точка жидкой фазы смещается вдоль пограничной линии Е1Е по направлению к тройной эвтектич. точке Е, в которой происходит кристаллизация всех трех компонентов при постоянной температуре, завершающаяся полным затвердеванием системы. Эвтектич. температура отвечает условно нонвариантному равновесию всех четырех фаз. Кристаллизация тройной жидкой смеси любого состава в системе такого типа всегда заканчивается образованием тройной эвтектики, т. е. поверхностью солидуса рассматриваемой системы является горизонтальная плоскость, проходящая через точку Е. Обычно рассматривают изотермич. сечение изобарной пространственной диаграммы, наз. изобарно-изотермической. Если при некоторой температуре все три компонента — жидкости, из которых две ограниченно смешиваются друг с другом, на Д. с., как и в случае двойных систем, имеется область сосуществования двух жидких фаз, ограниченная бинодалью ЕKF (рис. 10). Если жидким является лишь один из компонентов, напр., вода в системе, содержащей еще две соли В и С с общим ионом, диаграмма растворимости (рис. 11) состоит из четырех полей, отвечающих одной жидкой фазе L (поле ADEF), двухфазным состояниям (L + SВ) (поле DEB) и (L + SC) (поле FEC) с йодами, проходящими соотв. через точки В и С, и условно нонвариантному трехфазному состоянию (L+ SB + SС) (поле ВЕС), в котором твердые В и С находятся в равновесии с насыщенным этими веществами раствором состава Е, который наз. эвтоническим; отвечающая ему фигуративная точка наз. эвтонической или эвтоникой.
Рис. 10. Изобарно-изотермич. диаграмма состояния тройной системы ABC с ограниченной взаимной растворимостью компонентов А и С в жидком состоянии. EKF бинодаль, К — верхняя критич. точка растворимости.
Рис. 11. Изобарно-изотермич. диаграмма растворимости твердых В и С в жидком растворителе A. DE и EF — линии растворимости (кристаллизации), Е — эвтонич точка (эвтоника).
Линии DE и FE — геометрич. место точек жидких фаз, находящихся в равновесии соотв. с твердыми В и С; они наз. линиями растворимости, или линиями кристаллизации, этих компонентов, т. к. в частном случае водных растворов при изотермич. испарении воды, сопровождающемся движением фигуративной точки жидкости вдоль луча испарения, выходящего из вершины А, по достижении фигуративной точкой одной из этих линий начинается кристаллизация соответствующего компонента. При образовании в тройной системе хим. соед. (двойных солей, кристаллогидратов, интерметаллич. соед. и т. п.), а также твердых растворов пространственные Д. с. и их плоские сечения усложняются. Для тройных водно-солевых систем, содержащих соли с общими ионами, при построении изобарно-изотермич. Д. с. по координатным осям (в прямоугольной системе координат) иногда откладывают не массовые или молярные доли компонентов, а молярные концентрации солей или молярную долю одной из солей в общей солевой массе и число молей воды на 100 молей солевой массы. Разработаны спец. методы построения Д. с. для тройных систем, между компонентами которых возможны реакции замещения (обмена) или вытеснения, а также для систем, содержащих четыре и более компонентов.
Лит.: Кауфман Л., Бернстейн Г., Расчет диаграмм состояния с помощью ЭВМ, пер. с англ., М., 1972; Аносов В. Я., Озерова М. И., Фиалков Ю. Я., Основы физико-химического анализа, М., 1976; Захаров А. М., Диаграммы состояний двойных и тройных систем, 2 изд., М., 1978; Новосёлова А. В., Методы исследования гетерогенных равновесий, М., 1980; Глазов В. М., Лазарев В. Б., Жаров В. В., Фазовые диаграммы простых веществ, М., 1980; Зломанов В. П., р-Т-х диаграммы двухкомпонентных систем, М., 1980; Петров Д. А., Двойные и тройные системы, М.. 1986.