Ttf1 при иммуногистохимии что это
Ttf1 при иммуногистохимии что это
Immunohistochemistry, IHС, immunohistochemical analysis.
Какой биоматериал можно использовать для исследования?
Образец ткани / образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Иммуногистохимическое исследование клинического материала проводится в целях выявления в нем искомых веществ. Готовые гистологические препараты обрабатываются специальными реактивами, содержащими меченые специфические антитела к выявляемому веществу, которое в данной ситуации служит антигеном. Если искомое вещество находится в исследуемом материале, то антитело связывается с его определенными участками. В результате этого между ними образуется комплекс и происходит окрашивание ткани.
Данный метод используется в диагностике различных патологических состояний, особенно велика его роль в области онкологии. Иммуногистохимическое (ИГХ) исследование помогает не только диагностировать опухоль, определить ее нозологический вариант, выявить первичный опухолевый очаг и обнаружить раковое перерождение клеток, но также спрогнозировать варианты течения заболевания и успешность лечения. К факторам, влияющим на прогноз, относятся рецепторы к эстрогенам и к прогестерону, Ki-67 (маркер активности опухоли), her-2 neu (эпидермальный фактор роста, определяет чувствительность опухоли к химиопрепарату трастузумабу/герцептину), VEGF (сосудистый фактор роста), Bcl-2, р53 и др. В отличие от иммуногистохимического анализа, их невозможно определить при обычном гистологическом исследовании.
На основе ИГХ-анализа врач получает заключение с положительными и отрицательными маркерами, и это помогает подтвердить или опровергнуть гипотезу других клинико-лабораторных исследований.
Рак шейки матки относится к наиболее распространенным видам рака у женщин. Эпидемиологические и лабораторные данные подтверждают роль человеческого папиллома-вируса (ВПЧ, HPV) в качестве запускающего агента для подавляющего большинства предраковых и злокачественных поражений эпителия слизистой оболочки шейки матки. При этом ДНК ВПЧ могут быть обнаружены в 95-100% всех случаев.
Вирус папилломы человека представляет собой небольшие циркулярные двухцепочечные вирусы дезоксирибонуклеиновой кислоты (ДНК), принадлежащие к семейству Papillomaviridae. Известно более 130 типов ВПЧ. Они классифицируются по степени риска, основанного на их связи с цервикальной карциномой. ВПЧ 16 и 18 являются наиболее часто встречающимися типами высокого риска. Внедряясь в эпителиальные клетки, вирус вызывает в них дефекты генов, тем самым способствуя развитию опухоли. При помощи ИХГ легко обнаружить в клетках, пораженных HPV, экспрессию белков p16 и p18, и их позитивность сильно коррелирует с позитивностью HPV. Это помогает различить неопухолевую дисплазию (как результат воспаления) и опухолевую (вызванную вирусом папилломы и способную переродиться в рак), а также позволяет провести дифференциальную диагностику дисплазии умеренной и высокой степени тяжести (CIN II/III) и начальных форм рака шейки матки, выявление поражений, склонных к прогрессированию и развитию инвазивной карциномы. В дисплазиях умеренной и высокой степени (в 80-100% случаев CIN II и практически во всех случаях CIN III) и инвазивном раке шейки матки определяется усиленная экспрессия белка p16, и она усиливается по мере нарастания тяжести поражения.
У женщин с плоскоклеточными интраэпителиальными поражениями низкой степени тяжести очаговая и диффузная экспрессия свидетельствует о прогрессировании заболевания. Отсутствие или очаговая экспрессия p16 в поражениях высокой степени может служить дополнительным признаком благоприятного течения патологического процесса.
Применяется иммуногистохимическое исследование и при дифференциальной диагностике целиакии.
Целиакия – это системное заболевание, обусловленное генетической непереносимостью глютена или соответствующих проламинов, которые содержатся в семенах злаков. Характеризуется данная патология повреждением слизистой оболочки тонкой кишки (развитием атрофической энтеропатии), появлением в сыворотке крови специфических антител и широким спектром глютензависимых клинических проявлений. Заболевание встречается в два раза чаще среди женщин, чем среди мужчин, может впервые проявиться как в детстве, так и у взрослых. Целиакия может протекать с ярко выраженной или со стертой клинической картиной, а также без гастроэнтерологической симптоматики. Чаще всего встречается стертый вариант течения заболевания, поэтому диагностика глютеновой энтеропатии (ГЭ) затруднена.
На первичном лабораторном этапе проводится серологическое исследование, определяющее в крови специфические биомаркеры. Лицам с положительными результатами показана эндоскопия тонкой кишки с биопсией и последующим гистологическим и ИГХ анализом взятого материала.
Известно, что целиакия сопровождается повышением числа лимфоцитов внутри эпителиальных клеток тонкой кишки. При этом отличительной особенностью является то, что большинство интраэпитиальных лимфоцитов (ИЭЛ) несут на своей поверхности специфический Т-клеточный рецептор (CD3 γ и CD3δ-положительные клетки). Чем активнее протекает заболевание, тем больше ИЭЛ. Эта особенность используется при проведении иммуногистохимического исследования, позволяющего определить преобладающий тип лимфоцитов. Особенно важен этот анализ, когда существует расхождение между данными серологического исследования и гистологической оценкой на стандартных участках.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Диапазон значений индивидуален для каждого заболевания, зависит от используемых антител.
Расшифровка результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Проводится морфологическая оценка препарата (опухоли классифицируются согласно ВОЗ), дается описательный ответ с указанием оценки экспрессии антитела. ИХГ всегда следует использовать в качестве дополнения к морфологическому исследованию, результаты не следует интерпретировать изолированно.
Что может влиять на результат?
При некоторых заболеваниях есть факторы, которые могут влиять на результат. Так, при диагностике целиакии назначение безглютеновой диеты до исследования может приводить к получению ложноотрицательного результата.
Кто назначает исследование?
Онколог, гинеколог, гастроэнтеролог, терапевт, педиатр.
Мелкоклеточный рак легкого
Заболеваемость и смертность от мелкоклеточного рака легких во всем мире делают эту болезнь заметной проблемой для здравоохранения. Диагноз основывается на результатах гистологии, для подтверждения проводят иммуногистохимические исследования в сложных случаях. Типичными пациентами являются мужчины старше 70 лет, которые были раньше или являются сейчас заядлыми курильщиками и которые имеют сопутствующие заболевания дыхательной и сердечно-сосудистой систем. Симптомы могут начать быстро проявляться из-за локального внутригрудного роста опухоли, внелегочного отдаленного распространения, паранеопластических синдромов или комбинации этих особенностей [2]. Термин МРЛ впервые введен в 1926 году, когда было признано его эпителиальное происхождение [2].
Эпидемиология
Рак легких является причиной 12 % всех выявленных случаев рака во всем мире и основной причиной смерти от рака в США [4]. МРЛ представляет 13 % всех вновь диагностированных случаев рака легких во всем мире, или более 180 000 случаев в год. В развитых странах распространенность МРЛ снизилась за последние 30 лет, вероятно, из-за антитабачной политики. Ожидается увеличение заболеваемости в странах, где распространенность курения остается высокой [2].
Гистология
Хотя в 95% случаях мелкоклеточный рак развивается в легких, он также может возникать во внелегочных участках, включая носоглотку, желудочно-кишечный тракт и мочеполовой тракт. 11-13 Мелкоклеточный рак, как легочный, так и внелегочный, имеющие сходное клиническое и биологические течение, склонны к быстрому метастазированию [3].
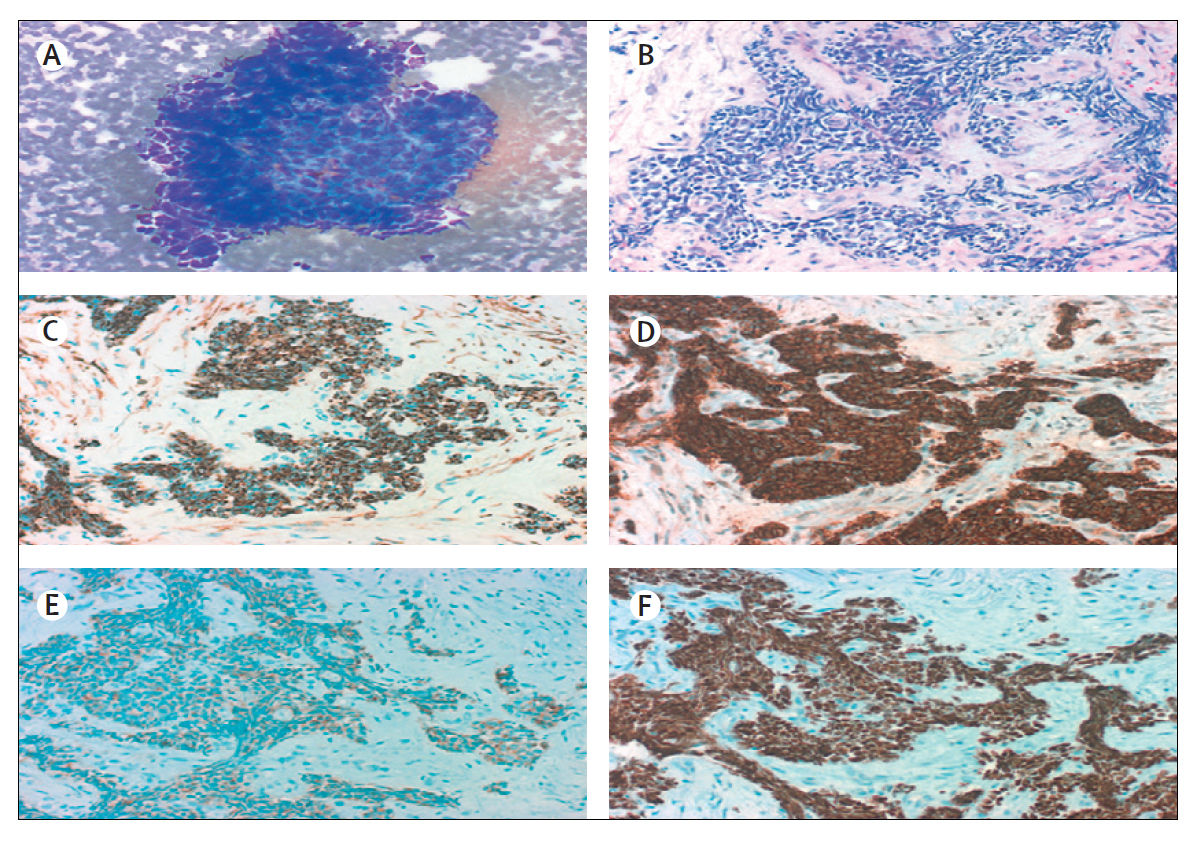
МРЛ — это злокачественная опухоль, состоящая из мелких эпителиальных клеток с небольшим количеством цитоплазмы, плохо очерченными клеточными границами, мелкозернистым ядерным хроматином и отсутствующими или незаметными ядрышками» (рис. 1). Клетки могут иметь круглую, овальную или веретенообразную формы. Типичный МРЛ включает только небольшие клетки и составляет около 90% всех случаев. Есть случаи, при которых опухоль содержит крупноклеточные компоненты [2,3]. С вероятностью 30 % при вскрытиях у пациентов с МРЛ выявляют участки немелкоклеточной дифференцировки карцином. Это чаще всего выявляется в образцах, полученных от ранее пролеченных пациентов и предполагает, что канцерогенез в легких происходит в плюрипотентных стволовых клетках, способных к дифференцировке по разным путям [3].
.
При иммуногистохимии результаты для (C) CK-7, нейроэндокринных маркеров (D) CD56 и (E) синаптофизина; и (F) TTF-1 положительны.
Все фотографии предоставлены с разрешения М. Праета и Л. Фердинанде, Гентский университет, Бельгия.
МРЛ можно заподозрить при наличии определенных симптомов и признаков. Для подтверждения диагноза требуются гистологические и цитопатологические исследования. Образцы из первичной опухоли, лимфатических узлов или других метастатических участков получают с помощью бронхоскопии или тонкоигольной аспирационной пункционной биопсии (ТАПБ). Опухоль растет под слизистой бронхов, и, следовательно, бронхоскопия или исследование мокроты могут не дать результатов. Иммуногистохимические исследования проводятся для подтверждения диагноза в сложных случаях. Тест на нейроэндокринные маркеры, такие как хромогранин, синаптофизин и CD56, также может быть полезным — менее 10 % опухолей МРЛ являются отрицательными для всех нейроэндокринных маркеров. Почти все МРЛ являются иммунореактивными в отношении кератина, антигена эпителиальной мембраны и фактора транскрипции щитовидной железы-1 (TTF-1) [3]. Реакция МРЛ на TTF-1 положительна в 90% случаев. Эпителиальные маркеры, такие как цитокератины, обнаруживаются во многих опухолях МРЛ и помогают отличить их от лимфом и других маленьких круглых опухолей. Но отличить мелкоклеточный от немелкоклеточного с помощью маркеров трудно [2].
Первыми описали отчетливые клинические особенности МРЛ Watson и Berg: центральное расположение на рентгенографии грудной клетки, тенденцию к раннему распространению, высокую чувствительность к химиотерапии и высокую частоту метастазов при вскрытии. Симптомы начинают проявляться, как правило, в течение 8–12 недель. Наиболее частыми симптомами являются кашель, хрипы, одышка, кровохарканье, вызванное локальным внутрипульмональным ростом опухоли; симптомы, обусловленные внутригрудным распространением на стенку грудной клетки, верхней полой веной или пищеводом, боль, усталость, анорексия и неврологические жалобы, вызванные отдаленное распространение и паранеопластические синдромы [2].
Предпочтительными участками для метастазирования являются мозг, печень, надпочечники, кости и костный мозг. МРЛ является наиболее частой причиной паранеопластических синдромов. Эти синдромы следует активно исключать всякий раз, когда у пациента проявляются какие-либо из их признаков. Наиболее частыми проявлениями синдромов со стороны эндокринной системы являются синдром неадекватного антидиуреза и синдром Кушинга. Известно о субклинических проявлениях обоих. Дерматологические аномалии, специфически связанные с МРЛ, включают приобретенный тилоз, трипальные пальмы и эритему. Редкими проявлениями являются дерматомиозит, гипергликемия, гипогликемия, гиперкальциемия и гинекомастия [2,4].
Классификация
Мелкоклеточный рак легкого входит в группу эпителиальных бронхопульмональных нейроэндокринных (НЭ) опухолей. Все НЭ опухоли легкого являются злокачественными новообразованиями и представлены четырьмя основными подтипами [1]:
1) типичный карциноид (ТК);
2) атипичный карциноид (АК);
3) крупноклеточный НЭ рак (КНЭР);
4) мелкоклеточный рак (МРЛ).
При этом ТК и АК являются высокодифференцированными нейроэндокринными опухолями с низкой степенью злокачественности (G1 и G2), а КНЭР и МРЛ — это низкодифференцированные нейроэндокринные опухоли с высокой степенью злокачественности (G3) [1,4].
Оценка распространенности опухолевого процесса влияет на решение о назначении терапии. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей [1,4].
Классификация, по которой выделяют пациентов с локализованным и распространенным мелкоклеточным раком легкого актуальна [1].
Локализованная стадия — опухоль занимает одну половину грудной клетки с регионарными метастазами в лимфоузлы корней легких с обеих сторон, с метастазами в надключичные узлы и лимфоузлы средостения, а также с выпотом в плевральной полости с этой же стороны.
Распространенная стадия — процесс, выходящий за пределы локализованного. Наличие М1 — это всегда распространенная стадия.
Лечение МРЛ
Распространенная стадия
Первая линия химиотерапии. В течение последних десяти лет комбинации ЕР или ЕС (этопозид + цисплатин / карбоплатин) является стандартом для лечения пациентов с МРЛ. Доказано, что противоопухолевая активность данного лечения при распространенном МРЛ составляет 60–78 % (полный эффект — у 10–20 % больных). Медиана выживаемости — 7,3–11,1 мес. Большинство новых режимов современной химиотерапии основыввется на комбинации ЕР (или ЕС) или путем замены этопозида на другое средство [1].
Вторая линия химиотерапии. Несмотря на высокую чувствительность МРЛ к химио- и лучевой терапии, в большинстве случаев приходится сталкиваться с рецидивом заболевания. В такой ситуации выбор дальнейшей лечебной тактики (химиотерапия второй линии) зависит от ответа пациентов на первую линию лечения, интервала времени, прошедшего после ее окончания, и от расположения метастазов [1,4].
Различают [1]:
• «чувствительный» рецидив — полный или частичный эффект от первой линии химиотерапии и прогрессирование опухолевого процесса не ранее 3 мес. после окончания индукционной терапии)
• «рефрактерный» рецидив, прогрессировавший в процессе индукционной терапии или менее чем через 3 мес. после ее окончания.
У пациентов с рецидивом МРЛ прогноз сомнительный, в особенности при рефрактерном рецидиве. Медиана выживаемости после обнаружения рецидива не превышает 4 месяца. В настоящее время схема CAV стала второй линией лечения МРЛ. Больным с резистентной формой МРЛ назначают химиотерапию второй линии. При этом эффективность отмечается у небольшого процента больных, но применение химиотерапии может стабилизировать болезни и/или замедлить прогрессирование [1].
Третья линия химиотерапии. Эффективность третьей линии химиотерапии распространенного МРЛ остается неизвестной. Больные в третьей линии могут получать таксол, гемцитабин, ифосфамид как в монотерапии, так и в комбинации с цисплатином или карбоплатином. Выживаемость больных с распространенным МРЛ следующая: 1 год после постановки диагноза живут 44 % больных, 1,5 года — 24 %, 2 года — 12 %, 3 года — 6 %, от 3,5 до 5 лет — 4 % больных [1].
Локализованная стадия МРЛ
У 50 % пациентов отмечается полная ремиссия и у них хорошие шансы на полное излечение. Стандартом современного лечения локализованного МРЛ является химиолучевая терапия, которая может проводиться как в одновременном, так и в последовательном режиме. Из всех схем комбинированной химиотерапии для комбинации с облучением наиболее удобной и подходящей оказалась схема этопозид + цисплатин. Лучевая терапия, начинающаяся на первой или второй неделе химиотерапии («ранняя ЛТ»), может проводиться в разовой дозе 1,5–2 Гр и суммарной дозе 45–50 Гр. Эффективность современной терапии при локализованном МРЛ колеблется от 65 до 90 %, с полной регрессией опухоли у 45–60 % больных и медианой выживаемости 18–24 мес [1].
Лучевая терапия МРЛ
Применяется у пациентов с локализованной и распространенной стадиями болезни. В результате отмечается регрессия опухоли в 60–80 % случаях, но отдельно от химиотерапии не увеличивает продолжительность жизни из-за появления отдаленных метастазов. Без облучения локальное прогрессирование болезни встречается у 80 % больных с локализованным МРЛ, получавших только химиотерапию. Лучевая терапия также проводится у больных с распространенной стадией (при метастазах в кости, в мягкие ткани, мозг). При появлении метастазов в мозге ЛТ является основным методом лечения. Химиолучевая терапия улучшает результаты лечения и увеличивает продолжительность жизни [1,4].
Профилактическое облучение мозга
Метастазы в головной мозг появляются у 20–30 % пациентов к моменту установления диагноза МРЛ и часто протекают бессимптомно. Иногда появление метастазов в головном мозге является первым симптомом МРЛ. Профилактическое облучение (ПОМ) показано больным с невыявленными метастазами в мозге, т. к. шансы на появление их в ближайшие 1,5–2 года достигают 70 % [1].
Таргетная терапия МРЛ
Молекулярно-генетические механизмы МРЛ разнообразны и пока недостаточно изучены. Для МРЛ характерны делеция хромосомы 3р, мутации гена р53, экспрессия Bcl-2, активация теломеразы и немутантного c-kit у 75–90 % пациентов. При МРЛ наблюдаются и другие молекулярные нарушения: экспрессия VEGF, потеря гетерозиготности хромосом 9р и 10q у большинства пациентов. Аномалии KRAS и р16 при МРЛ относительно редки. Многие таргетные препараты были изучены при МРЛ, но это не изменило клинические подходы и возможности терапии этого заболевания [1,2].
Хирургическое лечение МРЛ
Хирургическое лечение является доказанным методом выбора только у пациентов с I стадией болезни. Операция возможна у больных МРЛ и со II стадией, но клинических исследований недостаточно. При I стадии МРЛ 5-летняя выживаемость после операции — 48–50 %, а при II стадии — 32–39 %. Хирургическое лечение МРЛ также возможно у пациентов с неуточненным морфологичеким диагнозом и при наличии смешанных форм (с мелкоклеточным и немелкоклеточным компонентами). Во всех случаях через 2–3 нед. после оперативного вмешательства необходимо проведение адъювантной ХТ (4 курса с интервалами 3–4 нед.). Схемы адъювантной ХТ: этопозид + карбоплатин или этопозид + цисплатин [1].
Источники:
1. Бычков М.Б., Горбунова В.А. Клинические рекомендации по диагностике и лечению больных раком легкого // М.: Общероссийский союз общественных объединений ассоциация онкологов России. – 2014.
2. Fennell D. A. et al. Small-cell lung cancer //Lancet (London, England). – 2011. – Т. 378. – №. 9804. – С. 1741-1755.
3. Kalemkerian G. P. et al. Small cell lung cancer //Journal of the National Comprehensive Cancer Network. – 2013. – Т. 11. – №. 1. – С. 78-98.
4. Kalemkerian G. P. et al. NCCN guidelines insights: Small cell lung cancer, Version 2.2018 //Journal of the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 10. – С. 1171-1182.
Иммуногистохимия
Иммуногистохимия — способ исследования биологического материала после окрашивания с помощью специфических антител, которые связываются с определяемым веществом. Этот метод был разработан еще в первой половине ХХ века и к настоящему времени получил колоссальное развитие.
Выделяют два способа проведения реакции:
Антитела, используемые в иммуногистохимии, могут быть маркированы следующим способом:
Применение технологии в репродуктивной медицине
Иммуногистохимия в репродуктивной медицине применяется для диагностики причин бесплодия и оценки потенциальной эффективности ЭКО. Известно, что беременность при применении вспомогательных репродуктивных технологий наступает у 35–45 % пациенток после первой попытки. Около 30 % пациенток имеют многократные неудачи, причины которых различны, в том числе неблагоприятное состояние эндометрия.
Долгое время для изучения патологии эндометрия использовался гистологический метод исследования. Однако он не позволял достоверно оценить рецептивную способность эндометрия, что породило потребность в поиске более информативных методов диагностики. Одним из них стала иммуногистохимия, которую в настоящее время используют в следующих целях:
Ttf1 при иммуногистохимии что это
Экспертное заключение – доктор медицинских наук, профессор кафедры патологической анатомии лечебного факультета РГМУ М.В. Самойлов
Учебное пособие выполнено в рамках инновационной образовательной программы Российского университета дружбы народов, направление «Комплекс экспортоориентированных инновационных образовательных программ по приоритетным направлениям науки и технологий»
ПРИКЛАДНЫЕ ВОПРОСЫ ИММУНОГИСТОХИМИИ Тема № 4. Значение клеточных белков в оценке гистогенеза опухолей Тема № 5. Рецепторные белки в неизмененных и опухолевых клетках Тема № 6. Белки – маркеры клеточного цикла Тема № 7. Факторы апоптоза и пролиферации
ПРАКТИЧЕСКИЕ ВОПРОСЫ ОНКОМОРФОЛОГИИ
В настоящее время иммуногистохимический метод исследования широко применяется для выявления неизвестной локализации первичной опухоли при наличии её метастазов. От 10 до 15% раковых опухолей характеризуются метастазами в различных органах, полостях и лимфатических узлах.
При морфологической диагностике метастатические опухоли, согласно рекомендациям Европейского общества медицинской онкологии (ESMO, 2004), целесообразно разделять на пять крупных категорий: аденокарцинома, плоскоклеточный рак, нейроэндокринный рак, недифференцированный рак, недифференцированная опухоль. Эти морфологические категории наряду с данными о распространённости процесса во многих случаях позволяют определить адекватный план обследования и лечения.
Частота случаев, когда заболевание сопровождалось развитием метастазов, а локализация первичной опухоли на момент морфологического исследования неизвестна, составляет 3-15% от всех онкологических заболеваний. При этом локализация первичного очага определяется при жизни в среднем у 30-40% пациентов, на аутопсии – у 60-70%.
Иммуногистохимическое исследование в зависимости от морфологического типа новообразования позволяет уточнить гистогенез опухоли и/или высказаться о вероятной локализации первичного очага. Большинство из этих опухолей представляют аденокарциномы молочной железы, толстого кишечника, легких, яичников, поджелудочной железы, предстательной железы и желудка.
В случае метастазов аденокарциномы задача иммуногистохимического исследования состоит в выявлении вероятного источника метастазирования.
Для этих целей в настоящее время используется целый ряд маркеров включая цитокератины 7 и 20, тиреоидный фактор транскрипции (TTF-1), CA125, CDX2, рецепторы к эстрогенам, GCDFP-15, лизоцим, мезотелин, простат-специфический антиген.
Цитокератин 7 (CK7) относится к семейству белков промежуточных филаментов, имеет молекулярную массу 54 кДа, выявляется в различных видах железистого эпителия. Антитела клона OV-TL (Dako) окрашивают цитоплазму различных видов клеток нормального и неопластического железистого эпителия, включая эпителий протоков. CK7 выявляется в клетках цилиндрического и железистого эпителия легких, шейки матки, молочной железы, желчевыводящих путей и собирательных трубочек почек. CK7 окрашивает переходный эпителий мочевого пузыря, эпителий яичников и легких. Иногда можно встретить положительное окрашивание эндотелия сосудов. В свою очередь, CK7 не экспрессируется в эпителиальных клетках желудочно-кишечного тракта, предстательной железы. Практически не выявляется CK7 в гепатоцитах, эпителии проксимальных и дистальных извитых канальцев почек, миоэпителиальных клетках, многослойном эпителии кожи, языка, пищевода и эктоцервикса. Моноклональные антитела OV-TL выявляют отдельные виды аденокарцином и могут быть использованы для проведения дифференциальной диагностики между CK7-позитивными тканями (такими как рак яичников и переходноклеточный рак) и CK7-негативными тканями (такими как аденокарциномы желудочно-кишечного тракта и рак предстательной железы).
Цитокератин 20 (CK20) является представителем кератина I типа, который непосредственно экспрессируется в эпителии желудка и тонкого кишечника, уротелии и клетках Меркеля кожи. Антитела (клон Ks 20.8, Dako) реагируют с соответствующим белком молекулярной массой 46 кДа. CK 20 – это основной белок зрелых энтероцитов и бокаловидных клеток; он специфически экспрессируется в эпителиальных клетках слизистой оболочки желудка и тонкого кишечника. Его также можно выявить в аденокарциномах толстого кишечника, желудка, поджелудочной железы, желчных капилляров, в муцинозных опухолях яичников, переходноклеточном раке мочевого пузыря и раке из клеток Меркеля. В свою очередь, в плоскоклеточных раках, аденокарциномах молочной железы, легких, эндометрия, не муцинозных опухолях яичников и мелкоклеточных карциномах легких CK 20 не экспрессируется.
Лизоцим катализирует гидролиз отдельных мукополисахаридов клеточной оболочки бактерий. Используется для выявления опухолей из гистиоцитов и лейкозных клеток миелоидного ряда. Он выявлен в клетках селезенки, легких, почек, лейкоцитах крови, плазматических клетках, слюне, молоке и слезной жидкости.
Мезотелин – клеточный гликопротеин (молекулярная масса 40 кДа), располагается на поверхности мезотелиальных клеток и связан с механизмами клеточной адгезии. Он также выявляется в мезотелиомах, эпителиальных раках яичников и некоторых плоскоклеточных раках. Клон 5В2 (Novocastra) окрашивает эпителиоидные мезотелиомы и аденокарциномы легких, яичников, опухоли брюшины, эндометрия, поджелудочной железы, желудка и толстого кишечника. Антитела не реагируют с тканью почек, печени, плаценты, кожи и щитовидной железы. Мезотелина много в обычных мезотелиальных клетках, из которых формируются злокачественные мезотелиомы и цистаденокарциномы яичников. Эти антитела вместе с антителами к калретинину могут быть использованы для выявления мезотелиом.
CDX2 – рекомбинантный белок прокариотов, соответствующий аминокислотному N-терминальному участку молекулы CDX2 человека. Является специфическим транскрипционным фактором клеток тонкого кишечника. Ген cdx2 кодирует интестинально-специфический транскрипционный фактор, его белок экспрессируется на ранних стадиях развития тонкого кишечника и может иметь значение в регулировании пролиферации и дифференцировки эпителиальных клеток тонкого кишечника. Играет важную роль в инициации дифференцировки клеток в зрелые энтероциты. Клон AMT28 (Novocastra) реагирует с 40кДа белком, расположенным в ядрах клеток. Он экспрессируется в ядрах эпителиальных клеток кишечника от двенадцатиперстной кишки до прямой кишки. Белок CDX2 экспрессируется также в первичных и метастатических опухолях толстого кишечника, а также выявляется при кишечной метаплазии желудка и кишечном типе рака желудка, в свою очередь, в нормальных эпителиальных клетках желудка он не встречается. Данный белок обнаруживается в ядрах только цилиндрического эпителия и раковых клетках колоректальных аденокарцином, таким образом с его помощью можно идентифицировать метастазы рака толстого кишечника.
CA125 – белок ракового антигена яичников. Моноклональные антитела (клон Ov185:1, Novocastra) распознают муциноподобный гликопротеин молекулярной массой около 200 кДа. Антитела окрашивают различные опухоли, такие как аденокарциномы толстого кишечника, аденокарциномы молочной железы, опухоли матки, бронхо-альвеолярные раки, эндометриоидные и серозные аденокарциномы яичников.
ER – рецепторы к эстрогенам. Клон 6F11 (Novocastra) взаимодействует с эстрогеновым рецептором альфа. Антитела окрашивают ядра с рецепторами к эстрогенам в эпителиальных и гладкомышечных клетках матки, а также ядра эпителия молочных желез. Выявление рецепторов к стероидным гормонам широко применяется при лечении гормонально-зависимых опухолей. Наличие рецепторов к эстрогенам является маркером рака молочной железы, а также может свидетельствовать о прогнозе заболевания и эффективности эндокринной терапии.
Простат-специфический антиген (ПСА) – представляет собой гликопротеин. Клон ER-PR8 (Dako) получен к белку молекулярной массой 35 кДа. ПСА биохимически и иммуногистохимически отличается от другого широко используемого маркера опухоли предстательной железы – кислой простатической фосфатазы. Он располагается в цитоплазме клеток ацинарного и протокового эпителия нормальной ткани, выявляется при доброкачественной гиперплазии предстательной железы и аденокарциноме. Эти антитела можно использовать для выявления метастазов рака предстательной железы, поскольку ПСА выделяется опухолевыми клетками простаты и определяется в плазме крови у больных с раком простаты.
GCDFP-15 – белок, который встречается при диффузной кистозной мастопатии, для которой характерны макро- и микрокисты, протоковая и дольковая гиперплазия и др. патология молочных желез. Кисты формируются за счет апокриновой секреции эпителиальными клетками. Жидкость кист содержит гликопротеины, включая уникальный 15 кДа мономер. В нормальной ткани подобный белок встречается в эпителии слезных, подъязычных и мелких слюнных желез, в клетках серозных оболочек, трахеальных и бронхиальных желез.
GCDFP-15 и PSA одновременно экспрессируются в опухолях молочных желез с положительной реакцией на рецепторы к андрогенам. Данный маркер может быть использован для выявления аденокарциномы молочной железы, протоковых раков слюнных желез и апокринового эпителия.
Часть маркеров, такие как ПСА для рака предстательной железы, TTF-1 для рака легких, работают моноспецифично. Другая часть маркеров этой панели характерна для нескольких опухолей: так, рецепторы к эстрогенам могут быть выявлены при раке молочной железы или яичников, CDX2 – при опухолях желудочно-кишечного тракта. Часть маркеров может характеризовать источник метастаза только комплексно: рецепторы к эстрогенам, мезотелин и CA125 характеризуют опухоли яичников.
Метастазы плоскоклеточного и нейроэндокринного рака без выявленного
первичного очага (Савелов Н.А., Петровичев Н.Н., 2006)
При метастазах плоскоклеточного рака проводить иммуногистохимическое исследование нецелесообразно, так как возможности метода не позволяют уточнить вероятный источник метастазирования. Это относится и к метастазам низкодифференцированного нейроэндокринного рака. Однако при метастазах высокодифференцированного нейроэндокринного рака (синоним – атипичный карциноид) коэкспрессия CK7 и TTF1 может свидетельствовать о локализации первичного очага в легком, а коэкспрессия CK20 и CDX2 – в органах ЖКТ.
Метастазы недифференцированного рака без выявленного первичного
очага (Савелов Н.А., Петровичев Н.Н., 2006)
У пациентов с метастазами без четких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее, установление направления дифференцировки опухолевых клеток). Для этого применяется следующая панель антител: р63, CК5, CK14 или CК5/CK6, CК18, СD56 (N-CAM).
Антитела к белку Р63 (клон 4А4, Dako). Белок Р63 принадлежит к семейству Р53 опухолевых супрессорных генов, которые также включают белок Р73. Эти белки регулируют процессы клеточной транскрипции и запускают процессы апоптоза в ответ на повреждение ДНК и развитие гипоксии. Р63 экспрессируется в ядрах базальных клеток различных видов эпителия. Белок Р63 выявляется в пролиферирующих клетках эпителия шейки матки, уротелия и предстательной железы. Он также экспрессируется в большинстве низкодифференцированных плоскоклеточных раков. Антитела к Р63 помогают дифференцировать доброкачественные и злокачественные опухоли предстательной железы.
Антитела к белку CD56 (клон МОС-1, Dako). Белок CD56 является антигеном клеток натуральных киллеров. Реагирует с CD4+ и CD8+, Т-клетками в периферической крови. CD56 можно выявить в нейробластоме и мелкоклеточном раке легких, а также некоторых других опухолях.
Цитокератины CK5/CK6 (клон D6/16 B4, Dako). Цитокератины относятся к семейству промежуточных филаментов и выявлены практически во всех клетках. Типы цитокератинов CK5/CK6 выявляются в мезотелиальных клетках и не встречаются в аденокарциномах. CK5/CK6 применяются как маркеры мезотелиомы и плоскоклеточного рака легких, болезни Боуэна (разновидности карциномы, поражающей чешуйчатые клетки эпидермиса кожи, но не распространяющейся на ее базальные слои). Они не встречаются в аденокарциномах легких, но окрашивают мезотелиому и базальные клетки желез простаты. Данные антитела не реагируют с тканями мезодермального происхождения, такими как мышцы и соединительная ткань. Цитокератины CK5/CK6 экспрессируются в низкодифференцированных аденокарциномах и выявляются в эпителиоидных мезотелиомах.
Цитокератин CK14 (клон LL002, BioGenex), молекулярная масса 50 кДа, – это кислый цитокератин первого типа, с помощью которого можно отличить многослойный плоский эпителий от простого эпителия. Цитокератин CK14 равномерно экспрессируется в цитоплазме всех клеток многослойного плоского ороговевающего эпителия. Моноклональные антитела к цитокератину CK14 помогают дифференцировать типы клеток в молочных железах при развитии аденокарциномы.
Цитокератин CK18 (клон DC10, Dako) – белок с молекулярной массой 45 кДа. Антитела реагируют с большинством видов простого эпителия, включая эпителий протоков и ацинусов желез. Данный белок экспрессируется в эпителии щитовидной железы, молочной железы, желудочно-кишечного тракта и дыхательной системы. Антитела используют для выявления аденокарцином легких, при этом они окрашивают цитоплазму опухолевых клеток из эпителия и не окрашивают опухолевые неэпителиальные клетки (глиомы, меланомы, остеосаркомы).