структуры мозга формирующие серотонинэргическую антиноцицептивную систему это
Структуры мозга формирующие серотонинэргическую антиноцицептивную систему это
Успешное лечение депрессии началось с появлением в 30-е годы электросудорожной терапии. Затем к этому методу добавилась фармакотерапия: в 50-е годы — гетероциклическими антидепрессантами и ингибиторами моноаминоксидазы, в 60-е годы — литием, а в 70-е годы — стабилизирующим настроение противосудорожным средством карбамазепином.
Чтобы ослабить побочные эффекты (например, сухость в носоглотке, запор, электрическую нестабильность миокарда, обмороки, седатацию), были разработаны вещества, повышающие концентрацию серотонина (5-гидрокситриптамина [5-НТ]) в соответствующих синапсах, в том числе флуоксетин.
Вслед за ним быстро появились флувоксамин и сертралин, а затем ряд агонистов и антагонистов серотониновых (5-НТ) рецепторов. Выяснилось, что эти рецепторы делятся на различные типы и подтипы со специфическими функциями.
Серотонин, или 5-НТ, является регуляторным нейромедиатором, приводящим главным образом к тормозным эффектам. Он синтезируется из L-триптофана, который проникает через гематоэнцефалический барьер (сам серотонин к этому не способен), поглощается клетками центральной нервной системы и в них превращается в 5-гидрокситриптамин, т. е. 5-НТ.
Тела нейронов серотонинергической системы расположены прежде всего в шве, или области срединной линии, ствола головного мозга. Они образуют самую крупную сеть с единым нейромедиатором в головном мозге млекопитающих.
Типы серотониновых рецепторов
Известно 4 главных типа серотониновых рецепторов: 5-НТ1, 5-НТ2, 5-НТ3 и 5-НТ4. Первый тип делится на подтипы А, В, С, D и Е, а второй — на подтипы А и В. Рецепторы 5-НТ3 локализованы как в периферической, так и в центральной нервной системе. Антагонисты периферических 5-НТ3-рецепторов, например ондансетрон, гранисетрон и закоприд, применяются для лечения тошноты и рвоты.
Избирательные ингибиторы поглощения серотонина не связываются с какими-либо его специфическими рецепторами, но обеспечивают антидепрессивный эффект, селективно блокируя обратное поглощение этого нейромедиатора пресинаптическими окончаниями, из которых он выделился.

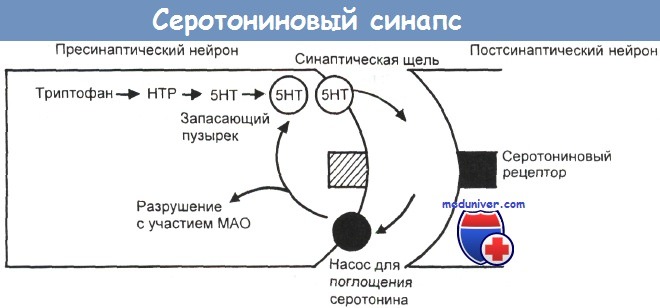
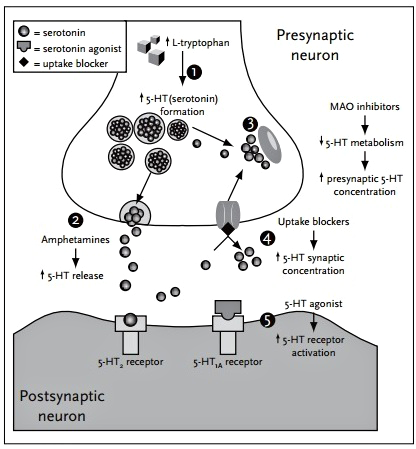
Серотонин (5-НТ), синтезируемый из триптофана через гидрокситриптофан (НТР), выделяется из пресинаптического нейрона в синаптическую щель.
Попав туда, его молекулы либо действуют на постсинаптический рецептор, обусловливая нервную передачу, либо возвращаются в пресинаптическую клетку с помощью поглощающего механизма насосного типа.
Вернувшись в пресинаптический нейрон, серотонин либо вновь запасается в синаптических пузырьках для будущего высвобождения, либо разлагается моноаминоксидазой (МАО). 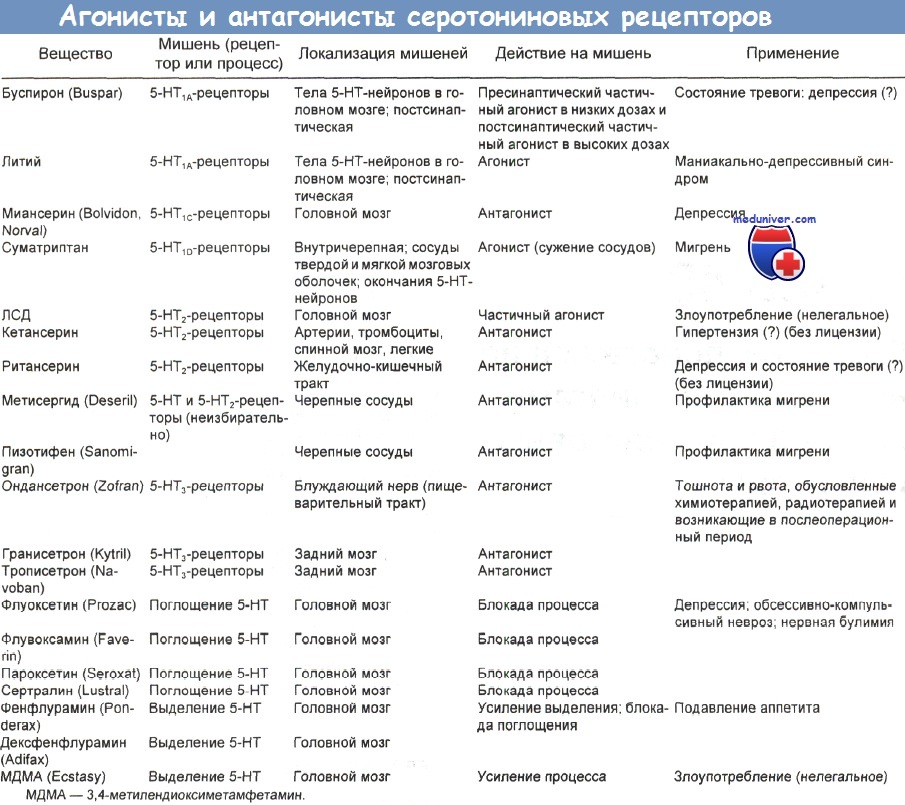
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Серотониновые сети
Автор
Редактор
Нейромедиаторы осуществляют передачу сигналов между клетками в нервной системе. Разные группы нейронов объединяются в целые функциональные системы, которые «работают» на определенном веществе. В психиатрии и нейробиологии особое внимание уделяется серотонину — нейромедиатору, о котором и пойдет речь.
Сырное настроение
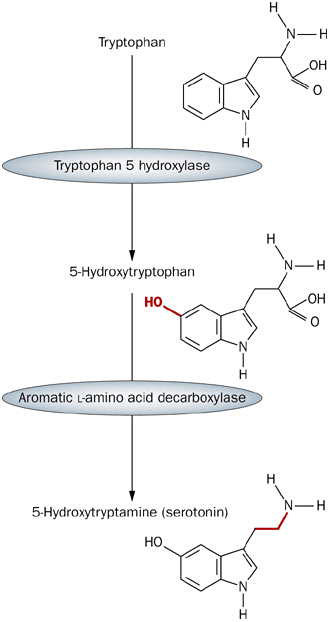
Рисунок 1. Две стадии синтеза серотонина из триптофана. Сначала к аминокислоте прикрепляется OH-группа, а затем отсоединяется карбоксильный радикал. (www.nature.com)
Ранее я уже писал о том, чем занимается дофамин в нашем мозге [1]. Сейчас речь пойдет о другом нейромедиаторе — серотонине. Как и в случае с дофамином, предшественником серотонина является аминокислота — триптофан. В состав триптофана входит ароматическое ядро индола, а само соединение синтезируется довольно сложным путем. Серотонин (5-гидрокситриптамин, 5-НТ) получается из триптофана всего за две реакции: сначала к индоловой части присоединяется гидроксильный радикал, а затем от получившейся молекулы отщепляется карбоксильная группа (рис. 1).
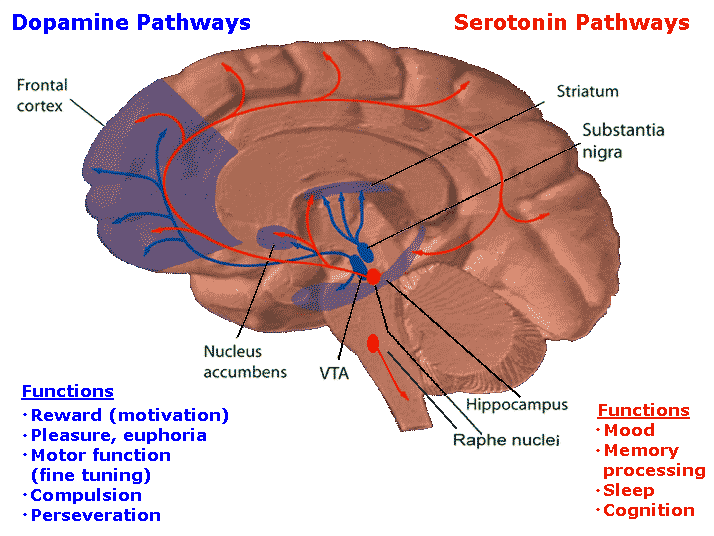
Схема распространения отростков серотониновых нейронов напоминает дофаминовую систему. Из глубоких отделов мозга — из комплекса скоплений нейронов, называемых ядра шва — сигналы разбегаются почти по всему органу (рис. 2). Уже на месте серотонин взаимодействует с рецепторами на постсинаптической мембране, осуществляя свои психофизиологические эффекты. Существует семь основных типов серотониновых рецепторов и множество их подтипов [2], но подробное описание их роли займет слишком много места.
Рисунок 2. Серотониновые и дофаминовые пути в головном мозге человека. Дофаминовые волокна из глубоких отделов мозга распространяются в подкорковые отделы и в лобную долю. Отростки серотониновых нейронов распространяются шире и влияют на большее количество функций. Рисунок из Википедии (англ.).
Лучше обратить внимание на то, как содержание триптофана, предшественника серотонина, может повлиять на наше поведение. Логично предположить, что повышение количества триптофана в пище приведет к тому, что увеличится и уровень серотонина. При депрессии содержание серотонина в центральной нервной системе снижается. Можно представить такой эксперимент: из рациона человека исключается триптофан. Вследствие этого страдает синтез серотонина, и мы наблюдаем снижение настроения — типичный симптом депрессии. На практике это работает немного по-другому. При уменьшении поступления триптофана с пищей снижение настроения отмечается только у тех людей, которые раньше болели депрессией [3]. Отказ от триптофана не оказывал значимого влияния на испытуемых без депрессивных эпизодов в прошлом. По всей видимости, это связано с изменёнными путями метаболизма серотонина у пациентов с депрессивными расстройствами, которых нет у здоровых людей.
Интересно, что если уровень триптофана в пище будет высоким, это может привести к щедрости. В исследовании голландских психологов [4] была выявлена именно такая связь. Испытуемые, принявшие большую дозу триптофана, жертвовали больше денег, чем те участники эксперимента, которые ее не получили. Сами исследователи объясняют повышенную щедрость связью между серотониновой и окситоциновой системами в головном мозге. Неспецифическое повышение интенсивности сигнала в серотониновой системе приводит к увеличению активности всех связанных с ней структур. Окситоциновые нейроны не становятся исключением, и в мозге появляется больше окситоцина. Такое повышение приводит к тому, что мозг человека становится более предрасположенным к выбору в пользу других людей. Кстати, лидером по содержанию триптофана среди пищевых продуктов является сыр, и было бы интересно проследить взаимосвязь между потреблением сыра и щедростью у разных народов.
Нейромедиатор контроля
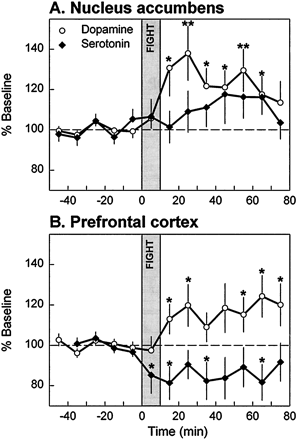
Рисунок 3. Изменение содержания нейромедиаторов у крыс в состоянии агрессии. Во время драки (серая вертикальная полоса) и после неё повышается содержание дофамина в добавочном ядре (А), регулирующем поведение и мотивацию, и снижается высвобождение серотонина в лобных отделах коры (B). Звездочки указывают на существенные различия с базовыми уровнями нейромедиаторов. Рисунок из [5].
Как уже говорилось, серотонин распространяется из продолговатого мозга, из ядер шва. Существенная разница с дофаминовой системой заключается в более широком охвате структур головного мозга серотониновыми волокнами. Такой охват позволяет серотонину влиять на процессы памяти и когнитивные способности: темп и качество мышления. При депрессии снижение интенсивности серотониновой передачи приводит к ухудшению сообразительности и замедлению мышления.
Кроме влияния на интеллект серотонин оказывает серьезное воздействие на агрессивное поведение. Например, у крыс сравнивалось содержание дофамина и серотонина в подкорковых структурах и лобной доле при драках [5]. Ученые выяснили, что агрессивное поведение животных связано со снижением уровня серотонина в лобных отделах коры, отвечающих за планирование и контроль поведения (рис. 3). У людей также показана связь между пониженным уровнем серотонина в лобных отделах коры и агрессивным поведением, но только импульсивным, возникающим внезапно [6].
Серотонин снижает активность нейронов префронтальной коры не прямым воздействием на них, а через тормозные нейроны, выделяющие гамма-аминомасляную кислоту (ГАМК). Нейромедиатор попадает на рецепторы, расположенные на теле и отростках ГАМК-ергических нейронов, блокируя или запуская передачу сигнала [7]. Примечательно, что при уменьшении активности отдельных нейронов под воздействием серотонина увеличивается упорядоченная активность нейронных систем, то есть серотонин упорядочивает совместную работу нейронов, не давая им перебивать друг друга в многоголосой беседе.
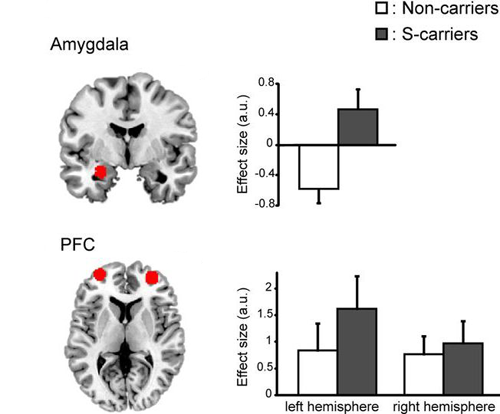
В вопросах влияния серотонина на личность стоит обратить внимание на один из генов серотониновой системы — ген белка-транспортёра серотонина (5-HTT, SERT). Существуют два варианта промоторной последовательности этого гена (serotonin transporter linked polymorphic region, 5-HTTLPR), различающиеся длиной, причем короткий вариант выполняет свою работу хуже, чем длинный. При исследовании влияния полиморфизма 5-HTTLPR на особенности социальной жизни оказалось, что обладатели короткого аллеля более склонны к тревожным реакциям при социальном взаимодействии [8]. Носители короткого варианта в гомозиготном и гетерозиготном состоянии проявляли повышенную чувствительность к эмоциональным стимулам и хуже контролировали своё поведение. В исследовании, опубликованном в 2013-м году в The Journal of Neuroscience [9], было показано, что у обладателей короткого аллеля 5-HTTLPR префронтальная кора хуже контролирует работу миндалины — центра эмоционального реагирования (рис. 4), который чувствителен и к другим «эмоциональным» аллелям, например, к полиморфизму гена моноаминоксидазы-А [10]. Выяснилось, что в течение жизни на активность 5-HTT может оказывать влияние опыт негативного взаимодействия с окружающими, например, жестокое обращение в детстве. Такие события ухудшают и без того слабую работу белка-транспортёра, приводя к нарушениям в работе головного мозга, вроде описанных выше.
Рисунок 4. Возбудимость миндалины (сверху) и передней префронтальной коры (снизу) в зависимости от полиморфизма промотора гена транспортёра серотонина. У обладателей короткого (S-, темные столбцы) варианта 5-HTTLPR активация миндалины выше, чем у носителей длинного аллеля (белые столбцы). На нейробиологическом уровне это значит, что мозг «захлестывают» эмоции. Чтобы справиться с этим информационным потоком, наблюдаемого незначительного повышения активности префронтальной коры в левом и правом полушариях не достаточно. Рисунок из [9].
Рискованные лекарства
Учитывая вовлеченность серотонина в психические процессы, ряд лекарств, которыми пользуются психиатры и психотерапевты, прицельно воздействует на серотониновые системы. Самым известным классом подобных препаратов являются антидепрессанты [11]. Среди антидепрессантов стоит отметить селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и селективные ингибиторы обратного захвата серотонина (СИОЗС).
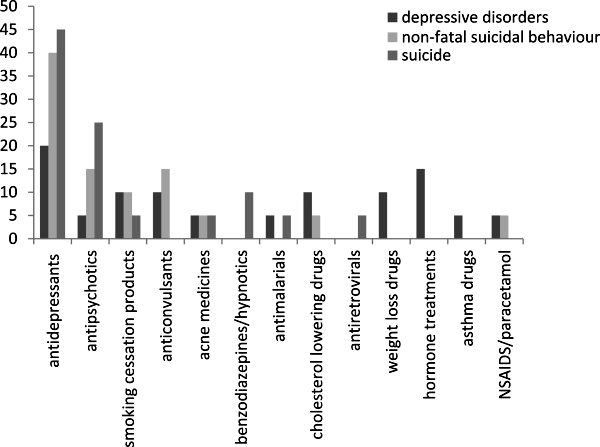
Рисунок 5. Антидепрессанты — лидеры по поведенческим побочным эффектам [12].
Принцип работы этих лекарств довольно прост. Под воздействием электрического сигнала из одного нейрона в синаптическую щель начинает выделяться серотонин. Связавшись с рецептором на поверхности другого нейрона, он удаляется из синапса при помощи специального фермента. При применении СИОЗС нарушение деятельности фермента, осуществляющего обратный захват серотонина, приводит к увеличению силы сигнала в серотониновой системе мозга. К классу СИОЗС относится всем известный прозак (флуоксетин). Другая группа препаратов — СИОЗСН — подавляет обратный захват как серотонина, так и норадреналина; среди них широко применяются венлафаксин и дулоксетин. На похожем принципе — подавлении обратного захвата нейромедиаторов — основана работа классического антидепрессанта амитриптилина, который «берёт еще шире»: не только тормозит захват серотонина и норадреналина, но и меняет активность транспортёров этих нейромедиаторов.
Однако с СИОЗС возник ряд проблем. В британском исследовании, которое объединило данные по нежелательным эффектам лекарств за 13 лет, эта группа антидепрессантов проявила себя не с самой лучшей стороны [12]. Среди всех препаратов, которые вызывали при приеме депрессию, пароксетин занял третье место. В случае суицидальных попыток, не приведших к смерти, чаще всего фигурировали СИОЗС пароксетин (1-е место), циталопрам (3-е место) и флуоксетин (4-е место). Если же смотреть по завершенным самоубийствам, то 2-е, 3-е и 4-е места заняли циталопрам, флуоксетин и пароксетин соответственно. Чаще всего именно антидепрессанты были связаны со всеми перечисленными нежелательными эффектами (рис. 5).
С одной стороны, эта информация выглядит пугающе и непонятно: как могут антидепрессанты провоцировать самоубийства? С другой стороны, у этого феномена могут быть два объяснения. Антидепрессанты назначаются в случае депрессии, а при депрессии часто бывают суицидальные мысли и намерения, поэтому нет ничего удивительного, что у человека с депрессией, даже принимающего препараты, может случиться суицидальный эпизод. Другое объяснение лежит в принципе действия группы СИОЗС: они напрямую вмешиваются в нейрометаболизм. Мы до сих пор не очень хорошо разбираемся в работе головного мозга и не можем выделить точные критерии для применения того или иного препарата. По этим причинам назначение СИОЗС может привести к нарушению работы головного мозга, усугублению проблем с нейромедиаторами. Но даже несмотря на это, в подавляющем большинстве случаев антидепрессанты работают должным образом, а описанные побочные эффекты остаются весьма редкими.
Рисунок 6. Механизм развития серотонинового синдрома. Применение СИОЗС приводит к увеличению концентрации серотонина в синаптической щели. ИМАО вызывают повышение количества этого нейромедиатора в пресинаптическом нервном окончании. Вместе эти два фактора обеспечивают избыток серотонина в нервных путях. Рисунок из [13].
Другим серьезным побочным эффектом, возникающим при применении серотонинергических препаратов, является серотониновый синдром. Серотониновый синдром — это состояние организма, при котором отмечается усиленное воздействие этого нейромедиатора на организм, чрезмерная активация серотонинергических структур головного мозга. Такое происходит, например, при одновременном назначении двух типов антидепрессантов — СИОЗС и ингибитора моноаминоксидазы (ИМАО). Если СИОЗС препятствуют удалению серотонина из синаптической щели, то ИМАО подавляют разрушение серотонина в пресинаптическом окончании. Последствием этих процессов будет повышенное содержание серотонина в синапсе и увеличение интенсивности сигналов в серотонинергической системе (рис. 6).
Кроме лекарственных средств серотониновый синдром может вызываться приемом экстази. Клинически это состояние проявляется следующим набором симптомов: у пациента повышается температура, он беспокоен или находится без сознания, у него могут участиться сердцебиение и дыхание, появиться одышка. Довершают картину болезни колебания артериального давления, диарея и беспорядочные мышечные сокращения. В случае диагностированного серотонинового синдрома отменяются все серотонинергические препараты; пациенту проводится дезинтоксикация [13]. Как и в случае с суицидальным поведением, серотониновый синдром встречается крайне редко, поэтому не стоит бояться их при лечении антидепрессантами группы СИОЗС.
Исследование серотониновой системы человеческого мозга еще раз возвращает нас к тому, насколько мы зависим от биологических, а не только социальных, факторов. Количество съедаемого сыра, гены, переданные нам от родителей, назначенные лекарства — всё это меняет метаболизм в мозге, а значит, меняет и нас. Конечно, можно сказать, что есть общение с другими людьми, различия в индивидуальном опыте, то есть чисто социальные моменты, но не надо забывать, что социальная составляющая нашей личности реализуется всё теми же биологическими — и доступными для исследования — механизмами нашей психики.
Нейробиология депрессии: серотониновая система мозга
Большая депрессия – распространенное психическое расстройство, которое является одной из наиболее частых причин нарушения трудоспособности [1, 2]. Это заболевание наблюдается во всех возрастных группах и поражает людей обоих полов в любом регионе мира. Опыт последних десятилетий показал, что перспективы изучения де-прессии связаны с ее нейробиологией. Для объяснения патогенетических механизмов депрессии широко используется молекулярная гипотеза. Согласно последней, неблагоприятные факторы окружающей среды, такие как стресс, воздействуют на генетическую уязвимость, что вызывает дезадаптивные изменения в цепи нейротрансмиттеров, среди которых основную роль играют моноамины. В большинстве имеющихся достижений в лечении заболевания также реализованы воздействия на расшифрованные медиаторные механизмы патогенеза [3].
Одной из важнейших систем церебральной нейромедиации, задействованных в патогенезе депрессии, является серотониновая система. Данная нейротрансмиттерная система имеет длительную эволюционную историю и участвует в целом ряде поведенческих актов и эмоциональных проявлений [4]. Она является объектом изучения значительного количества исследований, обзор которых представлен в настоящей публикации.
Для лучшего понимания интеграции серотониновой системы в мозговые процессы регуляции настроения следует в первую очередь рассмотреть имеющиеся данные о влиянии различных церебральных регионов на аффективные проявления. Так, исполнительные функции, включающие модулирование эмоционального поведения, которые могут иметь отношение к формированию когнитивных симптомов депрессии (депрессивное видение будущего), ассоциируются с гипоактивацией левой фронтальной коры [5].
Система эмоциональной памяти, включающая миндалину и гиппокамп, также вовлечена в реализацию проявлений депрессии. Депрессивные пациенты демонстрируют преимущественную сосредоточенность на негативных событиях прошлого [6]. Дисфункцией стриатных кругов, осуществляющих психомоторные функции, можно объяснить моторные симптомы депрессии. Расстройства пищевого поведения и нарушения ряда других соматических функций свидетельствуют о вовлечении в процесс гипоталамуса и гипоталамо-гипофизарно-надпочечниковой оси.
Названные мозговые образования анатомически и функционально связаны между собой с помощью нейрональных кругов [4].
Во многочисленной экспериментальной литературе указывается значение путей, объединяющих в единую сеть фронтальный, паралимбический (вентральные отделы лобной коры, цингулярная извилина, островок, передний височный полюс), стриатный и стволовый регионы в осуществлении аффективных и мотивационных процессов 7. В свою очередь, с помощью методов функциональной нейровизуализации были обнаружены нарушения активности указанных выше мозговых областей у депрессивных больных [10]. Развитию нейроанатомической модели депрессии способствовали данные о возникновении депрессивных нарушений при органических поражениях различных мозговых структур. Примером могут служить ишемические поражения левой лобной доли при постинсультной депрессии [11, 12], а также поражение фронто-стриатных путей у пациентов с сосудистой депрессией и болезнью Паркинсона 14.
Серотониновая система головного мозга является составной частью описанных нейрональных сетей регуляции настроения. Серотонинергические нейроны сгруппированы в 9 ядрах ствола мозга. Большинство из них совпадает с медиально расположенным ядром шва [16]. Серотонин (5-гидрокситриптамин [5-НТ]) синтезируется в указанных ядрах из триптофана.
В регулировании аффективных процессов принимают участие восходящие терминали серотонинергических ядер, которые заканчиваются в большом количестве мозговых структур: подкорковых образованиях (хвостатое ядро, скорлупа, переднее и медиальное ядра таламуса), промежуточном, обонятельном мозге и ряде образований, связанных с ретикулярной формацией, коре больших полушарий, миндалевидном теле и гипоталамусе. При этом в коре лимбической системы серотонина значительно больше, чем в неокортикальных регионах 17.
Важность нарушения звена синтеза серотонина для возникновения депрессии показана в работах, исследовавших эффекты ограничения приема триптофана с пищевыми продуктами. Гипотриптофановая диета приводила к появлению депрессивных симптомов у здоровых лиц и у пациентов с депрессией в стадии ремиссии. По данным позитронной эмиссионной томографии, у обследованных пациентов обнаруживали снижение активности пре- и орбитофронтальной коры, а также таламуса [20]. Имеются убедительные доказательства генетической детерминированности синтеза серотонина в головном мозге. Известно, что в геноме человека имеется ген 5-НТТ, активность которого регулирует уровень вырабатываемого мозгом серотонина [21].
Серотонин выполняет свою физиологическую роль посредством воздействия на 5-НТ-рецепторы.
В настоящее время известно более 15 видов серотониновых рецепторов 24, однако не все они идентифицированы в головном мозге человека.
В центральной нервной системе (ЦНС) млекопитаю-щих обнаружены серотониновые 5-НТ1-рецепторы и пять их подтипов – A, B, D, E, F, представляющие собой протеины, содержащие 365-422 аминокислотных остатка. Посредством ингибиторных G-протеинов данные рецепторы сопряжены с аденилатциклазой, активность которой при их активации подавляется.
5-НТ1А-рецепторы преимущественно локализованы в гиппокампе, миндалинах, прозрачной перегородке – структурах, принимающих участие в формировании настроения. Данные рецепторы ЦНС располагаются на пре- и постсинаптической мембране [27]. Пресинаптические 5-НТ1А-рецепторы по принципу обратной связи регулируют интенсивность высвобождения серотонина из пресинаптических нейрональных терминалей. Посредством стимуляции постсинаптических 5-НТ1А-рецепторов реализуется ряд важных физиологических функций серотонина: регуляция настроения, обсессивно-компульсивные реакции, сексуальное поведение, контроль аппетита, терморегуляция, кардиоваскулярное регулирование. Именно этот вид рецепторов вовлечен в реализацию антиде-прессивного эффекта селективных ингибиторов обратного захвата серотонина, антидепрессивного и противотревожного эффекта буспирона.
Подтип 5-НТ1D-рецепторов человека (функциональный аналог 5-НТ1В-рецепторов крысы) локализован во фронтальных отделах коры, стриатуме, базальных ганглиях [22, 28]. Пресинаптические 5-НТ1D-рецепторы играют роль ауторецепторов, через которые осуществляется отрицательная обратная связь между уровнем экстра- и интранейронального серотонина. Возможно, они играют также роль гетерорецепторов, посредством которых происходит управление выделением других нейротрансмиттеров, таких как дофамин, ацетилхолин, глутамат. Стимуляция же постсинаптических рецепторов данного подтипа в экспериментальных моделях вызывала длительную гиперактивность, антидепрессивное действие, снижение болевой чувствительности и аппетита, гипотермию.
Недавно было показано, что работа 5-НТ1В/D-рецептора зависит от пептида Р11, принадлежащего к группе белков S100. Концентрация пептида Р11 в головном мозге у больных с депрессией оказалась низкой. Длительное антидепрессивное лечение увеличивает уровень данного пептида в мозговой ткани [3]. Функция других подтипов 5-НТ1-рецепторов пока не установлена.
В ЦНС человека обнаружены 5-НТ2-рецепторы. Их семейство состоит из трех подтипов: 5-НТ2А, 5-НТ2В, 5-НТ2С [22, 29, 30]. В большей степени такие рецепторы представлены в пирамидных нейронах лобной коры, скорлупе, в меньшей – в гиппокампе и хвостатом ядре. Они являются звеном системы подкрепления мозга, низкая активность которой обусловливает возникновение ангедонии – одного из ключевых симптомов депрессии [22]. 5-НТ2А-рецепторы опосредуют анксиогенный эффект, учавствуют в формировании полового поведения, вовлечены в регуляцию сна. Уменьшение их количества отмечено при посмертных исследованиях у лиц, страдавших депрессией и покончивших жизнь самоубийством. Активация 5-НТ2А-рецепторов вызывает увеличение концентрации дофамина в стриатуме. Современные атипичные антипсихотики обладают большой активностью в отношении данного подтипа, с чем связывают анти-депрессивный эффект этих препаратов [31]. Антагонисты 5-НТ2А-рецепторов увеличивают продолжительность медленноволнового сна, улучшая его качество, а агонисты сокращают фазу быстроволнового.
5-НТ2С-рецепторы ЦНС в наибольшем количестве находятся в гиппокампе, коре головного мозга, полосатом теле, черной субстанции. Агонисты данных рецепторов вызывают анксиогенный и панический эффекты, нарушают сон. Блокада 5-НТ2С-рецепторов является одним из механизмов лечения депрессии.
С этим связана эффективность антидепрессантов, являющихся антагонистами данных рецепторов (миансерин, имипрамин, мапротилин, амитриптилин, дезипрамин, агомелатин) [32, 33]. Антагонисты 5-НТ2С-рецепторов улучшают сон [22, 30] и обладают анксиолитическим свойством. Последним частично объясняется противотревожное действие селективных ингибиторов обратного захвата серотонина.
5-НТ3-рецепторы располагаются в солитарном тракте, желатинозной субстанции, ядрах тройничного и блуждающего нервов, гиппокампе. Их центральные антагонисты оказывают анксиолитическое действие, повышают когнитивные способности, меняют чувствительность ноцицептивных нейронов, обладают противорвотным действием.
5-НТ4-рецепторы максимально представлены в областях, насыщенных дофаминергическими нейронами (базальные ядра, аккумбенс). Они локализуются на ГАМК-ергических и холинергических интернейронах и ГАМК-ергических проекциях в черную субстанцию. Агонисты этих рецепторов могут повышать активность дофаминергических систем, антагонисты – блокировать данный эффект. Есть данные об анксиолитическом эффекте антагонистов 5-НТ4-рецепторов [22, 34].
5-НТ6-рецепторы располагаются в стриатуме, амигдале, гиппокампе, коре, обонятельной луковице. Различные антидепрессанты (кломипрамин, амитриптилин, нортриптилин, доксепин) имеют к ним высокое сродство и являются их антагонистами.
5-НТ7-рецепторы представлены в гипоталамусе, таламусе, стволе головного мозга. Они могут участвовать в организации циркадных ритмов посредством воздействия на супрахиазматические ядра. В будущем 5-НТ6— и 5-НТ7-рецепторы могут стать мишенью для моделирования депрессии [3].
Следующим уровнем нарушений серотониновой системы при депрессии является обратный захват 5-НТ из синаптической щели в пресинаптический нейрон, который осуществляется белком-переносчиком серотонина. Плотность данного белка в мозге депрессивных пациентов уменьшалась, что выявлялось с помощью методов функциональной нейровизуализации, а у умерших вследствие суицида – по данным посмертных гистохимических исследований [35].
Индивидуальные особенности оборота серотонина в ЦНС в числе прочих наследственных факторов зависят от эффектов гена-переносчика серотонина
(5-НТТ). Данный ген расположен на 17-й хромосоме. В нем описано несколько полиморфных участков, в том числе инсерционно-делеционный полиморфизм (5-HTTLPR), обнаруженный в области промотора и представленный двумя аллельными вариантами – l (длинный) и s (короткий – с делецией). Этот полиморфизм является функциональным 36.
Ряд авторов обнаружили ассоциацию между полиморфизмом 5-HTTLPR и развитием депрессивных состояний в ответ на различные стрессоры [39]. Лица,
в генотипе которых имелся хотя бы один короткий аллель, демонстрировали более выраженные депрессивные симптомы, чаще имели диагноз депрессивного эпизода по классификации DSM-IV и сообщали о большем по сравнению с гомозиготами по длинному аллелю количестве суицидальных мыслей и попыток во время депрессивных эпизодов. Роль гена-переносчика серотонина в опосредовании связи между стрессовыми событиями жизни и последующим развитием де-
прессивных симптомов и физического дистресса была позднее подтверждена другими авторами 42. Кроме того, обнаружено, что здоровым людям – носителям короткого аллеля – в большей степени присущи повышенная эмоциональная реактивность и тревожность, то есть личностные особенности, которые рассматривают как предиспозиционные по отношению к аффективным расстройствам [43, 44].
Описанные выше факты свидетельствуют о большом значении серотониновой системы для функционирования областей головного мозга, имеющих прямое отношение к регуляции аффективных процессов: фронтальных регионов, модулирующих эмоциональное поведение; лимбического региона, имеющего отношение к эмоциональным и когнитивным нарушениям при депрессии; фронто-стриатных структур, определяющих возникновение ангедонии; психомоторных расстройств. Отдельно следует выделить роль серотониновой системы в функционировании гипоталамического региона – важнейшего звена нейро-эндокринной, вегетативной, циркадной регуляции.
Серотониновая дисфункция непосредственно влияет на лимбико-гипоталамо-гипофизарно-надпочечниковую регуляцию у пациентов с депрессией [45]. Депрессия ассоциируется с повышением суточной продукции адренокортикотропного гормона. Его гиперпродукция может объясняться повышением выработки кортикотропин-релизинг-фактора, синтез которого в норме лимитируется по механизму обратной связи уровнем кортизола в плазме крови.
Нарушение тормозных влияний кортизола на выработку кортикотропин-релизинг-фактора при депрессии связано с нарушением функции глюкокортикоидных и 5-НТ1А-рецепторов. Результатом гиперактивности гипоталамо-гипофизарно-надпочечниковой оси у больных с депрессией является повышение уровня плазменного кортизола. Гиперкортизолемия, в свою очередь, ведет к снижению активности постсинаптических 5-НТ1А-рецепторов, одного из главных проявлений серотониновой дисфункции. Таким образом, замыкается порочный круг.
Кортизол также потенцирует увеличение продукции адреналина. С этим связывают усиление активности симпатического звена сегментарного отдела вегетативной нервной системы. Данными механизмами обусловлены многие вегетативные симптомы депрессии.
Серотонинергическая система учавствует в регуляции цикла сон-бодрствование. Неудивительно, что одним из наиболее частых симптомов депрессии является нарушение сна. Считают, что главный генератор циркадных ритмов, локализующийся в супрахиазмальном ядре переднего гипоталамуса [46], получает информацию об уровне активности организма из ядер шва наряду со стимулами от межколенчатых ядер латерального коленчатого тела [47, 48]. Блокада 5-НТ2С-рецепторов гипоталамического региона, которые становятся сверхчувствительными при депрессии, по данным Krauchi et al. (1997) и Leproult et al. (2005), может ресинхронизировать циркадный ритм и вызывать противодепрессивные эффекты [3].
Воздействия на серотониновую нейротрансмиссию реализованы в механизмах действия многих современных антидепрессантов и других психотропных препаратов. Для одних препаратов эти механизмы являются основным фармакодинамическим эффектом, для других – имеют дополнительное значение.
Ингибирование обратного захвата серотонина лежит в основе фармакодинамики большого количества антидепрессантов: селективных ингибиторов обратного захвата серотонина (СИОЗС), ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН), трициклических антидепрессантов (ТЦА).
СИОЗС (циталопрам, сертралин, флуоксетин, флувоксамин, пароксетин) воздействуют на основной сайт белка-переносчика серотонина. Эсциталопрам блокирует как основной, так и аллостерический сайты данного протеина. Блокада белка-переносчика серотонина вызывает инициальное возрастание концентрации 5-НТ в соматодендритной зоне (но не в зоне аксональной терминали). Это, в свою очередь, вызывает снижение активности 5-НТ1А-ауторецепторов. Поскольку их роль заключается в подавлении импульсов, приходящих к серотонинергическим нейронам, а также в подавлении синтеза и высвобождении серотонина, блокада рецепторов вызывает освобождение нейронов от подавляющих влияний и усиливает выделение серотонина из аксонального окончания в синаптическую щель. Возрастание концентрации серотонина в синаптической щели позволяет ему осуществлять свои влияния на постсинаптические рецепторы, в чем и состоит антидепрессивный эффект данной группы препаратов. Время, необходимое для снижения активности соматодендритных ауторецепторов 5-НТ1А и результирующего высвобождения серотонина из аксональной терминали, объясняет 2-3-недельную задержку в наступлении эффекта СИОЗС 50. К главным преимуществам данной группы препаратов следует отнести их избирательное влияние на серотониновую систему, и отсутствие или минимальное воздействие на другие медиаторные системы головного мозга, что позволяет минимизировать побочные эффекты [3]. Селективность препаратов в группе СИОЗС не является одинаковой. По мере снижения селективности СИОЗС можно расположить следующим образом: эсциталопрам, циталопрам, сертралин, флуоксетин, пароксетин.
ИОЗСН (венлафаксин, милнаципран, дулоксетин) подавляют обратный захват серотонина наряду с ингибированием реаптейка норадреналина. О значении норадреналиновых нарушений при депрессии речь пойдет в дальнейших публикациях. Блокада реаптейка серотонина – один из основных механизмов действия большинства ТЦА (кломипрамин, амитриптилин, доксепин, имипрамин, протриптилин).
К сожалению, взаимодействие данных препаратов с другими рецепторными системами (особенно с холин-ергическими и гистаминовыми), приводит к появлению большого количества побочных эффектов и отказу от использования ТЦА как антидепрессантов первой линии [3].
Активными в отношении 5-НТ1А-рецепторов являются несколько препаратов. Пиндолол блокирует пресинаптические 5-НТ1А-рецепторы и, следовательно, должен предотвращать нежелательный эффект обратной связи, выражающийся в повышении концентрации соматодендритного серотонина. Он показал возможность ускорения начала действия антидепрессантов [3]. Буспирон, гепирон, азаперон, частичные антагонисты пресинаптических 5-НТ1А-рецепторов и активаторы постсинаптических обладают антидепрессивным действием [3].
Блокирующим эффектом в отношении 5-НТ2С-рецепторов обладают антидепрессанты различных химических групп: тетрациклические (миансерин), норадренергические и специфические серотонинергические (миртазапин), модуляторы серотонина (нефазодон, тразодон), агонист М1— и М2-рецепторов мелатонина и антагонист 5-НТ2С-рецепторов (агомелатин). Антидепрессивная активность современных атипичных антипсихотиков также связана с блокадой 5-НТ2С— и 5-НТ2А-рецепторов [3]. Кроме антидепрессивного действия, указанные антагонисты 5-НТ2-рецепторов синхронизируют нарушенные при депрессии биологические ритмы. В дополнение к ингибиции 5-НТ2С-рецепторов, миртазапин, блокируя a2-рецепторы, стимулирует синтез серотонина [3].
Потенциально интересные возможности в терапии депрессии могут быть связаны с воздействием на 5-НТ1В/D-, 5-НТ6— и 5-НТ7-рецепторы. Возникшие экспериментальные данные о фармакологической эффективности воздействия на эти мишени нуждаются в клинической валидизации [3].
Резюмируя представленные данные, мы полностью отдаем себе отчет, что была предпринята лишь попытка интегрировать современные сведения о нейробиологии серотониновой системы головного мозга и фармакотерапии депрессии, основанной на коррекции нарушений обмена серотонина. Результаты многих исследований остались за рамками настоящего обзора. Призмой, через которую проводился отбор данных для включения в работу, была возможность практического преломления полученных знаний. Ведь «нет ничего более практичного, чем хорошая теория». Выделение изолированной серотониновой дисфункции при депрессии также весьма условно. Очевидно, что деятельность данной нейромедиаторной системы необходимо рассматривать в структуре комплекса взаимосвязей расстройств норадрен-, дофамин-, ГАМК-, пептидергической и других медиаторных систем. Представленные сведения, являющиеся частью современной молекулярной гипотезы депрессии, необходимо дополнить данными о других биологических нарушениях, имеющих место при этом заболевании. Свое отражение они найдут в наших последующих публикациях. Очень надеемся, что предложенная информация о нейробиологических механизмах депрессивных расстройств будет полезной практикующим врачам.
Полный список литературы, включающий 51 пункт, находится в редакции.