симптомы осложнения коронавируса на мозг
Поражения нервной системы при COVID-19
До недавнего времени вопрос о том, поражает ли вирус SARS-CoV-2 структуры нервной системы, оставался открытым. С момента начала пандемии COVID-19 у заболевших отмечались отдельные неврологические симптомы, а с начала апреля в зарубежных источниках начали появляться отчеты о первых подтвержденных случаях поражения центральной нервной системы и периферических нервов. В данном материале мы приводим описания этих случаев. Отдельная благодарность за помощь в переводе описаний клинических случаев — Артуру Арсеньеву.
Предпосылки возможного инфицирования нервной системы
Некоторые специалисты предполагают, что SARS-CoV-2 не только воздействует на респираторный тракт, но и проникает в центральную нервную систему, вызывая неврологические расстройства. Механизмы возможного вовлечения центральной нервной системы различны, и авторы выделяют три наиболее вероятных варианта.
Во-первых, не исключается, что развитие дыхательной недостаточности, сопровождающей новую коронавирусную инфекцию, связано с вовлечением в патологический процесс не только нижних дыхательных путей, но и дыхательного центра в стволе головного мозга. Эпидемиологические исследования показывают, что при развитии коронавирусной инфекции среднее время от появления первых симптомов до развития дыхательной недостаточности составляет 5 дней. За это время вирус может проникнуть через гематоэнцефалический барьер через кровь или транссинаптическим путем и воздействовать на нейроны ствола головного мозга, нарушив тем самым работу дыхательного центра.
Во-вторых, нейроинвазивный потенциал COVID-19 исследуется на примере близких к нему по строению коронавирусов. SARS-CoV-1 обнаруживался в головном мозге пациентов и экспериментальных животных — значит, не исключено, что проникновение в ЦНС возможно и для SARS-CoV-2. Для инвазии в клетки COVID-19 использует ангиотензинпревращающий фермент 2 типа (АПФ2) в качестве рецептора, который обнаруживается на поверхности нейронов и глиальных клеток в головном мозге. Взаимодействие коронавируса с этими рецепторами может приводить к прямому повреждению нейронов без развития воспаления. Аналогичная картина была продемонстрирована в серии клинических случаев заражения SARS-CoV-1.
Рассматриваются и другие механизмы поражения нервной системы при новой коронавирусной инфекции. Особое внимание уделяется иммунным механизмам, не исключается вероятность аутоиммунных воздействий. Развитие цитокинового шторма при коронавирусной инфекции повышает проницаемость гематоэнцефалического барьера, делая возможным бесконтрольное проникновение вирусов, бактерий, иммунных клеток, токсичных метаболитов и воспалительных агентов в структуры ЦНС. Воздействие этих факторов на ткань головного мозга и его оболочки может привести к развитию неврологических симптомов без непосредственного проникновения SARS-CoV2, однако данные состояния все равно можно считать ассоциированными с этой инфекцией.
Источники:
Неврологические симптомы у пациентов с COVID-19
В актуальных исследованиях показано, что около 8 % пациентов с подтвержденной инфекцией COVID-19 жаловались на головную боль, 1 % — на тошноту и рвоту. Исследование 214 пациентов подтверждает, что 88 % больных в тяжелом состоянии (78 из 88 в исследуемой группе) демонстрируют такие неврологические симптомы, как острые цереброваскулярные состояния и нарушения сознания. По данным этого же исследования, у некоторых пациентов характерные симптомы коронавирусной инфекции появляются лишь спустя некоторое время после развития первых неврологических проявлений. По данным патологоанатомических исследований, у пациентов, умерших от последствий инфекции COVID-19, были выявлены признаки отека мозга.
Таким образом, специалисты сферы здравоохранения, работающие с COVID-19, должны быть насторожены в отношении возможного нейроинвазивного потенциала вируса. Далее будет описано несколько случаев поражения нервной системы у больных с COVID-19.
Источники:
Острая некротизирующая геморрагическая энцефалопатия
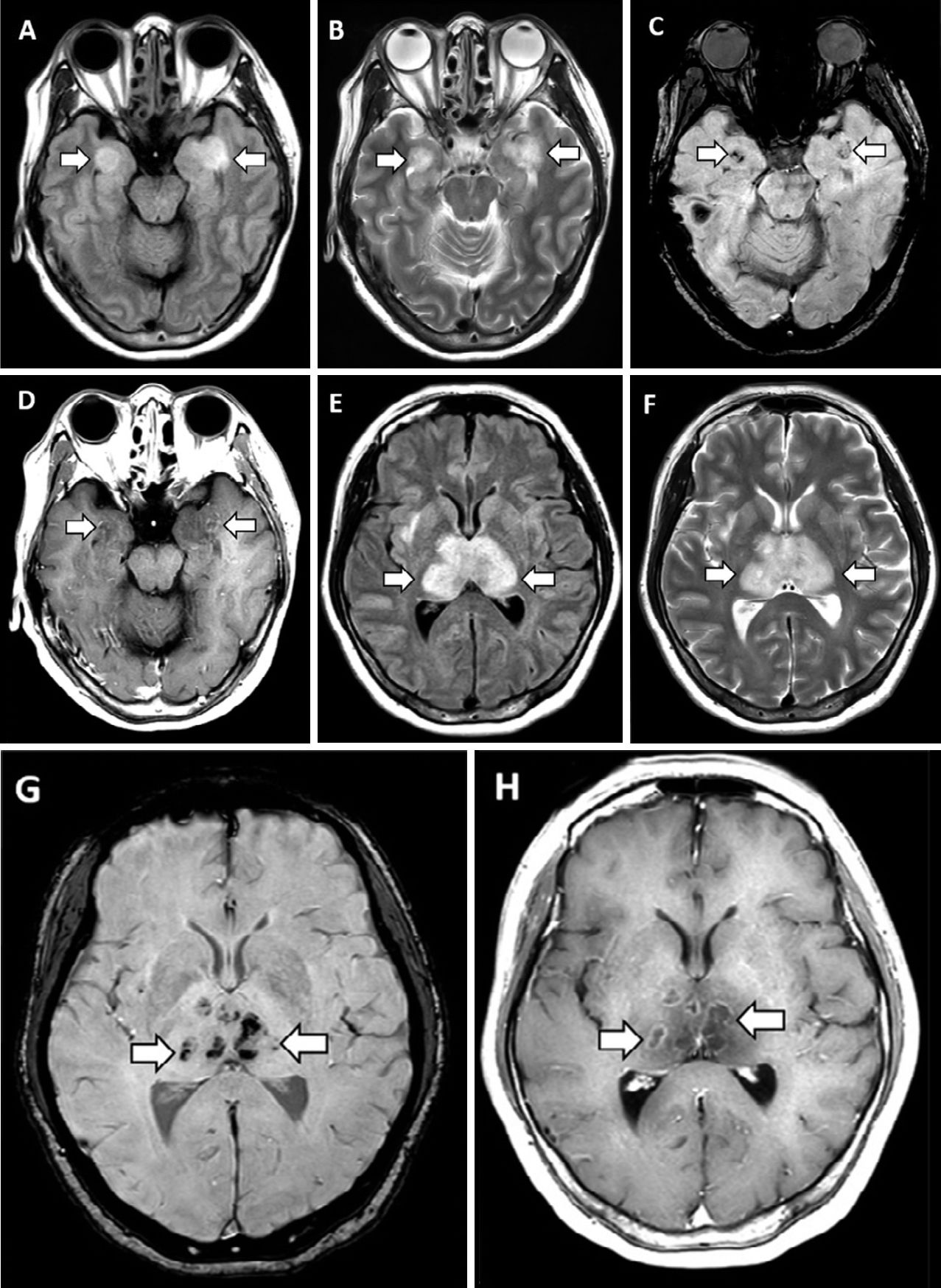
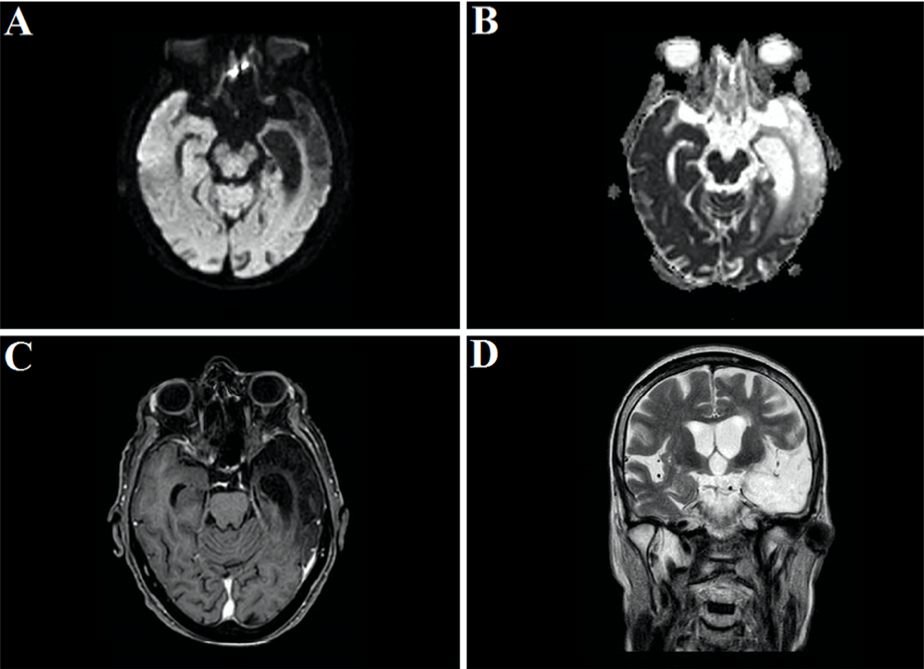
31 марта в журнале Radiology был описан случай COVID-19-ассоциированной острой некротизирующей геморрагической энцефалопатии. Данное состояние встречается редко и может быть ассоциировано с вирусными инфекциями, однако его связь с COVID-19 была установлена впервые. Первой пациенткой, демонстрирующей развитие энцефалопатии, стала женщина около шестидесяти лет с жалобами на кашель, лихорадку и помутнение сознания в течение трех дней. Диагноз новой коронавирусной инфекции был подтвержден методом ПЦР при исследовании мазка из полости носа. В цереброспинальной жидкости не было обнаружено ни бактериального роста, ни наличия вирусов простого герпеса 1 и 2 типов, вируса ветряной оспы и возбудителя лихорадки Западного Нила. Провести исследование цереброспинальной жидкости на предмет наличия SARS-CoV-2 не удалось. Компьютерная томография головы без введения контраста показала наличие симметричных участков просветления в медиальных отделах таламуса, а также нормальные данные ангиографии и венографии. На МРТ головного мозга были заметны участки усиления сигнала в таламусе, медиальных отделах височных долей и субинсулярных областях, свидетельствующие о геморрагии.
.
Полученные данные инструментальных исследований свидетельствуют о наличии острой некротизирующей энцефалопатии. Это редкое осложнение вирусных инфекций связано с развитием цитокинового шторма, который приводит к нарушению целостности гематоэнцефалического барьера. При этом не наблюдается инвазии вируса в головной мозг или демиелинизации. Данное состояние чаще описывают в педиатрической практике, но не исключено его развитие и у взрослых.
Источники:
Менингит и энцефалит
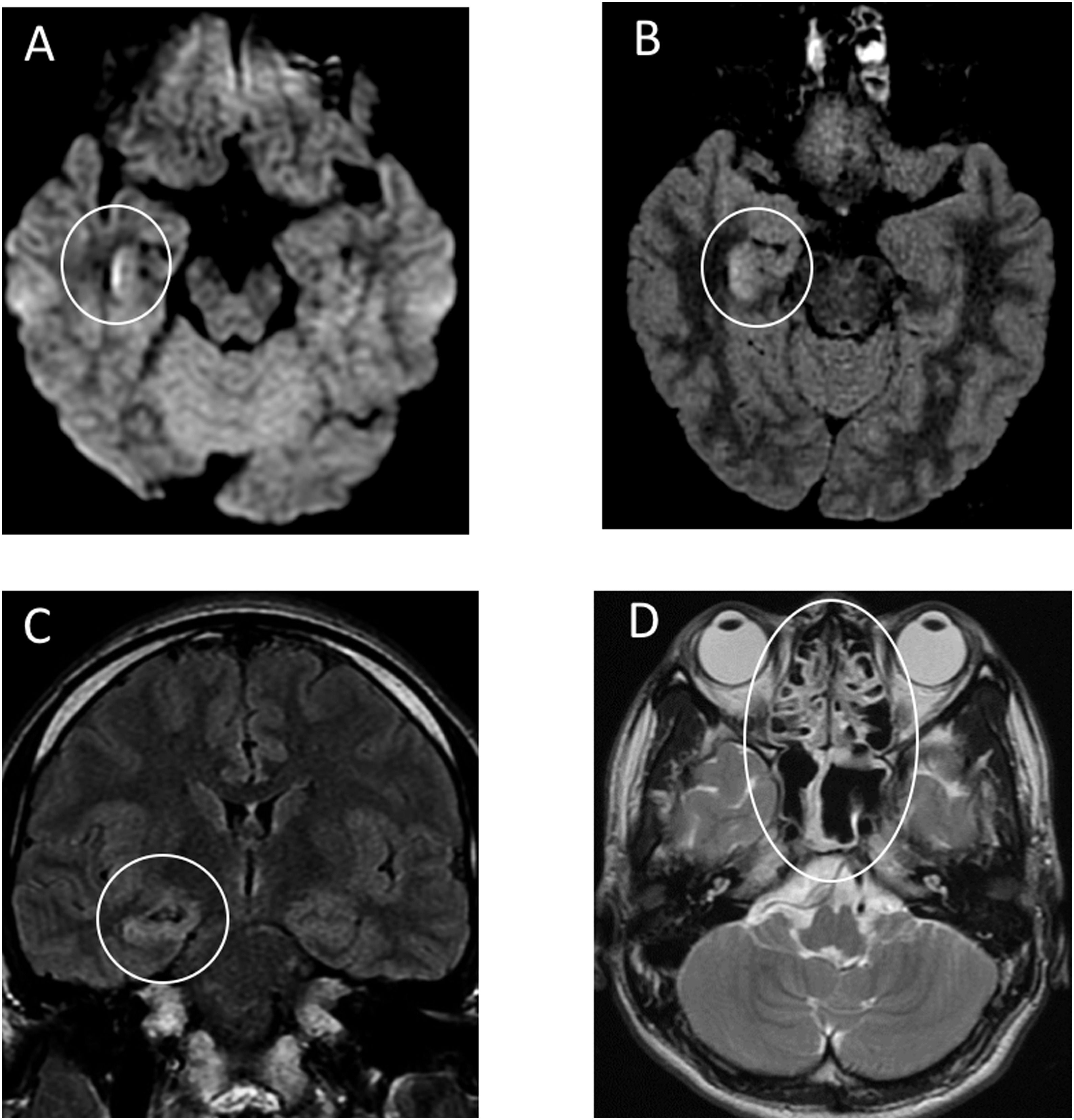
Позже в International Journal of Infectious Diseases был описан первый случай менингита и энцефалита, ассоциированных с COVID-19. Пациент 24 лет в конце февраля обратился к врачу с жалобами на слабость, головную боль и лихорадку. Врач предположил развитие гриппа и назначил ланинамивир и антипиретики. На пятый день заболевания пациент обратился в другую клинику в связи с ухудшением состояния, прошел рентгеновское исследование грудной клетки и анализ крови на наличие коронавирусной инфекции, анализ крови оказался отрицательным. На девятый день заболевания мужчина был найден в собственном доме в бессознательном состоянии, лежащим в собственных рвотных массах. По пути в стационар у пациента развились генерализованные судороги, продолжавшиеся одну минуту. Была заметна отечность в области шеи. По прибытию в стационар нарушение сознания пациента было оценено в 6 баллов по шкале комы Глазго (E4 V1 M1) с гемодинамической стабильностью. Анализ крови показал нейтрофильный лейкоцитоз с лимфопенией, высокий уровень С-реактивного белка. В бесцветной, прозрачной цереброспинальной жидкости были обнаружены мононуклеары и полиморфонуклеарные клетки, а методом ПЦР было выявлено наличие РНК SARS-CoV-2, анализ мазка из носоглотки при этом был отрицательным. В сыворотке крови не были обнаружены антитела типа IgM против вируса простого герпеса 1 типа и вируса ветряной оспы. Системная КТ не выявила отека мозга. КТ органов грудной клетки показала участки «матового стекла» в правой верхней доле и в обеих нижних долях. МРТ головного мозга показала гиперинтенсивные участки по стенке правого бокового желудочка и изменения сигнала в правой медиальной височной доле и гиппокампе, что предполагает возможность развития COVID-19-ассоциированного менингита и энцефалита.
.
В связи с обнаружением COVID-19 в цереброспинальной жидкости в данном случае можно говорить как о повышении проницаемости гематоэнцефалического барьера, так и о нейроинвазивном потенциале возбудителя коронавирусной инфекции.
Источники:
Поражение обонятельных луковиц
Одним из характерных клинических симптомов новой коронавирусной инфекции является аносмия, иногда — в сочетании с гипогевзией. Причиной развития аносмии в случае вирусной инфекции принято считать застойные явления в слизистой оболочке полости носа, ведущие к обструкции носовых ходов и временной потере чувствительности. Однако у некоторых пациентов аносмия становится перманентной, что может быть связано с необратимым вирусным повреждением нейронов. Важно отметить, что АПФ2 — рецепторы, необходимые для инвазии SARS-CoV-2, — экспрессируются в обонятельном эпителии.
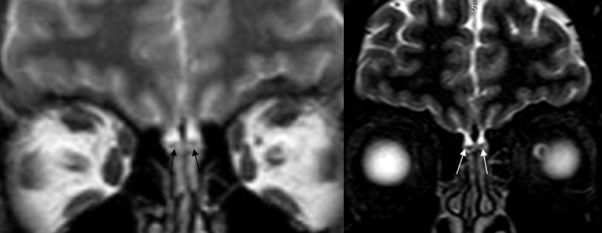
Особенности строения обонятельных областей исследуют методом МРТ. Основные находки на МРТ при аносмии, вторичной по отношению к инфекциям верхних дыхательных путей, — это снижение уровня сигнала, что говорит об уменьшении плотности нейронов, которая коррелирует с обонятельной функцией.
13 апреля в журнале Academic Radiology был представлен случай изолированной аносмии у пациента с новой коронавирусной инфекцией, подтвержденной методом ПЦР. Сообщается, что на МРТ обонятельных областей данного пациента интенсивность сигнала была нормальной, отсутствовали признаки застоя. Это говорит об отсутствии анатомических изменений, которые мог бы вызывать вирус SARS-CoV-2, а значит, нарушения обоняния обусловлены скорее функциональными изменениями, связанными с действием вируса.
.
Для получения более подробных данных об этих изменениях авторами было предложено проводить комбинированные исследования, например, сочетание однофотонной эмиссионной компьютерной томографии с МРТ.
Источники:
Синдром Гийена-Барре
1 апреля в журнале Lancet был описан первый случай синдрома Гийена-Барре, ассоциированного с COVID-19. В конце февраля 61-летняя женщина обратилась к врачу с жалобами на остро возникшую слабость в обеих ногах. Она вернулась из Уханя в конце января, но отрицала развитие у нее таких симптомов, как лихорадка, кашель, боль в груди и диарея. Функциональные показатели работы ее дыхательной системы были в норме, аускультация легких не выявила признаков патологии. Неврологическое исследование показало симметричную слабость (4/5 по шкале оценки мышечной силы MRC) и арефлексию в нижних конечностях. Симптомы прогрессировали: через три дня сила мышц составляла 4/5 для рук и 3/5 для ног. В дистальных отделах конечностей начала снижаться чувствительность к прикосновениям и уколам иглой. Исследование цереброспинальной жидкости на четвертый день после обращения показало нормальное количество клеточных элементов и высокий уровень белка. Проведенная на пятый день ЭНМГ показала задержку проводимости в дистальных отделах верхних и нижних конечностей и отсутствие F-волн, что свидетельствовало о наличии демиелинизирующей нейропатии. Женщине был поставлен диагноз: синдром Гийена-Барре.
На восьмой день у пациентки развились сухой кашель и лихорадка. КТ органов грудной клетки показала участки «матового стекла» в обоих легких. В мазках слизи из полости носа методом ПЦР была обнаружена РНК SARS-CoV-2. После проведенного курса лечения лопинавиром и ритонавиром состояние пациентки улучшилось. На 30 день с момента обращения восстановилась нормальная мышечная сила в руках и ногах, появились сухожильные рефлексы. У родственников, контактировавших с больной новой коронавирусной инфекцией, неврологических симптомов отмечено не было.
Авторы предполагают, что за развитие синдрома Гийена-Барре у данной пациентки ответственен именно COVID-19. Это вносит в перечень возможных механизмов поражений нервной системы еще один — аутоиммунные воздействия при инфицировании новым коронавирусом.
Таким образом, на данный момент в литературе уже были представлены случаи поражения структур нервной системы при инфицировании COVID-19 по трем основным механизмам: цитокиновый шторм, прямое повреждающее действие и аутоиммунное воздействие. Публикации новых клинических случаев позволят пролить свет на особенности этих механизмов. Уже сейчас становится ясно, что каждый специалист, работающий с COVID-19, должен быть насторожен в отношении возможного развития неврологических симптомов и вовремя их диагностировать.
Источники:
Потеря контроля над течением эпилепсии
Развитие эпилепсии в этом случае не совсем верно считать ассоциированным с COVID-19 — пациентка имела постэнцефалитическую эпилепсию после другого вирусного заболевания и успешно контролировала возникновение эпилептических припадков в течение двух лет. Однако изменение течения заболевания после инфицирования коронавирусом заставляет задуматься о возможном влиянии новой вирусной инфекции на течение контролируемой эпилепсии.
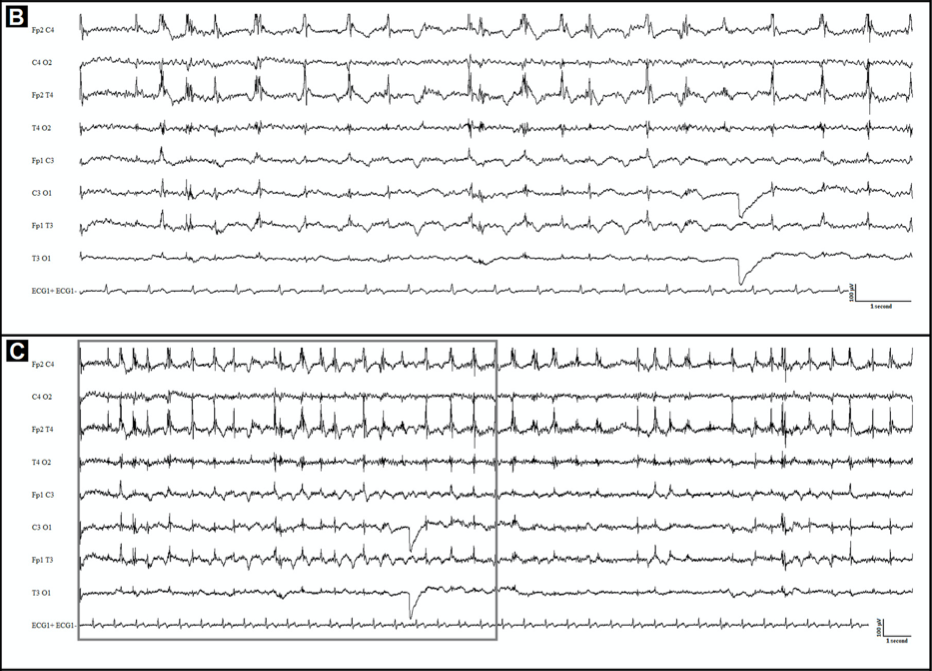
78-летняя женщина поступила в отделение неотложной помощи с продолжающимися миоклоническими судорогами правой половины лица и тела. В анамнезе — артериальная гипертензия и постэнцефалитическая эпилепсия. В возрасте 76 лет женщина перенесла герпесвирусный энцефалит, который манифестировал с повторяющихся оральных автоматизмов и афазии в течение 6 часов. На ЭЭГ наблюдались перемежающиеся эпилептиформные разряды над левой височной долей, формирующие бессудорожный эпилептический статус. Эпистатус был успешно купирован, после чего сохранялась слабо выраженная афазия и небольшая слабость конечностей. С целью профилактики приступов пациентка принимала вальпроевую кислоту и леветирацетам, ввиду чего эпилептические приступы не проявляли себя в течение двух лет.
Утром 12 марта 2020 года у пациентки развился фокальный эпилептический статус без продромальных симптомов. Температура на момент госпитализации составляла 36,1 °C. Неврологический осмотр выявил легкую афазию, паралич правой половины лица, пронацию правой руки и спастическое отведение правой ноги. Пациентка демонстрировала продолжающиеся миоклонические судороги век правого глаза и верхней губы в течение двух часов. Терапия проводилась при помощи вальпроевой кислоты и мидазолама внутривенно. На ЭЭГ фиксировалась нерегулярная, высокоамплитудная дельта-активность, в основном локализованная в лобно-центрально-височной области слева.
.
Противоэпилептическая терапия привела к регрессу эпистатуса. КТ головного мозга не выявила острой патологии, на МРТ головного мозга описывались очаги глиоза и атрофии височной и теменной долей слева, отсутствие новых патологических изменений и накоплений контрастного вещества. Рентген грудной клетки — без особенностей. Из лабораторных данных обращают на себя внимание лимфоцитопения и тромбоцитопения.
.
12 часов спустя у пациентки развилась лихорадка без типичных для коронавирусной инфекции респираторных проявлений. Сатурация была в норме. Анализ крови демонстрировал дальнейшее снижение уровней лейкоцитов и тромбоцитов. C-реактивный белок находился на уровне 29,7 мг/л, прокальцитонин — 0,07 нг/мл. Начатая антибактериальная терапия не оказала влияния на лихорадку. Исследования крови и мочи не выявили наличия бактерий, грибов или нейротропных вирусов.
Из эпидемиологического анамнеза стало известно, что на предыдущей неделе пациентка виделась со своим сыном, который контактировал с людьми, позитивными по COVID-19, и до этого находился на превентивной изоляции. ПЦР мазков из носо- и ротоглотки выявила у женщины наличие COVID-19. Пациентка была переведена в инфекционное отделение, получала терапию по схеме лопинавир-ритонавир + гидроксихлорохин с положительным эффектом. Дальнейшие исследования легких не выявили интерстициальной пневмонии. Пациентка не получала оксигенотерапию, судорожные приступы не рецидивировали. 28 марта была выписана после двух отрицательных ПЦР мазков при отсутствии лихорадки.
В данном случае коронавирус, возможно, стал триггером к активации эпилептической активности у пациентки, перенесшей ранее постэнцефалитическую эпилепсию. Нужно отметить, что инвазию вируса в ЦНС установить не удалось, так как не были проведены спинномозговая пункция и ПЦР цереброспинальной жидкости. Пока что можно предполагать, что коронавирусная инфекция может являться тем триггером, который в отсутствие других симптомов может приводить к рецидивам некоторых заболеваний ЦНС.
Источники:
Неврологическая манифестация COVID-19
Подводя итог, приводим инфографику с наглядным изображением частоты распространения основных неврологических симптомов, которые отмечались у пациентов с COVID-19 по всему миру.
.
Потеря обоняния и рассудка: что известно о влиянии COVID-19 на нервную систему?
Многие симптомы, которые испытывают люди, зараженные SARS-CoV-2, связаны с нервной системой. Пациенты жалуются на головные боли, боли в мышцах и суставах, слабость и спутанность сознания, утрату вкуса и обоняния — и все это может длиться от недели до нескольких месяцев после заражения. В тяжелых случаях COVID-19 способен привести к воспалению головного мозга или инсульту. Вирус, бесспорно, обладает неврологическим воздействием. Но то, как именно он влияет на нервные клетки, все еще отчасти остается загадкой. Может ли сама по себе реакция иммунной системы привести к таким симптомам? А что, если новый коронавирус непосредственно атакует нервную систему? В теме разобралась научный журналист Стефани Сазерленд, СПИД.ЦЕНТР публикует перевод ее статьи для журнала Scientific American.
Некоторые исследования, в том числе полученные недавно предварительные результаты анализа тканей мозга мышей и людей, доказали, что SARS-CoV-2 способен проникать в нервные клетки и мозг. Но ответа на вопрос, всегда ли так происходит или только в самых тяжелых случаях, пока нет. Бурная реакция иммунной системы может привести к далеко идущим последствиям. Вплоть до того, что иммунные клетки могут вторгнуться в мозг и разрушить его.
Некоторые неврологическим симптомы не так серьезны, но не менее загадочны. Один из таких симптомов, вернее, набор симптомов, который привлекает все больше внимания, называется весьма расплывчато — «спутанность сознания». Даже после того, как остальные проявления болезни прекратились, пациенты с COVID-19 нередко страдают от забывчивости, рассеянности и других ментальных затруднений. Все еще неясно, что вызывает эти явления, хотя они также могут быть связаны с воспалительным процессом во всем теле, который сопутствует COVID-19. Но у многих людей, переболевших коронавирусом даже в легкой форме, слабость и спутанность сознания длятся месяцами. Хотя, казалось бы, легкое течение болезни не должно подрывать иммунную систему.
Другой широко распространенный симптом, который называется аносмия, или потеря обоняния, также может быть связан с изменениями, не вызванными поражением самих нервных клеток. Обонятельные нейроны, клетки, которые передают запахи мозгу, не имеют того рецептора, через который SARS-CoV-2 проникает в клетки, так что, судя по всему, не заражаются. Исследователи все еще выясняют, может ли потеря обоняния быть связана с взаимодействием между вирусом и другим рецептором обонятельных нейронов, либо с не нервной тканью, которая устилает нос изнутри.
Эксперты говорят, что вирусу не обязательно проникать в нервные клетки, чтобы вызывать некоторые из загадочных неврологических симптомов, к которым приводит болезнь. Многие эффекты, связанные с болью, могут быть вызваны реакцией сенсорных нейронов, нервных волокон, которые тянутся от спинного мозга через все тело, чтобы собирать информацию о внешней окружающей среде или внутренних процессах тела. Ученые уже продвинулись вперед в понимании того, как именно SARS-CoV-2 захватывает рецепторные нейроны, чувствительные к боли (их еще называют ноцицепторами), приводя к некоторым из ключевых симптомов COVID-19.
Вкус боли
Нейробиолог Теодор Прайс из Техасского университета Далласа обратил внимание на симптомы, о которых сообщалось в ранних исследованиях и на которые жаловались пациенты его жены, фельдшера, которая удаленно работает с больными COVID-19. Эти симптомы включали боль в горле, головную и мышечную боль во всем теле, а также мучительный кашель. (Кашель отчасти вызывают чувствительные нервные клетки легких.)
Примечательно, что некоторые пациенты сообщали о потере чувства, которое называется хеместезис. Из-за его утраты люди переставали чувствовать вкус острого перца чили или прохладной перечной мяты. Речь идет о чувстве, которое передается рецепторами боли, а не вкуса. И пусть многие эти симптомы характерны для вирусных инфекций, распространенность и устойчивость симптомов, связанных с болью, и их возникновение даже при слабом течении болезни подсказывают, что COVID-19 может вызывать не только типичную воспалительную реакцию на заражение, но и поражать рецепторные нейроны.
Прайс считает, что это удивительно. Все пострадавшие пациенты «жалуются на головные боли, а у некоторых появились проблемы с болью, которая выглядит как невропатия», то есть хроническая боль, возникающая при повреждении нервов. Это наблюдение подтолкнуло его изучить, способен ли новый коронавирус поражать ноцицепторы (болевые рецепторы).
Главный критерий, который используют ученые, чтобы определить, может ли SARS-CoV-2 проникнуть в клетки тела, — наличие ангиотензин — превращающего фермента 2 (ACE2), мембранного белка клетки. ACE2 действует как рецептор, посылая клетке сигналы, регулирующие давление крови, а также является точкой входа SARS-CoV-2. Поэтому Прайс стал искать его в нервных клетках и уже опубликовал свое исследование на эту тему в журнале PAIN.
Как коронавирус может проникать в нервные клетки
Ноцицепторы — как и другие рецепторные нейроны — собираются в неприметные с виду кластеры, расположенные по ходу спинного мозга, которые называются дорсальные корешковые ганглии (DGR). Прайс и его команда изучили нервные клетки, полученные от доноров после смерти или в ходе онкологических операций. Они применили секвенирование РНК, чтобы определить, какие белки должна производить клетка, и использовали антитела, чтобы выделить сам ACE2. Ученые обнаружили, что ряд дорсальных ганглий и правда содержит ACE2, тем самым открывая вирусу доступ в клетки.
Рецепторные нейроны выбрасывают своего рода длинные щупальца — аксоны. Их окончания воспринимают определенные стимулы, а затем передают их мозгу в виде электрохимических сигналов. Оказалось, что нервные клетки, которые содержат ACE2, также имеют генетические инструкции и РНК для белка под названием MRGPRD. Этот белок помечает клетки как вид нейронов, окончания которых сосредоточены на коже и поверхностях внутренних органов, включая легкие — где они как раз и могут подхватить вирус.
Прайс считает, что заражение нервной системы может обострять симптомы COVID-19, а также влиять на их продолжительность. «Самый вероятный сценарий заключается в том, что и вегетативные, и рецепторные нейроны подвержены инфекции», — говорит он. «Мы понимаем, что если вирус заражает нейроны, то это может привести к долгосрочным последствиям», даже если вирус не остается в клетках.
Однако, по мнению Прайса, «заражение нервных клеток происходит необязательно». В другом недавнем исследовании он сравнил данные генетического секвенирования клеток пациентов с легким COVID-19 со здоровой контрольной группой, чтобы увидеть, как происходит взаимодействие со здоровыми DGR человека. Прайс говорит, что его команда отыскала у зараженных пациентов множество молекул, которые называются цитокины. Они дают сигналы иммунной системе и могут взаимодействовать с рецепторами нервных клеток. «Тут масса всего, что имеет отношение к невропатической боли», — замечает Прайс. Его наблюдение подсказывает, что даже если вирус не атакует нервные клетки напрямую, они могут подвергаться длительному губительному воздействию со стороны иммунных молекул.
Анна Луиза Оклендер, невролог больницы общего профиля Массачусетса, которая написала комментарий к статье Прайса в PAIN, говорит, что исследование было «исключительно качественным», в частности, потому, что в нем использовались клетки человека. Но, добавляет она, «у нас нет доказательств того, что непосредственное проникновение вируса в [нервные] клетки является основным механизмом их повреждения». В то же время последние открытия не исключают такой возможности. Оклендер считает «вполне возможным», что влиять на активность клеток и даже причинять им непоправимый вред могут и воспалительные процессы, протекающие вне нервных клеток. Еще один вариант — частицы вируса, взаимодействуя с нейронами, приводят к аутоиммунной атаке на нейроны.
Эксперименты с мышами и крысами
Предполагается, что точкой проникновения нового коронавируса является ACE2. Но Раджеш Ханна, нейробиолог и исследователь из Аризонского университета, отмечает, что «ACE2 — не единственная возможность для SARS-CoV-2 проникнуть в клетки». «Альтернативным каналом» может быть другой белок, который называется нейропилин-1 (NRP1). NRP1 играет важную роль в ангиогенезе (образовании новых кровеносных сосудов) и в отращивании нервными клетками своих длинных аксонов.
Эта идея возникла благодаря исследованиям клеточного материала и опыту на мышах. Выяснилось, что NRP1 взаимодействует с печально известным шиповидным белком вируса, который SARS-CoV-2 использует, чтобы проникать в клетки. «Мы доказали, что он связывает нейропилин, так что этот рецептор потенциально может позволять инфицирование», — объясняет вирусолог Джузеппе Балистрери из Хельсинкского университета, соавтор работы, основанной на опытах с мышами, которая была опубликована в Science наряду с результатами исследования клеток. Судя по всему, NRP1 является вспомогательным фактором инфицирования через ACE2, но не позволяет вирусу проникнуть в клетку сам по себе. «Нам известно, что если есть оба рецептора, мы получаем больше инфекции. Вместе они дают более мощный результат», — добавляет Балистрери.
Эти открытия привлекли внимание Ханны, который изучал фактор роста сосудистого эндотелия (VEGF), молекулу, роль которой в передаче сигналов боли давно признана и которая также связана с NRP1. Раджеш задумался, может ли вирус влиять на передачу сигналов боли через NRP1, и проверил это на крысах в исследовании, статья о котором также была опубликована в PAIN. «Мы ввели VEGF в животных [в лапы] и к нашему удивлению заметили явные признаки боли в течение 24 часов», — говорит Ханна. «А затем мы получили еще более классный результат: мы ввели одновременно VEGF и шиповидные белки. И знаете что? Боль исчезла».
Исследование показало, «что происходит с сигналами нейронов, когда вирус касается рецептора NRP1», объясняет Балистрери. «Результаты убедительно продемонстрировали», что «прикосновение шиповидного белка вируса к NRP1» влияет на активность нейронов.
В эксперименте на крысах с поврежденными нервами для моделирования хронической боли введение шиповидного белка приводило к ослаблению проявлений боли у животных. Это открытие дает надежду на то, что препарат подобной формы, связывающий NRP1, может стать потенциальным болеутоляющим. Такие молекулы уже разрабатывают для использования при онкологических заболеваниях.
Ханна выдвигает провокационную и непроверенную гипотезу о том, что шиповидный белок может воздействовать на NRP1 для подавления ноцицепторов, таким образом маскируя симптомы, связанные с болью на ранних стадиях заражения. Когда SARS-CoV-2 только начинает заражать человека, белок создает анестетический эффект и облегчает распространение вируса. «Не буду исключать такой вариант», — комментирует Балистрери: «В этом нет ничего невероятного. Вирусы обладают арсеналом средств, которые позволяют им оставаться незаметными. Обходить наши защиты — это то, что они умеют лучше всего».
Нам все еще предстоит узнать, способна ли SARS-CoV-2-инфекция приводить к анальгезии у людей. Балистрери объясняет, что ученые «использовали большую дозу вируса в лабораторных условиях и на крысе, а не человеке. Сила эффекта, который они наблюдали, [может быть связана] с большой дозой белка вируса, который они использовали. Пока что мы не знаем, может ли сам вирус [приглушать боль] у людей».
Опыт одного пациента — Рейва Преториуса — 49-летнего мужчины из Южной Африки, подсказывает, что, возможно, в этом направлении исследований есть потенциал. В 2011 году Преториус пережил аварию, которая привела к трещинам позвоночника в шейном отделе и серьезному повреждению нервов. Он страдает от постоянной острой боли в ногах, которая будит его каждую ночь около 3–4 утра. По словам Преториуса: «Как будто кто-то вечно льет кипяток мне на ноги». Но когда в июле он заразился коронавирусом на предприятии, где он работает, все изменилось. «Это было очень странно. Когда я болел COVID, боль была терпимой. Порой даже, казалось, будто она прошла. Мне было сложно в это поверить». Преториус впервые смог спать по ночам так же, как до аварии. Он отмечает, что несмотря на слабость и изнурительные головные боли, ему «стало лучше во время болезни, потому что боль прошла». Теперь, когда Преториус вылечился от COVID, невропатическая боль вернулась.
Хорошо это или плохо, но, кажется, COVID-19 влияет на нервную систему. Инфицирует ли SARS-CoV-2 сами нервные клетки — все еще неизвестно, как и многое другое об этом вирусе. Но можно прийти к выводу, что даже если вирус способен проникать в некоторые нейроны, ему не обязательно это делать. Он способен натворить немало бед и оставаясь вне этих клеток.