рвота после операции на головном мозге
Рвота после операции на головном мозге
• При большинстве краниотомии следует экстубировать пациента в сознании в конце операции.
• В некоторых клиниках всех пациентов после краниотомии но поводу опухолей отправляют в специальное отделение интенсивной терапии.
• Пациенты обычно лежат с приподнятым на 15-30° головным концом стола.
• Очень важно адекватное обезболивание, так как значительное количество пациентов испытывает умеренную или сильную боль после краниотомии, даже при правильном проведении операции.
• Необходимо быстро распознать и купировать судорожную активность. Ее распознавание в раннем послеоперационном периоде может быть довольно трудным, поэтому необходима высокая степень настороженности.
• ИВЛ в послеоперационном периоде может потребоваться пациентам с предшествующим серьезным неврологическим нарушением, особенно при пониженных рефлексах воздухоносных путей или дыхания, или же при значительном отеке мозга.
• Мониторинг ВЧД может быть показан пациентам на ИВЛ в послеоперационном периоде.
• Доза дексаметазона в послеоперационном периоде обычно снижается в течение нескольких дней после операции.
В послеоперационном периоде некоторые опухоли или их локализация вызывают определенные проблемы:
• Длительная компрессия лобных долей при удалении менингиом обонятельной борозды может вызвать послеоперационный отек. Необходимо после операции продолжить седацию и вентиляцию, хотя нет достаточных данных, что это повлияет на появление или исход осложнения.
• После резекции височных долей пациенты могут находиться в просоночном состоянии в течение нескольких дней.
• Глиомы с вызываемым опухолью отеком в некоторых случаях реагируют на резекцию развитием массивного и смертельного отека мозга в раннем послеоперационном периоде. Обычно в таких случаях потребуется проведе ние седации и вентиляции.
• У пациентов с опухолями задней черепной ямки в послеоперационном периоде может развиться значительная бульварная симптоматика, снижение защитных рефлексов верхних дыхательных путей, так что они будут неспособны самостоятельно обеспечить защиту дыхательных путей после операции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Послеоперационная тошнота и рвота
Послеоперационная тошнота и рвота (ПОТиР) — частое осложнение, сопровождающееся дискомфортом у пациента и увеличением длительности и стоимости лечения. Частота развития послеоперационной тошноты и рвоты составляет 50 и 30 % соответственно. При наличии у пациента нескольких факторов риска частота ПОТиР достигает 80 %.
Идентификация пациентов с рисками развития ПОТиР
Выделяют ряд факторов, имеющих доказанную связь с развитием ПОТиР:
В данной шкале риска учитываются следующие факторы: женский пол, анамнез ПОТиР, возраст
Ввиду трудности выявления тошноты у детей определяется риск развития рвоты. В данной шкале риска учитываются следующие факторы: длительность операции (≥ 30 мин), возраст ≥ 3 лет, операции по поводу косоглазия, ПОР или ПОТиР в анамнезе. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 10, 30, 50 и 70 % соответственно.
Используя вышепредставленные шкалы, пациенты разделяются на группы риска:
От категории риска зависит дальнейшая тактика анестезиолога в предупреждении и лечении ПОТиР.
Уменьшение базового уровня риска развития ПОТиР
Для уменьшения базового риска ПОТиР необходим комплексный подход к ведению пациента во время периоперационного периода. Необходимо оценить преимущества и недостатки методов анестезии. Известно, что при проведении регионарной анестезии частота развития ПОТиР значительно меньше, чем при использовании ингаляционных анестетиков и закиси азота. Также использование пропофола для индукции и поддержания анестезии достоверно уменьшает частоту ПОТиР.
Поддержание адекватной гидратации пациента (объем инфузии 30 мл/кг) во время операции уменьшает частоту ПОТиР. Снижение использования опиоидов возможно с помощью применения других препаратов для достижения анальгезии: нестероидных противовоспалительных средств (НПВС) и ингибиторов ЦОГ-2, кетамина в интраоперационном периоде. Однако, данные препараты имеют собственные ограничения и противопоказания к применению.
Профилактика развития ПОТиР
Профилактика проводится всем пациентам вне зависимости от риска развития ПОТиР. Профилактика включает комбинацию препаратов из разных групп антиэметиков и мероприятия по снижению базального уровня риска:
Классы противорвотных препаратов (антиэметиков):
1. Антагонисты рецепторов 5-HT3 (5-гидрокситриптамина)
Данная группа включает такие препараты, как ондансетрон, доласетрон, гранисетрон, трописетрон, рамосетрон и палоносетрон. Ондансетрон является «золотым стандартом» в сравнении с другими антиэметиками. Максимальная эффективность наблюдается при введении данных препаратов во время окончания оперативного вмешательства, кроме палоносентрона, который чаще вводится во время индукции анестезии.
Данная группа имеет благоприятный профиль побочных эффектов. При использовании антагонистов рецепторов 5-HT3 есть риск удлинения интервала QT, ввиду этого FDA ограничила дозу ондансетрона для лечения тошноты и рвоты до 16 мг однократно.
2. Антагонисты рецепторов NK-1 (нейрокинин-1)
Новый класс антиэметиков, к которому относятся апрепитант, касопитант, релопитант. Клинические испытания показали, что антиэметический эффект данных препаратов сопоставим с эффектом ондансетрона в дозировке 4 мг. Доказано усиление эффекта при использовании комбинации касопитанта с ондансетроном.
3. Кортикостероиды
Дексаметазон эффективно предупреждает развитие тошноты и рвоты в послеоперационном периоде. Профилактические дозы 4–5 мг в/в применяются у пациентов повышенного риска в начале операции. Использование доз > 0,1 мг/кг дексаметазона уменьшает послеоперационную боль, снижает потребность в опиоидах, частоту развития тошноты и рвоты. Метилпреднизолон более эффективен в предупреждении поздней ПОТиР.
Возможно повышение уровня глюкозы крови через 6–12 часов после применения дексаметазона в дозе 8 мг. Требуется осторожное использование препарата у пациентов с нарушениями толерантности к глюкозе, сахарным диабетом второго типа, ожирением. Применение дексаметазона однократно в профилактических дозах (4–8 мг) не вызывает повышения риска развития инфекционных осложнений со стороны операционной раны.
4. Бутирофеноны
Дроперидол в низких дозах Профилактические дозы препаратов и время введения для взрослых
1. Во время индукции анестезии:
2. В конце операционного вмешательства:
3. До операционного вмешательства, в составе премедикации:
Профилактические дозы препаратов для детей
Частые комбинации препаратов для профилактики ПОТиР
1. Взрослые:
2. Дети:
Немедикаментозные методы профилактики
Имеются данные о том, что стимуляция различными методиками точки P6 (дистальная треть предплечья), и срединного нерва с помощью титанической стимуляции снижают частоту развития ПОТиР в раннем послеоперационном периоде. Данные методы рекомендуется применять до либо после индукции анестезии. Эффект стимуляции сопоставим с применением распространенных антиэметиков и не зависит от возраста и инвазивности методики.
Лечение развившихся ПОТиР
При развитии ПОТиР терапия должна проводиться антиэметиками из фармакологического класса, не использовавшегося при периоперационной профилактике.
Профилактика ПОТиР не проводилась:
Профилактика ПОТиР проводилась:
При неэффективности предыдущего этапа:
При развитии ПОТиР необходимо исключить механические и лекарственные причины тошноты и/или рвоты: высокие дозы опиоидов, затекание крови и/или других жидкостей в гортань (часто после тонзилэктомии), кишечную непроходимость.
Источник:
Последствия и реабилитация после удаления опухоли головного мозга в Асаф-ха-Рофэ
Отделение кардиологии и кардиохирургии
Отделение пластической хирургии
Лечение псориаза на Мертвом море
Лечение радиоактивным йодом
Отделение внутренних болезней
Передовые методы лечения
Сложно дать точную информацию, поскольку есть разные типы операций. Выбор хирургии определяется на основе расположения опухоли и ее величины. Некоторые пациенты находятся в бессознательном состоянии несколько дней после хирургии, но большинство приходит в себя почти сразу.
Первые часы

Будучи без сознания
В некоторых случаях больной находиться без сознания несколько дней. Иногда такое состояние длится дольше, чем ожидалось. Однако это не означает, что не стоит ожидать полного восстановления. Просто процесс занимает больше времени.
В это время больной находиться на аппарате искусственной вентиляции легких. ИВЛ применяют в основном после операции на стволе мозга, либо при проблемах с дыханием на любом этапе хирургии или периода восстановления.
Аппарат подключается к трубке, которую вводят через горло вниз к основным дыхательным путям в верхней части легких. Иногда трубку вводят через небольшое отверстие в шее – трахеостому. Есть ряд причин, почему проводят данную операцию (трахеостомию). К примеру, если в области шеи или горла есть опухоль или отек после операции.
В случае, когда пациент находится без сознания 3 или 4 дня, через назогастральный зонд подают жидкость в желудок. Больному обеспечивают полный уход.
Наблюдение
После операции по удалению опухоли головного мозга к пациенту присоединяют несколько устройств, необходимых в первое время.
Среди озвученных устройств может быть наружный вентрикулярный дренаж, устраняющий лишнюю жидкость из мозга, предупреждая гидроцефалию. Также может быть использован монитор измерения внутричерепного давления.
Обезболивающие препараты

Сильная боль после операции по удалению опухоли головного мозга – необычное явление. Если пациент перенес хирургическое вмешательство на позвоночнике, боли может быть значительно больше. В таком случае используется капельница, через которую поступают анальгетики. Доза корректируется при необходимости.
Следующие несколько дней
В течение следующих нескольких дней медсестры помогают, если что-то необходимо сделать, чтобы пациент не напрягался. Любой вид напряжения может поднять давление внутричерепное. Возможно, придется несколько дней лежать. Может быть поднято изголовье кровати, чтобы предотвратить отек.
В зависимости от проведенной операции медсестры регулярно помогают поменять положение пациенту, что предупредить образование пролежней. Кроме того, больной выполняет специальные упражнения для рук и ног, что способствует кровообращению, упражнения для дыхания (глубокие вдохи каждый час).
Через 48-72 часа проводят сканирование мозга с помощью КТ или МРТ. Оно показывает, есть ли опухоль, величину отеку в оперированной области.
Еда и питье
Сначала размещают назогастральный зонд через нос в желудок. Он присоединяется к дренажной сумке и предотвращает возникновение тошноты, которая может повысить внутричерепное давление.
Как только пациент приходит в себя, ему дают несколько глотков воды. Медсестра внимательно следит, если ли какие-либо проблемы с глотанием. Иногда это случается после операции по удалению опухоли головного мозга. Данное нарушение также могут проверить с помощью речи, прежде чем терапевт разрешит что-нибудь поесть или попить.
После того, как больной сможет пить воду, назогастральный зонд извлекают. Сначала пациенту дают бульон, постепенно переводят на нормальную пищу.
Подъем с кровати и перемещение по комнате может сначала показаться очень сложным. Однако это снизит риск тромбообразования. Первое время пациента поощряют вставать с кровати и пересаживаться в кресло. С больным работает физиотерапевт.
Реабилитация после удаления опухоли головного мозга в Израиле

После хирургии не редкость – головокружение или спутанность сознания, когда человек не осознает, что с ним происходит или где он находится. Эти симптомы эпизодичны, они приходят и уходят. Врачи объяснят, что это нормальное явление, часть восстановительного периода.
Сама операция может усилить существующие ранее симптомы. Либо пациент заметит, что возникли признаки, которых раньше не было. Отек может стать причиной:
Это особенно трудное время для друзей и родственников. Они могут беспокоиться, что операция не дала результата. Но такие симптомы обычно ослабевают и исчезают по мере реабилитации после удаления опухоли головного мозга. Это может занять всего несколько дней, но в некоторых случаях – несколько недель или месяцев.
Хирург в больнице Асаф ха Рофэ даст определенное представление, чего ожидать в период восстановления. У некоторых людей выздоровление будет полным. Они вернутся на тот же уровень физической подготовки, к обычной деятельности.
Из-за расположения опухоли у некоторых людей развиваются:
Возможно любое количество различных симптомов, в зависимости от того, где была опухоль мозга. Может потребоваться много времени для восстановления. Важно, как можно раньше начать любую терапию. Для пациентов это обычно трудный период. Однако усилия и помощь физиотерапевтов, логопедов и других специалистов по реабилитации обязательно дадут положительные результаты.
Процесс реабилитации после удаления опухоли мозга начинается, когда пациент подымается с постели. Постепенно он сможет делать все больше и больше. Возможно, никогда не удастся восстановиться до того же уровня физической активности, но состояние обязательно будет улучшаться.
Уверенность будет возрастать по мере того, как человек будет справляться с нарушениями, которые вызывала опухоль и операция.
Возможные последствия операции (удаления) опухоли головного мозга
Потенциальные побочные эффекты будут зависеть от следующих факторов:
Основные возможные нежелательные последствия удаления опухоли головного мозга:
Злокачественные опухоли головного мозга
Злокачественные новообразования центральной нервной системы очень агрессивны, быстро растут и разрушают ткань мозга. При их обнаружении операцию по удалению опухоли желательно проводить как можно раньше, до развития тяжелого необратимого неврологического дефицита.
Нейрохирурги клиники НАКФФ проводят сложнейшие операции при глиобластомах и других новообразованиях ЦНС высокой степени злокачественности. Врачи могут безопасно удалить даже глубоко залегающие опухоли, так как перед вмешательством они выявляют функционально важные зоны мозга, чтобы не повредить их во время операции.
Какие бывают злокачественные опухоли мозга
Самые распространенные опухоли мозга – это глиомы и менингиомы. Первая группа развивается из мозговой ткани, вторая – из оболочек мозга. Большинство менингиом – доброкачественные, и только 1% приходится на менингиомы третьей, самой высокой степени злокачественности. В то же время большинство глиом – злокачественные.
Самая частая опухоль этого типа – глиобластома. Для глиом выделяют 4 степени злокачественности новообразований, и глиобластома имеет четвертую, самую высокую степень. Проблема её лечения заключается в том, что она часто располагается в глубине мозга, и до неё трудно добраться. К тому же, опухоль не имеет четкой границы: она врастает в окружающие здоровые ткани.
Даже самые агрессивные новообразования обычно не дают метастазов за пределы центральной нервной системы. Но они распространяются в пределах мозга, а при росте разрушают окружающие здоровые ткани.
На практике нейрохирургу, который оперирует взрослых пациентов, среди всех злокачественных новообразований чаще всего приходится сталкиваться с глиобластомой или метастатическими опухолями рака другой локализации. Большинство других образований встречаются очень редко или имеют доброкачественную природу.
Как лечат опухоли мозга?
Чаще всего для лечения опухолей мозга используют три метода:
Самый эффективный способ лечения – хирургическая операция. Два других способа имеют множество недостатков, поэтому применяются как дополнительные методики или у пациентов с противопоказаниями к операции.
Проблема медикаментозного лечения состоит в том, что большинство препаратов плохо проникают через гематоэнцефалический барьер. К тому же, успехи лечения далеко не самые выдающиеся. При глиобластоме стандартный препарат для химиотерапии увеличивает продолжительность жизни человека в среднем на 10 недель.
Методы лучевой терапии часто позиционируются как альтернатива операции. Пациентов впечатляют и названия процедур: Кибернож, Гамма-нож. Складывается впечатление, что опухоль «вырезается» из головы радиацией, быстро и безболезненно. Но правда заключается в следующем:
В силу этих причин лучевая терапия всё же не считается основным радикальным методом лечения злокачественных новообразований мозга и не может использоваться как альтернатива операции. Облучение должно дополнять, а не замещать нейрохирургический метод лечения. Если лучевая терапия применяется вместо, а не в дополнение к операции, то такие случаи связаны исключительно с глубоким залеганием опухоли, до которой нельзя добраться из-за угрозы тяжелого неврологического дефицита, или наличием медицинских противопоказаний к операции.
Преимущества хирургического вмешательства:
Как проводят операцию?
Нейрохирургические операции по удалению злокачественных опухолей – сложные и высокотехнологичные. Врачу важно удалить новообразование полностью, и при этом не повредить функционально значимые зоны мозга.
Процедуры, определяющие успех операции, часто начинаются ещё до её начала. Врачи проводят тщательное обследование пациента, особенно при глубоком залегании опухоли. Они определяют границы опухоли при помощи ПЭТ или функциональной МРТ. Затем требуется выявление функционально значимых зон, чтобы обойти их, рассекая мозговую ткань. Для этого используется функциональное картирование и электрофизиологическое исследование. При необходимости исследования могут быть выполнены прямо во время операции.
Операция проводится под стереотаксическим контролем. Стереотаксис позволяет врачу идеально ориентироваться внутри черепа пациента. Классический вариант подразумевает использование жесткой рамы, которую фиксируют винтами к надкостнице. В последние годы получили распространение системы безрамного стереотаксиса.
Важнейшая задача нейрохирурга, определяющая успех операции, состоит в полном удалении опухоли. Но для этого её нужно отличить от здоровой ткани. Выглядят они практически одинаково. Чтобы найти границы новообразования, используется флуоресцентная диагностика и лазерная спектроскопия. Врач использует вещество, которое поглощается патологическими клетками и заставляет их светиться.
Немецкое исследование с участием 350 пациентов показало, что без флуоресцентной диагностики только у 1 из 3 пациентов глиобластому удается удалить полностью, а при её использовании – в 2/3 случаев. Вероятность отсутствия рецидива опухоли в течение 6 месяцев после операции увеличивается в 2 раза.
Рвота после операции на головном мозге
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», Москва, Россия, ФГБНУ НИИ нейрохирургии им. Н.Н. Бурденко (дир. — акад. РАН А.А. Потапов), Москва, Россия, Кафедра акушерства и гинекологии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
Послеоперационная тошнота и рвота в нейрохирургии – подходы меняются, проблема остается
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2019;83(2): 93-100
Клюкин М. И., Куликов А. С., Лубнин А. Ю. Послеоперационная тошнота и рвота в нейрохирургии – подходы меняются, проблема остается. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2019;83(2):93-100.
Klyukin M I, Kulikov A S, Lubnin A Yu. Postoperative nausea and vomiting in neurosurgery: the approaches are varied but the problem remains unsolved. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2019;83(2):93-100.
https://doi.org/10.17116/neiro20198302193
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Послеоперационная тошнота и рвота (ПОТР) могут провоцировать дислокацию и вклинение мозга, особенно в условиях отека. Цель исследования — оценить актуальность проблемы ПОТР в условиях использования современных подходов к ее профилактике, выявить факторы риска ПОТР, характерные для пациентов нейрохирургического профиля. Материал и методы. В обсервационное проспективное исследование включены 240 больных, перенесших плановые вмешательства в Центре нейрохирургии в июле — ноябре 2017 г. Материалом для исследования послужили результаты анкетирования больных в течение первых 48 ч после операции, а также данные историй болезни. Результаты. Частота развития ПОТР в общей группе составила 39,6%. После операций на задней черепной ямке ПОТР развилась у 36 (68%) из 53 пациентов. В сравнении с частотой после вмешательств при другой локализации риск развития ПОТР после операций на задней черепной ямке достоверно выше (p 0,05). При применении ондансетрона частота ПОТР в первые 8 ч после операции составила 22,8%, без применения ондансетрона — 37,2% (p 0,05). Заключение. Проблема ПОТР в нейрохирургии остается актуальной. ПОТР встречается с частотой от 10,5 до 68% в зависимости от области операции. Эффективность современных подходов в ее предотвращении неабсолютна. Необходимы дальнейшие исследования, направленные на повышение эффективности профилактики ПОТР, с применением антагонистов NK-1 рецепторов и электростимуляции срединного нерва.
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», Москва, Россия, ФГБНУ НИИ нейрохирургии им. Н.Н. Бурденко (дир. — акад. РАН А.А. Потапов), Москва, Россия, Кафедра акушерства и гинекологии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
Послеоперационная тошнота и рвота (ПОТР) — частый побочный эффект анестезии, приводящий к значительному дискомфорту пациента. Частота тяжелых случаев послеоперационной рвоты в общей популяции больных достигает 1 случая на 1000 (0,1%) анестезий [1, 2]. Среди нейрохирургических больных этот показатель существенно выше и, по разным данным, составляет около 50% случаев в течение первых 24 ч после трепанации черепа [3, 4]. У отдельных групп пациентов, например при лечении патологии задней черепной ямки (ЗЧЯ), фиксируется еще бóльшая частота ПОТР [5, 6]. ПОТР ведет к увеличению системного артериального и внутричерепного давления, что у нейрохирургических больных сопряжено с риском опасных для жизни осложнений — дислокации и вклинения головного мозга, а также послеоперационной гематомы и отека [4—5, 7]. Кроме того, ПОТР может послужить причиной легочной аспирации, особенно при удалении образований ЗЧЯ [5].
Большие надежды на решение проблемы ПОТР в хирургии возлагались на блокаторы серотониновых рецепторов, показавших высокую эффективность в ряде исследований, проведенных, в частности, с участием пациентов нейрохирургического профиля [6, 8—11]. В последнем руководстве по управлению ПОТР ондансетрон, наиболее известный блокатор серотониновых рецепторов, называют «золотым стандартом» среди других антиэметиков [12]. Подход, основанный на использовании комбинации ондансетрона и дексаметазона в целях профилактики ПОТР, широко используется в клинической практике [13—15]. Вкупе с тотальной внутривенной анестезией (ТВА) пропофолом данные препараты активно используются и в нашем Центре.
Цель исследования — оценить актуальность проблемы ПОТР в условиях использования современных подходов к ее профилактике, а также выявить факторы риска ПОТР, характерные для пациентов нейрохирургического профиля.
Материал и методы
Представленное обсервационное проспективное исследование проводилось на базе ФГАУ «НМИЦН им. акад. Н.Н. Бурденко» Минздрава России. Материалом для исследования послужили результаты анкетирования, а также данные историй болезни пациентов, перенесших плановое оперативное вмешательство. В исследование включили только 268 пациентов, перенесших плановое нейрохирургическое вмешательство в июле — ноябре 2017 г.
Критериями исключения стали: сниженный уровень сознания в пред- и послеоперационном периоде, когнитивные/мнестические расстройства, афазия, развитие ранних послеоперационных осложнений (гематома, отек (набухание мозга), дислокация и вклинение мозга).
Большинству взрослых пациентов анестезия проводилась по однотипной схеме: премедикация мидазоламом и тавегилом на операционном столе, ТВА пропофолом, аналгезия фентанилом и миорелаксация рокуронием. Локо-регионарная аналгезия скальпа ропивакаином выполнена у 15 больных. Послеоперационное обезболивание осуществлялось путем назначения нестероидных противовоспалительных препаратов (НПВП) (лорноксикам, кетонал), при их недостаточной эффективности использовался трамадол у 41 пациента. Трансдермальный пластырь с фентанилом был применен у 5 больных.
При опросе и работе с историями болезни собирались следующие данные: демографические показатели, особенности оперативного вмешательства и анестезии, факторы риска по шкале Apfel (пол, курение, ПОТР или морская болезнь в анамнезе, использование опиоидов в послеоперационном периоде), факторы риска, связанные с операцией, анестезией и другими параметрами, примененные средства профилактики (дексаметазоном и ондансетроном) и терапии ПОТР. Выраженность тошноты и рвоты оценивали по 4-балльной шкале в течение 48 ч после операции: 0 баллов — нет ни тошноты, ни рвоты, 1 балл — тошнота без рвоты, 2 балла — тошнота и рвотные позывы, 3 балла — тошнота и рвота (Приложение 1).
Статистическая обработка данных проводилась в программных пакетах Microsoft Excel 2007 и Statsoft Statistica 10. Рассчитывалось среднее значение ± стандартное отклонение. Статистическая достоверность различий между группами оценивалась с помощью точного критерия Фишера, различия признавались достоверными при p 
Средняя продолжительность анестезии от момента индукции до окончания введения анестетика составила 213±90 мин; среднее время пробуждения с момента окончания операции до экстубации — 97±91 мин. Средняя доза опиоидов (фентанил), введенных интраоперационно, — 3,74 мкг/кг на 1 ч.
В общей группе пациентов частота развития ПОТР, зафиксированной хотя бы однократно в течение 48 ч после операции, составила 39,6%. Без учета экстракраниальных вмешательств этот показатель достиг 42,1%.
В возрастной группе от 3 до 50 лет (которая традиционно рассматривается как группа повышенного риска ПОТР) частота ПОТР составила 42,4%, в группе пациентов младше 3 и старше 50 лет — 35,6% (p>0,05).
При оценке выраженности ПОТР в разные периоды времени после операции (табл. 2) 
Среди факторов риска ПОТР, связанных с областью операции (см. рисунок), 
При анализе факторов риска развития ПОТР по аналогичной шкале у детей мы получили убедительные данные о высоком риске развития ПОТР у детей 3 лет и старше по сравнению с детьми до 3-летнего возраста (52,4% против 15%; p 0,05). Эффективность ондансетрона более наглядно проявилась в первые 8 ч после операции: при его применении ПОТР отмечена у 22,8% пациентов, тогда как без его применения — у 37,2% (p 0,05).
Обсуждение
Полученные нами результаты убедительно доказывают, что проблема ПОТР остается актуальной в нейроанестезиологии, несмотря на существенный прогресс в ее фармакологической профилактике. В нашем исследовании, исключая группу экстракраниальных вмешательств, ПОТР наблюдалась с частотой 42,1% (93 пациента из 221), что сопоставимо с данными литературы [3, 4].
Важнейшим специфическим фактором, влияющим на частоту развития ПОТР в нейрохирургии, подтвержденным в нашем исследовании, является область оперативного вмешательства. По полученным данным, частота ПОТР после субтенториальных вмешательств более чем в 2 раза превысила таковую после других операций (68% против 31,6%), что также в целом согласуется с данными литературы [5—6, 16—19].
Результаты нашего исследования хорошо согласуются с мировыми данными о влиянии неспецифических факторов риска на частоту ПОТР [1, 3]. Женский пол, некурящий статус, использование опиоидов в послеоперационном периоде и ПОТР в анамнезе — компоненты прогностической системы Apfel остаются важнейшими факторами повышенного риска развития этого осложнения, в том числе применительно к нейрохирургическим больным [20, 21]. Актуальным остается и описанный в литературе [21, 22] возрастной фактор: в нашем исследовании пациенты младше 3 и старше 50 лет существенно реже предъявляли жалобы на тошноту и рвоту.
Наблюдаемая нами наибольшая частота развития ПОТР в промежутке от 4 до 24 ч после экстубации может быть связана, на наш взгляд, с ограниченным по времени действием фармакологической профилактики, так как препараты вводились однократно. В течение первых 4 ч действие интраоперационно введенных ондансетрона и дексаметазона на фоне остаточной седации после ТВА предотвращали развитие тошноты и рвоты. В дальнейшем этот эффект прогрессивно уменьшался. Это делает актуальным поиск оптимальных сроков и подходов к продолжению терапии, направленной на предотвращение ПОТР. В руководстве по управлению ПОТР 2014 г. говорится о 6-часовом периоде повторного назначения лекарств. Это означает, что через 6 ч и более после оперативного вмешательства можно применять любые средства, купирующие ПОТР, в том числе использованные ранее для профилактики [12].
Существенным результатом исследования мы считаем продемонстрированную эффективность медикаментозной профилактики ПОТР в общей популяции нейрохирургических больных. При введении ондансетрона нами было отмечено снижение частоты эметогенных реакций на 15% в первые 8 ч после операции и на 10% в первые 48 ч. Подчеркнем, что ондансетрон и дексаметазон в соответствии с последними рекомендациями по контролю ПОТР (2014) [12] являются рекомендованными противорвотными средствами, показавшими эффективность в целом ряде исследований [8—11, 13—15], включая наше. Тем не менее очевидно, что, несмотря на достигнутые в последние годы положительные результаты профилактики при широком применении дексаметазона (78% больных) и ондансетрона (68% больных), частота ПОТР в нейрохирургии при применении данных препаратов остается высокой (39,9 и 36,4% соответственно). В этой связи актуальным представляется поиск новых подходов к профилактике и терапии ПОТР, обеспечивающих более высокую эффективность. В этом поиске, по данным мировой литературы [23—29], выделяются попытки усилить эффективность профилактики ПОТР с помощью дроперидола, блокаторов NK-1 рецепторов и немедикаментозных методик (например, электростимуляции срединного нерва).
Заключение
Наше исследование показало, что проблема ПОТР в нейрохирургии остается актуальной и сегодня. Даже ТВА на основе пропофола с дексаметазоном и ондансетроном не является полностью эффективной в предотвращении ПОТР. В зависимости от зоны операции частота ПОТР достигает 10,5—68%. На наш взгляд, необходимы дальнейшие исследования, направленные на повышение эффективности профилактики ПОТР, с включением новых препаратов, таких как антагонисты NK-1 рецепторов, а также альтернативных методик, в частности электростимуляции срединного нерва.
Концепция и дизайн исследования — М.К., А.К.
Сбор и обработка материала — М.К.
Статистическая обработка данных — М.К., А.К.
Написание текста — М.К.
Редактирование — А.К., А.Л.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Проблема послеоперационной тошноты и рвоты (ПОТР) является особенно актуальной для нейрохирургии. Нейрохирургических пациентов отличает высокая частота ПОТР, а рвота в раннем послеоперационном периоде может быть как причиной, так и следствием интракраниальных хирургических осложнений. Статья посвящена актуальной проблеме, общей для нейрохирургии, нейроанестезиологии и нейрореаниматологии. Новизна работы заключается в том, что она демонстрирует низкую эффективность «золотого стандарта» — комбинации ондансетрона и дексаметазона в профилактике ПОТР. Таким образом, работа мотивирует на поиск более эффективных методик профилактики ПОТР, внедрение в рутинную клиническую практику которых было бы целесообразно. Проспективный дизайн исследования и использование стандартизированных методик оценки ПОТР делают полученные результаты достоверными. Приведена современная литература, что демонстрирует глубокую погруженность авторов в изучаемую проблему, еще раз подчеркивает актуальность исследования и достоверность его результатов. Четко структурированное резюме отражает суть работы. Статья представляет несомненный интерес для читателей журнала.

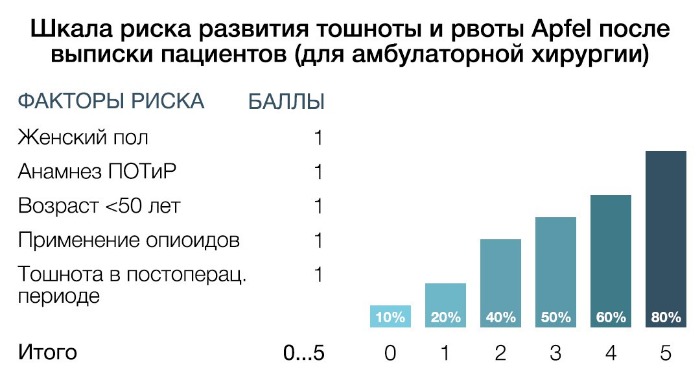 В данной шкале риска учитываются следующие факторы: женский пол, анамнез ПОТиР, возраст
В данной шкале риска учитываются следующие факторы: женский пол, анамнез ПОТиР, возраст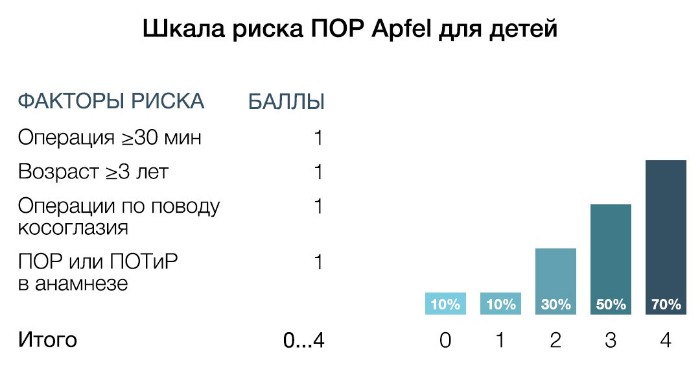 Ввиду трудности выявления тошноты у детей определяется риск развития рвоты. В данной шкале риска учитываются следующие факторы: длительность операции (≥ 30 мин), возраст ≥ 3 лет, операции по поводу косоглазия, ПОР или ПОТиР в анамнезе. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 10, 30, 50 и 70 % соответственно.
Ввиду трудности выявления тошноты у детей определяется риск развития рвоты. В данной шкале риска учитываются следующие факторы: длительность операции (≥ 30 мин), возраст ≥ 3 лет, операции по поводу косоглазия, ПОР или ПОТиР в анамнезе. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 10, 30, 50 и 70 % соответственно.
