низкий уровень мозаицизма по отдельным хромосомам что это
Низкий уровень мозаицизма по отдельным хромосомам что это
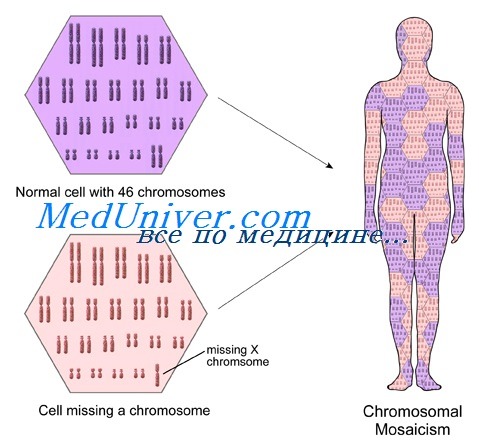
Мозаицизм — присутствие в организме или ткани по крайней мере двух генетически отличающихся клеточных линий, производных от одной зиготы. Хотя мы имеем обыкновение считать, что при формировании клеток они получают одинаковый набор генов и хромосом, это упрощенное представление. Мы уже ввели понятие мозаицизма, вызванного инактивацией Х-хромосомы, формирующей две различных популяции соматических клеток у женщин, с активной отцовской или материнский Х-хромосомой.
Чаще мутации, возникающие в единственной клетке во внутриутробной или послеродовой жизни, могут вызывать линии клеток, генетически отличающихся от зиготы, поскольку однажды произошедшая мутация может передаваться всем потомкам клетки. Мозаицизм по числовым или структурным аномалиям хромосом — клинически важный феномен, а соматические мутации признают основными причинами многих типов опухолей.
Мозаицизм по мутациям в одном гене, в соматических или половых клетках, объясняет множество необычных клинических наблюдений, например сегментный нейрофиброматоз, когда кожные проявления появляются не по всему телу, а участками, или повторное рождение у здоровых родителей двух или более детей с несовершенным остеогенезом, высокопенетрантной аутосомно-доминантной болезнью.
Популяция клеток, несущих мутацию у мозаичного пациента, теоретически может присутствовать в некоторых тканях тела, но не в гаметах (чистый соматический мозаицизм), ограничиваться только гаметами (чистый половой мозаицизм) или присутствовать как в соматических, так и в половых клетках, в зависимости от того, когда произошла мутация в ходе эмбрионального развития. Включает ли мозаицизм только соматические ткани, только половые клетки или и те, и другие, зависит от времени появления мутации в эмбриогенезе — до или после разделения половых и соматических клеток.
Если до, то и соматические, и половые клетки будут мозаичными, а мутация может передаваться потомству и проявляться соматически в мозаичной форме. Мутацию, произошедшую позже, обнаруживают только в половых клетках или части соматических тканей. Таким образом, например, если мутация произошла в предшественнике половых клеток, часть гамет будет нести мутацию. До мейоза половые клетки проходят около 30 митотических делений у женщин и несколько сотен у мужчин, допуская массу возможностей для мутаций, происходящих в течение митотических этапов развития гаметы.
Выявление мозаицизма по мутации только в половых или соматических клетках может быть трудным, поскольку отсутствие мутации в клетках из легкодоступных соматических тканей (например, лейкоцитов периферической крови, кожи или клеток слизистой оболочки рта) не доказывает, что мутация не присутствует где-нибудь еще, включая половые клетки. Охарактеризовать распространенность соматического мозаицизма еще труднее, если мутантный аллель у мозаичного эмбриона встречается исключительно во внезародышевых тканях (т.е. в плаценте) и не присутствует в самом эмбрионе.
Соматический мозаицизм
Мутации, влияющие на морфогенез и проявляющиеся в ходе эмбрионального развития, могут быть обнаружены как сегментные или пятнистые аномалии, в зависимости от этапа, в котором произошла мутация, и происхождения соматической клетки. Например, нейрофиброматоз I типа иногда может проявляться как сегментный, влияя только на одну часть тела. Сегментный нейрофиброматоз I типа вызван мозаицизмом по мутации, произошедшей после зачатия. В таких случаях родители пациента здоровы, но если он (или она) рожает больного ребенка, фенотип у ребенка полный, т.е. не сегментный.
В таких случаях мутация находится в гаметах пациента и, по-видимому, произошла до разделения половой и соматической линии клеток.
Мозаицизм по половым клеткам
Так как шанс, что аутосомное или Х-сцепленное заболевание, вызванное новой мутацией, может неоднократно происходить в сибстве, очень низок, поскольку спонтанные мутации обычно происходят редко (порядка 1 на 104-106), появление двух независимых мутаций в том же гене в одной семье весьма маловероятно (менее чем 1 на 108-1012). После тщательного исключения даже малых проявлений болезни у здоровых родителей ребенка с аутосомно-доминантным или Х-сцепленным заболеванием и при отрицательных результатах молекулярного тестирования носительства обычно принято сообщать родителям, что болезнь их ребенка — результат новой мутации и шанс того же дефекта у последующего ребенка незначительный, равный популяционному риску.
Существуют, тем не менее, хорошо подтвержденные примеры, когда фенотипически здоровые родители с отрицательными тестами на носительство имеют более чем одного ребенка с высокопенетрантным аутосомно-доминантным или Х-сцепленным заболеванием. Такие необычные родословные могут объясняться половым мозаицизмом. Половой мозаицизм хорошо подтвержден почти в 6% летальных форм аутосомно-доминантного несовершенного остеогенеза, когда мутации в гене коллагена I типа приводят к формированию аномального коллагена, ломким костям и частым переломам.
Родословные, которые могут объясняться половым мозаицизмом, также отмечены при нескольких других заболеваниях, например гемофилии А, гемофилии В и мышечной дистрофии Дюшенна, но очень редко встречаются при других доминантных болезнях, например ахондроплазии. Точно измерить частоту полового мозаицизма сложно, но приблизительно считают, что самая высокая встречаемость отмечена при мышечной дистрофии Дюшенна, при которой до 15% матерей в изолированных случаях не имеют подтверждения мутации в их соматических тканях при наличии мутации в половых клетках.
Теперь, когда феномен полового мозаицизма признан, генетики и генетические консультанты отдают себе отчет о потенциальной погрешности прогноза, что специфический аутосомно-доминантный или Х-сцепленный фенотип, кажущийся новой мутацией, имеет незначительный риск повторения в потомстве. Очевидно, для болезней с доказанной возможностью полового мозаицизма фенотипически здоровым родителям ребенка, у которых предположительно болезнь возникла вследствие новой мутации, нужно сообщать, что риск повторения не настолько незначительный.
Кроме того, родители ребенка с любым аутосомно-доминантным или Х-сцепленным заболеванием имеют риск повторения 3-4%, даже если половой мозаицизм не доказан и если известно, что они не носители мутации. Таким парам следует предложить доступную пренатальную диагностику. Точный риск повторения оценить трудно, поскольку он зависит от доли мутантных гамет.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Особенности мозаицизма у эмбрионов человека в программах лечения бесплодия методами вспомогательных репродуктивных технологий
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия
Актуальность. На сегодняшний день, несмотря на широкое применение преимплантационного генетического тестирования на анеуплоидии (ПГТ-А), правильная оценка полученных результатов крайне важна. Наличие мозаицизма является одной из причин ошибочной интерпретации данных о генетическом статусе эмбриона при проведении ПГТ-А.
Материалы и методы. Проведено исследование, включающее анализ трофэктодермы 17 эмбрионов с помощью метода высокопроизводительного секвенирования (NGS). Все эмбрионы были анеуплоидными. Анеуплоидные эмбрионы были разделены на три части: клетки внутренней клеточной массы (ВКМ), трофэктодермы №1 и трофэктодермы №2.
Результаты. При анализе образцов клеток из разных частей эмбриона были обнаружены дополнительные хромосомные аномалии. У эмбриона №1 в клетках ВКМ были обнаружены делеция и дупликация по одной из хромосом, а в образце трофэктодермы №2 получена моносомия. Результат анализа клеток ВКМ эмбриона №2 показал дупликацию.
Заключение. Полученные данные подтверждают, что биопсия части трофэктодермы может быть нерепрезентативной относительно всех клеток трофэктодермы и ВКМ. Таким образом, стоит подчеркнуть, что в программах вспомогательных репродуктивных технологий (ВРТ) рекомендовано обязательное проведение скрининга I триместра на сроке 11–13 недель гестации.
У эмбрионов человека хромосомный мозаицизм определяется как две или более отдельных клеточных линий внутри одного эмбриона и является достаточно частым явлением, которое широко обсуждается в области вспомогательных репродуктивных технологий (ВРТ) [1]. Мозаицизм может возникать в результате митотического кроссинговера, соматических мутаций в зиготе или на ранних стадиях дробления, ошибок сегрегации при делении клеточного ядра и генотерапии [2]. Традиционно считалось, что только генетические нарушения в ооцитах или сперматозоидах ответственны за возникновение аномальных эмбрионов. Тем не менее в настоящее время доказано, что мозаицизм также возникает во время первых митотических делений [3]. Во время преимплантационного периода мозацизм является относительно частым явлением, однако на различных стадиях развития эмбриона степень мозаицизма колеблется. Считается, что степень мозаицизма максимальна на 2–3-и сутки развития и уменьшается к 5–6-му дню после оплодотворения. Способность эмбрионов самостоятельно компенсировать мозацизм по мере своего развития отражает возможный физиологичный характер данного явления и необходимость более тщательной интерпретации результатов преимплантационного генетического тестирования (ПГТ) [4].
В литературе описано несколько моделей, объясняющих, почему происходит уменьшение уровня мозаицизма эмбриона на стадии бластоцисты. Естественный отбор чаще работает против мозаичных эмбрионов – in vivo может происходить элиминация эмбриона на основании доли анеуплоидных клеток в нем на разных этапах развития. Другая модель – это модель «клонального истощения», которая описывает апоптотические изменения клеток эмбриона и элиминацию анеуплоидных клеток у эмбрионов с мозаицизмом. И третья модель описывает коррекции анеуплоидий, которые позволяют клеткам с моносомией или трисомией разделяться на клетки с эуплоидным количеством хромосом [5, 6].
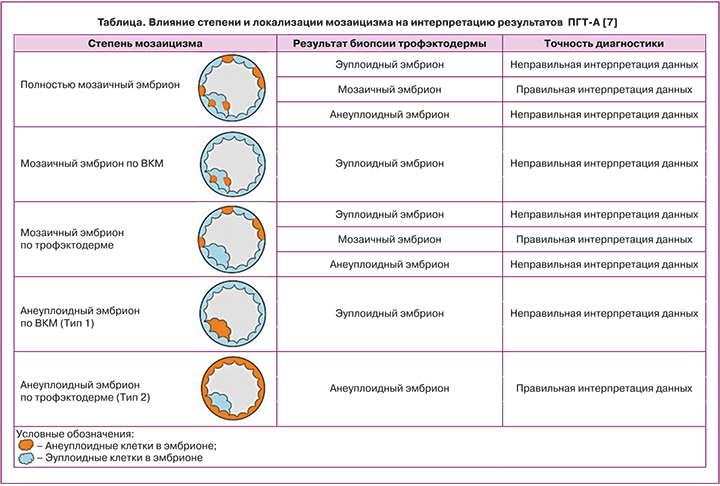
При биопсии трофэктодермы уровень мозаицизма, по разным данным, составляет от 4 до 32%. С введением высокопроизводительного секвенирования следующего поколения (NGS) теперь возможно диагностировать хромосомный мозаицизм на уровне от 20 до 80% [7]. Тем не менее в зависимости от степени выраженности мозаицизма и его локализации результат биопсии трофэктодермы эмбриона и последующая интерпретация данных ПГТ-А (преимплантационное генетическое тестирование на анеуплоидии) не всегда соответствует истинным показателям. Мозаицизм может затрагивать как весь эмбрион, так и отдельные его части: трофэктодерму, из которой образуется плацента, или внутриклеточную массу (ВКМ), которая дает начало эмбриону. Если мозаицизм затрагивает только ВКМ, то результат биопсии трофэктодермы у такого эмбриона будет соответствовать эуплоидному эмбриону. Если биопсия трофэктодермы была произведена у эмбриона, мозаичного по клеткам трофэктодермы, но в исследуемый образец попали эуплоидные клетки, результат ПГТ-А будет интерпретирован в пользу эуплоидного эмбриона. В таблице представлены точность диагностики различной степени и локализации мозаицизма у анализируемого эмбриона и возможные варианты диагностических ошибок. Представленные данные подтверждают, что процент мозаицизма в образце биопсии не всегда может быть прямым показателем процента мозаицизма во всем эмбрионе [8].
Несмотря на отсутствие определенного ограничения для определения мозаицизма, Международное общество преимплантационной генетической диагностики (PGDIS, 2019) предлагает эмбрион с более чем 20% анеуплоидных клеток считать мозаичным. Это означает, что эмбрионы с более низким уровнем мозаицизма следует рассматривать как нормальные (эуплоидные). Мозаичные эмбрионы отличаются по степени (низкая, средняя или высокая) и типу мозаицизма (сегментарный, одиночная хромосома, двойная хромосома или сложный мозаицизм) [9]. Результаты нескольких крупных исследований показали, что мозаичные эмбрионы могут имплантироваться и приводить к рождению здоровых детей в программах ВРТ [10]. В исследовании Spinella F. et al., опубликованном в 2017 г., было показано, что исход беременности при переносе мозаичного эмбриона зависит от степени мозаицизма и типа анеуплоидии [11].
Существуют предположения, что в случае соматических клеток мозаицизм обладает благотворным влиянием на организм. Например, в нейронах мозаицизм встречается очень часто, что позволяет разнообразить их функциональный статус [12–14]. Однако чаще всего мозаицизм связывают с очевидно отрицательными последствиями, например, с повышенной частотой прерывания беременности, появлением врожденных дефектов, задержками и расстройствами развития. Чем выше уровень мозаицизма эмбриона, тем ниже вероятность имплантации и выше риск выкидыша. В научной литературе сообщается о статистически значимом снижении частоты наступления клинической беременности, имплантации и живорождении при переносе эмбрионов с высоким уровнем мозаици.
Низкий уровень мозаицизма по отдельным хромосомам что это
Наконец, мутация может возникнуть у будущей матери (отца) на ранней стадии их эмбрионального развития в такой клетке, которая дает начало развитию и дифференцировке зародышевых тканей. В этом случае мать (отец) будут являться соматическими мозаиками, но при этом все их гаметы будут мутантными. В такой ситуации дальнейшее наследование мутантной хромосомы у потомков (и, соответственно, наследование болезни у мужчин или наследование носительства у женщин) будет полностью подчиняться классическому X-сцепленному рецессивному типу.
Родительский соматический мозаицизм, однако, является еще одним источником ошибок при медико-генетическом консультировании: поскольку обычные процедуры генодиагностики базируются на исследовании ДНК клеток крови, данный анализ может показать нормальный генотип родителя, тогда как половые клетки обследуемого родителя являются мутантными.
Например, для локуса дистрофина в спорадических случаях ПМД Дюшенна/Бекеpa возможность материнского соматического/гонадного мозаицизма составляет около 7% [van Essen A. et al., 1997].
Свои особенности имеет медико-генетическое консультирование в случае новых мутаций при заболеваниях, обусловленных экспансией тринуклеотидных повторов. Источником такой мутации обычно является имеющийся у здорового родителя аллель с «промежуточным» числом повторов, который в гаметогенезе трансформируется в полную мутацию и ведет к развитию болезни у ребенка. При таком механизме генетически нестабильный «промежуточный» родительский аллель может претерпевать повторные аналогичные трансформации при передаче гена следующим детям.
Таким образом, при спорадических случаях тринуклеотидных болезней, обусловленных новой мутацией у пробанда, для сибсов риск унаследовать заболевание является гораздо более высоким, чем считалось ранее [Goldberg Y. et al., 1993]. Поэтому в подобной ситуации (даже при отсутствии явной мутации у родителей!) оправданной является постановка вопроса о проведении прямой ДНК-диагностики у всех братьев-сестер пробанда.
Мозаицизм плода как причина ложноотрицательного результата неинвазивного пренатального ДНК–скрининга анеуплоидий по 21-й хромосоме
ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Проанализировать причину ложноотрицательного результата неинвазивного пренатального ДНК-скрининга анеуплоидий (НИПС)
Материал и методы. Представлено клиническое наблюдение 35-летней пациентки с ложноотрицательным результатом НИПС. Проведен неинвазивный пренатальный ДНК-скрининг анеуплоидий, исследование периферической крови ребенка методом FISH с использованием молекулярного кариотипирования.
Результаты. По данным FISH исследования крови родившегося ребенка показана мозаичная форма трисомии по 21 хромосоме.
Заключение. Этот случай иллюстрирует, что отрицательный результат НИПС не позволяет полностью исключить наличие анеуплоидии, демонстрирует важность скрининга 1-го триместра и ограничения НИПС в случае беременностей с высоким риском анеуплоидий по данным комбинированного скрининга.
Неинвазивный пренатальный ДНК-скрининг (НИПС) анеуплоидий плода по крови матери используется для определения риска наличия анеуплоидий с 2011 года. Широкомасштабные исследования показали высокую чувствительность и специфичность метода для определения частых анеуплоидий. Наиболее высокие показатели чувствительности и специфичности достигаются для трисомии по 21 хромосоме [1]. Однако диагностической точности теста достичь не удается из-за возможных ложноотрицательных и ложноположительных результатов [2]. Несоответствие результатов НИПС и кариотипа плода может возникать из-за целого набора биологических причин: плацентарного мозаицизма, вариаций числа копий фрагментов хромосом у матери, исчезающего близнеца, онкологических заболеваний матери и фетоплацентарного мозаицизма. Большая часть ложноотрицательных результатов, для которых проведено исследование причин, объясняется фетоплацентарным мозаицизмом [2].
Описаны 2 механизма, которые могут объяснять возникновение мозаицизма. Оба механизма включают нерасхождение хромосом в процессе митоза или мейоза. В первом случае нерасхождение происходит в процессе мейоза, чаще всего у матери, что приводит к образованию трисомной зиготы, после чего в процессе митотических делений в части клеток происходит потеря лишней хромосомы. В результате образуется 2 линии клеток с нормальным и трисомным кариотипом. В клетках с нормальным кариотипом возможна однородительская дисомия. Во втором случае зигота имеет нормальный кариотип, а нерасхождение происходит в одном из первых делений митоза, что приводит к образованию 3-х клеточных линий: нормальной, трисомной и моносомной. Принято считать, что в случае анеуплоидии по аутосомам, моносомная клеточная линия быстро элиминируется, и при цитогенетическом исследовании дет.
Низкий уровень мозаицизма по отдельным хромосомам что это
Лимфоциты крови плода. Для хромосомного анализа крови плода используют стандартную методику стимулирования лимфоцитов фитогемагглютинином. Обычно анализируют 11—20 метафазных пластинок.
Этот метод дает наиболее адекватное представление о хромосомном статусе плода и настоятельно рекомендуется для кари-отипирования плода в случае хромосомного мозаицизма в плаценте, а также при наличии пороков развития не только во II триместре, но, как показывает наш опыт, и в поздние сроки беременности. В последнем случае кариотипирование плода позволяет решить вопрос о тактике ведения беременности, родов и неонатального периода.
Диагностические проблемы кариотипированая плода
К диагностическим ошибкам при цитогенетической ПД могут привести структурные перестройки хромосом, возникшие de novo, сверхчисленные маркерные хромосомы и мозаицизм хромосом.
Структурные перестройки хромосом, возникшие de novo
Структурные перестройки хромосом, не унаследованные от кого-либо из родителей при подтвержденном отцовстве, встречаются довольно редко (0,06-0,20% от всех пренатальных исследований). При обнаружении перестройки хромосом, действительно возникшей de novo, невозможно полностью исключить микроперестройки и, следовательно, несбалансированность хромосомного набора у плода. В этой ситуации риск рождения ребенка с аномалиями развития составляет 10%.
Маркерные хромосомы
Сверхчисленные маркерные хромосомы в пренатальном периоде выявляются с частотой 0,6-0,96/1000. Все маркерные хромосомы делятся на несколько классов: возникшие de novo и семейные, мозаичные и немозаичные, спутничные и лишенные спутников. Риск рождения ребенка с аномалиями развития зависит от хромосом, принимающих участие в их образовании, а также от их принадлежности к тому или иному классу. Поэтому обнаружение в кариотипе плода маркерной хромосомы требует не только ее идентификации всеми доступными методами, но и кариотипирования родителей для установления происхождения маркера и формы анеуплоидии (полная или мозаичная).
Прогноз в отношении плода более благоприятен, если один из фенотипически нормальных родителей является носителем идентичной маркерной хромосомы.
Общий риск аномалий развития у плода при сверхчисленных маркерных хромосомах, возникших de novo, составляет около 8% для сателлитных маркеров (содержащих короткие плечи акроцентрических хромосом, несущих рибосомные гены) и 27% —для несателлитных. При этом наличие эухроматинового материала, выявленного методами дифференциального окрашивания (G-,Q-,NOR-,DA/DAPI) или FISH с использованием наборов цельнохромосомных ДНК-зондов, свидетельствует о частичной трисомии и существенно увеличивает вероятность аномалий развития.
Мозаицизм хромосом
Проблеме хромосомного мозаицизма в ПД уделяется особое внимание в связи с тем, что накопленные к настоящему времени данные свидетельствуют о совместимости с внутриутробным развитием и живорождением многих аутосомных трисомии. При этом тяжесть проявления синдромов не зависит от формы анеуплоидии (полная или мозаичная) и доли анеупло-идных клеток в исследуемой ткани.
Вероятность обнаружения клеток с разным хромосомным набором существенно различается в зависимости от используемого метода приготовления препаратов. Однако в любом случае необходимо определить, является ли мозаицизм артефактным, т.е. возникающим в процессе приготовления хромосомных препаратов, или он действительно отражает кариотип плода. В отличие от аутосомных моносомий, которые, как правило, обусловлены методическими моментами, моносомия X, а также трисомии по любым хромосомам набора требуют самого пристального внимания.
Наиболее частыми источниками диагностических ошибок являются контаминация образца и псевдомозаицизм.
Контаминация образца материнскими клетками
Образцы любого эмбрионального материала могут быть контаминированы клетками материнского происхождения.
Во избежание диагностических ошибок при анализе лимфоцитов пуповинной крови необходимо контролировать чистоту образца в соответствии с методикой, основанной на отличиях реакции фетального гемоглобина от окраски гемоглобина взрослых эритроцитов в щелочной среде.