нижняя полая вена коллабирует более 50 процентов что
Синдром нижней полой вены
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Иногда, во время беременности и не только, диагностируют синдром нижней полой вены. Называть данный синдром заболеванием не совсем корректно: скорее, это нарушение адаптации организма к увеличению матки или другим изменениям венозного кровообращения.
В большинстве случаев синдром обнаруживается у женщин с многоплодием, многоводием, крупным плодом, при беременности, сочетающейся с сосудистой гипотонией, а также при опухолях и нарушениях свертываемости крови.
Код по МКБ-10
Причины синдрома нижней полой вены
Изначальная причина синдрома до сих пор окончательно не установлена. Тем не менее, доказано, что провоцирующими факторами могут стать:
Кроме периода вынашивания ребенка, значительно реже синдром нижней полой вены может развиваться при эхинококкозе, опухолевых процессах в брюшной полости. Пациентам с подобными патологиями необходимо быть особенно бдительными относительно своего здоровья.

Патогенез
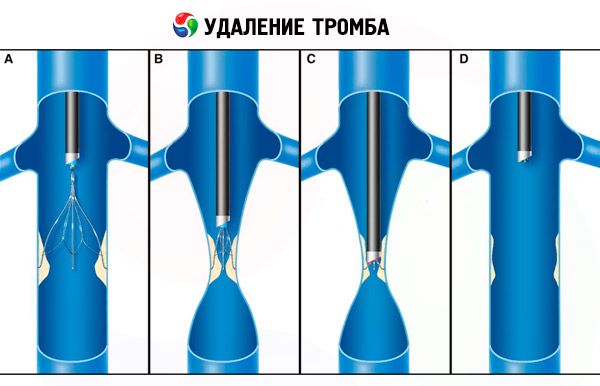
Патогенез синдрома специфичен, но зависит от особенностей конкретного организма. Чаще всего наблюдается нарушение проходимости основания нижней полой вены, что зачастую может сочетаться с формированием тромба на пораженном участке сосуда.

Симптомы синдрома нижней полой вены
Симптомы данного синдрома зависят от степени пережатия или закупорки просвета нижней полой вены. Наиболее выраженные признаки наблюдаются при максимальной закупорке сосуда в сочетании с ухудшением проходимости вен печени и почек.
Первые признаки синдрома, на которые следует обратить внимание – это ощущения «ползания мурашек» в ногах, с последующим онемением.
Далее болезнь развивается в зависимости от локализации закупорки нижней полой вены.
Кроме этого, может повышаться кровяное давление, появиться слабость и ощущение тревожности, усилиться сердцебиение.
Синдром верхней и нижней полой вены
Появляется синдром верхней и нижней полой вены из-за расстройства кровообращения в верхней полой вене.
Физиологически через верхнюю полую вену течет венозная кровь из верхней части туловища. Нормальный кровоток может быть нарушен опухолевыми процессами, аневризмой, увеличенными лимфатическими узлами, тромбами.
Обычно подобный синдром развивается постепенно. Больной может отмечать у себя периодические головные боли, нарушения сна, кровотечения из носа или горла, ухудшение зрения, трудности с засыпанием в лежачем положении. Со временем у больного появляются отеки, посинение и выделение вен верхней части тела. Одновременно выявляются и симптомы основной патологии, которая изначально спровоцировала непроходимость.
Лечение синдрома верхней и нижней полых вен назначается в зависимости от степени закупорки и её локализации. Консервативная терапия предусматривает прием фибринолитических, антикоагулирующих и дезагрегантных препаратов.
Осложнения и последствия
Синдром нижней полой вены у беременных не всегда приводит к каким-либо негативным последствиям. Дело в том, что у большего количества пациенток отток венозной крови с нижней части тела происходит посредством непарной и позвоночной вены, поэтому синдром нижней полой вены может не сопровождаться нарушением кровообращения.
Опасность представляет ситуация, при которой развивается коллаптоидное состояние. Обычно это происходит во время операции «кесарева сечения» и учитывается врачами.
При значительном придавливании маткой нижней полой вены ухудшается кровообращение непосредственно в матке и почках. Вследствие этого страдает состояние будущего ребенка, а также нарушается клубочковая фильтрация у женщины. Перечисленные процессы могут послужить причинами преждевременной отслойки плаценты, формирования тромбов и варикозного расширения вен.

Диагностика синдрома нижней полой вены
Лабораторные методы: общие анализы крови и мочи, биохимия крови, оценка свертываемости крови.

Что нужно обследовать?
Как обследовать?
Дифференциальная диагностика
Дифференциальная диагностика направлена на исключение экстравазального сдавливания нижней полой вены опухолевым или воспалительным процессом. При этом важно определить наличие или отсутствие опухоли по результатам УЗИ, КТ или флебографии.

К кому обратиться?
Лечение синдрома нижней полой вены
На данный момент не разработано четкой схемы лечения синдрома нижней полой вены. В большинстве ситуаций применяют консервативную терапию с обязательным назначением препаратов, влияющих на сворачиваемость крови, как прямого, так и непрямого воздействия.
При назначении лекарства следует учитывать продолжительность заболевания, которую при данном синдроме определить практически не представляется возможным. Известно, что наибольший эффект противотромботические средства оказывают лишь на начальных этапах формирования закупорки.
Немаловажное значение имеет также поддержание нормальной работы почек и печени.
Применяют до и после оперативного вмешательства, чаще по 0,3 мл инъекционно п/к.
Кровотечения, подкожные гематомы, кровоизлияния.
Препарат не применяют внутримышечно.
Чаще всего принимают перорально, от 2 до 10 мг в сутки.
Кровоточивость, кровоизлияния, анемия, дерматиты, головная боль.
Во время терапевтического курса следует контролировать степень свертываемости крови.
Средство для инфузионной терапии. Доза препарата подбирается только индивидуально.
Кровоточивость десен, гематомы, покраснения кожи, внутренние кровотечения.
Назначают осторожно при заболеваниях печени и почек, а также в пожилом возрасте.
Вводят внутривенно капельно, от 10 до 1000 мл в сутки.
Рвота, зуд кожи, болезненность в пояснице.
Во время лечения обязательно контролируют почечную функцию.
Принимают по 75 мг трижды в сутки.
Учащенное сердцебиение, диспепсия, тромбоцитопения, шум в ушах, ощущение слабости.
Не рекомендуется принимать одновременно с кофеин содержащими напитками.
Основные витамины, которые способствуют укреплению венозных стенок – это токоферол и аскорбиновая кислота. Пища, богатая этими витаминами, снижает вероятность формирования тромбов и закупорки нижней полой вены.
Токоферол (в. E) присутствует в бобах, злаках, печени, брокколи, а также в растительных маслах.
Аскорбиновая кислота в достаточном количестве находится в ягодах, винограде, киви и цитрусах.
Кроме этого, желательно употреблять пищу, богатую каротином, рутином, а также такими микроэлементами, как медь, железо и цинк. Для этого необходимо чаще готовить блюда из капусты, орехов, красных фруктов и овощей, мяса.
Из фармацевтических препаратов особенно рекомендуются Аевит и Аскорутин, которые назначают по 1 таблетке или капсуле дважды в сутки, в течение 3-4 недель. При беременности необходимо подбирать витаминный препарат только под контролем врача.
Физиотерапевтическое лечение при синдроме нижней полой вены применяется крайне редко. Возможно назначение лечебной физкультуры, мануальной терапии (согласно показаниям).
Гомеопатия уже много лет занимается лечением заболеваний такого рода, как синдром нижней полой вены. Врачи гомеопаты в данном случае советуют применять средства, укрепляющие сосудистые стенки, регулирующие кровообращение и улучшающие свойства крови. Тактика лечения обычно определяется в зависимости от болезни или состояния, которые могли спровоцировать закупорку вены.
В последнее время интерес представляют следующие гомеопатические препараты:
Кроме этого, могут быть назначены препараты, приготовленные на основе свертывающих факторов: тромбина, фибриногена, фибрина и пр. В перспективе рекомендуется применять средства Aorta suis Ingeel, Arteria suis Injeel, Vena suis Ingeel, которые изготовлены из тромботического материала.
Оперативное лечение назначают при тромбозе нижней полой вены:
Операции не рекомендуются, если у пациента имеется декомпенсация сердечной деятельности, свежий инсульт сосудов головного мозга.
Народное лечение
По согласованию с врачом можно использовать следующие народные рецепты:
Лечение травами часто включает в себя и сложные многокомпонентные рецепты:

УЗИ нижней полой вены (норма и патология)
УЗИ нижней полой вены. Анатомия
Прежде чем разобрать характеристики УЗИ, рассмотрим анатомические особенность нижней полой вены (НПВ). Нижняя полая вена образована слиянием общих подвздошных вен на уровне 5-го поясничного отдела позвонка и идет справа краниально от средней линии. Она проходит через диафрагму на уровне 8-го грудного позвонка и входит в правое предсердие. У зародыша имеется сложное венозное расположение венозных пазух, которые образуются во время эмбриогенеза, и несколько из них способствуют формированию нижней полой вены. Это означает что есть много вариантов анатомии НПВ, которые можно будет видеть на УЗИ. Наиболее распространенным вариантом является то, что общие подвздошные вены продолжаются краниально как парные «полые вены» с пересечением левого компонента для соединения с правой стороной на уровне левой почечной вены. Много другие изменения были также зарегистрированы. Такие состояния легко и больше оцениваются с помощью контрастного КТ, чем при ультразвуковом сканировании, но может вызвать некоторую путаницу, если они видны во время УЗИ и не распознаются.
ТЕХНИКА УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ НПВ
Нижнюю полую вену исследуют с использованием УЗИ методик, описанных нами ранее для брюшной аорты. Однако в положении на спине сосуд может быть узким и в переднезадней плоскости его трудно определить. Поперечное сканирование с цветным допплером и использованием аорты в качестве ориентира может позволить определить локализацию вены в этих обстоятельствах. Другой прием, с поднятием ног помощником будет увеличивать поток и калибр вены, делая его более заметным. Калибр НПВ будет варьироваться в зависимости от состояния гидратации больного. У хорошо-гидратированного пациента нижняя полая вена на УЗИ будет растянута, в то время как у обезвоженного пациента будет спадаться, тогда ее узкий просвет будет сложнее визуализировать. Избыточное давление датчиком, приложенное для рассеивания газа в кишечнике, также может сжать может НПВ, поэтому необходимо искать баланс для визуализации сегментов сосуда у некоторых сложных пациентов.
НОРМАЛЬНЫЕ И ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ НИЖНЕЙ ПОЛОЙ ВЕНЫ НА УЗИ
Поток в нижней полой вене на УЗИ в норме медленный и меняется в зависимости от как дыхание, так и пульсация сердца. На вдохе диафрагма опускается и это приводит к отрицательному давлению в грудной клетке и повышению давления в брюшной полости, поэтому кровь течет из живота к грудному отделу, обратное происходит по истечении срока этой фазы дыхания. На это накладывается более быстрая периодичность в результате сердечной деятельности, что видно особенно в верхней части живота. Известно также, что форма волны в нижней полой вене также зависит от степени гидратация больного. У обезвоженного пациента НПВ будет узкой и ее довольно трудно увидеть, также как и почечные вены, в то время как при перегрузке жидкости нижняя полая вена на УЗИ расширена и сердечная периодичность обнаруживается вниз на подвздошные вены.
Одним из наиболее распространенных показаний для специфического обследования нижней полой вены является оценка того, распространился ли тромб из тромбоза глубоких вен таза или нижних конечностей в ее просвет. Тромб может заполнить просвет НПВ и даже вызвать расширение этого сосуда. В качестве альтернативы можно увидеть язык тромба, лежащий свободно в просвете, идущий вверх по направлению к правому предсердию.
У некоторых пациентов, которые подвергаются риску легочной эмболии из-за более дистального тромба, вводятся кава-фильтры. Есть несколько типов, но все они вставляются в среднюю или нижнюю область, ниже почечных вен. Выявление металлической эхогенной структуры на УЗИ в нижней полой вене над уровнем почечных вен может указывать на миграцию фильтра. Существует небольшой риск того, что тромб может пройти через фильтр или развиться тромбоз на месте фильтра. Цветной допплер — это быстрый и простой метод подтверждения проходимости НПВ вокруг фильтра и над ним. Металлические стойки фильтра могут быть распознаны в просвете нижней полой вены, и цветной допплер, или энергетический допплер, покажет кровоток за уровнем фильтра.
Опухоли почек и гепатоцеллюлярная карцинома представляют собой две опухоли, которые имеют тенденцию проникать в венозные сосуды, и в результате опухолевый тромб может распространяться в полость из почечной или печеночной вены. Нарушение венозного оттока печени или почек на УЗИ проявляется потерей нормальной сердечной и дыхательной периодичности формы венозной волны, и опухолевый тромб может быть отчетливо виден, когда он распространяется в просвет полости. Некоторые опухоли забрюшинного пространства могут сдавливать или непосредственно вторгаться в нижнюю полую вену, вызывая обструкцию венозного возврата из нижней части живота и ног. Хотя каудальные сегменты нижней полой вены и подвздошных вен обычно остаются открытыми, они часто будут расширяться, венозный кровоток будет вялым или ретроградным, профиль потока будет плоским, и отсутствовать нормальная реакция Вальсальвы. В редких случаях в стенке НПВ могут развиваться внутренние опухоли, обычно мезенхимальные по происхождению, такие как фибросаркомы, лейомиосаркомы, также сообщалось о нахождении липомы на УЗИ.
После трансплантации печени следует оценить просвет НПВ для обеспечения удовлетворительного кровотока. Внешний вид будет зависеть от типа выполняемого анастомоза. В прошлом сегмент донорской НПВ, прикрепленный к новой печени, заменял эквивалентный сегмент нативной нижней поло вены, который был удален с больной печенью. Многие хирурги в настоящее время выполняют технику «контрейлерных перевозок», когда нативная НПВ остается на месте, нижний конец донорского полого сегмента зашивается, а верхний конец анастомозируется с нативной нижней полой веной. Это приводит к появлению послеоперационного периода, который может сбивать с толку, если его не распознать, так как могут появиться две НПВ на УЗИ, связанные с пересаженной печенью. Другие послеоперационные проблемы, которые могут возникнуть в связи с НПВ после трансплантации, включают компрессию, если новая печень относительно большая; искажение нижней полой вены также может произойти, если имеется относительное скручивание кавального канала в результате встраивания донорской печени в новые условия. В долгосрочной перспективе стеноз может развиваться в местах анастомоза. Пересадка печени будет рассматриваться в других постах блога.
Забрюшинные и другие образования брюшной полости могут сдавливать или закупоривать нижнюю полую вену. Ситуация на УЗИ обычно очевидна, особенно с цветным допплером, который показывает, что НПВ входит в образование и сужается или перекрывается отсутствующим потоком. Могут возникнуть врожденные ткани, особенно в верхнем конце НПВ. Это может приводить к различной степени ее сужения, а в некоторых случаях может предрасполагать к тромбозу печеночной вены и синдрому Бадда-Киари.
Свищи, вовлекающие нижнюю полую вену, могут редко встречаться самопроизвольно, часто вторично к аневризме аорты, или они могут быть созданы хирургическим путем, как в случае с портокавальными шунтами. В случае аортокавальных свищей на УЗИ цветовой допплер может показать видимый тканевый отросток с пульсирующим течением в полости выше уровня фистулы; иногда сам фистулу трудно идентифицировать. Хирургические портокавальные шунты обычно представляют собой шунтирующие из стороны в сторону в верхней части живота на уровне, где проксимальная основная воротная вена проходит близко перед полостью. Ткань может быть заметна, и шунт легче идентифицировать, если печень можно использовать как окно до точки анастомоза, а поворот пациента вверх на левую сторону может облегчить визуализацию. Тем не менее, в настоящее время они выполняются редко, их заменяют внутрипеченочные внутрипеченочные портосистемные шунты.
Сосудистые аномалии легочного круга кровообращения как причина кровохарканья у женщины с бронхиальной астмой
Рассмотрены причины развития легочных кровохарканий и кровотечений у больных бронхиальной астмой. Описаны легочные артериовенозные мальформации — клиническая картина, методы диагностики, подходы к лечению. Приведен клинический случай.
The reasons of pulmonary blood spitting and bleeding in patients with bronchial asthma were considered. Pulmonary arteriovenous malformations were described— clinical representation, diagnostic methods, approaches to treatment. A clinical case was given.
Кровохарканье и легочное кровотечение — респираторные симптомы, которые могут приводить к развитию грозных осложнений, таких как массивная кровопотеря, аспирационная пневмония и асфиксия пациента выделяющейся кровью. В клинической практике для разграничения этих понятий чаще всего используют количество выделившейся крови. Так, под кровохарканьем понимают откашливание из дыхательных путей отдельных прожилок крови или небольшой примеси в мокроте ярко-красного цвета. Легочное кровотечение определяют как более массивное выделение крови в чистом виде из дыхательных путей или в виде обильной примеси к мокроте (в объеме более 100 мл или 200 мл крови).
Причиной развития легочных кровохарканий и кровотечений может быть один или сочетание нескольких факторов, к которым относятся врожденная или приобретенная патология легких, сердечно-сосудистой системы, пищевода, болезни системы крови, системные заболевания, реже инфекционные и паразитарные. Нередко предрасполагающими моментами служат травма грудной клетки, резкое повышение внутригрудного давления, психоэмоциональное напряжение, нарушение целостности сосудистой стенки, применение антикоагулянтов и некоторые другие факторы.
В связи с тем что легочные кровотечения более опасны для пациента, а также учитывая сообщения описываемой нами больной о том, что при впервые возникшем кровохарканьи у нее выделилось более 200 мл кровяных сгустков, мы в статье особое внимание уделим ангиодисплазии как наиболее частой причине легочных кровотечений в настоящее время.
Структура нозологий, вызывающих легочные кровотечения, за последние десятилетия претерпела существенные изменения. Если в середине прошлого столетия большинство легочных кровотечений наблюдалось у больных деструктивными формами туберкулеза, абсцессом, гангреной и распадающимся раком легкого, то в настоящее время легочные кровотечения чаще происходят из сосудов большого круга кровообращения при хронических воспалительных заболеваниях легких.
Среди относительно нечасто встречающихся причин легочного кровотечения или кровохарканья являются пороки развития сосудов легких или ангиодисплазии, при которых могут возникать патологические соустья или открываться ранее закрытые межсосудистые шунты как в системе малого или большого кругов кровообращения, так и между двумя системами кровообращения. Менее неблагоприятной сосудистой аномалией служит шунтирование артериальной оксигенированной крови из бронхиальных артерий в легочные вены, более неблагоприятной и клинически более значимой является ангиодисплазия со сбросом венозной неоксигенированной крови в большой круг кровообращения, минуя легочную капиллярную сеть. В доступной литературе среди сосудистых заболеваний легких, приводящих к легочным кровотечениям, наибольшее внимание в настоящее время уделяется легочным артериовенозным мальформациям (ЛАВМ), чему способствует развитие и внедрение в практику различных рентгенэндоваскулярных хирургических методов лечения в противовес радикальным инвазивным вмешательствам.
ЛАВМ ранее была описана в литературе под множеством названий: доброкачественная кавернозная гемангиома легких, легочный артериовенозный ангиоматоз, гамартоматозная гемангиома легких, артериовенозная аневризма легких, артериовенозная фистула легких и другие.
Первое описание ЛАВМ у 12-летнего ребенка было дано T. Churton в 1987 г. [1]. Начиная с 1980-х гг. в литературе периодически стали публиковаться работы об успешном лечении ЛАВМ при помощи малоинвазивных рентгенэндоваскулярных методов (эмболизации) [2, 3]. В настоящее время продолжается сравнение эффективности и безопасности радикальных хирургических и малоинвазивных методов лечения ЛАВМ.
Четкие статистические данные о частоте встречаемости ЛАВМ отсутствуют, однако распространенность заболевания не превышает 2–3 случая на 100 тыс. населения. Встречаемость ЛАВМ у мужчин и женщин приблизительно одинакова. Довольно часто ЛАВМ ассоциируют с множественными геморрагическими телеангиэктазиями, наиболее известными как синдром Рандю–Ослера–Вебера: до 90% пациентов с ЛАВМ диагностируют также этот синдром [4]. Согласно статистическим данным чаще встречаются односторонние ЛАВМ. До 70% больных имеют поражения в нижних долях легких. Размер ЛАВМ колеблется в среднем от 1 до 5 см, но в ряде случаев может достигать 10 см в диаметре.
Что касается ангиодисплазий легкого, то они представляют собой патологические сообщения между артериальной и венозной системами легкого посредством прямых соустий, сети шунтов (микрофистул) или различного рода гемангиом, которые могут располагаться как в глубине легочной ткани, так и субплеврально. Величина артериовенозного сброса может колебаться от 20% до 80% от объема циркулирующей крови, что определяет степень выраженности клинических проявлений заболевания. Единичные образования менее 2 см в диаметре не сопровождаются какой-либо симптоматикой. Клинические симптомы отмечаются при множественных ангиодисплазиях или размере ЛАВМ свыше 2 см.
Классическая картина ЛАВМ включает жалобы на одышку, кровохарканье или легочные кровотечения, реже встречаются цереброваскулярные нарушения и транзиторные ишемические атаки. Превалирующее большинство пациентов предъявляет жалобы на одышку, интенсивность которой зависит от степени гипоксемии. Выраженность одышки может возрастать при переходе от горизонтального положения к вертикальному, что происходит вследствие увеличения кровотока в нижних отделах легких, где чаще локализуется ЛАВМ, и усугубления шунтирования неоксигенированной крови. При осмотре больных с ангиодисплазиями обращают на себя внимание такие проявления хронической гипоксемии, как диффузный цианоз кожных покровов, изменения формы ногтей, приобретающих вид «часовых стекол», и изменения пальцев рук и ног в виде «барабанных палочек». Одним из постоянных компенсаторных изменений крови в ответ на артериовенозное шунтирование является эритроцитоз или полицитемия и повышение уровня гемоглобина.
Достоверная диагностика ЛАВМ возможна уже при рентгенологическом исследовании органов грудной клетки. Для данной ангиодисплазии характерно усиление сосудистого рисунка в прикорневых зонах, а также обнаружение патологической тени, локализующейся главным образом в периферических отделах нижних долей легких. Характерным признаком является связь дополнительной тени с корнем легкого, что делает ее похожей на комету. Однако далеко не всегда обзорная рентгенограмма может выявить ЛАВМ. С большей точностью определить количество и анатомические характеристики аномалий легочных сосудов позволяет спиральная компьютерная томография высокого разрешения с внутривенным контрастным усилением.
Наиболее точными и информативными методами исследования при ангиодисплазии легких являются контрастные исследования: ангиопульмонография и бронхиальная артериография, позволяющие не только определить число, размер и диаметр артерий, вовлеченных в процесс, но и напрямую измерить давление и исследовать газовый состав крови того или иного кругов кровообращения. Избежать инвазивных методов исследования, особенно при невозможности их проведения, может позволить тест с микропузырьками (bubble-test) — одна из простых и доступных методик контрастной эхокардиографии, использующейся в современной кардиологии для оценки право-левых сбросов крови при пороках сердца, однако по информативности сильно уступающая инвазивным исследованиям [5]. Несмотря на этот метод диагностики, неоспоримым считается тот факт, что все пациенты с ЛАВМ должны быть прооперированы — либо радикально, либо малоинвазивно. Обе лечебные тактики позволяют ликвидировать межсосудистые шунты и предовтратить развитие грозных осложнений. Отказ больного от оперативного лечения сопряжен с высоким риском летального исхода и ведет к быстрому прогрессированию заболевания с развитием тяжелых тромбоэмболических осложнений или легочных кровотечений.
К радикальному методу лечения сосудистых аномалий легких относят открытую операцию в объеме пульмонэктомии или резекции легкого в пределах анатомических границ поражения. Менее инвазивными способами лечения ангиодисплазий легких служат рентгенэндоваскулярные методы лечения. В доступной литературе продолжается обсуждение преимуществ той или иной оперативной тактики.
До середины прошлого века только хирургическое лечение данной патологии рассматривалось как единственная эффективная и безопасная тактика ведения больного при ограниченных формах ангиодисплазий, в частности ЛАВМ. Открытая операция показана пациентам с большими центрально расположенными сосудистыми образованиями, с короткими приводящими артериями, с субплеврально расположенными образованиями, которые могут разорваться, а также при продолжающемся массивном легочном кровотечении. Вероятность рецидива при инвазивном лечении не превышает 2% [6].
В последние три десятилетия достойной альтернативой открытой операции у больных с ЛАВМ, межсосудистыми шунтами и фистулами становится рентгеноэндоваскулярная окклюзия легочных артериальных сосудов, вовлеченных в патологический процесс. Этот метод менее инвазивный, при необходимости его можно использовать повторно. Для ангиографической окклюзии сосудистой аномалии в качестве эмболизирующего материала используют различного типа материал: съемные баллончики (впервые в 1977 г. описал W. Porstmann), металлические спирали С. Gianturco (впервые использованы в 1975 г.), ивалон (поливинил) и другие. Убедительных преимуществ использования баллона или спиралей для окклюзии сосудов не отмечено ни одним из авторов. Выбор определяется диаметром и числом артерий, которые предстоит окклюзировать.
После лечения все пациенты подлежат динамическому наблюдению в течение ближайших нескольких лет в связи с возможным рецидивированием легочных ангиодисплазий, особенно при сохраняющихся патогенетических факторах. По сравнению с открытой операцией после рентгеноэндоваскулярной окклюзии сосудистой аномалии риск рецидива, к сожалению, выше, в связи с чем наряду с ежегодной рентгенографией органов грудной клетки и пульсоксиметрией требуется также динамический контроль картины компьютерной томографии. В то же время пациенты с ЛАВМ, прошедшие резекцию легкого, не требуют столь сложного послеоперационного наблюдения.
Ниже приводим клиническое наблюдение, в котором отражена сложность дифференциальной диагностики легочного кровотечения/кровохарканья и возможности рентгеноэндоваскулярных методов лечения ангиодисплазии легких.
Пациентка И., 56 лет, поступила в терапевтическое отделение ФТК УКБ № 1 Первого МГМУ им. И. М. Сеченова 07.09.2015.
При поступлении предъявляла жалобы на кашель с отделением небольшого количества мокроты слизистого характера, свистящее дыхание, одышку при умеренной физической нагрузке, общую слабость, потливость.
Из анамнеза жизни известно, что пациентка родилась в 1949 г. в Москве, росла и развивалась соответственно возрасту, получила среднее специальное образование по профессии «парикмахер». Однако, работая парикмахером, при частом контакте с красками для волос, лаками начинали беспокоить заложенность носа, приступообразный кашель, в связи с чем сменила вид деятельности и в настоящее время работает кассиром в театре. Из семейного анамнеза известно, что отец умер в 56 от рака гортани, мать — в 85 лет (о заболеваниях информации нет), сестра, дети — практически здоровы. Пациентка эпизодически курит, выкуривая до 3 сигарет в день (индекс курящего человека менее 5 пачек/лет), алкоголем не злоупотребляет. Из перенесенных заболеваний отмечает острый калькулезный холецистит, панкреатит, осложнившийся панкреонекрозом в 1983 г., гипертоническая болезнь с 1982 г., с максимальными подъемами уровня артериального давления до 180/100 мм рт. ст. без приема регулярной гипотензивной терапии. Гипотиреоз на протяжении 10 лет, медикаментозно компенсированный (L-тироксин 75 мкг). В 1982, 1994 гг. проведено кесарево сечение. В аллергологическом анамнезе обращает на себя внимание возникновение заложенности носа и приступообразного кашля при контакте со средствами бытовой химии и парфюмерии. При приеме антибиотиков пенициллинового ряда возникает крапивница.
Из анамнеза заболевания известно, что с детского возраста отмечает частые простудные заболевания (до 3–4 раз в год), страдает вазомоторным ринитом. Приступообразный кашель также беспокоит пациентку с детского возраста. За медицинской помощью не обращалась. С апреля текущего года появилось свистящее дыхание и одышка. 18.04.2015 г. в предутренние часы возник приступ кашля, сопровождавшийся кровохарканьем, откашливанием сгустков крови вишневого цвета, со слов больной до 200 мл. Была госпитализирована в ГКБ по месту жительства, где при обследовании на компьютерной томографии органов грудной клетки от 22.04.2015 в нижней доле левого легкого (сегменты S9–10) были выявлены сливающиеся фокусы уплотнения легочной ткани по типу «матового стекла» и единичные, более плотные перибронхиальные очаги, что было расценено как картина поствоспалительных изменений в нижней доле левого легкого, предположительно аспирационного генеза. По данным бронхоскопии выявлена локальная кровоточивость в верхнедолевом бронхе справа. Во время нахождения на стационарном лечении возникали еще два эпизода кровохарканья, купированные, как и предыдущие, внутривенным введением эпсилонаминокапроновой кислоты и приемом Дицинона. Причины кровохарканья установлены не были. В повторных анализах мокроты микобактерии туберкулеза отсутствовали. Вместе с тем по выписке домой пациентке было рекомендовано амбулаторно посетить фтизиатра, однако больная к фтизиатру не обратилась, и тщательное обследование для исключения туберкулеза как причины кровохарканья было проведено во время следующей госпитализации в ГКБ в июле 2015 г. Повторный эпизод кровохарканья возник 05.05.2015 г., купированный больной самостоятельно приемом Дицинона, эпсилонаминокапроновой кислоты и не потребовавший госпитализации.
26 июля 2015 г. в предутренние часы очередной приступ кровохарканья не удалось купировать самостоятельно, была повторно госпитализирована в ГКБ по месту жительства. По данным мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки от 10.08.2015 г. в S3 и S9 справа обызвествленный очаг до 2 мм в диаметре, немногочисленные очаги линейного и очагового фиброза в обоих легких, перибронхиальные зоны уплотнения по типу «матового стекла», сливающиеся друг с другом в базальных сегментах нижней доли левого легкого. При бронхоскопии грубых органических изменений в бронхиальном дереве не выявлено. Отмечалась лишь повышенная контактная кровоточивость слизистой верхнедолевых бронхов на фоне кашля. При сцинтиграфии легких нарушение перфузии и вентиляции легких, с преобладанием вентиляционных нарушений. Больная была тщательно обследована у фтизиатра с проведением диагностических проб, данных за туберкулез не получено. Вновь состояние с учетом данных МСКТ органов грудной клетки было расценено как поствоспалительные изменения в легких, предположительно аспирационного генеза. Повторная терапия эпсилонаминокапроновой кислотой, Дициноном оказалась успешной. Кровохарканье не рецидивировало. Причина кровохарканья по-прежнему оставалась неуточненной. В сентябре 2015 г. кашель, одышка и свистящее дыхание усилились, и пациентка, опасаясь повторения кровохарканья, обратилась в поликлиническое отделение Первой университетской клинической больницы Первого МГМУ им. И. М. Сеченова и была госпитализирована в Факультетскую терапевтическую клинику.
В биохимическом анализе крови: общий белок 74,8 г/л, альбумин 44,5 г/л, альфа2-глобулины — 6,2%, креатинин 0,7 мг/дл, глюкоза 5,0 ммоль/л, железо 17,5 мкмоль/л, K + 4,7 мэкв/л, Na + 140 мэкв/л, АЛТ 21 ед/л, АСТ 19 ед/л, ГГТ 74 ед/л.
В общем анализе мочи и кала без особенностей. Реакция кала на скрытую кровь отрицательная.
Общий анализ мокроты: характер — слизистый, лейкоциты 10–15 в поле зрения, эритроциты единичные в препарате, макрофаги — много, эпителий плоский — немного, эпителий цилиндрический — немного, спирали Куршмана — 1 в препарате, эозинофилы сплошь покрывают поля зрения.
При микробиологическом исследованим мокроты выявлена условно-патогенная флора (Haemophilus parahaemolyticus, Streptococcus sanguinis, Streptococcus oralis, Candida albicans) в диагностически незначимом титре.
На ЭКГ ритм синусовый, правильный, ЧСС 62 уд. в мин. ЭОС отклонена влево, PR 190 мсек, QRS 90 мсек, QT 394 мсек, QTc 402 мсек. Начальные признаки гипертрофии левого желудочка.
Функция внешнего дыхания (ФВД): исходно ЖЕЛ 3,00 л (117%), ОФВ1 2,73 л (114%), ОФВ1/ЖЕЛ 79%, МОС25 78%, МОС50 91%, МОС75 54%. После Беротека: ЖЕЛ 4,29 л (145%), ОФВ1 3,31 л (138%), ОФВ1/ЖЕЛ 77%, МОС25 94%, МОС50 104%, МОС75 69%.
Заключение. Нарушение вентиляции легких по обструктивному типу. Обструктивные нарушения легкой степени тяжести. Снижение скорости воздушного потока в дистальном отделе. ЖЕЛ в пределах возрастной нормы. Положительная проба с Беротеком 400 мкг (КБД 11%, +260 мл).
ФВД: исходно ЖЕЛ 3,44 л (100%), ОФВ1 2,34 л (97%), ОФВ1/ЖЕЛ 78%, МОС25 69%, МОС50 74%, МОС75 63%. После Атровента: ЖЕЛ 3,89 л (103%), ОФВ1 3,26 л (102%), ОФВ1/ЖЕЛ 83%, МОС25 92%, МОС50 81%, МОС75 78%. Заключение: нарушений вентиляции легких не выявлено. ЖЕЛ в пределах возрастной нормы. Положительная проба с Атровентом (КБД 21%, +580 мл). Таким образом, при ФВД получены данные, свидетельствующие об обратимой бронхиальной обструкции, преимущественно на уровне мелких бронхов.
С учетом жалоб пациентки на кашель с отхождением мокроты, свистящее дыхание, одышку при умеренной физической нагрузке, данных анамнеза (заложенность носа и приступообразный кашель на средства бытовой химии), данных осмотра (сухие хрипы над всей поверхностью легких), а также результатов клинико-лабораторного обследования (эозинофилы в мокроте, обратимая бронхиальная обструкция по данным ФВД с медикаментозными пробами) больной впервые был поставлен диагноз «бронхиальная астма, инфекционно-аллергическая, легкого течения» и начата терапия Онбрезом Бризхалер 150 мкг 1 вдох утром, Пульмикортом Турбухалер 200 мкг 1 вдох утром. По поводу артериальной гипертонии проводилась терапия Амлодипином 5 мг по 1 таблетке 1 раз в день с дальнейшим увеличением до 1 таблетки 2 раза в день, Индапамидом ретард 1,5 мг по 1 таблетке утром. Продолжает принимать L-тироксин 75 мкг по 1 таблетке утром. Самочувствие больной оставалось удовлетворительным, жалобы не беспокоили больную. Однако, ввиду того, что главной причиной обращения пациентки в клинику послужили эпизоды кровохарканья в анамнезе, больной был проведен тщательный поиск их причины.
С учетом того, что причины легочного кровохарканья чрезвычайно разнообразны, мы сразу анамнестически исключили существования заболеваний, сопровождающихся развитием легочных васкулитов, служащих источником кровохарканья (васкулит Вегенера, болезнь Гудпасчера и т. д.), так как у больной отсутствовали клинические проявления этих заболеваний, не было признаков активности процесса (нормальные значения СОЭ, альфа2-глобулинов, нет гематурии и т. д.).
Не выявлены изменения в свертывающей системе крови, которые также могли быть причиной кровохарканья: АЧТВ 0,93, ПТИ по Квику 119%, фибриноген 3,17 г/л, тромбиновое время 18,6 сек, FM-тест менее 40 мг/л, Д-димер 0,25 мкг/мл, ИТТ 0,98, АРТТ LA 0,94, SLA 0,99, агр. Т. АДФ 50%, агр. Т-коллаген 48%, ТЭГ (Р) 5`20« мин, ТЭГ (К) 1`40« мин, ТЭГ (МА) 55 мм, агр. Т. Ристомицин 70% — все показатели коагулограммы в пределах нормальных значений.
Осмотр ЛОР-врача исключил источник кровохарканья в верхних отделах дыхательных путей. Отмечено лишь незначительное усиление сосудистого рисунка, слизь обнаружена в передних отделах полости носа с обеих сторон, что может быть результатом вазомоторного ринита. Выявлено небольшое S-образное искривление перегородки носа, больше вправо.
Источник кровохарканья в верхних отделах желудочно-кишечного тракта также не обнаружен: при эзофагогастродуоденоскопии отмечалась лишь недостаточность кардии, поверхностный очаговый гиперпластический гастрит.
После тщательного анализа анамнеза заболевания и результатов повторных бронхоскопий, выполненных накануне в ГКБ по месту жительства, результатов лабораторно-инструментального обследования, выполненного в клинике, исключившего основные причины кровохарканья (воспалительные, инфекционно-грибковые, врожденные аномалии, пороки сердца, ТЭЛА, болезнь Рандю–Ослера, легочные васкулиты, патологию в свертывающей системе крови и т. д.), было высказано предположение о наличии у пациентки артериовенозных анастомозов в системе сосудов легочного круга кровообращения или ЛАВМ. Эту же идею поддержал и торакальный хирург, профессор В. Д. Паршин.
Больная 22 сентября 2015 г. была переведена в отделение торакальной хирургии Факультетской хирургической клиники Первого МГМУ им. И. М. Сеченова для проведения бронхиальной артериографии, где артериография и была проведена 23.09.2015 г. При артериографии бронхиальных артерий выявлены аневризматические изменения в области сосудов нижней доли правого легкого и выраженные артериовенозные анастомозы в области нижней доли левого легкого (рис. 1), что потребовало в дальнейшем проведения эндоваскулярной эмболизации этих артерий. 25 сентября 2015 г. проведена эндоваскулярная суперселективная эмболизация бронхиальных артерий (рис. 2). Послеоперационный период протекал гладко, без особенностей. 6 октября 2015 г. больная была выписана из клиники под амбулаторное наблюдение. В настоящее время больная чувствует себя хорошо, работает, эпизодов кровохарканья не наблюдается. Продолжает получать противоастматическую, антигипертензивную терапию, L-тироксин.
Литература
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва


_575.jpg)