нейродегенеративный процесс головного мозга что это такое
Нейродегенеративные заболевания
Лептин и инсулин являются ключевыми анорексигенными гормонами, продуцируемыми адипоцитами при накоплении жировых запасов и эндокринной поджелудочной железы соответственно. Грелин вырабатывается желудочно-кишечным трактом и стимулирует процесс потребления пищи. Множество и других периферических гормонов участвует в регуляции метаболизма, и большинство из них сигнализирует о своей активности гипоталамусу. Более того, гипоталамические нейроны также фиксируют изменения в питательных веществах, таких как глюкоза или жирные кислоты, и способны модифицировать метаболический гомеостаз.
Причины потери веса и аномального питания в течение клинической фазы AD остаются неизвестными ( метаболические изменения могут быть связаны с вышеупомянутыми поражениями гипоталамуса). Некоторые исследования подтверждают участие передачи сигналов лептина в изменениях энергетического гомеостаза при AD. Было обнаружено, что пептиды Aβ способны изменять реакцию нейронов NPU дугообразного ядра на лептин. В нескольких исследованиях также показано, что пациенты с болезнью Альцгеймера могут иметь резистентность к инсулину, и, следовательно, маловероятно, что изменения массы тела у пациентов с АD обусловлены увеличением анорексигенного действия инсулина. Кроме того, поражения дугообразного ядра благоприятствуют развитию AD-подобных поражений в экспериментальных моделях.
Помимо потери веса тела, убедительные доказательства на протяжении многих лет поддерживают взаимосвязи между изменениями гомеостаза глюкозы и патогенезом AD. Как указывалось выше, ожирение, резистентность к инсулину и диабет являются значимыми факторами риска развития болезни Альцгеймера. Экспериментальные исследования подтверждают связь между такими метаболическими нарушениями и AD с нарушенной амилоидной или тау-патологией, усиливающейся после развития ожирения и резистентности к инсулину в трансгенных моделях AD амилоидогенеза или тау-патологии. В некоторых исследованиях утверждается, что периферические нарушения склонны поддерживать устойчивость мозга к инсулину и сами по себе достаточны для развития развития тау-патологии и амилоидогенеза. Патологические изменения также могут быть связаны с гипотермией. Интересно отметить, что риск развития диабета был увеличен у пациентов с AD. Было показано, что мозг пациентов с болезнью Альцгеймера проявляет резистентность к инсулину, примером чего является увеличение кортикального фосфорилирования сайтов ингибирования серина IRS-1, которое коррелирует с когнитивными нарушениями. Это наблюдение согласуется с известной способностью передачи сигналов инсулина для содействия процессов пластичности и памяти, которые могут иметь отношение к изменениям в коре головного мозга или улучшение памяти, наблюдаемое у людей после введения интраназального инсулина. Потенциальное появление устойчивости к инсулину мозга при развитии нарушений гомеостаза глюкозы у пациентов с болезнью Альцгйемера также подтверждается известной ролью передачи сигналов инсулина в процессах регуляции энергетического метаболизма. Происхождение резистентности к инсулину мозга у пациентов с АD, по-видимому, связано с патологией Aβ и tau. С одной стороны, интра церебровентрикулярная инфузия олигомеров Aβ у мышей является достаточной для того, чтобы вызвать непереносимость периферической глюкозы с помощью механизма, функционирующего на основе гипоталамуса. С другой стороны, потеря функции tau, которая, как ожидается, будет сопровождаться последующим гиперфосфорилированием и агрегацией тау, снижает чувствительность к инсулину и связана с измененным гомеостазом глюкозы. Это соответствует увеличению ингибирования IRS-1 в мозге пациентов с чистыми тауопатиями. Было показано, что олигомеры Aβ способствуют интернализации инсулиновых рецепторов, а также активации путей JNK, PKR и TNFα, которые в свою очередь ингибируя функцию IRS-1. Кроме того, было предложено стимулировать функцию IRS-1, а также продукцию PIP3, способствуя передаче сигналов инсулина. Примечательно, что недавние данные показали, что ApoE4 способствует нейронной резистентности к инсулину и может синергически действовать вместе с поражениями.
Метаболические изменения, такие как потеря веса или резистентность к инсулину, были зафиксированы в большинстве случаев нейродегенеративных заболеваний. Во многих случаях эти изменения были причинно связаны с по крайней мере частью неврологического фенотипа и показали, что они способствуют прогрессированию болезни.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
Нейродегенеративные заболевания и их диагностика
МРТ головного мозга. Демонстрация атрофии и нормы при цветовой обработке.
Под термином “нейродегенеративные заболевания” (НДЗ) определяется большая группа заболеваний преимущественно позднего возраста, для которых характерна медленно прогрессирующая гибель определенных групп нервных клеток и одновременно – постепенно нарастающая атрофия соответствующих отделов головного и/или спинного мозга. В основе развития этих заболеваний лежит нарушение метаболизма и изменение конформации клеточных белков с их последующим накоплением и агрегацией в определенных группах нейронов. При НДЗ страдают преимущественно нейроны и глиальные клетки базальных ганглиев и стволовых структур, вырабатывающие ацетилхолин, дофамин, серотонин.
Классификация делит НДЗ на 2 большие группы – спорадические и ирритативные.
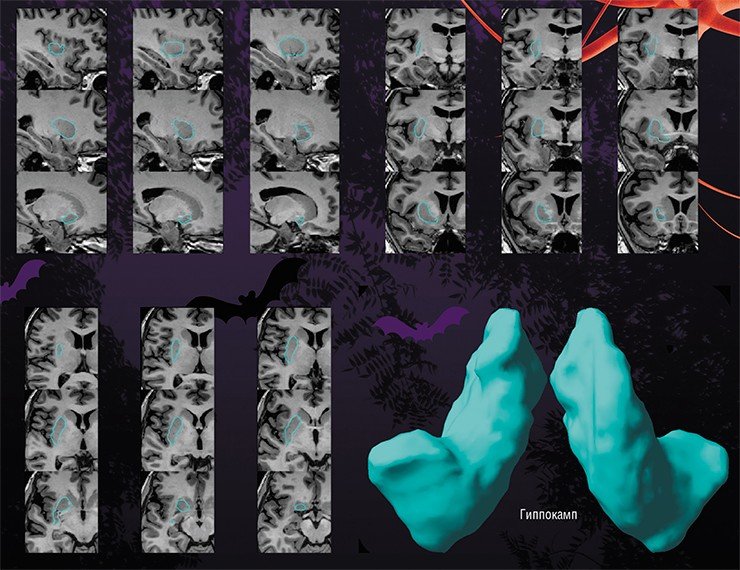
Болезнь Альцгеймера – прогрессирующее нейродегенеративное заболевание, характеризующееся постепенным развитием деменции. Происхождение заболевания точно неизвестна. Биохимические изменения состоят в снижении активности холин-ацетил-трансферазы коры головного мозга и гиппокампов. Патологические проявления заключаются в образовании специфических амилоидных бляшек, нейрофибриллярных тяжей и реактивном глиозе. Развивается атрофия, захватывающая преимущественно кору вокруг Сильвиевых щелей и гиппокампы, с вторичным расширением желудочков, особенно височных рогов
Заболевание впервые описано Alois Alzheimer в 1907 году. Процесс напоминает естественное старение, но резко ускоренное. Начинается с нарушений памяти, затем потерянность, невозможность повседневного самообслуживания, повторяющиеся вопросы. Позже присоединяются глубокие нарушения психики, речи, потеря веса, судороги.
Частота составляет 0,51% для лиц в возрасте 70-74 лет с возрастным прогрессирующим увеличением частоты. Клинические проявления состоят в нарушении памяти, депрессии, поведенческих нарушениях и галлюцинациях. На поздних стадиях к психическим расстройствам добавляется экстрапирамидная симптоматика. Заболевание занимает 4 место по смертности. Диагноз ставится на основании клинического и нейрофизиологического обследования, а также нейровизуализации. Типичные проявления на КТ состоят в диффузной атрофии (особенно,височных долей), вторичном расширении борозд и желудочков. Чувствительность КТ (без измерения объемов) в сравнении с нормальной возрастной группой около 80%, специфичность около 70%. Измерение объемов гиппокампов при выполнении МРТ с тонкими срезами повышает точность до 85%.
МРТ головного мозга. Т2-взвешенная сагиттальная МРТ. Болезнь Пика. Цветовая обработка изображения.
МРТ головного мозга служит метода выбора оценки структурных изменений. Атрофические изменения выражены во всём медиобазальном отделе височной доли. Чувствительность и специфичность МРТ при начальной деменции около 80%. Измерение объемов гиппокампов и амигдалы повышает точность до до 85%.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Диффузная атрофия при болезни Альцгеймера.
Дифференциальную диагностику при МРТ головного мозга надо проводить с болезнью Паркинсона, мультиинфарктной деменцией и лобнотеменной деменцией (болезнь Пика).
В этих же зонах отмечается гипоперфузия и снижение активации при фМРТ. Кроме МРТ при исследовании болезни Альцгеймера важное значение имеет ПЭТ с [ 18 F] флюоро-2-деоксиглюказой (FDG). Гипометаболизм хорошо коррелирует с тяжестью заболевания и предсказывает его развитие.
При деменции, связанной с болезнью Паркинсона при МРТ головного мозга отмечается снижение толщины коры в проекции парагиппокампальной части левой средней затылочно-височной извилины и уменьшение объема левого нижнего продольного пучка. Уменьшение толщины коры левой парагиппокампальной зоны связано с высоким риском депрессии. Отмечено, что дневная сонливость коррелирует с уменьшением толщины коры фузиформной зоны, определяемое при МРТ.
Для прослеживания динамики и прогнозирования также прибегают к различным измерениям при МРТ головного мозга:
Прогрессирующий надъядерный паралич проявляется в виде нарушения взора вверх, экстрапирамидной симптоматики и умственных нарушениях. Заболевание развивается у лиц около 60 лет. Этиология неизвестна, почти все случаи спорадические. Частота 1-1,5 случаев на 100 тыс. населения. Заболевание характеризуется патологическим скопление в головном мозге тау-протеина. При МРТ головного мозга наблюдается диффузная атрофия, причем на сагиттальных Т1-взвешенных МРТ отмечается характерный симптом “пингвина”. Атрофические изменения моста и среднего мозга приводят к расширению водопровода и III желудочка, контур которых напоминает очертания пингвина.
МРТ головного мозга. Т12-взвешенная сагиттальная МРТ. Прогрессирующий надъядерный паралич. Симптом “пингвина”.
Центральный понтинный миелиноз (осмотическая деменция) представляет собой приобретенное метаболическое расстройство. Чаще встречается у алкоголиков. Гипонатрийемия приводит к демиелинизации, видимой при МРТ. Центральный понтинный миелиноз часто сопровождается экстрацентральным, когда есть поражение выше ствола. Клинические проявления сводятся к заторможенности (вплоть до летаргии), спастическому тетрапарезу и поражению нижних черепных нервов.
МРТ головного мозга. Т2-взвешенная аксиальная МРТ. Центральный понтинный миелиноз,
Болезнь Бинсвангера (субкортикальная атеросклеротическая энцефалопатия, деменция мелких сосудов). Это состояние, связанное с множественными инфарктами мелких ветвей, что при МРТ головного мозга видно как лакунарные ОНМК. Заболевание постепенно прогрессирует. Вариантом болезни Бинсвангера можно считать наследуюмую семейную артериопатическую лейкоэнцефалопатию.
МРТ головного мозга. Т2-взвешенная МРТ типа FLAIR. Болезнь Бинсвангера.
Болезнь Гентингтона относится к наследуемым заболеваниям, проявляется в среднем возрасте и быстро прогрессирует. В клинической картине преобладают хореоатетоз и деменция.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Болезнь Гентингтона.
Болезнь Фара очень редкое наследственное заболевание, проявляющееся в кальцификации базальных ганглиев и зубчатого ядра. На Т2-зависимых МРТ ядра резко гипоинтенсивны, что соответствует кальцинатам, хорошо видимым на КТ. Нередко в области зрительных бугров обнаруживаются мелкие гиперинтенсивные очажки.
МРТ и КТ головного мозга в аксиальной плоскости. Болезнь Фара.
Об МРТ в СПб при нейродегенераторных заболеваниях можно также читать на странице нашего другого сайта. Исследование мы выполняем в закрытом аппарате, но можно и на открытом МРТ. МРТ СПб позволяет выбирать место МРТ, но в этом случае мы рекомендуем Вам обследоваться у нас.
Дегенеративные заболевания нервной системы: болезнь Паркинсона, болезнь Альцгеймера, эссенциальный тремор. Правила профилактики болезни Альцгеймера.
Дегенеративные состояния возникают по неустановленным причинам и характеризуются поражением определенных нейрональных систем из-за прогрессирующей гибели нейронов.
Характерные черты дегенеративных заболеваний
Дегенеративно-дистрофические заболевания имеют схожие черты. Начало у заболеваний практически незаметно, но все они неуклонно прогрессируют, что может длиться десятилетиями. Начало сложно отследить, причину невозможно выявить. Пораженные ткани и органы постепенно отказывают в выполнении своих функций, дегенерация движется по настающей. Болезни этой группы имеют устойчивость к терапии, лечение всегда комплексное, сложное и редко эффективное. Чаще всего оно не дает желаемых результатов. Можно замедлить дегенеративный рост, но остановить его практически невозможно. Заболевания чаще встречаются среди людей старшего, пожилого возраста, среди молодежи они распространены реже.
Виды дегенеративных болезней
К дегенеративным заболеваниям относится: болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, боковой амиотрофический склероз, болезни мотонейрона. Дегенеративные заболевания нервной системы относятся к широко распространенным – болезнь Паркинсона или Альцгеймера диагностируется у 1 человека из 1000. Причем нейродегенеративные заболевания не являются характерными только для старшей возрастной группы, например дистонические синдромы чаще всего отмечаются в продуктивном возрасте.
Многие дегенеративные заболевания проявляются ограниченной или диффузной атрофией мозга, в определенных структурах происходит микроскопическое снижение нейронов. В некоторых случаях происходит только нарушение в функциях клеток, гибель их не происходит, атрофия мозга не развивается (эссенциальный тремор, идиопатическая дистония). В подавляющем большинстве дегенеративные заболевания имеют длительные сроки скрытого развития, но неуклонно прогрессирующую форму.
Дегенеративные заболевания ЦНС классифицируются по клиническим проявлениям и отображают вовлечение определенных структур нервной системы. Выделяются:
Болезнь Альцгеймера
За последние 30-40 лет одновременно с повышением продолжительности жизни во всем мире, в обществе возрастает бремя нейродегенеративных заболеваний мозга, затрагивающих прежде всего пожилых людей. Среди этих болезней наиболее распространена и наиболее широко известна болезнь Альцгеймера, поскольку она поражает как интеллект, так и эмоциональное благополучие своих жертв, и имеет потенциально разрушительное воздействие на их жизнь и жизни их семей.
Нервно-дегенеративные заболевания с проявлениями деменции чаще возникают в пожилом возрасте. Самой распространенной является болезнь Альцгеймера. Прогрессирует у лиц старше 80 лет. В 15% случаев заболевание носит семейный характер. Развивается на протяжении 10-15 лет. Начинаются поражения нейронов в ассоциативных областях теменной коры, височной и лобной, при этом слуховые, зрительные и соматосенсорные участки остаются непораженными.
Это заболевание является наиболее распространенной формой потери памяти, или деменции. Обычно болезнь Альцгеймера диагностируют у людей старше 65-ти лет, однако она может появиться и в более раннем возрасте. К сожалению, в последнее время наблюдается все более широкое распространение и «помолодение» болезни Альцгеймера, которую диагностируют у лиц в возрасте 45–65 лет. Помимо тех, чьи родственники страдают этой болезнью, в группу риска попадают люди, жизнь которых не была связана с интеллектуальным трудом и интеллектуальной активностью, лица, страдающие сахарным диабетом и избыточной массой тела, имеющие хроническую гипоксию, атеросклероз магистральных артерий головы и некоторые другие заболевания. Наиболее часто заболевание начинается с расстройства кратковременной памяти, то есть человек легко забывает полученную недавно информацию, и в то же время легко воспроизводит факты и данные, относящиеся к далекому прошлому. Затем и долговременная память тоже расстраивается, появляется ряд других симптомов. Болезнь развивается постепенно.
Как начинается болезнь Альцгеймера?
Как протекает болезнь Альцгеймера: симптоматика заболевания на разных стадиях?
При первых признаках болезни Альцгеймера следует немедленно обратиться к врачу и кардинально пересмотреть свой образ жизни!
Отсутствие двигательной активности, интеллектуальной деятельности, общения, недостаток витаминов, пагубные привычки (алкоголь, курение) могут усугубить болезнь и дать толчок к ее стремительному развитию.
В начале заболевания человек часто сам замечает свои проблемы. В течение этого периода человек может понять свое состояние, он может самостоятельно искать помощь и справляться с большей частью своей повседневной деятельности. Этот период должен быть лучшим временем для диагностики болезни.
Может случиться так, что человек изначально будет пытаться скрыть свои проблемы от других!
По мере прогрессирования болезни способность к критической оценке и внимание еще более снижаются, а ухудшение памяти начинает выражаться все более сильнее. Люди с болезнью Альцгеймера забывает дату, день недели и года, забывает свой адрес и место, где они находятся в настоящее время. В большинстве случаев пациенты не замечают изменения вокруг и в себе, хотя иногда могут быть моменты прояснения, когда понимание более ясное.
На поздних стадиях болезни способность людей говорить и понимать речь настолько нарушена, что они не могут выразить себя или понять смысл других. Тем важнее становится невербальное общение с близкими — тон голоса, выражение лица, жесты. Все прежние навыки человека исчезают, и он больше не может встать с постели, одеваться, ходить, посещать туалет или принимать пищу
Существует ряд способов облегчить болезнь Альцгеймера, приостановить ее развитие, смягчить симптомы. Эффективность лечения зависит от своевременной диагностики — чем раньше будет обнаружена болезнь, тем результативнее действуют все принимаемые меры.
Депрессия и нейродегенерация: новые стратегии диагностики и терапии
В последнее время мы являемся свидетелями настоящего бума в области нейронаук: ежегодно в мире выходит свыше 200 тыс. статей, посвященных психологии, изучению когнитивных возможностей, структуры и функций мозга, а общее число таких публикаций исчисляется миллионами. Причина этого интереса не только в том, что благодаря стремительному прогрессу современных исследовательских инструментов мы все больше узнаем о тонких механизмах, обеспечивающих функционирование отдельных нервных клеток (нейронов) и специализированных нейрональных сетей на уровне целого мозга. Одновременно в обществе на фоне все более возрастающего информационного «давления» быстро растет число людей с психическими расстройствами, депрессиями и нейродегенеративными заболеваниями. Между тем несмотря на огромный объем накопленных знаний мы пока лишь приближаемся к пониманию механизмов работы мозга, которые обеспечивают огромное разнообразие вариантов нормального функционирования психики человека и участвуют в патогенезе не только самых распространенных психических, но и соматических заболеваний
Одно из важнейших направлений современных нейронаук – исследование механизмов нейрональной пластичности, которая определяет способность нервных клеток головного мозга гибко, адекватно и адаптивно реагировать на любые повреждающие факторы, как на внешние (информационная перегрузка, эмоциональный и психологический стресс, физические травмы), так и внутренние (возрастные изменения) вызовы. Сбои в работе этих механизмов носят универсальный характер и служат первопричиной основных нейропсихиатрических заболеваний вне зависимости от доминирующего в клинической картине комплекса патологических симптомов – аффективного, когнитивного или поведенческого.
Возьмем, к примеру, большое депрессивное расстройство (БДР). В научном сообществе сложилось мнение, согласно которому при этом заболевании в головном мозге наблюдается целый ряд изменений, в той или иной степени связанных с его клиническим проявлением. К таким изменениям относятся в первую очередь нарушения метаболизма биогенных аминов, или нейромедиаторов – биологически активных веществ, образующихся при декарбоксилировании аминокислот и служащих химическими передатчиками нервных импульсов. Кроме того, наблюдается уменьшение числа дендритов – отростков нейронов, обеспечивающих связь между ними и специализированными образованиями мозга; повреждение и даже гибель нейронов в результате чрезмерной продукции возбуждающих нейромедиаторов; торможение процессов формирования новых нейронов, а также развитие нейровоспаления вследствие усиления активности провоспалительных цитокинов.
Первая линия терапии БДР традиционно заключается в лекарственной стабилизации метаболизма биогенных аминов, например, с помощью препаратов, являющихся ингибиторами обратного захвата «гормона счастья» серотонина. Но уже на этом этапе монотерапии возникают серьезные трудности: оказывается, устойчивый терапевтический эффект наблюдается лишь у половины пациентов, и не раньше, чем через несколько недель применения; само же такое лечение сопровождается рядом нежелательных побочных эффектов. При этом обязательным условием положительной динамики в клинической картине у пациента с депрессией служит «разворот» в сторону улучшения нейрональной пластичности.
Такие наблюдения приводят к мысли, что ведущий вклад в патогенез депрессии, особенно ее резистентных и рецидивирующих форм, дают все-таки нарушения нейрональной пластичности, связанные с нейродегенеративными процессами, чему в последние годы появляется все больше эмпирических доказательств. Более того, согласно одному из последних определений БДР оно официально признано умеренно выраженным нейродегенеративным заболеванием.
Надежным свидетельством в пользу этого утверждения служат результаты недавнего исследования большого депрессивного расстройства, которое было проведено в 20 странах мира на огромной выборке больных и здоровых людей в рамках глобального проекта изучения мозга ENIGMA. В этом исследовании участвовала лаборатория аффективной, когнитивной и трансляционной нейронауки Института физиологии и фундаментальной медицины совместно с «А1 клиникой» института.
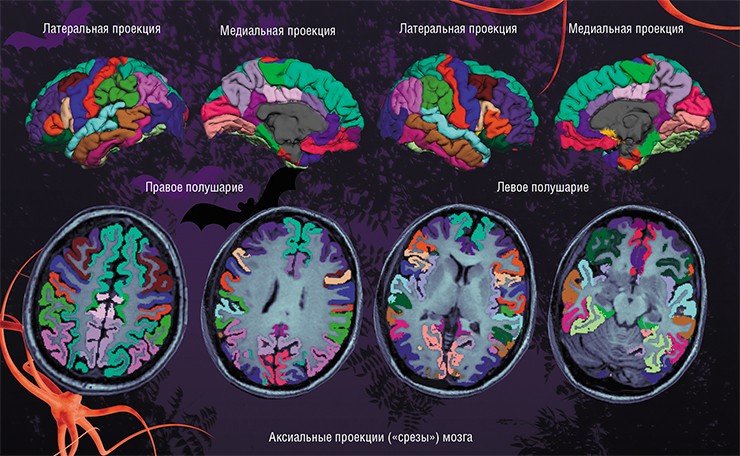
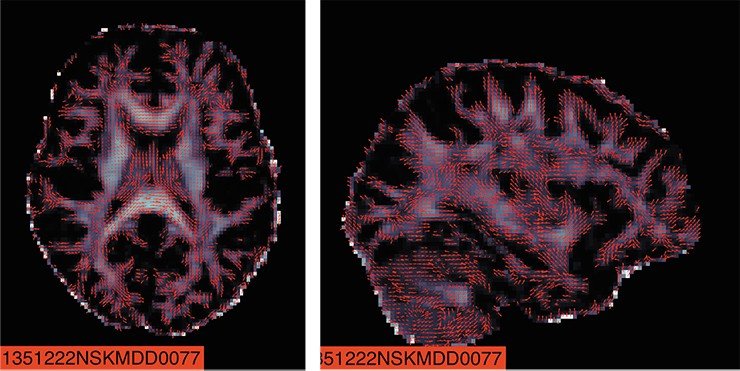
В результате на основе данных магнитно-резонансной томографии (МРТ) было надежно установлено, что у взрослых пациентов с БДР утончается серое вещество в различных областях коры головного мозга, при этом выраженность и площадь поражения зависят от фазы и истории болезни. У подростков с БДР уменьшается общая площадь, но не толщина, различных участков коры, при этом наиболее выраженные поражения зафиксированы у пациентов с рекуррентной (с наличием повторяющихся эпизодов) формой депрессии. Принципиальный вывод из этой работы: депрессия поражает структуру коры больших полушарий динамическим образом, формируя в течение жизни пациента различную картину нарушений (Schmaal et al., 2016).
Поиск доказательств гипотезы о решающем вкладе механизмов нейрональной пластичности в патогенез депрессий, а также разработка их эффективной терапии с помощью препаратов нового поколения, «гибридов» антидепрессанта и нейропротектора, – это актуальный вызов ученым и медикам. Если же говорить о классических нейродегенеративных заболеваниях (например, болезни Альцгеймера), для которых фактор нейродегенерации является ключевым, то к настоящему времени полноценно лечить эти заболевания мы так и не научились. И хотя в подобные разработки вкладываются огромные средства, анализ эффективности более сотни фармакологических соединений для терапии и профилактики болезни Альцгеймера показал, что в лучшем случае мы имеем эффект плацебо.
Медицина как «точная наука»
В последние годы клиническая нейронаука развивается в русле так называемой точной медицины (precision medicine). Именно точной, а не «персонализированной», как часто можно слышать. Согласно этому более удачному определению, для эффективной диагностики, терапии и профилактики нейропсихиатрических нарушений необходимо ясно понимать патогенетические механизмы возникновения и динамики болезни у каждого больного. Ключевая задача точной медицины – оказать действенную помощь реальному человеку, минимизируя нежелательные последствия.
Именно в рамках точной медицины должны быть сформированы проверочные алгоритмы, с помощью которых можно быстро и однозначно оценить эффективность ответа конкретного пациента на конкретную лекарственную терапию. Принятое в мире определение такого подхода – это диагностически управляемая терапия, или тераностика.
Только такой подход позволяет максимально правильно и эффективно ответить на все вызовы депрессии, главный из которых связан с отсутствием адекватного терапевтического ответа у достаточно большой группы пациентов. Как говорилось выше, в 40–60 % случаев этого заболевания мы сталкиваемся с устойчивостью к традиционным лекарственным препаратам. И хотя механизмы подобной резистентности в настоящее время активно изучаются, даже самые мощные и быстродействующие антидепрессанты, созданные за последние 5–7 лет, многие из которых еще даже не получили официального признания, в 30–40 % случаев также не работают.
Но если лекарство не помогает, его необходимо срочно менять! Сегодня эффективность препарата от депрессии оценивают, главным образом, на основе клинических признаков, и сделать это можно обычно не ранее, чем через 4–8 недель от момента начала лечения. Но что делать, если речь идет о пациенте с высокой суицидальной готовностью, что в случае этой болезни не редкость?
Здесь на помощь должны прийти нейрофизиологические и нейровизуализационные, а также омиксные маркеры. Омиксные технологии были названы по суффиксу «-омик», общему для передовых областей биологии, таких как геномика, транскриптомика, протеомика и метаболомика, которые изучают реализацию наследственной информации на всех уровнях молекулярной организации живого организма, от генома до протеома и метаболома (совокупности всех белков и низкомолекулярных продуктов метаболизма, соответственно).
Для определения эффективности терапии депрессии мы можем использовать целый арсенал омиксных маркеров, начиная с ДНК-маркеров генетического полиморфизма и уровня мРНК до конкретных протеомно-метаболомных характеристик. То же самое можно сказать и в отношении различных клинических форм классических нейродегенеративных заболеваний – болезней Паркинсона и Альцгеймера. В более широком смысле речь идет о разработке предикторов («предсказателей») не только риска возникновения, но и характера клинической динамики и чувствительности к медикаметозной терапии для целого ряда аффективных и нейродегенеративных заболеваний. В отдельную группу, безусловно, необходимо выделить предикторы и маркеры высокой суицидальной готовности.
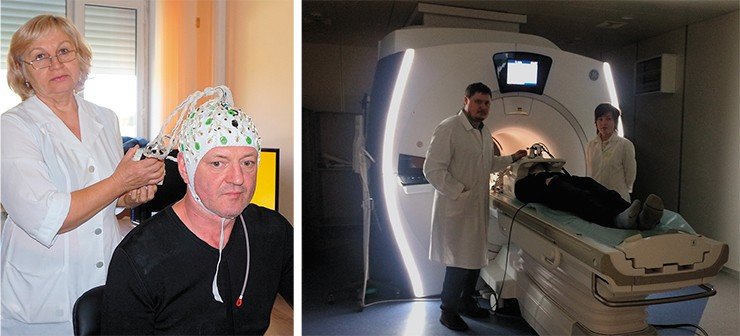
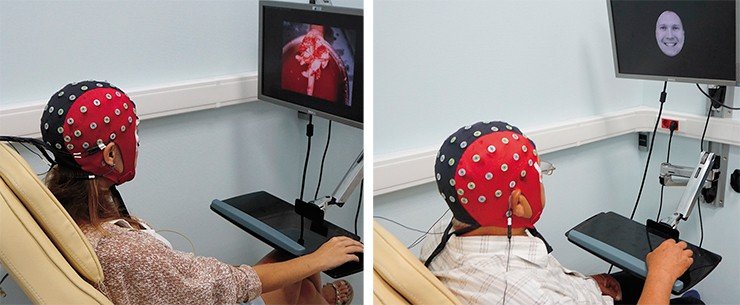
Примером такого подхода к диагностике эффективности терапии может служить исследование, запланированное в рамках САЕ «Нейронауки в трансляционной медицине» НГУ. Речь идет об использовании в качестве динамического маркера уровня нейрональной пластичности характеристик обонятельного эпителия верхних носовых ходов пациента, который в то же время является периферическим звеном обонятельного анализатора головного мозга и содержит полноценные мозговые нейроны. Образцы такого эпителия легко получить с помощью простой амбулаторной биопсии.
Далее открываются широкие возможности: мы можем оценить характер и динамику процессов нейрональной пластичности в ответ на специфическую лекарственную терапию по изменению уровня содержания таких маркеров, как нейротрофический фактор мозга (BDNF) или мРНК. Более того, из обонятельного нейронального эпителия можно получать стволовые клетки – предшественники нейронов, культивировать их и использовать для тестирования лекарственных препаратов. В результате в будущем мы сможем оценивать адекватность назначенного медикаментозного лечения уже через несколько дней (а не недель) после начала лечения. Пилотное исследование на эту тему мы уже выполняем в рамках гранта РНФ.
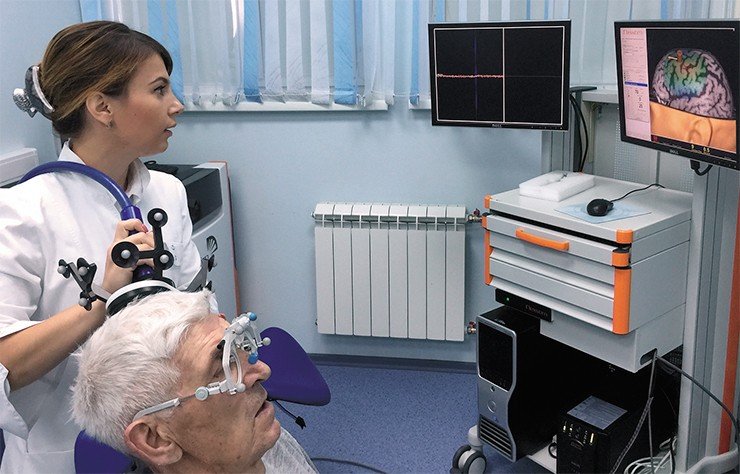
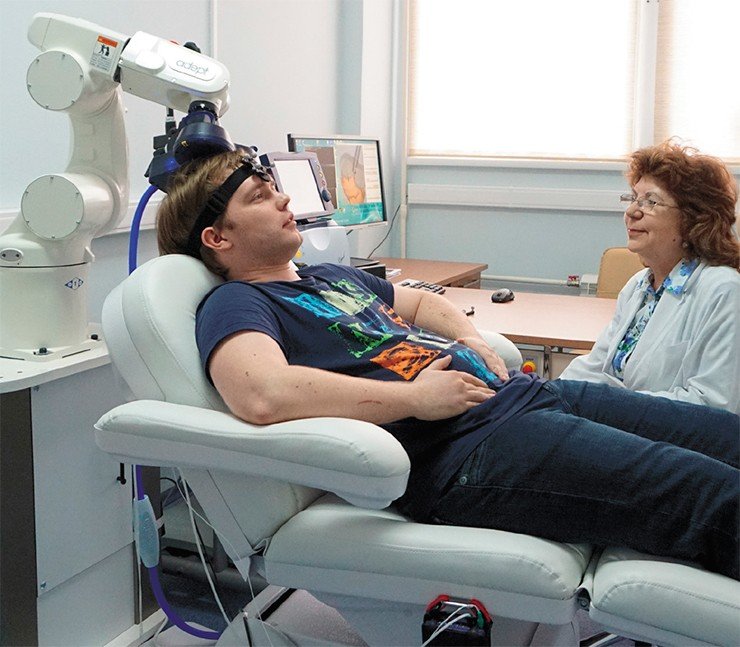
Если же пациент с депрессией в принципе не отвечает на «лечение таблетками», то сегодня есть возможность прибегнуть к альтернативному лечению – навигационной транскраниальной стимуляции головного мозга (ритмической магнитной, постоянным или переменным током и др.), которая является лидирующим трендом в современной клинической нейронауке. Эффективность этих неинвазивных методов в случае лекарственной устойчивости достаточно высока. Лечение персонифицировано, так как все «координаты» мозга пациента, отсканированного с помощью МРТ, передаются в навигационную компьютерную систему. С помощью этой системы можно с высокой (до 1 мм) точностью позиционировать катушку над специализированными участками коры больших полушарий, участвующих в процессах развития депрессий и нейродегенеративных заболеваний, и направить туда стимулирующие импульсы.
В США такой метод стимуляции мозга официально зарегистрирован в качестве нефармакологической технологии терапии депрессий. В принципе, вся линейка подобных технологий разработана и в лаборатории аффективной, когнитивной и трансляционной нейронауки НИИФФМ, и сейчас мы активно работаем над их усовершенствованием и внедрением в клиническую практику специализированной клиники нашего института.
Вступаем в игру
Несмотря на отдельные достижения, с точки зрения представленности аппаратных клинических нейротехнологий наша страна на карте мира в целом выглядит пока как пустыня. Тем более важно, что благодаря усилиям новосибирских и московских исследователей из ведущих научных центров в России создаются первые «оазисы» подобных технологий.
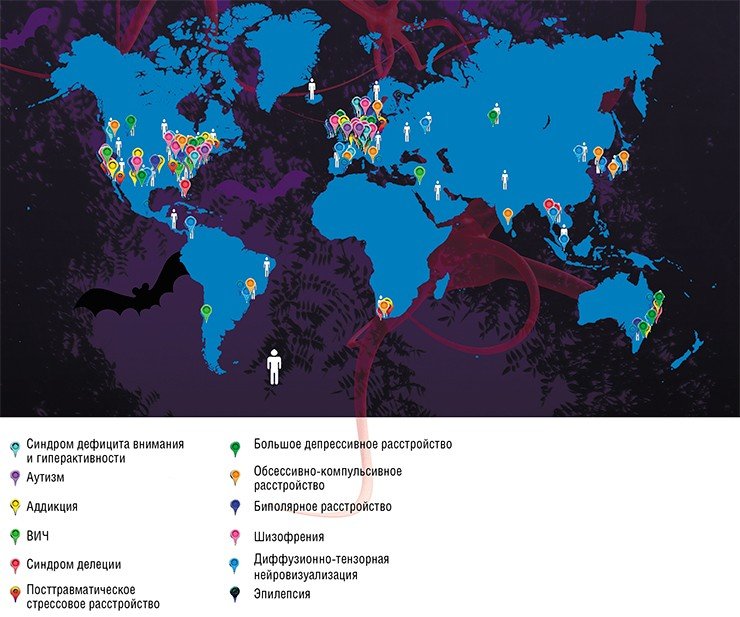
Стратегические академические единицы (САЕ) – это научно-образовательные консорциумы университета, которые объединяют исследователей, ведущих поиск в актуальных научных направлениях, а также активно участвующих в образовательной деятельности. Одна из основных задач САЕ «Нейронауки в трансляционной медицине» Новосибирского государственного университета – исследования механизмов нейропластичности мозга, ухудшение которой является общей чертой депрессий и других аффективных и нейродегенеративных заболеваний, разработка современных технологий прогнозирования риска возникновения этих патологий и индивидуальной чувствительности к терапии. «Под зонтиком» САЕ лаборатории НГУ будут работать в тесном контакте с исследовательскими организациями из Новосибирского научного центра и сибирского региона, включая академические институты СО РАН и новосибирские технопарки, с лидирующими нейроцентрами Москвы – в рамках больших «сквозных» проектов НТИ «НейроНет», а также с зарубежными партнерами. Среди последних – Университет Южной Калифорнии (США), где успешно развиваются новые технологии коммуникации человека с машиной (интерфейс «мозг-компьютер»), и крупнейший международный консорциум по исследованию мозга ENIGMA
В дальнейшем большую роль в развитии нашей страны должна сыграть Национальная технологическая инициатива (НТИ) «НейроНет». В ее основе лежит концепция, что следующий этап развития интернета будет базироваться на основе нейрокомпьютерных интерфейсов, а сами компьютеры станут похожими на мозг благодаря использованию гибридных цифроаналоговых архитектур. В центре внимания созданного в рамках этой инициативы проекта CoBrain, призванного обеспечить преодоление технологических барьеров и консолидацию научных и внедренческих ресурсов РФ, лежат исследования, связанные с расширением ресурсов мозга человека, в первую очередь за счет его прямой интеграции с техническими информационно-аналитическими комплексами и робототехническими устройствами. Предполагается, что это станет основой грядущей технологической революции.
В рамках этого проекта планируется создать не менее десяти НейроНет-центров (ННЦ), основными структурными компонентами которых станут научно-исследовательские лаборатории мирового класса. Такое объединение поможет создать единую базу нейроданных (Big Data).
Международный консорциум ENIGMA объединяет исследователей свыше 70 научно-клинических организаций для сбора и анализа огромных массивов данных геном-ассоциативных исследований головного мозга в норме и при нейропсихиатрических заболеваниях. Исследователи объединены в более чем 30 тематических рабочих групп. Первым российским участником этого глобального проекта стал НИИ физиологии и фундаментальной медицины со своей специализированной «А1 клиникой». В кооперации с томским НИИ психического здоровья институт входит в группу ENIGMA-MDD, занимающуюся изучением большого депрессивного расстройства. Задача этой группы – синтез данных нейрогеномики и функциональной МРТ, полученных у больных с БДР. В настоящее время российские ученые также занимаются исследованиями в рамках рабочей группы ENIGMA-PD, которая работает с пациентами с болезнью Паркинсона
Кластер в Новосибирске должен был начать работу уже в 2016 г., но его открытие было перенесено проектным офисом НТИ на 2017 г. по техническим причинам. Предполагается, что новосибирский НейроНет-центр объединит всех основных научных «игроков»: САЕ «Нейронауки в трансляционной медицине» НГУ, институты СО РАН, новосибирские технопарки, медицинские клиники и НИИ, а также зарубежные и международные научно-исследовательские организации, в том числе консорциум ENIGMA.
Научная продукция лабораторий, входящих в состав НейроНет-центров, будет разрабатываться с прицелом на рынок по самым разным направлениям: нейромедицина, нейрообразование, нейрокоммуникации и нейромаркетинг, нейроразвлечения и т. п. Обязательная компонента всех НейроНет-центров – образовательная. Причем ориентироваться они будут даже не на студентов, а на более молодое поколение, используя клубы юных технологов и бизнес-акселераторы, которые будут рождаться в новом информационном поле. Примером такого подхода может служить созданная в 2016 г. Научно-техническая проектная лаборатория НГУ «Инжевика», где будущие нейротехнологи могут заниматься робототехникой и компьютерными технологиями.
В рамках научно-образовательного консорциума САЕ «Нейронауки в трансляционной медицине» в НГУ уже сделаны первые практические шаги.
Вложения в нейронауки оцениваются сегодня в миллиарды долларов. Так, в последнее десятилетие XX в., объявленное «декадой мозга», Конгресс США выделил на исследования в этой области около 3 млрд долларов. Для сравнения: на исследование генома человека в это же время было выделено около 3,7 млрд долларов; символично, что два этих важнейших научных проекта шли параллельно (Зельман, 2016)
В первую очередь это создание кафедры нейронаук и лаборатории трансляционной и клинической нейронауки, которые начали активно работать в 2017 г. Проблема в том, что современные достижения наук, занимающихся исследованиями мозга, сейчас не встроены в традиционные клинические дисциплины, относящиеся к компетенциям врача-невролога, психиатра или психотерапевта. На новой кафедре будут разработаны спецкурсы для студентов медицинского факультета («Аффективная нейронаука: от нормы к психопатологии», «Биологическая психиатрия» и др.), которые дадут им возможность освоить основы клинической нейронауки.
Появятся новые учебные курсы и для студентов немедицинских факультетов. Целесообразно разработать обязательную общую программу, которая будет знакомить будущих ученых с современными представленями о ментальном здоровье, способами сохранения креативного потенциала и т. д.
Следующим шагом должно стать создание клинической базы НГУ, которое начнется с проектирования учебно-научно-медицинского центра, где смогут работать не только студенты, от первокурсника до будущего магистра, но и специалисты со всего мира. На его базе планируется создание Центра ментального здоровья НГУ – современной нейроклиники, где здоровый человек сможет получить информацию о рисках возникновения того или иного нервно-психического заболевания или диагностировать скрытую патологию, а больной – помощь с позиций точной медицины.
Особое внимание сегодня привлекает и проблема аутизма. Постановка такого диагноза требует от врача, с одной стороны, определенной компетенции, с другой – понимания, что за этим должны последовать некие организационные решения, которые не всегда нравятся руководителям. Мы планируем активную работу в этой области, в первую очередь по организации первого в РФ масштабного мультицентрового исследования аутизма.
На 2018 г. запланировано создание при НГУ Центра экспериментальной патопсихологии и доказательной психотерапии параллельно с развертыванием Центра депрессии. Необходимость в этих структурах во многом определяется еще и тем, что достаточно большое число психотерапевтов не имеют психиатрического образования. Сегодня, оказывая помощь пациенту, они в большей степени используют технологии психологического консультирования. Между тем понять патогенетические нейробиологические процессы, лежащие в основе депрессии, может только психиатр, и их адекватная коррекция с помощью современных методов биологической психиатрии – только его прерогатива. При этом важная роль психотерапии в лечении таких больных не ставится под сомнение: речь идет о правильном сочетании методов.
Согласно последним данным, депрессия присутствует в структуре самых разных заболеваний: с теми или иными аспектами этой патологии вынуждены часто встречаться не только профессиональные психиатры, но и врачи общеклинической практики. Согласно надежным мультицентровым исследованиям, проводимым по единой методике одновременно в нескольких лечебных учреждениях, депрессия является одной из причин снижения иммунитета и, как следствие, служит важнейшим фактором риска развития многих соматических болезней, включая сердечно-сосудистые и онкологические. Более того, в некоторых случаях она играет роль «маски», долгое время «прикрывающей» скрыто текущий патологический процесс
Организация подобных образовательно-лечебных центров – цивилизованный способ реализации адекватного комплексного подхода к лечению депрессий и других аффективных патологий с использованием всего терапевтического арсенала психиатрии и доказательной психотерапии. Предполагается, что доходы от платных образовательных, медицинских и консультационных услуг в этой сфере к 2019 г. должны достигнуть более 200 млн руб. в год, т. е. эта научно-исследовательская программа должна стать самоокупаемой. В самой отдаленной перспективе – к 2021 г., планируется создать при НГУ самостоятельный Институт нейронаук со своей клинической базой. Соединив в одном месте все компетенции, мы, в конечном счете, получим главное – современного врача, который будет смотреть на пациента с точки зрения самых продвинутых представлений о здоровье, где элемент «нейро-» станет ведущим.
Бэйлок С. Мозг и тело. Как ощущения влияют на наши чувства и эмоции. М.: МИФ, 2015. 272 с.
Корб А. Как нейрофизиология помогает справиться с негативом и депрессией — шаг за шагом. М.: МИФ, 2016. 256 с.
Зельман В.Л. «Википедия мозга» против слабоумия, психических заболеваний и мозговых «катастроф» // НАУКА из первых рук. 2016. №1 (67). С. 18–23.
Aftanas L. I., Akhmetova O. A., Brack I. V. et al. Cognitive and affective strategies during gazing at one’s own face in patients with major depressive disorder // Psychophysiology. 2016. V. 53(1). P. 1–54.
Aftanas L. I., Golocheikine S. A. Human anterior and frontal midline theta and lower alpha reflect emotionally positive states and internalized attention: high-resolution EEG investigation of meditation // Neurosci. Lett. V. 310 P. 57–60.
Reva N. V., Pavlov S. V., Loktev K. V. et al. The influence of long term Sahaja Yoga meditation practice on emotional processing in the brain: an ERP study // Neuroscience. 2014. V. 281. P. 195–201.