немеют ноги при диабете 2 типа что делать
Что нужно знать о диабетической нейропатии
Диабетическая нейропатия — это осложнение диабета, которое приводит к повреждению нервной системы. Это прогрессирующее заболевание, и симптомы со временем ухудшаются.
Нейропатия возникает, когда высокий уровень холестерина или сахара в крови повреждает нервы в организме, вызывая различные симптомы.
Нервы координируют работу всего организма. Они позволяют людям двигаться, отправлять сообщения о том, как они себя чувствуют, и управлять автоматическими функциями, такими как дыхание.
Нейропатия обнаруживается у 1/3- 1/2 пациентов, страдающих СД, по данным Национального института диабета, желудочно — кишечных и почечных заболеваний (NIDDK).
В этой статье мы рассмотрим различные типы, эффекты и риски диабетической нейропатии.
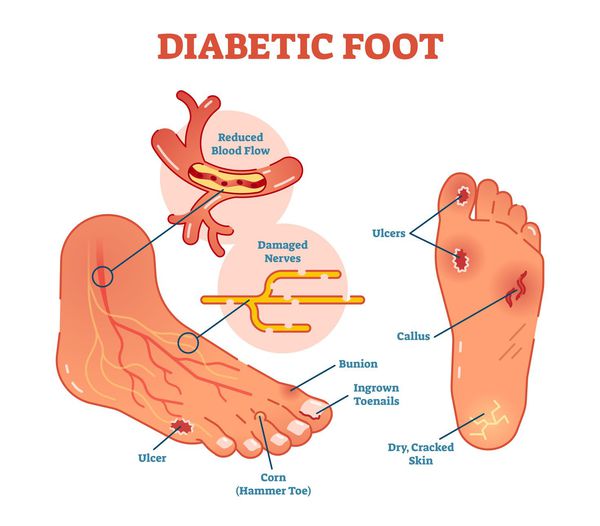
Периферическая нейропатия может привести к потере чувствительности в ногах.
Выделяют четыре основных типа нейропатии:
Симптомы нейропатии зависят от типа и пораженного нерва.
Симптомы
Признаки и симптомы диабетической нейропатии обычно появляются несколько лет после постановки диагноза Сахарный диабет
Периферическая невропатия
Симптомы периферической нейропатии включают в себя:
Периферическая нейропатия, которая поражает стопы, может мешать человеку стоять, что повышает риск падения.
Когда пациент не чувствут жару, холод или травму, это может привести к новым осложнениям.
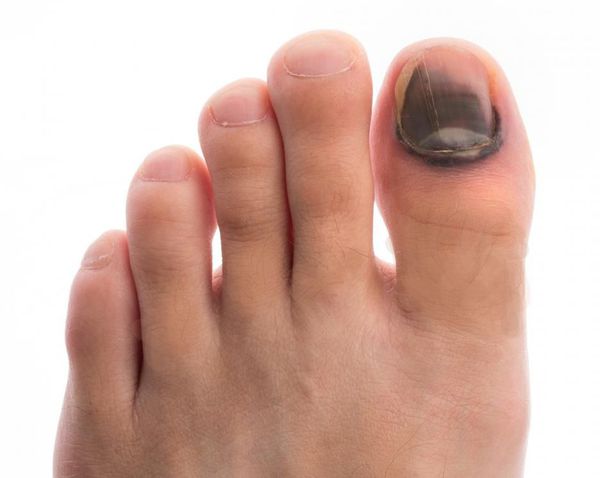
Например, волдырь на ноге может стать язвенным, потому что человек не чувствовал боли на ранних стадиях. По мере прогрессирования инфекции может развиваться гангрена.
В конце концов, ампутация бывает неизбежна.
Нажмите здесь, чтобы узнать больше о периферической невропатии.
Вегетативная нейропатия
Эффекты вегетативной невропатии включают в себя:
Другие типы
Проксимальная нейропатия может привести к боли в нижней части тела, часто, с одной стороны, и слабости в ногах.
Симптомы очаговой нейропатии могут широко варьироваться в зависимости от пораженного нерва. Фокальная нейропатия и черепная нейропатия могут привести к нарушениям зрения, таким как двойное зрение.
Лечение
Первым шагом в лечении полинейропатии является поддержание глюкозы крови в целевом диапазоне, согласованным врачом, и снижение высокого артериального давления и уровня холестерина.
Управление уровнем глюкозы сведет к минимуму риск диабетической нейропатии. Ключевой частью лечения является уменьшение боли и устранение некоторых симптомов.
Некоторые лекарственные препараты и физиотерапия могут помочь контролировать боль при диабетической нейропатии, наряду с другими методами лечения. Однако они не могут восстановить нервные клетки. Пациенты также должны бросить курить и ограничить потребление алкоголя максимум одной дозой в день для женщин и двумя для мужчин.
Лекарственные препараты
Выделяют ряд препаратов, которые могут помочь справиться с болью:
Употребление опиоидов может привести к зависимости, поэтому врачи должны назначать их как можно в меньшей дозе
Физиотерапия, применяемая в сочетании с медикаментами, может помочь облегчить боль и снизить риск зависимости от опиоидов.
Мануальный терапевт, массажист или остеопат может проводить регулярные массажи или мануальную терапию для растяжения мышц. Массаж может подавлять мышечные сокращения, судороги и атрофию из-за плохого кровоснабжения.
Специальные упражнения, такие как плавание или аэробика, могут помочь человеку развить и поддержать мышечную силу и уменьшить потерю мышечной массы.
Терапевтический ультразвук — это еще один вид физиотерапии, в котором ультразвуковые волны для стимуляции ткани под кожей. Это может помочь некоторым людям восстановить чувствительность в ногах.
Осложнения
Диабетическая нейропатия может привести к ряду осложнений высокого риска, начиная от изменений сердечного ритма и заканчивая нарушениями зрения.
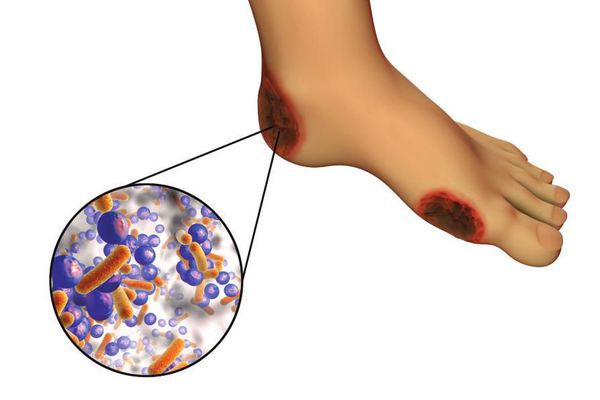
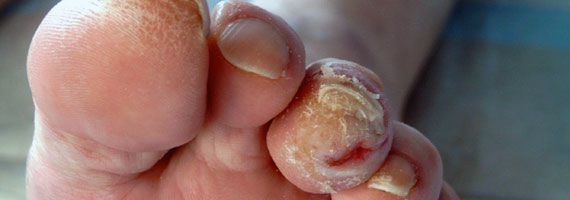
Возможные осложнения включают потерю чувствительности в ногах, что может привести к неспособности чувствовать порезы или язвы, и в результате может возникнуть инфекция. Не вылеченная инфекция конечности может привести к необходимости ампутации конечности
Чтобы предотвратить осложнения диабетической периферической невропатии, необходим особый уход за ногами. Пациенты с сахарным диабетом должны каждый день осматривать свои ноги на предмет повреждений или язв.
Курение также увеличивает риск проблем с ногами у людей с диабетической нейропатией
Резюме
Диабетическая нейропатия — это тип повреждения нервов, которые возникают у людей, страдающих диабетом.
Существует четыре типа: вегетативная, периферическая, проксимальная и очаговая нейропатия.
Диагностика включает в себя ряд сканирований и тесты на лодыжечные рефлексы, ощущения, а также текстуру и тон кожи.
Лечение включает в себя несколько видов физиотерапии и лекарств для контроля боли и нервной проводимости.
Поскольку люди с диабетической невропатией, как правило, не чувствуют травм ног, необходимо регулярно осматривать ноги, чтобы избежать необнаруженной инфекции и возможной потери конечностей.
Диабетическая невропатия: диагностика, лечение
Обследование голеностопного сустава
Диабетическая невропатия является одним из распространенных осложнений диабета. Повреждение нервов приводит к повреждению различных частей тела. Пациент должен быть очень внимателен,, чтобы не пропустить это осложнение. Невропатия может протекать бессимптомно в течение многих лет.
Сегодня поговорим о его диагностике и методах лечения диабетической невропатии.
Основные направления диагностики
Эндокринолог ставит диагноз невропатия на основании симптомов и результатов обследования. В первую очередь он измеряет давление, частоту сердечных сокращений, мышечную силу, рефлексы, чувствительность к изменениям положения, температуры, вибрации, легким прикосновениям.
При диабете в первую очередь контролируется состояние ног
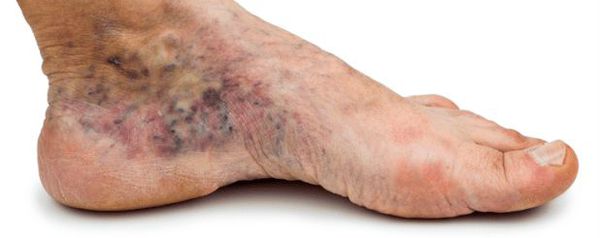
При нефропатии первыми повреждаются лодыжки. Диабетик должен проверять состояние лодыжки не реже одного раза в год, а если диагностируется периферическая невропатия — еще чаще.
Тщательное обследование голеностопного сустава предполагает обследование кожи, мышц, костей, кровообращения и чувствительности. Чувствительность изучается с помощью специальной щетки или легким нажатием острого предмета. Потеря чувствительности увеличивает риск растяжений и язв на лодыжке, и при диабете их трудно вылечить.
При необходимости проверяется, как ноги пациента воспринимают температуру и вибрацию.
Другие исследования
Врач также может посчитать необходимыми другие обследования:
Регулирование уровня глюкозы — единственный вариант лечения нефропатии
Первым шагом в лечении является регулирование уровня глюкозы, что также является единственным способом предотвращения повреждения нервов. Этот метод требует регулярного контроля, правильного питания и физической активности. В зависимости от состояния, эти меры могут быть дополнены таблетками, влияющими на уровень глюкозы или инсулином.
Если уровень глюкозы резко возрастет, признаки нейропатии ухудшатся. В этом случае глюкозу необходимо снижать как можно скорее — признаки невропатии могут не ослабевать сразу, но со временем состояние обязательно улучшится.
В зависимости от типа повреждения нерва и жалоб, о которых сообщалось, эндокринолог также использует другие методы лечения, улучшающие симптомы.
Управление болью
Облегчить боль при нефропатии помогают многие обезболивающих препараты. При сильных болях назначают комбинацию нескольких лекарств. Для этой цели используются антидепрессанты, противосудорожные препараты, опиоиды и другие лекарства, хотя все они имеют побочные эффекты. Некоторые из болеутоляющих средств не рекомендуются для пожилых людей и людей с заболеваниями сердца. Что касается безрецептурных болеутоляющих средств (парацетамол, ибупрофен), некоторые специалисты не советуют пациентам принимать их, потому что для снятия нейропатической боли их недостаточно, но они имеют серьезные побочные эффекты.
» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/%D0%91%D0%BE%D0%BB%D0%B5%D1%83%D1%82%D0%BE%D0%BB%D1%8F%D1%8E%D1%89%D0%B8%D0%B5-%D0%BF%D1%80%D0%B5%D0%BF%D0%B0%D1%80%D0%B0%D1%82%D1%8B.jpg?resize=900%2C600&ssl=1″ alt=»Болеутоляющие препараты» width=»900″ height=»600″ srcset=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?w=900&ssl=1 900w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?resize=450%2C300&ssl=1 450w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?resize=825%2C550&ssl=1 825w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/02/Болеутоляющие-препараты.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Болеутоляющие препараты
Для облегчения боли также используются наружные средства, особенно эффективные для применения на лодыжках. Врач может выписать крем, содержащий капсаицин, лидокаин, спрей нитрат и др. У некоторых пациентов состояние облегчается альфа-липолевой кислотой, эндотрахеальным маслом и другими средствами.
Для пациентов с повышенной чувствительностью ступней и прикосновениям, например, одеяла, используют специальное устройство — раму, которая удерживает одеяло в воздухе.
Некоторые пациенты снимают боль с помощью иглоукалывания, био-коммуникации, физиотерапии. Но влияние электростимуляции на нервную боль, магнитотерапию, лазеротерапию и фототерапию до сих пор не изучено.
Другие проблемы
Уход за ногами при диабетической нефропатии
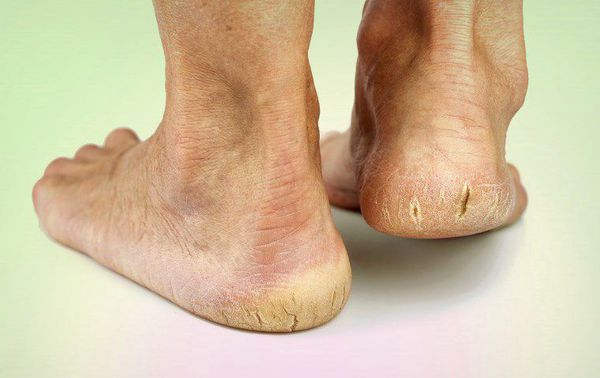
Люди с диабетической невропатией должны особенно заботиться о ногах. Нервы лодыжки — самые длинные нервы в организме, и нейропатия чаще всего повреждает именно их.
Когда пациент теряет чувствительность лодыжки, он не может воспринимать травму, и может не заметить зараженную область и начало инфекции. Если пациент курит, риск травмирования голеностопного сустава и ампутации увеличивается, поэтому решающее значение имеет отказ от табака.
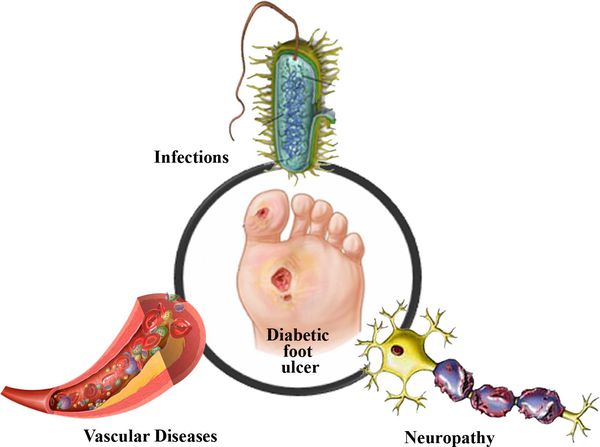
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 36 лет.
Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [1]
Главная причина ДС — это Сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «Сахарный диабет» должен помнить о таком грозном возможном осложнении.
СДС развивается в разной степени и разных формах:
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-«мозолью» в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
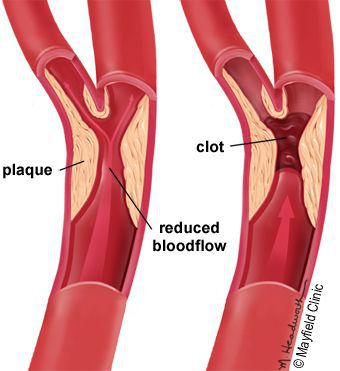
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
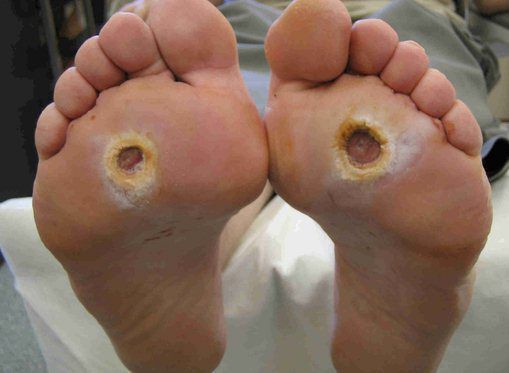
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
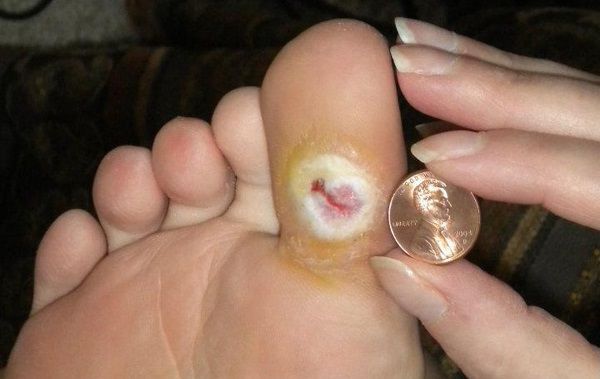
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую патологическую последовательность:
Таки образом, при СДС происходит повреждение всех тканей нижней конечности.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
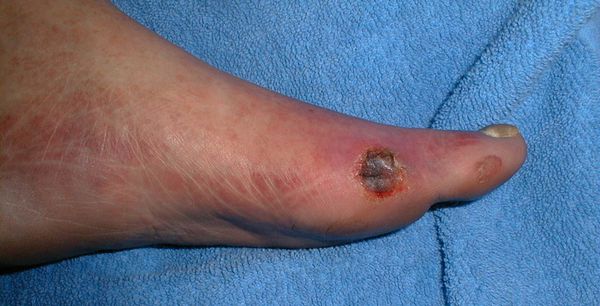
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
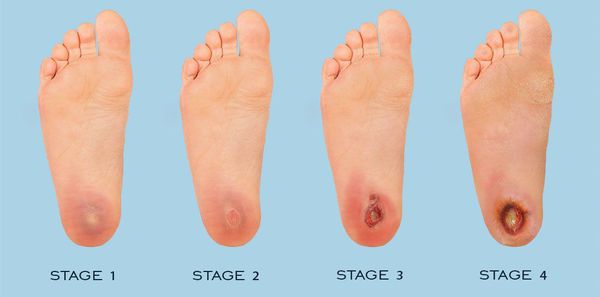
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Почему немеют ноги при сахарном диабете и что делать?
Игнорировать этот симптом нельзя, т.к. он ведет к опасным для жизни последствиям.
Зная причины происхождения данного заболевания и применяя правильные методы лечения можно предотвратить прогрессирование болезни и навсегда избавиться от онемения в области стоп, голеней и икроножных мышц.
Почему немеют ноги при сахарном диабете?
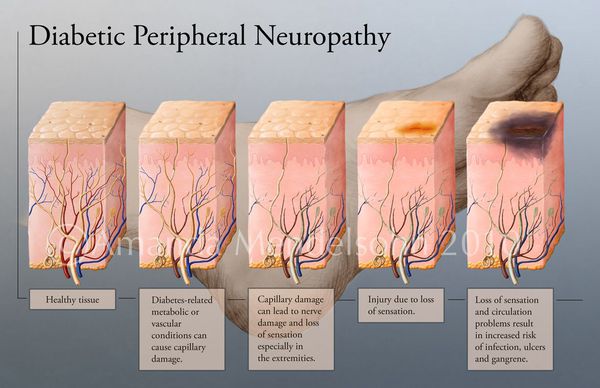
Онемение пальцев ног при диабете, лечение которого начинается с выяснения причин заболевания, связано с развитием нейропатии.
Кровеносные сосуды работают с повышенной нагрузкой и не обеспечивают нормальное снабжение тканей конечностей кровью и кислородом. Также наблюдается отмирание нервных окончаний, перестающих передавать нервные импульсы.
В результате этих процессов снижается чувствительность, что приводит к возникновению онемения. Первым признаком нейропатии является жалоба пациента на то, что у него болят и немеют ноги ступни при диабете.
Локализация этих дискомфортных ощущений начинается, как правило, с пальцев, постепенно двигаясь к коленям.
Еще одной причиной, почему появляются боли в ногах при сахарном диабете, врачи называют ухудшение метаболизма, а именно нарушения процесса связывания белка.
При этом образуются токсичные соединения, которые пагубно влияют на нервы, разрушая их оболочку. Пациент при этом чувствует покалывание и выкручивание в области пальцев.
Нейропатию и негативное действие токсинов усугубляют следующие факторы:
Онемение конечностей часто встречается на стадии диабетической стопы. В этом случае причиной недуга является нейропатия совместно с ишемией.
Покалывание в ногах при диабете и другие симптомы
Онемение пальцев стопы, требующее серьезного лечения, начинается с появления менее выраженных симптомов:
Вначале симптомы проявляются только после интенсивных физических нагрузок или наоборот при малоподвижном образе жизни. Неприятные ощущения человек испытывает, как правило, в ночное время. Также часто при диабете отекают ноги, что провоцирует и усугубляет болезненные симптомы.
Почему опасно если немеют стопы ног при сахарном диабете?
Отсутствие адекватного лечения приведет к поражению большего количества нервных окончаний. Если пренебрегать прописанным лечением, то пациент столкнется с хроническим нарушением двигательной функции конечностей, что часть становится причиной инвалидности у диабетиков.
Онемение пальцев ног при сахарном диабете, лечение которого способствует предотвращению развития осложнений, приводит к другим тяжелым последствиям:
При диабете немеют ноги: что делать для лечения?
Лечением рассматриваемого симптома занимаются врачи-невропатологи и флебологи.
Лечебный курс включает в себя:
При отсутствии кожных повреждений и отеков рекомендуется лечебный массаж ног. После процедуры массажа необходимо использовать натуральные крема для ног при диабете, предотвращающие появление сухости и ороговения эпидермиса.
Кликните по картинке ниже, чтобы узнать подробнее о мазях для диабетиков и заказать их с доставкой на дом или по почте.
Немеют ноги при сахарном диабете: лечение народными средствами
Чем лечить онемение ног при сахарном диабете дома? Существует действенный способ, который помогает снять боли и уменьшить ощущение скованности и онемения.
Рецепт ванночки для ног: 1 литр нежирного молока + 0,5 литра теплой (не горячей!) воды + 50 г меда + 50 г морской соли. Все компоненты смешать в тазике или кастрюле до полного растворения. Опустить ноги в полученный раствор на 15-30 минут.
Данная процедура особенно эффективно перед сном, когда дискомфортные ощущения мешают уснуть. Однако, как и другие методы лечения диабетической стопы на дому, этот способ не заменяет полноценного лечения.
Использовать его можно для временного облегчения болей или в качестве дополнительного средства к назначенному лечебному курсу.
Важно! Если у вас немеют пальцы ног при сахарном диабете, то использовать горячие травяные ванночки категорически запрещается. Также нельзя применять народные средства в основе которых лежит использование перца и других жгучих растений.
Немеют ноги при сахарном диабете: что делать для профилактики?
Профилактика онемения в конечностях должна начинаться сразу после обнаружения диабета. Во многом она сводится к своевременному лечения нейропатиии и нарушений кровотока. Кроме этого пациенту рекомендованы массаж и ежедневные водные процедуры.
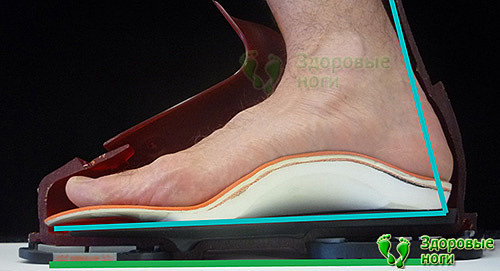
Эффективным средством профилактики является ношение качественной, удобной обуви с которой необходимо обязательно использовать стельки для разгрузки ног. Разгрузка стоп позволяет избежать сдавливания самых нижних вен и предотвращает деградацию нервных волокон.
Вот эти диабетические стельки отлично подходят для регулярной носки в качестве профилактического средства онемения ног и диабетической стопы.
В нашем интернет-магазине собраны самые эффективные и современные средства для ног при диабете. Мы осуществляем доставку по всей России курьером на дом, в пункты выдачи заказов и почтой. Кликните на картинку ниже и узнайте подробнее.
Лечение болевой формы диабетической полинейропатии
Диабетическая дистальная симметричная сенсорно-моторная полинейропатия (ДПН) — самый частый вариант диабетической нейропатии, который выявляется более чем у 50% больных с сахарным диабетом (СД) 1-го и 2-го типа.
Диабетическая дистальная симметричная сенсорно-моторная полинейропатия (ДПН) — самый частый вариант диабетической нейропатии, который выявляется более чем у 50% больных с сахарным диабетом (СД) 1-го и 2-го типа [1]. ДПН является второй по частоте встречаемости причиной нейропатической боли (НБ). Распространенность ДПН варьирует в зависимости от используемых диагностических критериев. Частота нейропатии, диагностируемой на основании симптомов, составляет около 25%, а при проведении электронейромиографического исследования — 100% у больных СД [2].
Диагноз ДПН основывается на тщательно собранном анамнезе, неврологическом обследовании, электрофизиологическом исследовании. Типичными симптомами являются ощущение «бегания мурашек», жжения, боли в голенях и стопах, ночные судороги мышц. При неврологическом обследовании выявляются ослабление ахилловых рефлексов, нарушение чувствительности по типу «носков» и «перчаток», снижение проприоцептивной чувствительности. При несвоевременно начатом лечении и неэффективности терапии развиваются такие осложнения ДПН, как язвы стоп, которые могут приводить к некрозу, гангрене (диабетическая стопа) и часто к ампутациям. Пациенты с СД нуждаются в ежегодном неврологическом и клиническом обследовании стопы [3].
Общепризнано, что основной причиной развития ДПН является повышенный уровень глюкозы [4]. Соответственно, единственным подтвержденным методом лечения, способным замедлять и даже в некоторой степени обращать прогрессирование ДПН, является хороший контроль уровня гликемии у больных с инсулинзависимым СД. У пациентов с интенсивной терапией СД (3 или более инъекции инсулина в день либо выполнение непрерывной подкожной инфузии инсулина с помощью дозатора инсулина (уровень HbA1c в диапазоне 6,5–7,5)) наблюдалось достоверное снижение риска развития микрососудистых осложнений и нейропатии [5]. Интенсивное лечение сульфонилмочевинами пациентов с инсулинонезависимым типом СД также приводило к снижению частоты и прогрессирования нейропатии [6]. Однако только достижение нормогликемии не способно быстро ликвидировать клинические проявления ДПН. В связи с этим требуется дополнительное патогенетическое и симптоматическое лечение, особенно для купирования болевого синдрома.
К препаратам патогенетического действия относится альфа-липоевая (тиоктовая) кислота (Эспа-липон, Тиоктацид, Тиогамма, Тиолепта). Эти препараты являются золотым стандартом патогенетического лечения ДПН. Альфа-липоевая кислота является мощным липофильным антиоксидантом. Тиоктовая кислота, накапливаясь в нервных волокнах, снижает содержание свободных радикалов; увеличивает эндоневральный кровоток; нормализует содержание NO, регулятора расслабления сосудистой стенки (если его много, как при СД, то он начинает действовать как свободный радикал); улучшает эндотелиальную функцию; снижает уровень общего холестерина, увеличивает уровень антиатерогенной фракции липопротеинов высокой плотности. В ряде исследований показано, что применение альфа-липоевой кислоты в дозе 600 мг/день в/в или перорально в течение от трех недель до шести месяцев уменьшает в клинически значимой степени главные симптомы ДПН, включая боль, парестезии и онемение [7, 8]. Оптимальным считается назначение в начале лечения внутривенного капельного введения альфа-липоевой кислоты (600 мг на 200 мл физиологического раствора) в течение 3 недель (15 капельниц) с последующим приемом 600 мг препарата в виде таблеток (один раз в день за 30–40 минут до еды) в течение 1–2 месяцев.
К препаратам, которые улучшают метаболизм пораженных нервных структур, традиционно относятся витамины группы B, что обусловлено их нейротропными свойствами. Витамин B1 участвует в синтезе ацетилхолина, а В6 — в синтезе нейромедиаторов, передаче возбуждения. Витамин В12 улучшает трофику периферических нервов. Показана высокая эффективность препарата Мильгамма драже в комплексном лечении ДПН. В его состав входят 100 мг бенфотиамина и 100 мг пиридоксина. Препарат назначается по одному драже 2–3 раза в сутки в течение 3–5 недель. Важно, что Мильгамма содержит бенфотиамин, липидорастворимость которого является причиной достижения высокой концентрации тиамина в крови и тканях.
Данные об эффективности и профиле безопасности позволяют рассматривать альфа-липоевую кислоту и бенфотиамин как препараты первой линии патогенетически ориентированной терапии диабетической полинейропатии [9].
В двух мультицентровых плацебо-контролируемых исследованиях 1335 пациентов с ДПН показано, что прием ацетил-L-карнитина в дозе 1000 мг 3 раза в день в течение 6 и 12 месяцев значительно уменьшал симптоматику ДПН [10].
Направление патогенетической терапии является чрезвычайно важным и во многом предопределяет прогноз. Однако лечение проводится длительными курсами и не всегда сопровождается быстрым очевидным клиническим улучшением. В то же время даже при негрубой ДПН может иметь место выраженный болевой синдром, приводя к нарушениям сна, депрессии, тревоге и социальной дезадаптации. Именно поэтому параллельно с патогенетической терапией чрезвычайно важно проводить своевременную симптоматическую терапию НБ.
Хочется сразу подчеркнуть, что простые анальгетики и нестероидные противовоспалительные препараты в лечении болей при ДПН не рекомендуются из-за их неэффективности [11]. К сожалению, в мире более 60% больных с НБ по-прежнему получают эти препараты, что недопустимо и чрезвычайно опасно при длительном применении (осложнения со стороны желудочно-кишечного тракта (ЖКТ), печени и крови). Основными группами препаратов для лечения НБ при ДПН являются: антидепрессанты, антиконвульсанты, опиоиды, антиаритмические средства, средства местного действия.
Трициклические антидепрессанты (ТЦА) стали одними из первых препаратов, которые продемонстрировали свою эффективность в лечении пациентов с НБ [12]. Тем не менее в России зарегистрирован только один ТЦА — амитриптилин, который используется для лечения НБ (постгерпетическая невралгия, ДПН). Считается, что обезболивающее действие ТЦА связано с ингибированием ими обратного захвата серотонина и норадреналина, следствием чего является усиление нисходящей активности норадренергических и серотонинергических систем, оказывающих тормозящее влияние на проведение болевых импульсов по ноцицептивным путям в ЦНС.
Помимо блокирования обратного захвата серотонина и норадреналина ТЦА блокируют альфа1-адренергические, Н1-гистаминовые, М-холинергические рецепторы, что обусловливает целый ряд противопоказаний и побочных эффектов, ограничивающих их применение. Среди побочных эффектов наблюдаются нарушение зрения, сухость во рту, синусовая тахикардия, запор, задержка мочи, спутанность сознания и/или нарушение памяти (антихолинергические эффекты); седативный эффект, сонливость, увеличение веса (Н1-гистаминовые эффекты); ортостатическая гипотензия, головокружение, тахикардия (альфа1-адренергические эффекты) [13]. ТЦА противопоказаны больным с острым и подострым инфарктом миокарда, с нарушением внутрижелудочковой проводимости, с закрытоугольной глаукомой, принимающими ингибиторы моноаминоксидазы (ИМАО). Эти препараты следует применять с осторожностью пациентам с ишемической болезнью сердца (ИБС), аритмией, артериальной гипертонией, после инсульта, а также с задержкой мочи или вегетативной недостаточностью. Данное обстоятельство существенно ограничивает применение ТЦА в общемедицинской практике.
Эффективность применения ТЦА (амитриптилин, дезипрамин, кломипрамин, имипрамин) при лечении болевой формы ДПН показана в ряде рандомизированных плацебо-контролируемых исследований [14]. Наиболее распространенными препаратами этой группы, применяемыми для лечения болевых полинейропатий, являются амитриптилин и имипрамин [15]. Наиболее широко используется амитриптилин. Начальная доза препарата составляет 10–12,5 мг на ночь, затем дозу постепенно увеличивают на 10–25 мг каждые 7 дней до достижения эффекта (максимально до 150 мг/сут). Суточную дозу принимают однократно на ночь или дробят на 2–3 приема. При сопутствующей депрессии обычно требуется назначение более высоких доз препарата. При непереносимости амитриптилина возможно назначение других ТЦА, например имипрамина или кломипрамина. Пробное лечение антидепрессантами должно продолжаться как минимум 6–8 недель, при этом максимально переносимую дозу пациент должен принимать не менее 1–2 недель. Хотя амитриптилин эффективен примерно у 70% больных с НБ, выраженные побочные эффекты ограничивают его применение. Перед назначением любого ТЦА обязательно предварительное проведение ЭКГ, особенно у лиц старше 40 лет.
При плохой переносимости ТЦА возможно применение тетрациклических антидепрессантов (например, мапротилина, 25–100 мг/сут) или селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) (венлафаксина, 150–225 мг/сут, или дулоксетина, 60–120 мг/сут) [16]. Эффективность венлафаксина неоднократно доказана в ходе исследований, включавших пациентов с ДПН [17, 18], при этом у него отсутствуют постсинаптические эффекты, свойственные для ТЦА (действие на М-холинорецепторы, альфа-адренергические и гистаминовые рецепторы). Это делает препарат более безопасным, чем ТЦА. Наступление противоболевого эффекта отмечено уже на второй неделе терапии [19].
Таким образом, венлафаксин является эффективным, безопасным, хорошо переносимым лекарственным средством при лечении ДПН. В трех мультицентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях длительностью от 12 до 13 недель показана эффективность применения дулоксетина в дозе от 60 до 120 мг/сут у больных с болевой ДПН. В результате исследований обнаружено 50% снижение интенсивности боли при лечении дулоксетином (вне зависимости от применяемой дозы) у 41% больных, по сравнению с 24% пациентов, принимавших плацебо [20].
Селективные ингибиторы обратного захвата серотонина (СИОЗС) (флуоксетин, пароксетин, сертралин, циталопрам, эсциталопрам) вызывают меньше побочных действий, но оказывают менее отчетливый противоболевой эффект, что, возможно, объясняется отсутствием прямого влияния на норадренергическую передачу. Они показаны, главным образом, в тех случаях, когда боль связана с депрессией, а больной плохо переносит другие антидепрессанты [16].
Поскольку НБ часто сопровождается депрессией, актуальным является выбор препарата, эффективно воздействующего на это психопатологическое состояние и обладающего хорошим профилем безопасности. Одним из таких препаратов является пипофезин (Азафен) [21]. Механизм антидепрессивного действия основан на неизбирательном ингибировании обратного захвата серотонина и норадреналина, что приводит к увеличению их концентрации в ЦНС. Препарат не обладает кардиотоксическими свойствами. В связи с отсутствием холинолитического действия Азафен можно назначать больным глаукомой и другими заболеваниями, при которых противопоказано применение препаратов, обладающих холинолитической активностью, в том числе имипрамина и амитриптилина. Отсутствие выраженных побочных явлений позволяет назначать препарат больным с соматическими заболеваниями и лицам пожилого возраста, прежде всего, в амбулаторной практике.
Среди антиконвульсантов, применяемых при лечении болевой ДПН, наиболее эффективными являются габапентин (Нейронтин) и прегабалин (Лирика) [22, 23]. Механизм действия габапентина и прегабалина, по-видимому, основан на способности связываться с альфа-2-дельта-субъединицами потенциалзависимых кальциевых каналов периферических сенсорных нейронов. Это приводит к снижению входа кальция в пресинаптический нейрон, в результате чего уменьшается высвобождение главных медиаторов боли (глутамата, норадреналина и субстанции Р) перевозбужденными нейронами, что сопровождается редукцией болевого синдрома. Оба препарата обладают хорошей переносимостью и высокой эффективностью, наблюдаемой уже на 1-й неделе лечения. Наиболее частыми побочными эффектами являются головокружение и сонливость. Начальная доза габапентина — 100–300 мг на ночь. Затем суточную дозу постепенно увеличивают каждые 3–5 дней на 100–300 мг, переходя на трехкратный прием.
Средняя эффективная доза составляет 1800 мг/сут (600 мг 3 раза в день), максимальная — 3600 мг/сут. На титрование дозы габапентина может уйти от 2 до 8 недель. Прежде чем делать вывод о неэффективности препарата, его максимально переносимую дозу следует принимать 1–2 недели. По показателям эффективности и безопасности прегабалин примерно соответствует габапентину, но в отличие от габапентина обладает линейной фармакокинетикой, что обеспечивает предсказуемость изменений концентрации препарата в плазме крови при изменении дозы. Диапазон суточных доз преагабалина — 150–600 мг/сут в 2 приема.
При лечении болевой ДПН стартовая доза может составлять 150 мг/сут. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сут через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сут) через 7-дневный интервал. В соответствии с опытом применения препарата, при необходимости прекращения приема рекомендуется постепенно снижать дозу в течение недели. Прегабалин быстрее всасывается в кровь и обладает более высокой биодоступностью (90%) по сравнению с габапентином (33–66%). Вследствие этого препарат эффективен в меньших дозах и обладает меньшей частотой и выраженностью побочных эффектов, в особенности седации [22, 23].
Использование опиоидов для лечения болевых синдромов возможно только при отсутствии эффекта от других препаратов. Среди опиоидов наиболее эффективными при лечении болевой ДПН оказались оксикодон в дозе 37–60 мг/сут [24] и трамадол (препарат, обладающий низкой аффинностью к опиоидным μ-рецепторам и одновременно являющийся ингибитором обратного захвата серотонина и норадреналина). Лечение трамадолом начинают с дозы 50 мг на ночь (или 25 мг 2 раза в день), спустя 5–7 дней дозу увеличивают до 100 мг/сут. При необходимости дозу повышают до 100 мг 2–4 раза в день. Пробное лечение трамадолом должно продолжаться не менее 4 недель [25]. Опиоиды ценятся за их болеутоляющие свойства, но препараты этого класса вызывают в организме и чрезвычайно выраженные и опасные побочные эффекты.
Комбинация трамадола с парацетамолом (Залдиар) позволяет снизить дозу трамадола и тем самым риск побочного действия, не жертвуя анальгетическим эффектом [26]. При комбинации двух указанных препаратов, обладающих разным механизмом действия (механизм анальгетического эффекта парацетамола может быть связан с ингибирующим эффектом на центральный синтез простагландинов, возможно, за счет торможения ЦОГ-3), возникает эффект синергизма. Адекватное обезболивание при приеме комплекса препаратов наблюдается в 1,5–3 раза чаще, чем при применении каждого из соединений в соответствующих дозах.
Кроме того, для парацетамола и трамадола характерен взаимодополняющий фармакокинетический профиль, благодаря которому препарат быстро начинает действие — уже через 15–20 минут (за счет парацетамола) и длительное время поддерживает анальгетический эффект (за счет трамадола) [26]. В состав Залдиара входит низкая доза трамадола (в одной таблетке содержится 37,5 мг трамадола и 325 мг парацетамола), поэтому побочные эффекты при его применении возникают реже, чем при применении трамадола. Назначение препарата не требует длительного титрования дозы, лечение может быть начато с дозы 1–2 таблетки в день, в последующем доза может быть повышена до 4 таблеток в сутки.
Пероральный антиаритмический препарат мексилетин также относится к анестетикам. Считается, что мексилетин блокирует натриевые каналы, таким образом стабилизируя мембрану нейронов и блокируя передачу болевых импульсов. Испытания по применению мексилетина при НБ дают противоречивые результаты. В ряде случаев мексилетин значительно уменьшает боль, особенно при его применении в высоких дозах. Однако при этом чаще возникают побочные эффекты, в частности со стороны ЖКТ. Препарат следует применять с осторожностью при наличии в анамнезе сердечной патологии или выявлении нарушений при ЭКГ-исследовании [27].
В ряде исследований было показано, что применение местных анестетиков (кремов, гелей и пластыря (Версатис) с 5-процентным содержанием лидокаина или препаратов на основе экстрактов жгучего перца — капсаицина) было эффективным при лечении болевой формы ДПН [27, 28]. Эффект лидокаина основан на блокировании транспорта ионов натрия через мембрану периферических нейронов, в результате чего происходит стабилизация клеточной мембраны, замедляется распространение потенциала действия, а следовательно, уменьшается боль. Из побочных эффектов может наблюдаться местное раздражение кожи в области нанесения, которое чаще всего незначительно и быстро проходит. Действие препаратов капсаицина основано на истощении запасов субстанции Р в терминалях сенсорных волокон. Жжение, покраснение и зуд в месте нанесения являются наиболее частыми побочными эффектами, часто отмечается усиление боли при первом нанесении препарата.
Тем не менее ни одно лекарственное средство нельзя рассматривать в качестве единственного препарата для лечения боли при ДПН [29]. Нередки случаи, когда применение любого из перечисленных выше средств оказывается недостаточно эффективным и возникает потребность в комбинации препаратов. Поэтому хотя число одновременно принимаемых пациентом лекарственных средств по общему правилу следует стараться ограничивать, но в большинстве случаев НБ при ДПН удается адекватно контролировать лишь с помощью комбинации двух и более препаратов. Нерационально сразу же назначать комбинацию нескольких средств: первоначально следует испробовать один препарат, и лишь убедившись, что в переносимых данным пациентом дозах он оказывает лишь частичный эффект, к нему следует присоединить следующее средство, которое, как правило, обладает иным механизмом действия.
В клинической практике часто комбинируют антидепрессант с антиконвульсантом, антиконвульсант с трамадолом или Залдиаром. Рекомендуется избегать сочетания трамадола (особенно больших доз) с ИМАО, СИОЗС и СИОЗСН, так как подобная комбинация может спровоцировать серотониновый синдром. С осторожностью трамадол следует назначать в комбинации с трициклическими антидепрессантами (учитывая риск серотонинового синдрома) [30].
Нефармакологические методы лечения ДПН включают в себя психотерапию, бальнеотерапию, гипербарическую оксигенацию (1,2–2 атм.), фототерапию, магнитотерапию, электрофорез, диадинамические токи, электростимуляцию паретичных мышц, чрескожную электронейростимуляцию, иглорефлексотерапию. Противопоказанием к их применению является тяжелое состояние больного, обусловленное соматической патологией и/или тяжелая декомпенсация метаболизма. Рядом авторов показана высокая эффективность электростимуляции спинного мозга, используемой для лечения болевой диабетической нейропатии [31]. Как правило, имплантацию стимуляторов производят у пациентов с рефрактерными к фармакотерапии болевыми синдромами.
В заключение следует заметить, что лечение каждого пациента должно быть индивидуальным с учетом клинических особенностей, а также наличия коморбидных заболеваний (тревоги, депрессии, заболеваний внутренних органов и т. д.). При выборе лекарственных препаратов, помимо непосредственного анальгетического эффекта, должны быть учтены другие положительные эффекты выбранного препарата (уменьшение уровней тревоги, депрессии, улучшение сна и настроения), а также его переносимость и возможность развития серьезных осложнений.
Ряд авторов в качестве препаратов первого ряда при лечении болевых форм полинейропатий рекомендуют ТЦА и габапентин или прегабалин. К препаратам второго ряда относят СИОЗСН — венлафаксин и дулоксетин. Они обладают меньшей эффективностью, но более безопасны, имеют меньше противопоказаний по сравнению с ТЦА, и им должно быть отдано предпочтение при лечении больных с сердечно-сосудистыми факторами риска. Препараты третьей линии включают в себя опиоиды. К препаратам с более слабым эффектом относятся капсаицин, мексилетин, окскарбазепин, СИОЗС, топиромат, мемантин, миансерин [32].
Литература
*Первый МГМУ им. И. М. Сеченова, **МОНИКИ им. М. Ф. Владимирского, Москва