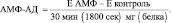недостаточность аденозинмонофосфата дезаминазы 1 что это
Недостаточность аденозинмонофосфата дезаминазы 1 что это
Маркер связан с особенностями развития скелетных мышц. Исследуется для выявления способности переносить продолжительные физические нагрузки.
Полиморфизм длин рестрикционных фрагментов.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 1p13.2
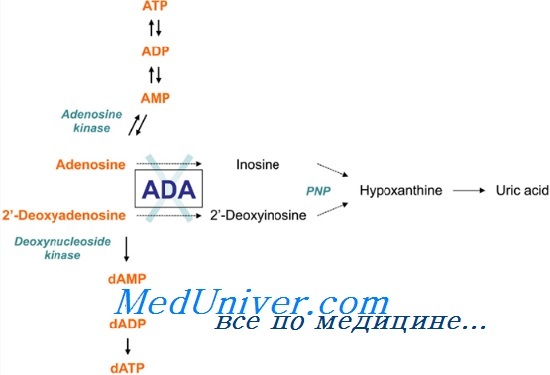
Ген AMPD1 кодирует аденозинмонофосфат-дезаминазу 1, специфичный для скелетных мышц белок, участвующий в регуляции энергетических процессов. Он катализирует дезаминирование аденозин монофосфата (АМР, англ. аdenosine monophosphate) до инозина монофосфата (IMP, англ. inosine monophosphate) и играет важную роль в цикле пуриновых нуклеотидов.
Генетический маркер C34T
Участок ДНК в составе гена AMPD1, в котором происходит замена цитозина (С) на тимин (Т) в позиции 34, называется генетическим маркером C34T. Если в данной позиции находится цитозин, такой вариант гена обозначается как С-аллель, а если тимин – Т-аллель.
В результате данной замены кодон, кодирующий аминокислоту глутамин, замещается на стоп-кодон и синтез белка на нем прекращается. Синтезируется укороченный белок, лишенный каталитической активности.
Встречаемость в популяции
Встречаемость аллеля Т в европейской популяции составляет 11 %.
Общая информация об исследовании
В регуляции энергетического обмена в живых организмах принимает участие фермент – аденозинмонофосфат-дезаминаза (АМФ-дезаминаза). У человека существует 3 изоформы АМФ-дезаминаз: ген AMPD1 кодирует M (muscle, мышечную) изоформу, ген AMPD2 кодирует L (liver, печеночную) изоформу и ген AMPD3 кодирует E (erythrocyte, эритроцитарную) изоформу белка АМФ-дезаминазы.
Ген AMPD1 кодирует аденозинмонофосфат-дезаминазу 1, специфичый для скелетных мышц белок, участвующий в регуляции энергетических процессов. Он катализирует дезаминирование аденозин монофосфата (АМР, англ. аdenosine monophosphate) до инозина монофосфата (IMP, англ. inosine monophosphate) и играет важную роль в цикле пуриновых нуклеотидов.
Специфическая для скелетных мышц изоформа АМФ-дезаминазы активируется при выполнении краткосрочных физических упражнений высокой интенсивности и является важным регулятором метаболизма мышечной энергии при физической нагрузке.
Сравнивая две группы людей, исследователи выявили, что частота генотипа Т/Т и аллеля Т ниже в группе спортсменов скоростно-силовых видов спорта, по сравнению с группой людей, не занимающихся спортом. Это говорит о том, что при становлении спортивного мастерства у атлетов происходит естественный отбор, который дает преимущества людям с благоприятными для спортивных достижений вариантами генов. Таким образом, аллель С гена AMPD1 можно считать маркером предрасположенности к скоростно-силовым видам мышечной деятельности. В то время как наличие в генотипе аллеля Т негативно сказывается на самочувствии человека при тяжелых физических нагрузках (может отмечаться слабость, быстрая утомляемость и мышечные судороги).
Результаты исследования должны интерпретироваться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Для данного маркера не существует понятия «норма» и «патология», т.к. исследуется полиморфизм гена.
Недостаточность аденозинмонофосфата дезаминазы 1 что это
Аденозиндезаминазы (АДА) — основной фермент пуринового метаболизма, катализирующий дезаминирование аденозина с образованием инозина и дезоксиаденозина с образованием дезоксиинозина. Недостаточность аденозиндезаминазы (АДА) — аутосомно-рецессивная болезнь, полностью вызываемая накоплением в лимфоцитах токсичных пуринов, особенно дезоксиаденозина.
Это приводит к выраженным нарушениями как клеточного, так и гуморального иммунитета, что делает недостаточность аденозиндезаминазы (АДА) одной из причин тяжелого комбинированного иммунодефицита. Нелеченые больные умирают от инфекции в первые два года жизни. Как обсуждается позже, есть сообщения об успешной генотерапии недостаточности АДА.
Методом выбора на сегодняшний день, тем не менее, остается пересадка костного мозга от полностью HLA-совместимого донора. При отсутствии подходящего донора костного мозга показана эффективность введения бычьего фермента аденозиндезаминазы (АДА).
Модифицированная аденозиндезаминаза
Оказывается, введение бычьей аденозиндезаминазы (АДА), модифицированной путем ковалентного присоединения инертного полимера ПЭГ, значительно превосходит использование немодифицированного фермента. Во-первых, ПЭГ-аденозиндезаминаза (АДА) вызывает выработку нейтрализующих антител лишь у незначительного количества больных.
Во-вторых, модифицированный фермент остается во внеклеточной жидкости, где он может расщеплять токсичные пурины. В-третьих, период полураспада ПЭГ-аденозиндезаминаза (АДА) в плазме крови составляет от 3 до 6 сут, что значительно превышает рассчитанный на животных моделях период полураспада немодифицированного фермента.
Заместительная терапия ферментом ПЭГ-аденозиндезаминаза (АДА) практически нормализует аномалии в метаболизме пурина. Хотя ПЭГ-аденозиндезаминаза (АДА) полностью не корректирует иммунный статус (у большинства пациентов сохраняется дефицит Т-клеток), иммунная защита существенно восстанавливается и наступает кардинальное клиническое улучшение. Эффективность лечения при пожизненном использовании до конца не установлена, но сам подход представляет важную терапевтическую стратегию.
Общие принципы, видимые на примере использования ПЭГ-аденозиндезаминаза (АДА):
1) белки могут химически модифицироваться с улучшением их эффективности;
2) ферменты, в норме располагающиеся в клетке, могут оказаться эффективными внеклеточно, если субстрат находится в равновесии с внеклеточной жидкостью и если продукт может быть усвоен нуждающимися в нем клетками.
Как видно, стратегия модификации может распространяться на белки, функционирующие только внутриклеточно, нацеливая белок в специфический тип клеток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
АМФ-дезаминаза (AMPD1). Выявление мутации C34T
Маркер связан с особенностями развития скелетных мышц. Исследуется для выявления способности переносить продолжительные физические нагрузки.
Локализация гена на хромосоме – 1p13.2
Ген AMPD1 кодирует аденозинмонофосфат-дезаминазу 1, специфичный для скелетных мышц белок, участвующий в регуляции энергетических процессов. Он катализирует дезаминирование аденозин монофосфата (АМР, англ. аdenosine monophosphate) до инозина монофосфата (IMP, англ. inosine monophosphate) и играет важную роль в цикле пуриновых нуклеотидов.
Генетический маркер C34T
Участок ДНК в составе гена AMPD1, в котором происходит замена цитозина (С) на тимин (Т) в позиции 34, называется генетическим маркером C34T. Если в данной позиции находится цитозин, такой вариант гена обозначается как С-аллель, а если тимин – Т-аллель.
В результате данной замены кодон, кодирующий аминокислоту глутамин, замещается на стоп-кодон и синтез белка на нем прекращается. Синтезируется укороченный белок, лишенный каталитической активности.
Возможные генотипы
Частота встречаемости в популяции
Частота встречаемости аллеля Т в европейской популяции составляет 11 %.
В регуляции энергетического обмена в живых организмах принимает участие фермент – аденозинмонофосфат-дезаминаза (АМФ-дезаминаза). У человека существует 3 изоформы АМФ-дезаминаз: ген AMPD1 кодирует M (muscle, мышечную) изоформу, ген AMPD2 кодирует L (liver, печеночную) изоформу и ген AMPD3 кодирует E (erythrocyte, эритроцитарную) изоформу белка АМФ-дезаминазы.
Ген AMPD1 кодирует аденозинмонофосфат-дезаминазу 1, специфичый для скелетных мышц белок, участвующий в регуляции энергетических процессов. Он катализирует дезаминирование аденозин монофосфата (АМР, англ. аdenosine monophosphate) до инозина монофосфата (IMP, англ. inosine monophosphate) и играет важную роль в цикле пуриновых нуклеотидов.
Участок ДНК в составе гена AMPD1, в котором происходит замена цитозина (С) на тимин (Т) в позиции 34, называется генетическим маркером C34T. Если в данной позиции находится цитозин, такой вариант гена обозначается как С-аллель, а если тимин – Т-аллель.
В результате данной замены кодон, кодирующий аминокислоту глутамин, замещается на стоп-кодон и синтез белка на нем прекращается. Синтезируется укороченный белок, лишенный каталитической активности.
Специфическая для скелетных мышц изоформа АМФ-дезаминазы активируется при выполнении краткосрочных физических упражнений высокой интенсивности и является важным регулятором метаболизма мышечной энергии при физической нагрузке.
Сравнивая две группы людей, исследователи выявили, что частота генотипа Т/Т и аллеля Т ниже в группе спортсменов скоростно-силовых видов спорта, по сравнению с группой людей, не занимающихся спортом. Это говорит о том, что при становлении спортивного мастерства у атлетов происходит естественный отбор, который дает преимущества спортсменам с благоприятными для спортивных достижений вариантами генов. Таким образом, аллель С гена AMPD1 можно считать маркером предрасположенности к скоростно-силовым видам мышечной деятельности. В то время как наличие в генотипе аллеля Т негативно сказывается на самочувствии человека при тяжелых физических нагрузках (может отмечаться слабость, быстрая утомляемость и мышечные судороги).
С другой стороны, была показана ассоциация наличия Т — аллеля в генотипе больных с ишемической болезнью сердца и сердечной недостаточностью и более редкой встречаемостью у них ожирения и диабета. То есть носительство генотипа С/Т или Т/Т является защитой от развития ожирения и диабета у таких пациентов. Аллель Т также ассоциирован с лучшей выживаемостью пациентов с ишемической болезнью сердца. Это связано с повышением концентрации аденозина в сердечной мышце, что защищает её во время ишемических событий и продляет пациенту жизнь.
Результаты исследования должны интерпретироваться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Для данного маркера не существует понятия «норма» и «патология», т.к. исследуется полиморфизм гена.
Литература
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
| Дефицит аденозинмонофосфатдезаминазы 1 типа | |
|---|---|
| Другие имена | Дефицит миоденилатдезаминазы |
 | |
| Аденозинмонофосфат | |
Генетическая форма AMPD1 вызвана дефектом генетического механизма производства AMP-дезаминазы, фермента, который превращает аденозинмонофосфат (AMP) в инозинмонофосфат (IMP). Хотя это заболевание поражает примерно 1-2% людей в группах населения преимущественно европейского происхождения, это расстройство, по-видимому, встречается значительно реже в азиатских популяциях.
СОДЕРЖАНИЕ
Симптомы и признаки
Возможные осложнения
Существует повышенный риск того, что статины (препараты, снижающие уровень холестерина) вызовут миопатию (мышечную слабость) у людей с MADD.
В большинстве случаев, когда миопатия присутствует с MADD, присутствует второе мышечное заболевание, и симптомы хуже, чем любое заболевание в отдельности.
Причины
Механизм
Эта неспособность дезаминировать молекулы AMP имеет три основных эффекта. Во-первых, значительные количества АМФ теряются из клетки и организма. Во-вторых, аммиак не освобождается, когда клетка работает. В-третьих, не поддерживается уровень IMP в ячейке.
Ниже приводится очень упрощенная модель того, что может происходить внутри мышечной клетки с дефицитом AMPD. Существует два основных полустабильных состояния: одно с доступным внутриклеточным гликогеном, а второе с истощением гликогена. Оба состояния изменяются тем, насколько снижен цикл лимонной кислоты по умолчанию.
В мышечных клетках с нормальной активностью AMPD пуриновый нуклеотидный цикл теперь начинает постепенно добавлять фумарат к пулу промежуточных продуктов цикла лимонной кислоты. Это снизит избыточную скорость производства пирувата за счет увеличения его потребления, увеличит скорость перезарядки АМФ до АТФ за счет цикла лимонной кислоты и, следовательно, уменьшит высвобождение глюкозы из гликогена, пока увеличение количества переносимого с кровью топлива не позволит остановить гликогенолиз. полностью.
В мышечных клетках с дефицитом AMPD скорость производства АТФ цикла лимонной кислоты не будет синхронизирована с потребностью в АТФ. Было продемонстрировано, что мышечные клетки, в которых отсутствует AMPD1, запасаются и потребляют значительно больше глутамата и производят больше аланина в этом состоянии по сравнению со здоровым контролем, что указывает на наличие более высокой концентрации пирувата в клетке во время упражнений. Пул АМФ также становится больше, чем в контроле, что может вызвать более высокую скорость высвобождения глюкозы из гликогена.
Это состояние может длиться до тех пор, пока доступен гликоген, и может быть продлено, если постоянно есть пищу, богатую углеводами. Если нагрузка на мышцы превышает способность организма перерабатывать лактат обратно в глюкозу, лактат начинает накапливаться в крови. Как только лактат достигает порога реабсорбции почками (5–6 ммоль / л у населения в целом), он выводится с мочой, тратя много калорий (и образуя яркие матово-желтые частицы на поверхностях, где высыхает моча). Примерно в то же время почки также начнут корректировать кислотность крови за счет подкисления мочи. Чрезмерно кислая моча вызывает раздражение, похожее на частые позывы к мочеиспусканию (с небольшим объемом) и «горячую» мочу.
Чтобы вывести лактат, почки также должны выделять магний в качестве обязательного катиона, что может привести к острому и хроническому дефициту магния. Дополнительный магний в форме лактата или цитрата может быть быстро потерян таким же образом. Поскольку магний необходим для аэробного метаболизма, со временем потеря магния может привести к порочному кругу, когда цикл лимонной кислоты еще больше снижается, производство лактата увеличивается, а потеря магния снова увеличивается.
Хотя это, вероятно, не связано с дефицитом AMPD, если у человека наблюдается высокий уровень d-лактата в крови (в основном из-за еды и брожения в толстой кишке), осадок, потеря лактата и потеря магния могут произойти даже раньше, чем l-лактат ( в основном из мышц) достигает порога почечной реабсорбции. Это происходит потому, что l-лактат и d-лактат конкурируют друг с другом за реабсорбцию почками, а также потому, что d-лактат имеет значительно более низкий порог реабсорбции почками, Диагностика
Диагноз MADD необходимо учитывать у пациентов, страдающих миалгией, судорогами, а иногда и слабостью, вызванными физической нагрузкой. Также может возникнуть умеренно повышенная креатинкиназа. Следует исключить другие мышечные заболевания, такие как болезнь Макардла и нарушения карнитинового цикла. MADD может быть идентифицирован, если после тестирования предплечья с физической нагрузкой не наблюдается повышения уровня аммиака. Затем диагноз может быть подтвержден генетическим тестированием.
Пациентам с MADD важно поддерживать силу и физическую форму, не тренируясь и не работая до изнеможения. Усвоить этот баланс может быть труднее, чем обычно, поскольку мышечная боль и усталость могут восприниматься иначе, чем у нормальных людей.
Симптоматическое облегчение последствий MADD иногда может быть достигнуто путем перорального приема рибозы в дозе приблизительно 10 граммов на 100 фунтов (0,2 г / кг) веса тела в день и, при необходимости, с модуляцией физических упражнений. Принимаемая ежечасно, рибоза является прямым, но ограниченным источником энергии для клеток. Пациенты с дефицитом миоаденилатдезаминазы не удерживают рибозу во время тяжелых упражнений, поэтому для восстановления уровня АТФ могут потребоваться добавки.
Моногидрат креатина также может быть полезен для пациентов с AMPD, поскольку он обеспечивает альтернативный источник энергии для анаэробной мышечной ткани и, как было обнаружено, полезен при лечении других, не связанных с ним мышечных миопатий.
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
7.2. Метод определения активности АМФ-дезаминазы
Фермент АМФ-дезаминаза (аденозинмонофосфат дезаминаза, КФ 3.5.4.6, AMPD) существует в нескольких формах: М (мышечная, AMPD1), L (печёночная АМРD2), Е (эритроцитарная, AMPD3). Тип М (AMPD1) специфичен для скелетной и сердечной мышц. Недостаточность миоаденилат дезаминазы – наиболее частая причина метаболических миопатий (мышечная слабость и подёргивания после физической нагрузки). Заболевание характеризуется мышечными болями при физической нагрузке, судорогами и/или быстрой утомляемостью.
Тип Е (AMPD3). Мутантные аллели широко распространены в Японии, Корее, Восточной Европе (носитель – каждый тридцатый житель). Клинические проявления недостаточности эритроцитарной формы фермента не обнаружены. Отсутствие активности изоформы AMФ-деаминазы эритроцитов было описано у пациентов с низким уровнем мочевой кислоты в плазме.
Определение активности АМФ-дезаминазы (С.О. Тапбергенов, С.М. Тапбергенова, 1984)
АМФ-дезаминаза (АМФ-ДА) – катализирует гидролитическое дезаминирование АМФ в ИМФ с освобождением аммиака (NH3). Метод определения активности этого фермента основан на количественном определении аммиака, освобождающегося при дезаминировании АМФ. По количеству освободившегося NH3 за 30 минут судят об активности ферментов. Количество аммиака определяется в среде инкубации без его предварительной отгонки с помощью цветной реакции Бертло. Из всех способов определения аммиака фенол нитропруссид гипохлоридная реакция Бертло, является наиболее чувствительной и специфичной и основана на реакции между фенолом и гипохлоридом в щелочной среде. Трис, его следы – подавляют развитие цветной реакции.
1. 0,05 М фосфатный буфер: 50 мл 0,2 М KH2PO4 + 39,2 мл 0,2 М NaOH до 200 мл дист. водой.
2. 0,2 М КН2РО4: 27,22 г – 1000 мл дист. воды или 13,61 г – 500 мл дист. воды.
3. 0,2 М NaOH: 8 г NaOH – 1000 мл дист воды или 4 г NaOH – 500 мл дист. воды.
4. 0,05 М MgCl2: 4,76 г MgCl2 – 1000 мл дист. воды или 2,38 г MgCl2 – 500 мл дист. воды.
5. 1М KCl: 74,56 г – 1000 мл дист. воды или 37,28 г – 500 мл дист. воды.
6. Реактив № 1: 5 г перегн. фенола + 62,5 мг нитропруссида натрия, до 500 мл дист. водой.
7. Реактив № 2: 50 г Na3PO4 12H2O + 10 мл гипохлорида Na до 500 мл дист. воды.
8. Приготовление гипохлорида натрия (NaClO) удобнее всего получать реакцией между продажной хлорной известью и углекислым натрием:
СаОСl2 + Na2CO3 = CaCO3 + NaClO + NaCl.
Тщательно размешивают 100 г хлорной извести с содержанием активного хлора 35–36 % с 170 мл дистиллированной воды в течение 15 мин и в смесь при непрерывном помешивании вносят раствор 70 г Na2CO3 (тех. сода) в 170 мл воды. Масса сначала густеет, затем опять разжижается. Жидкость отсасывают от осадка через полотняный фильтр. Получается 320 мл раствора гипохлорида натрия с содержанием активного хлора 71–100 г/л.
В день опыта приготовить:
1. Среда инкубации: 60 мл 0,05 М MgCl2 + 4,32 мл 1 М KCl + до 300 мл фосфатный буфер (рН – 7,4).
2. АМФ 0,75 %: 30 мг + 4 мл фосфатного буфера.
Для одного анализа необходимо 2 пробирки.
В первую пробирку вносят 1,5 мл среды инкубации, 0,1 мл биоматериала, 0,2 мл АМФ. (активности АМФ-дезаминазы).
Во вторую пробирку (контрольную) вносят 1,5 мл среды инкубации, 0,1 мл биоматериала (контроль ткани на содержание аммиака).
Все пробы инкубируют 30 мин при 37 °С, в термостате в течение 180 мин, затем быстро добавляют холодных реактивов № 1 и № 2 по 2 мл. Через 30 минут при 37 °С в термостате развивается устойчивая на протяжении 24 часов окраска, интенсивность которой пропорциональна количеству образовавшегося аммиака. Все пробы центрифугируют при 3000 об/мин, в течение 10 мин. Прозрачный надосадочный раствор колориметрируют на КФК при длине волны 540 нм, кювета 10 мм, против дист. воды.
Количество аммиака в пробе рассчитывают по калибровочному графику, который строят по стандартным растворам сернокислого аммония. С учетом разницы опыта и контроля рассчитывают активность фермента.
Активность выражают в нмоль аммиака на 1 мг белка. Метод отличается высокой чувствительностью и аналитической надежностью, но при его использовании следует соблюдать все правила работы с ферментами.
Расчет активности АМФ-дезаминазы
Удельная активность АМФ-дезаминазы, рассчитывается в нмолях аммиака (NH3 определяют по калибровочному графику), образовавшегося в 1 мин (или сек), при 37 °С на мг белка, по следующей формуле:
● единица измерения активности фермента: нмоль NH3, в мин на (мг) белка.