на что влияет вилочковая железа
Зачем человеку вилочковая железа?
Железа молодости
Какая функция у вилочковой железы? Владислав Владимирович, Минск.
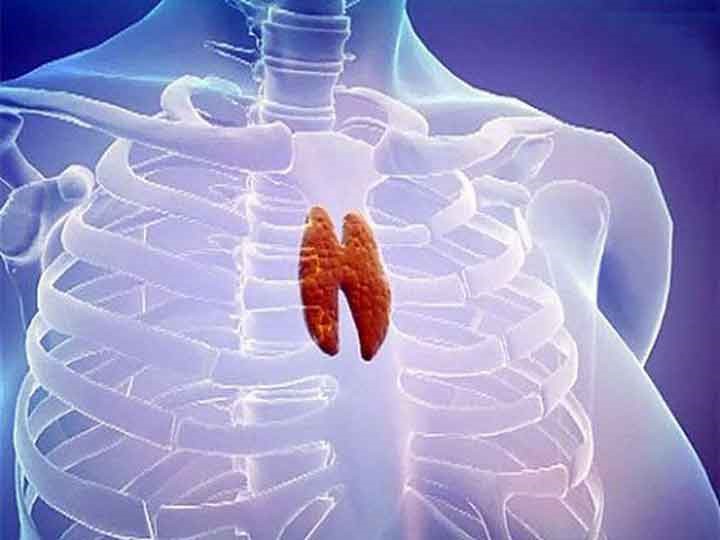
Вилочковая железа, или тимус, — один из наименее изученных органов человека. Она расположена в верхней части грудной клетки, сразу за грудиной. По своему виду напоминает двузубую вилку, за что и получила название вилочковой. В 60-х годах прошлого века было доказано, что она является главным органом иммунной системы и отвечает за развитие и дифференцировку “тимусных” клеток (Т-лимфоцитов).
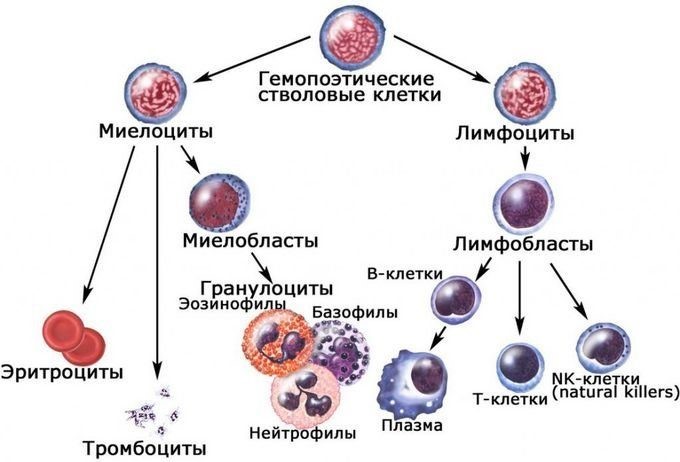
Лимфоциты — едва ли не самые главные клетки иммунной системы. Они делятся на две большие группы:
Т и В. В-лимфоциты отвечают за выработку антител (специальных белков крови, которые борются с бактериями и вирусами). Специализация этих клеток проходит в красном костном мозге, в основном в костях таза и ребрах. Есть еще Т-лимфоциты, на них возлагается обязанность уничтожать опухолевые клетки и поврежденные вирусами, находить и распознавать поврежденные клетки организма, не позволять своим собратьям нападать на здоровые ткани и так далее. При нарушении работы клеток этого типа возможно возникновение целого ряда аутоиммунных заболеваний, например, системной красной волчанки, ревматоидного артрита, аутоиммунного тиреоидита и других.
К интересной особенности вилочковой железы можно отнести то, что своего полного созревания она достигает в детском возрасте, но уже у подростков подвергается обратному развитию и атрофии. Этот процесс продолжается в течение всей жизни — у взрослых людей ткани тимуса в основном заменяются жировыми клетками, при этом количество лимфоцитов, находящихся там, значительно сокращается. Этот орган можно назвать железой нашей молодости. Если у взрослого человека не происходит угасания вилочковой железы, его организм более восприимчив к инфекционным болезням, повышается также риск развития онкологических заболеваний. Нарушение работы тимуса в детском возрасте тесно связано с возникновением иммунодефицита, патологией эндокринной и нервной систем.
Современная наука относит вилочковую железу к иммунной системе, но она вырабатывает еще и целый ряд гормонов. Тот факт, что эта железа у детей и подростков имеет относительно большие размеры, а у взрослых фактически исчезает, дает основание предположить, что она участвует в процессах роста организма. Проводимые ранее исследования показали, что подопытные животные с удаленным в раннем возрасте тимусом отставали в росте, у них нарушались процессы развития костной ткани. Но окончательно это не доказано, поэтому остается только ждать новых открытий в этой области.
Юрий Кузьменков, врач РНПЦ “Кардиология”
Сфера интересов доктора — терапия, кардиология, эндокринология.
Ждем ваших вопросов, друзья!
Заболевания вилочковой железы
11.05.2011 Вилочковая железа или тимус является важным органом иммунной системы, который в детском возрасте отвечает за формирование первичного иммунитета. Он расположен сразу за грудиной в переднем отделе средостения (средостение — пространство в грудной полости, ограниченное легкими с двух сторон) и частично распространяется на шею. У взрослых в 20-25 лет функционирование вилочковой железы прекращается, и она постепенно превращается в жировую клетчатку.
В тимусе могут появляться опухоли, кисты, метастазы рака других органов, лимфомы. Тимомы — наиболее часто встречающиеся опухоли вилочковой железы. Они могут прорастать в окружающие ткани или нет. По гистологическому строению тимомы относят к опухолям с неопределенным поведением.
Часто пациенты не предъявляют никаких жалоб, и тимомы оказываются случайной находкой при КТ исследовании грудной клетки. У некоторых пациентов появляются ряд симптомов (см. новообразования средостения).
Однако особым свойством заболеваний вилочковой железы, выделяющих их среди других новообразований, являются так называемые «паратимические синдромы». К ним относятся гипогаммаглобулинемия, гипоплазия красного костного мозга, дерматомиозит, системная красная волчанка, апластическая анемия, ревматоидный артрит и другие аутоиммунные заболевания. Однако наиболее распространенным из них является неврологическое заболевание – аутоиммунная миастения, которая встречается более чем у 40% больных тимомами.
Миастения — заболевание, которое характеризуется аутоиммунным поражением нервно-мышечного соединения, приводящим к затруднению или к полной блокаде передачи сигнала от нерва к мышечному волокну. Оно проявляется слабостью и патологической утомляемостью различных групп скелетной мускулатуры. Вилочковая железа у больного миастенией вырабатывает аутоантитела, блокирующие ацетилхолиновые рецепторы и, тем самым, передачу сигнала о движении от нерва к мышце.
Миастенический криз (развивается у 10-15% больных) — крайняя степень миастении, характеризующаяся быстрым усугублением двигательных расстройств, приводящих к нарушению дыхания и глотания. Если в это время не оказать больному экстренную помощь, возникает реальная угроза для жизни.
Некоторые лекарственные препараты могут провоцировать обострение миастении. К ним относятся некоторые антибиотики, β-адреноблокаторы, ботулотоксин, антагонисты кальция, курареподобные миорелаксанты, соли магния, лидокаин, прокаинамид, хинин, хинидин, рентгеноконтрастные средства, D-пеницилламин, дифенин, гормоны щитовидной железы, а также глюкокортикоиды.
При подозрении на миастению необходима консультация невропатолога и госпитализация в специализированную клинику, владеющую всем комплексом диагностических (в том числе КТ и МРТ) и лечебных возможностей, включая хирургическое лечение — удаление вилочковой железы (тимэктомия).
Для лечения тимом используют хирургический метод. Часто операцию можно выполнить торакоскопически, однако при больших размерах новообразования (более 8 см) используют стернотомию. При прорастании опухоли в соседние ткани и органы лечение следует продолжить лучевой терапией.
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
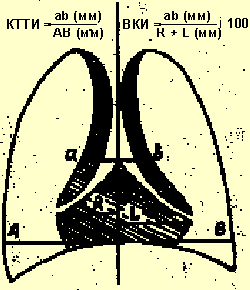 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
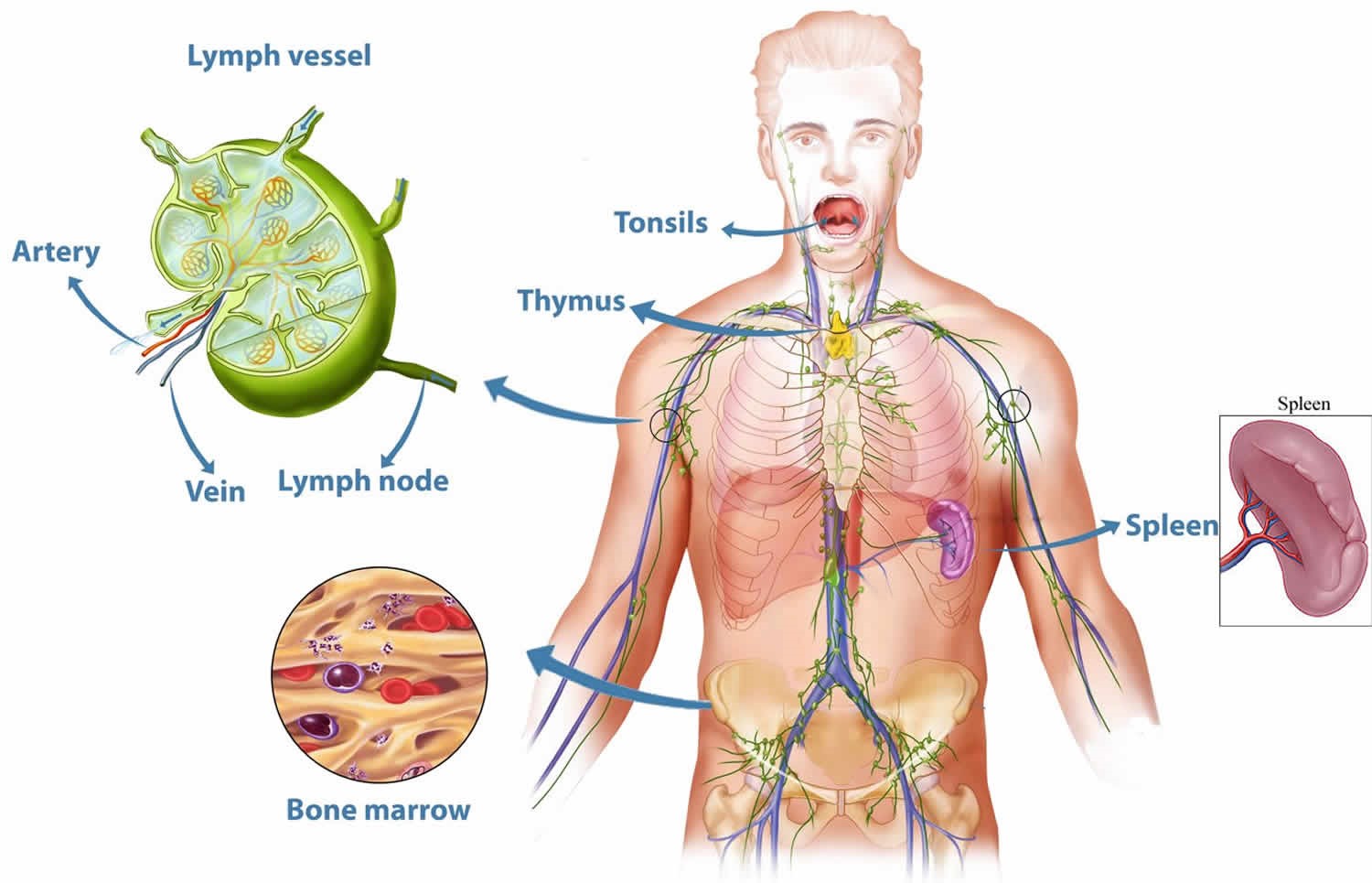
Иммунная система включает центральные и периферические органы.
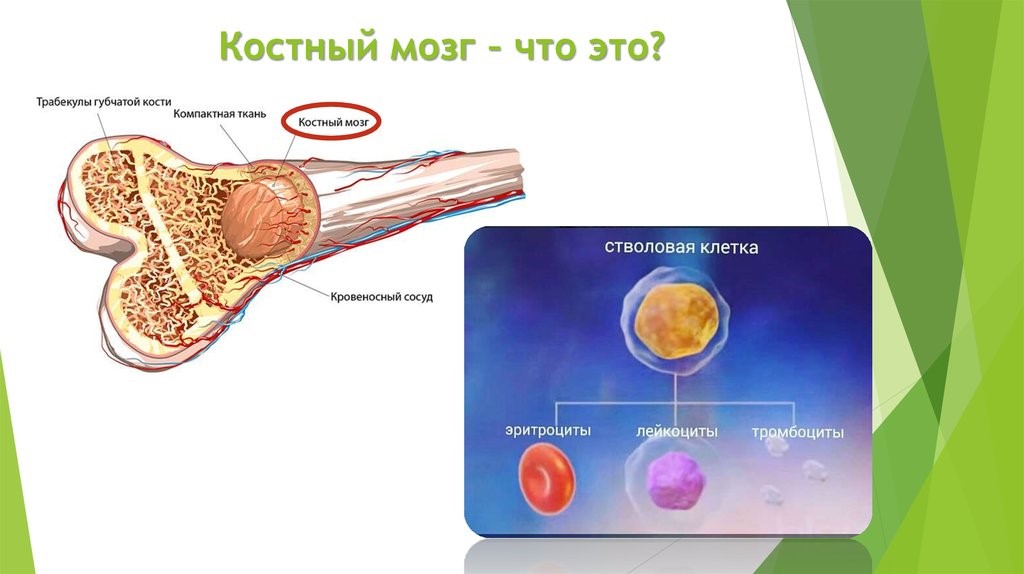
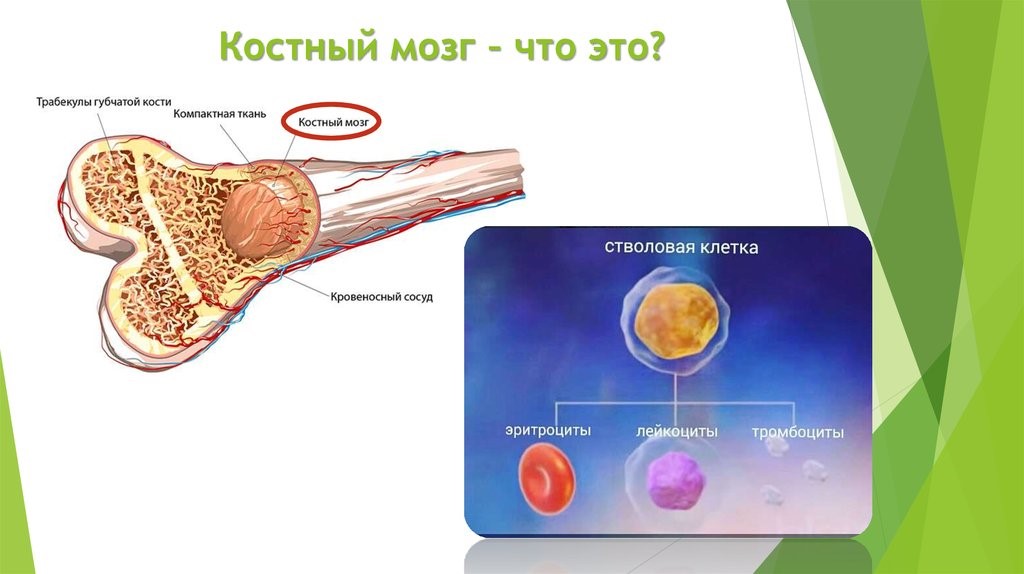
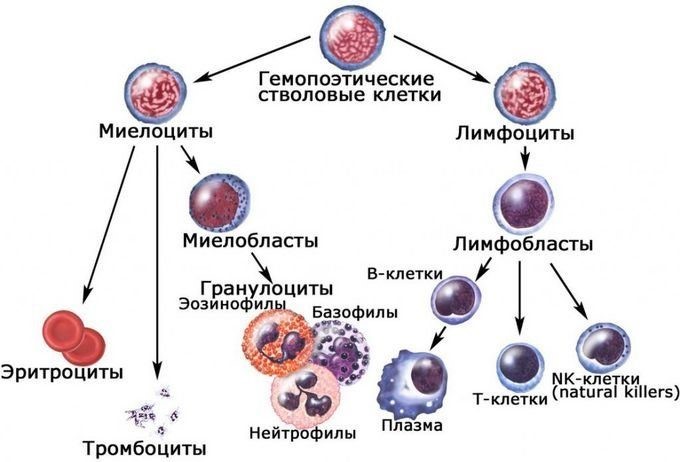
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
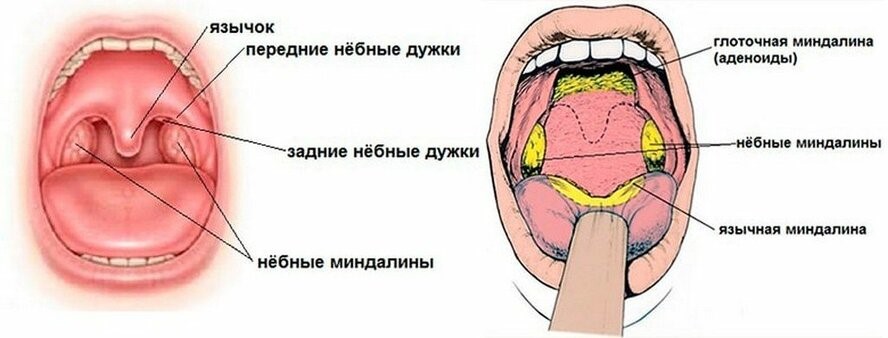
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
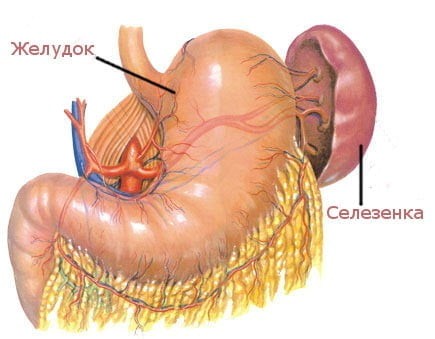
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
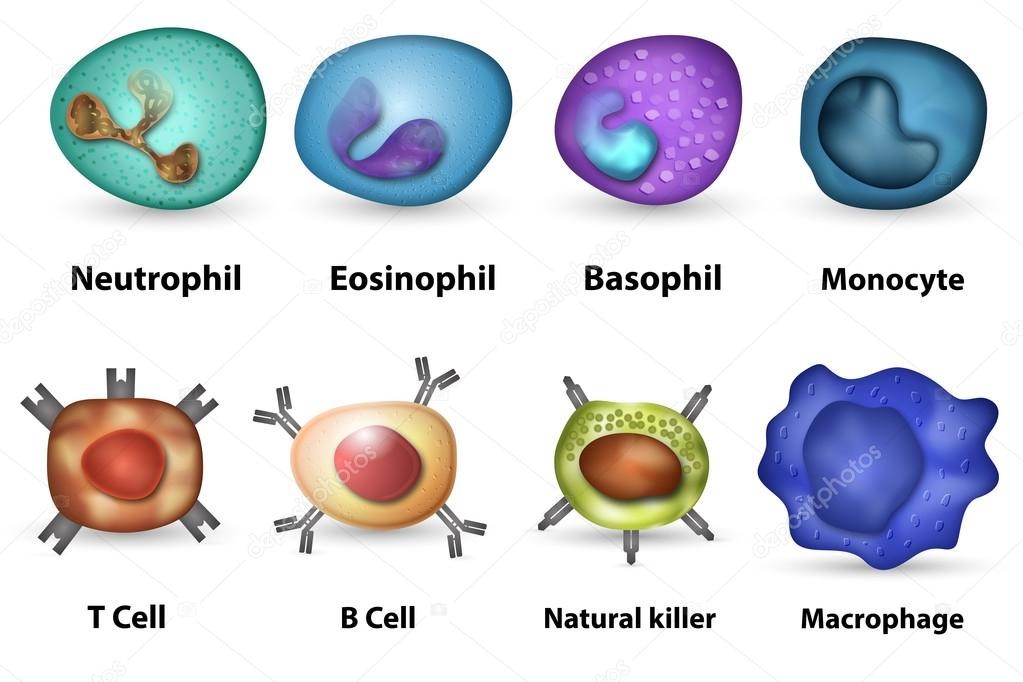
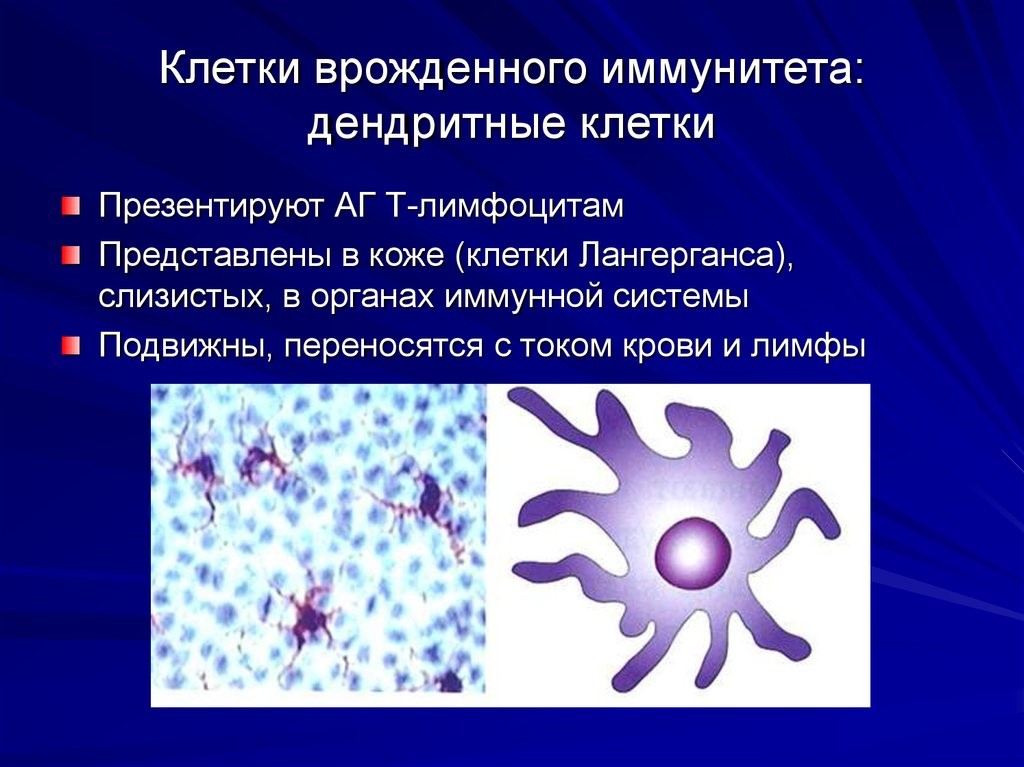
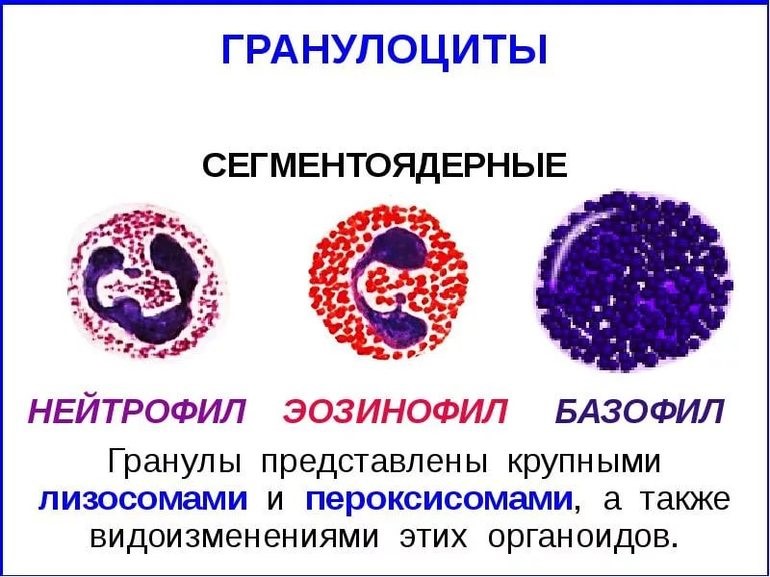
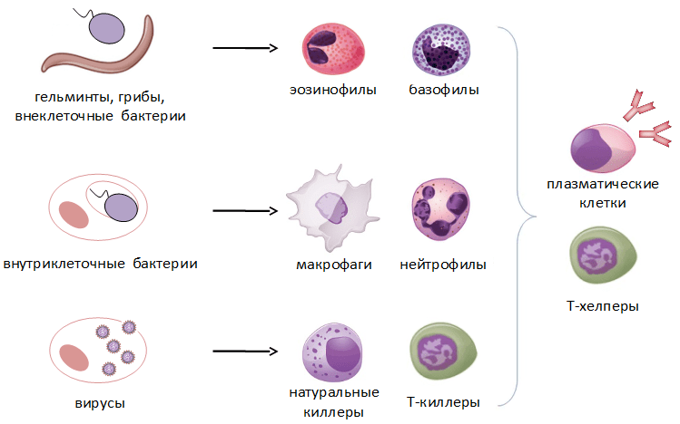
Врожденный иммунитет на клеточном уровне представляют:
Рис.8. Дендритная клетка и
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
Рис.10. Натуральный киллер
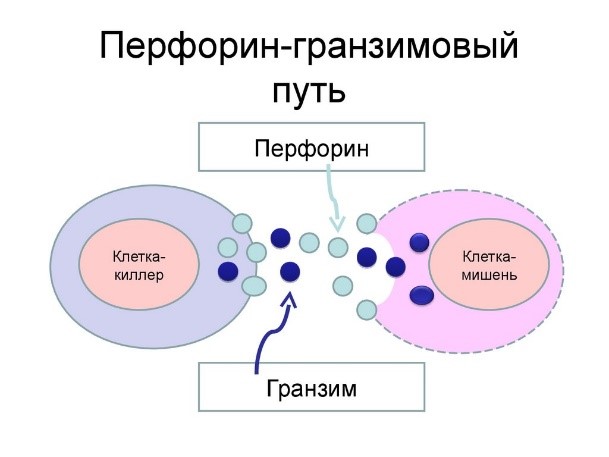
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
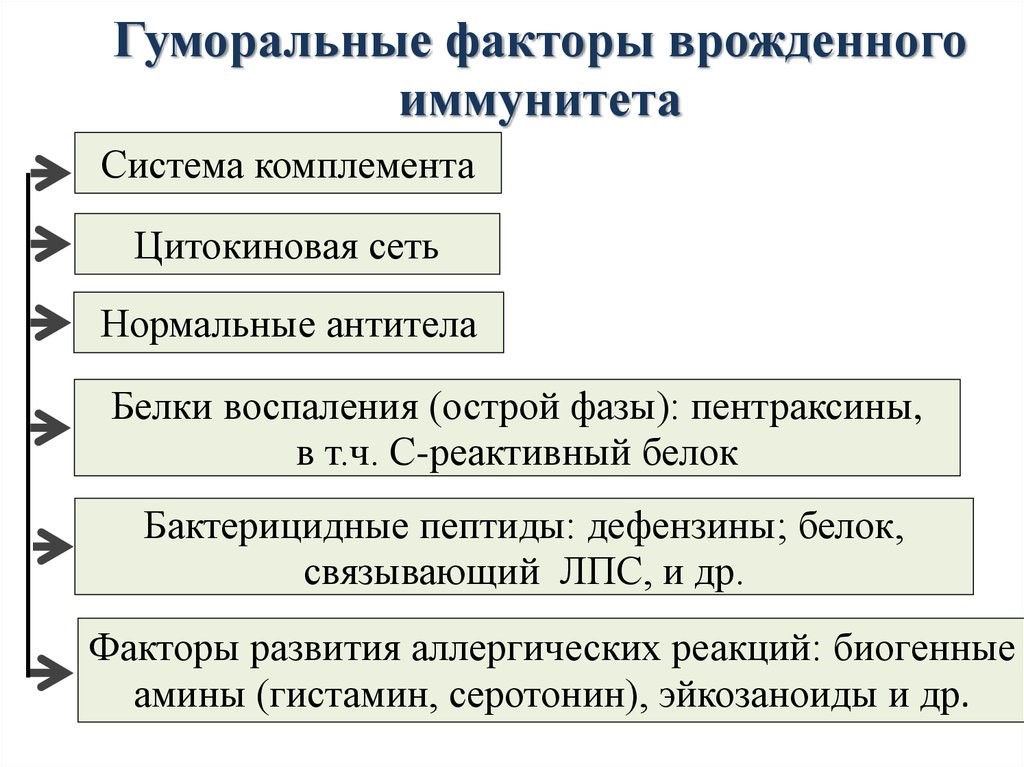
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
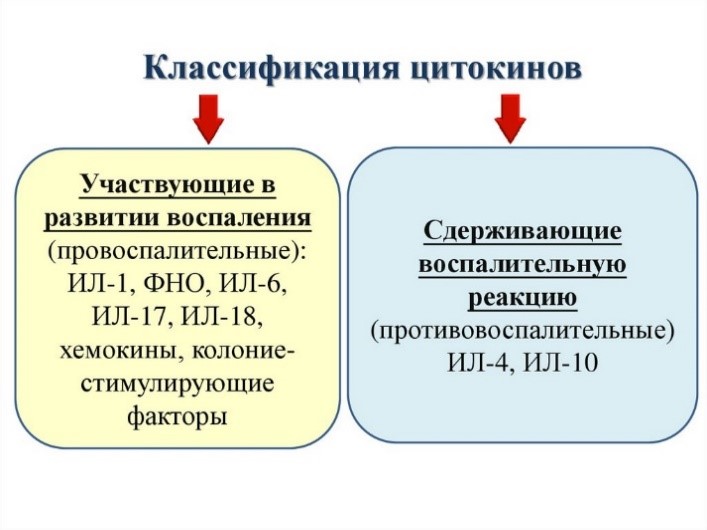
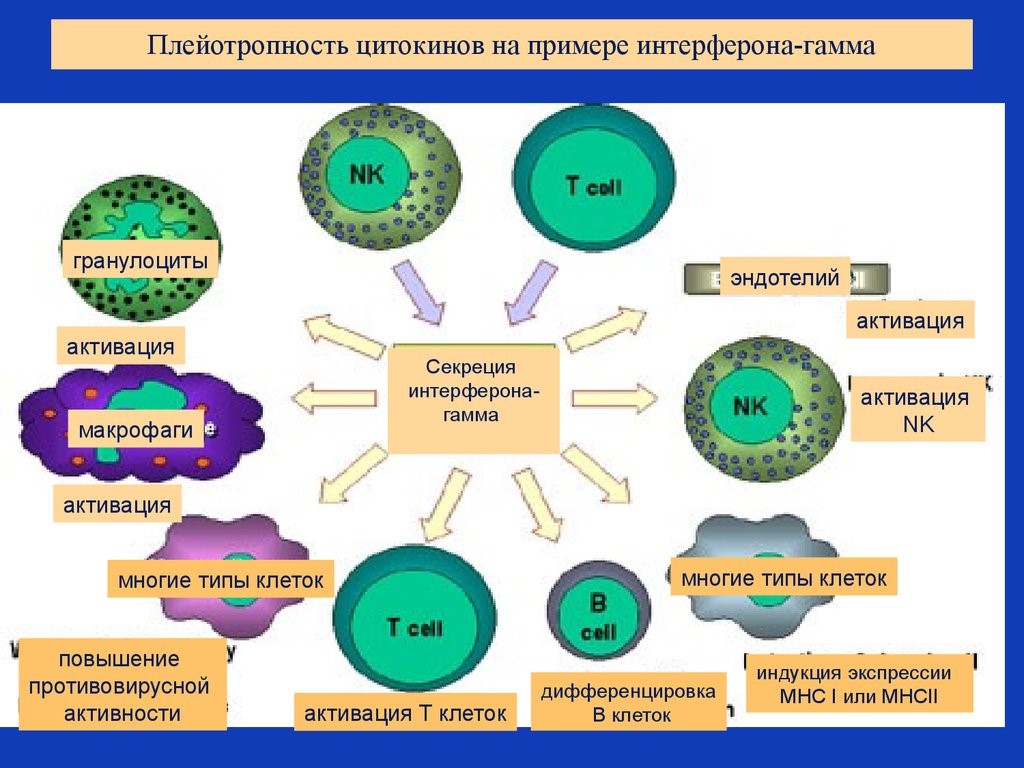
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
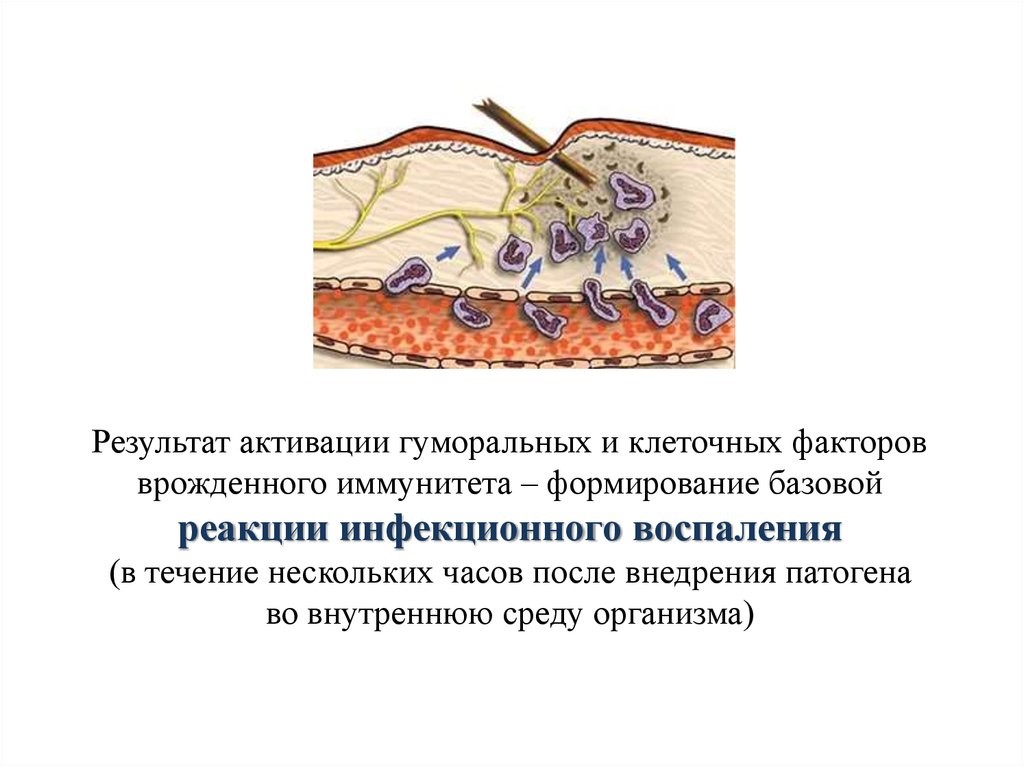
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
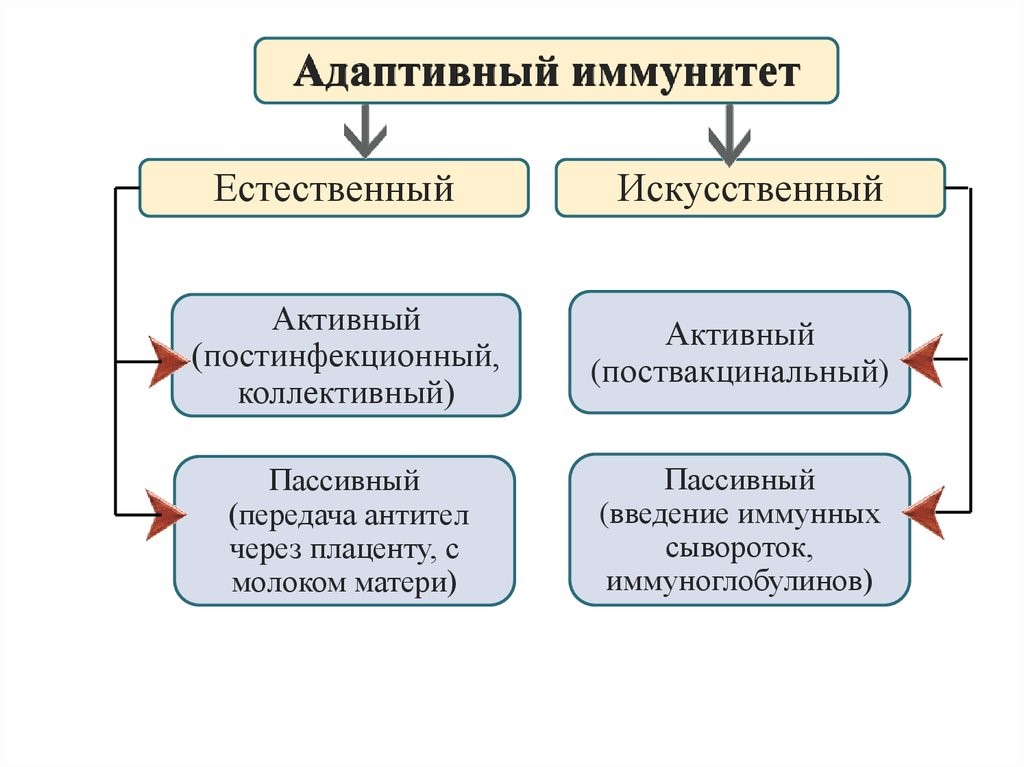
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
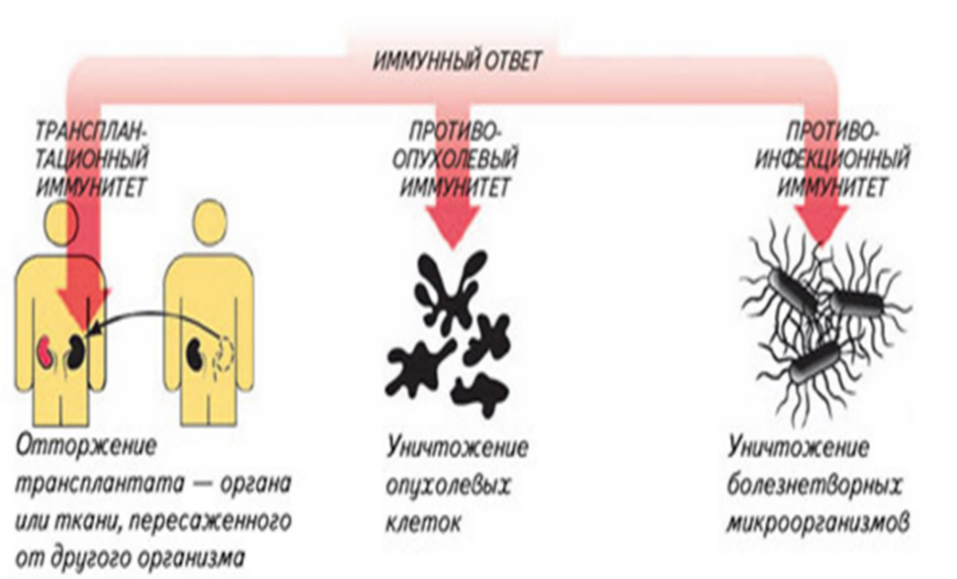
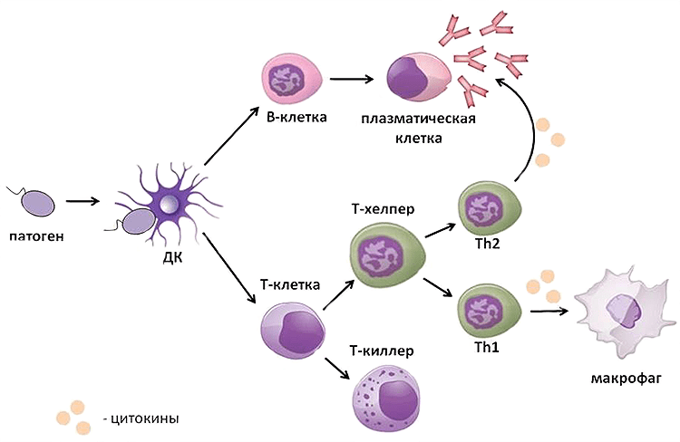
Адаптивный иммунитет основывается на трех главных процессах:
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
Лимфоидная стволовая клетка
CD19, CD72, CD79 и др.
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
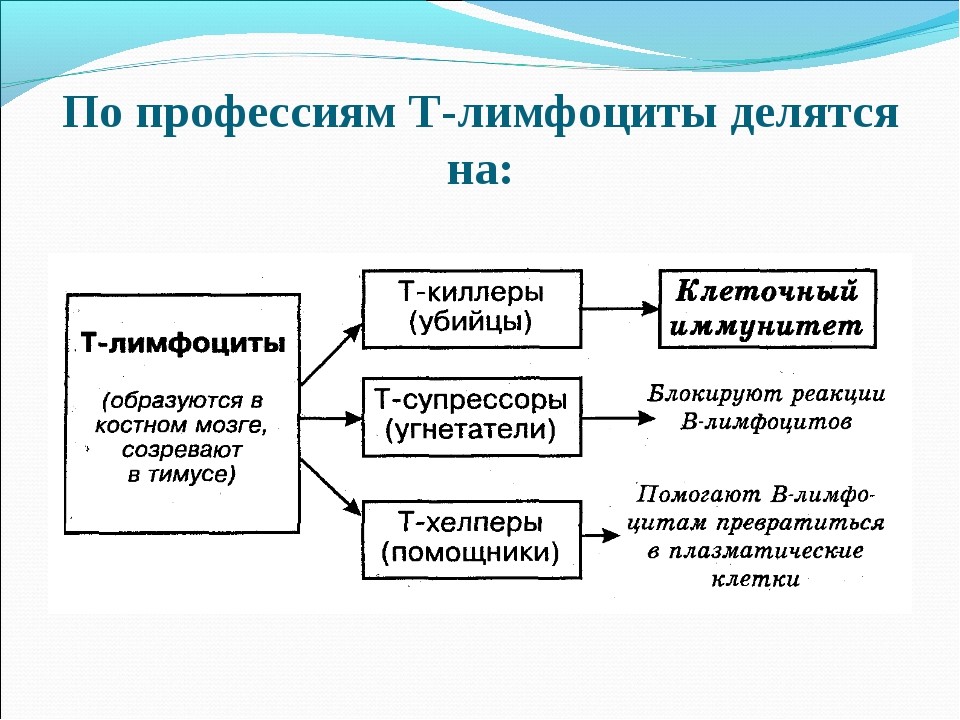
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
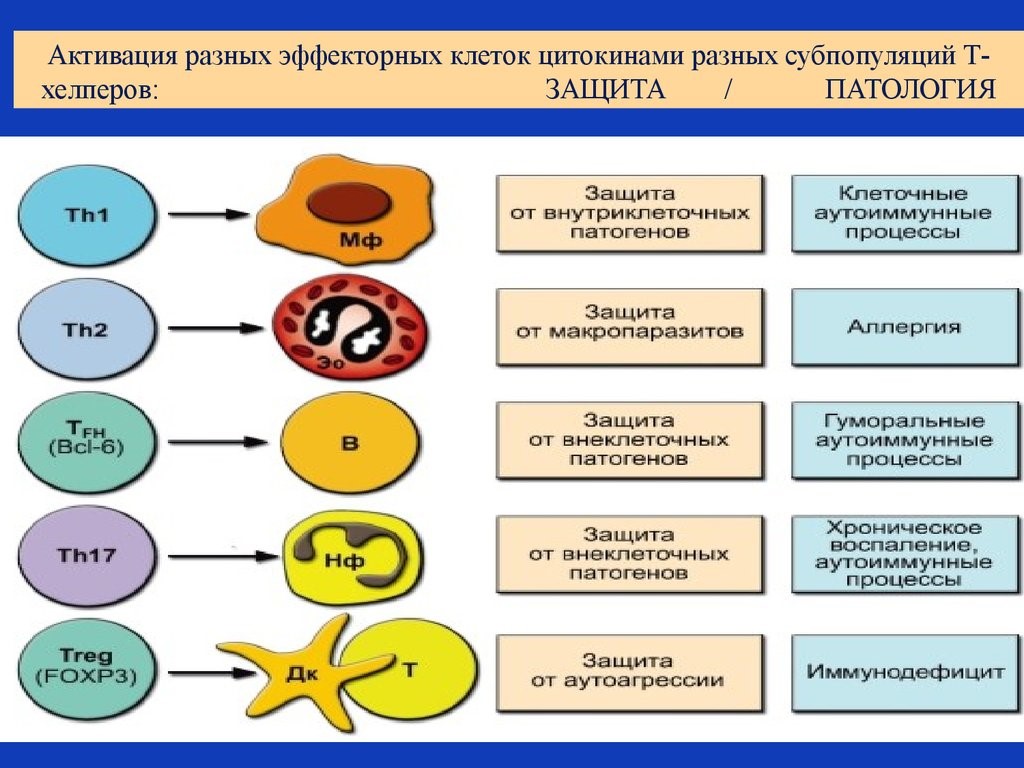
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
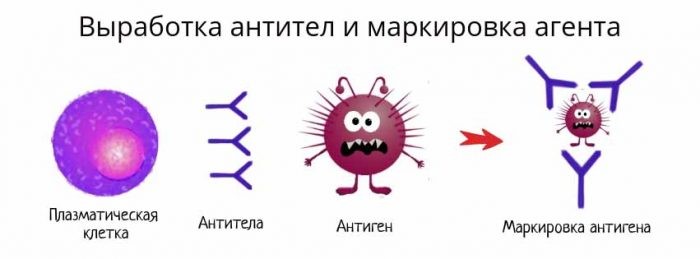
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
Результат молекулярного исследования
Инфицированный или повторно инфицированный пациент
Ранние стадии инфекции. Требуется дополнительное исследование
Инфекция. Требуется дополнительное исследование
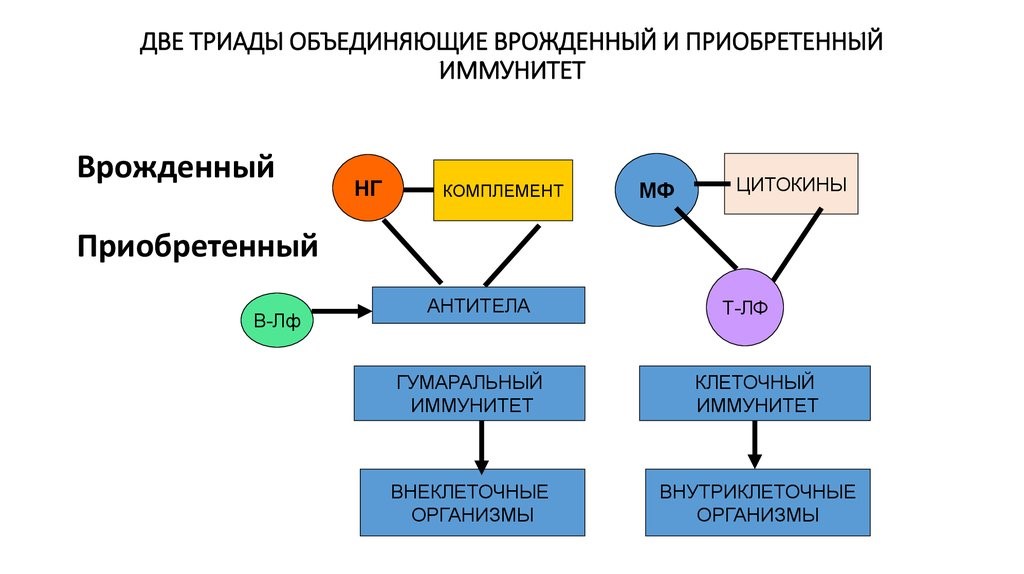
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
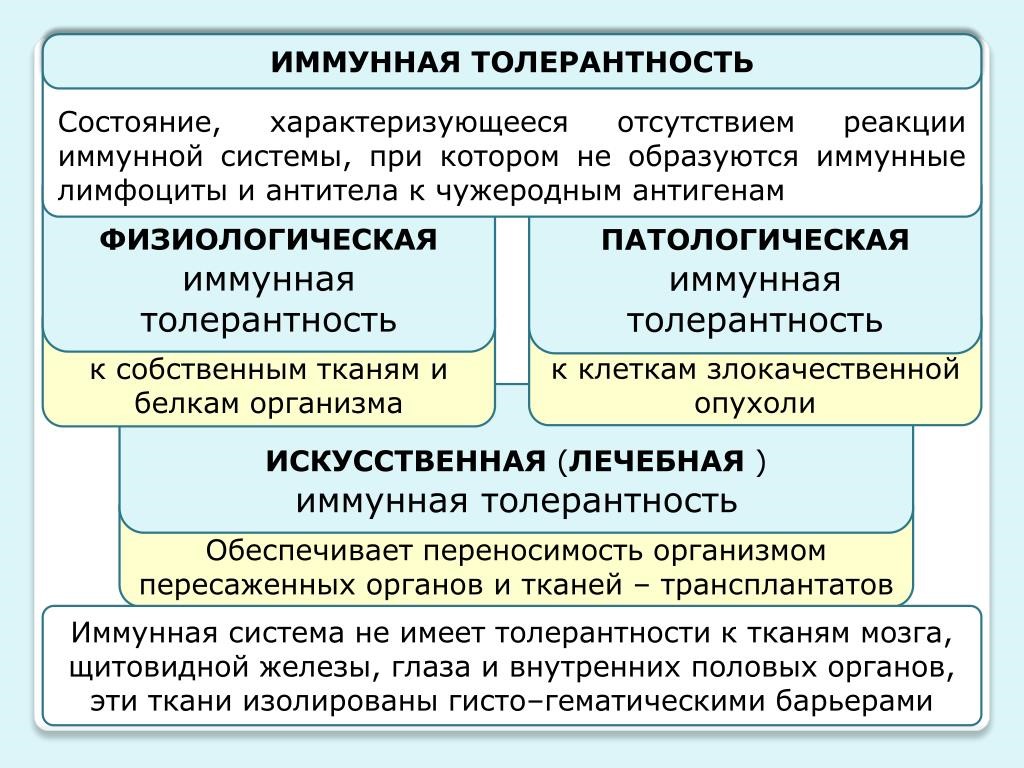
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
Таблица 3. Некоторые первичные иммунодефициты
Частые бактериальные инфекции
Дефицит или полное отсутствие В-лимфоцитов
Антибиотики, пожизненное введение IgG
Частые респираторные инфекции, отиты
Дефекты Т- и В- лимфоцитов
Антибиотики, пожизненное введение IgG
Атаксия-телеангиоэкстазия (синдром Луи-Бар)
Аномалия двигательной функции, слабость мышц, нарушение речи
Дефицит Т- и В- лимфоцитов
ПИД, обусловленные дефектами фагоцитоза
Хроническая гранулёматозная болезнь
Частые пневмонии, гнойные инфекции
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма
ПИД, обусловленные дефектами в системе комплемента
Наследственный ангионевротический отек
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни
Низкая концентрация ингибитора эстеразы С1
Введение концентрата ингибитора эстеразы С1
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
Эффективные методы воздействия на иммунитет:
Спекулятивные методы вокруг иммунитета:
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.