Клинический и терапевтический эффект в чем разница
Как в фильмах не будет: что должен знать каждый пациент о лекарственной терапии
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
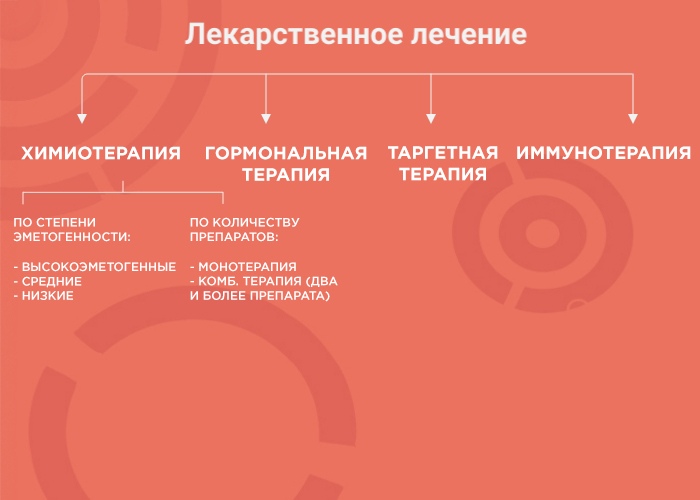 |
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта*. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму данного рецептора**. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при ТТ менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. ИТ занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
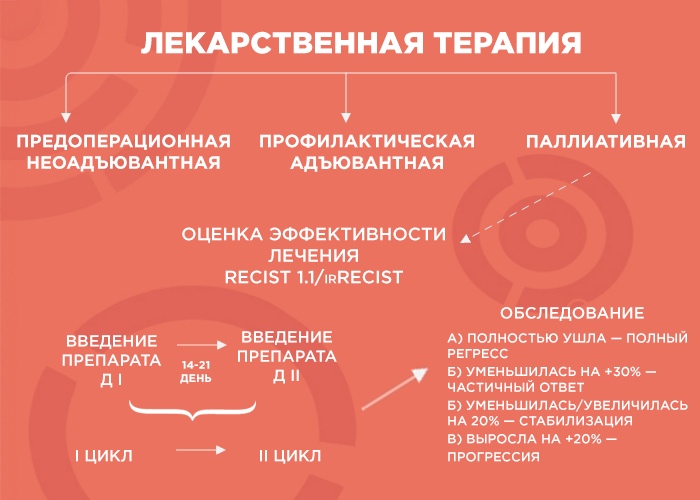 |
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Транквилизаторы (анксиолитики)
Транквилизаторы — это группа психотропных лекарственных препаратов с противотревожным эффектом, снимающих беспокойство и внутреннее напряжение, тревогу, тремор и мышечное напряжение невротического происхождения, чувство страха. Некоторые препараты данной группы, помимо нормализующего психоэмоциональное состояние и ночной сон эффекта, способны оказывать тонизирующее действие.
Среди транквилизаторов (от лат. tranquillo — успокаивать) выделяют типичные и атипичные, не обладающие ярко выраженными непрофильными действиями и не вызывающие зависимость при длительном приеме. По химическому строению анксиолитики делятся на производные бензодиазепина (хлордиазепоксид, диазепам, феназепам, оксазепам, медазепам, мидазолам) и препараты иных химических групп (мепротан, бенактизин, фенибут, мебикар, бензоклидин).
Фармакодинамическая активность всех анксиолитиков сводится к пяти основным компонентам: успокаивающему, противотревожному, снотворному, расслабляющему и противосудорожному. Степень выраженности того или иного терапевтического эффекта у каждого конкретного препарата своя, определяющая его клиническое применение (например, в психиатрии, неврологии, кардиологии, гастроэнтерологии, отоларингологии, анестезиологии).
Анксиолитики назначают для снятия состояний ажитации (1) и астении (2), сопутствующих различным расстройствам психики:
Как правило, приведенные выше состояния возникают на фоне следующих расстройств психики:
В практике врача-невролога транквилизаторы могут быть назначены, например, при возникновении состояний ажитации и астении вследствие черепно-мозговых травм, инсультов сопровождающихся повышением мышечного тонуса, эпилепсии, остеохондроза позвоночника. Иные врачи соматического профиля назначают анксиолитики при лечении функциональных нарушений в работе ЖКТ (гастроэнтеролог), сердечно-сосудистой системы (кардиолог), мочевыделительной системы (гинеколог, уролог), абстинентных состояний и последствий органического поражения ЦНС (нарколог, токсиколог).
Механизм действия транквилизаторов
Терапевтический механизм действия транквилизаторов заключается в способности воздействовать на межнейрональную передачу нервных импульсов в диэнцефалоне (промежуточном) и спинном мозге, снижать активность подкорковых областей головного мозга, редуцировать уровень дофамина и норадреналина, а также процессы в ГАМК-системах мозга, блокировать холинергические рецепторы.
Механизм действия транквилизаторов зависит от их химического строения. Среди анксиолитиков можно выделить шесть классов органических веществ, представленные основными химическими группами (по Анатомо-терапевтическо-химической классификации лекарственных средств, ATC):
Мишенью анксиолитиков являются следующие структуры мозга:
На сегодняшний день достаточно хорошо изучен механизм действия транквилизаторов производных бензодиазепина. Бензодиазепиновые рецепторы участвуют в биохимических процессах, связанных с ГАМКергическим торможением на всех уровнях ЦНС. Разносторонняя активность транквилизаторов определяется воздействием на различные типы бензодиазепиновых рецепторов, позволяющим, таким образом, оказывать анксиолитический, седативный, гипнотический, миорелаксантный и противосудорожный эффекты.
Рис. 1. Механизм действия транквилизаторов.
Анксиолитический (противотревожный) эффект
Основная задача транквилизаторов — оказывать анксиолитический (противотревожный) эффект: снимать беспокойство, тревогу, страх (антифобическое действие), редуцировать эмоциональное напряжение. Помимо этого, анксиолитики помогают справляться с обсессивными мыслями и ипохондрией, иррациональными переживаниями за состояние собственного здоровья.
Седативный (успокаивающий) эффект
Анксиолитики обладают седативным (успокаивающим) эффектом, который выражается в снижении гиперактивности, психомоторной возбудимости, скорости двигательных и психических реакций, концентрации внимания. Седативный эффект можно отнести к дополняющему анксиолитический.
Снотворный (гипнотический) эффект
При нарушениях сна (трудностях в процессе засыпания, при наличии поверхностного, чуткого к внешним раздражителям сна, а также короткого, недостаточного для восстановления сил), которые, как правило, возникают на фоне течения легких и пограничных расстройств психики, транквилизаторы помогают справиться с данными состояниями посредством снотворного (гипнотического) эффекта.
Миорелаксирующий (расслабляющий) эффект
При психопатологических состояниях, вызывающих напряжение скелетной мускулатуры, мышечное и двигательное возбуждение, полезным оказывается миорелаксирующий (расслабляющий) эффект анксиолитиков. Однако если профессиональная деятельность или образ жизни пациента связан с необходимостью сохранения быстрой психической и физической реакции, необходим строгий подбор препарата в правильной дозировке. В противном случае возможно появление субъективного ощущения вялости, слабости.
Противосудорожный эффект
Противосудорожный эффект транквилизаторов обычно используется при состояниях, сопровождающихся эпилептогенной активностью. В частности, данный эффект находит терапевтическое применение при истероэпилепсии (неэпилептических пароксизмальных состояниях), бессудорожной эпилепсии, нейропсихогенных приступах (например, задержке дыхания, парасомнии, паническом расстройстве, кардиогенных приступах, головных болях напряжения).
Вегетостабилизирующий эффект
Профиль терапевтического действия некоторых транквилизаторов включает вегетостабилизирующий эффект — стабилизирующий функциональную активность автономной нервной системы. При приеме таких препаратов купируются вегетативные проявления тревоги, например: учащенное сердцебиение, повышенное артериальное давление, потливость, расстройства желудочно-кишечного тракта.
Рис. 2. Принцип назначения транквилизаторов.
Побочные эффекты транквилизаторов
Транквилизаторы уверенно вошли в малую и пограничную психиатрию во второй половине XX века в качестве препаратов первого выбора, сместив нейролептики и антидепрессанты, по причине отсутствия выраженных побочных эффектов и хорошей переносимости. Поиск новых препаратов данной группы ведется с 1959 года, после того как в клинической практике зарекомендовал себя с лучшей стороны первый транквилизатор — хлордиазепоксид (элениум). Стоит отметить, что на сегодняшний день существует более 50 наименований только лишь среди бензодиазепиновых транквилизаторов, которые обладают улучшенным профилем действия и переносимостью.
Злоупотребление и немедицинское использование
К основным побочным эффектам транквилизаторов, проявляющимся на фоне злоупотребления или немедицинского использования препаратов данной группы, относятся:
Лекарственное опьянение
Эффект от злоупотребления и немедицинского использования транквилизаторов отчасти сходен с барбитуратной наркоманией. Последствия интоксикации зависят от принимаемого препарата, однако выраженность побочных эффектов транквилизаторов мала и не достигает серьезных интеллектуально-мнестических и аффективных нарушений. Такое лекарственное опьянение может выражаться разнообразными состояниями:
Побочные эффекты транквилизаторов при употреблении на длительной дистанции отражаются на внешнем виде и поведении человека, очевидных для окружающих. У такого человека нарушается координация движений, походка становится вялой и пошатывающейся; речь неразборчивой и сбивчивой, но оживленной; ухудшается состояние кожи — она становится бледной; зрачки — расширены, вяло реагируют на свет; полость рта сухая, язык покрывается белым налетом.
Со стороны соматоневрологического статуса побочные эффекты транквилизаторов могут выражаться следующими состояниями:
Лечение зависимости от транквилизаторов включает отмену препарата и психосоциальную реабилитацию. Как правило, резкое прекращение приема транквилизаторов может вызвать абстиненцию, сопровождающуюся эпилептическими припадками, поэтому при лечении с необходимостью проводят замену на иной (слабый) транквилизатор с целью постепенного снижения дозировки.
Психопатология на фоне длительного немедицинского приема транквилизаторов варьируется от легких тревожно-фобических состояний до состояния деперсонализации-дереализации. Помимо этого, в процессе лечения зависимости высока вероятность усиления сниженного настроения, ипохондрических состояний, безынициативности и нарушений сна, которые могут привести к возникновению депрессии. Отражаясь на качестве жизни в целом, такой человек с необходимостью нуждается в длительной работе с психотерапевтом, в том числе по направлению ресоциализации.
Список препаратов транквилизаторов
В международной Анатомо-терапевтической-химической классификации (АТС), принятой Министерством здравоохранения РФ в 2002 году, анксиолитики (N05B) включены в подраздел раздела Препаратов для лечения заболеваний нервной системы (N) — Психолептики (N05). Данный подраздел включает шесть групп транквилизаторов:
Далее приведем два списка препаратов транквилизаторов, которые могут быть назначены при неврозах и неврозоподобных расстройствах психики на основании элементов ведущей симптоматики.
Рис. 1. Формула первого транквилизатора.
Мишень — элементы ажитации
Легкие и пограничные расстройства психики могут сопровождаться элементами ажитации: тревогой, паникой, страхом, сверхценными мыслями страха, навязчивыми страхами, раздражительностью, дисфорией, трудностями в отходе ко сну, снижением длительности сна, вегетативной лабильностью, вегетативными кризами. Элементы ажитации являются мишенью для следующих транквилизаторов:
Мишень — элементы астении
Элементы ажитации при обратимых психических расстройствах включают: психическую и физическую астению, синдром хронической усталости, ипохондрию, нарушения внимания и запоминания, снижение интеллектуальной активности, слабость, усталость, вялость, апатию, истощаемость, раздражительную слабость, вегетативную лабильность, отсутствие бодрости после сна, тревогу. При наличии такой симптоматики эффективны следующие транквилизаторы:
Выбор того или иного транквилизатора зависит от терапевтических целей, характера течения заболевания и индивидуальных особенностей состояния здоровья пациента. Это же относится к дозировке и срокам приема препаратов данной группы. Отказ от рекомендаций доктора по приему анксиолитика (частота приема, рекомендуемая дозировка, сроки лечения) недопустим.
Список использованной литературы
1. Усов Л.А., Суфианова Г.З., Минакина Л.Н. «Фармакология центральной нервной системы».
2. Самаренко В.Я. «Химическая технология лекарственных субстанций».
3. Бакумов П.А., Евсеев А.В. «Применение транквилизаторов в терапевтической практике».
4. Мурашко Н.К. «Психофармакотерапия кардионеврологических больных».
5. Серов В.Н., Баранов И.И. «Транквилизаторы в акушерско–гинекологической практике».
6. Вербенко В.А., Вербенко Н.В. «Психотропные препараты в терапевтической практике».
7. Малин Д.И. «Терапия критических состояний в психиатрии»
8. Дробижев М.Ю., Овчинников А.А. «Патогенетическая психофармакотерапия тревожных расстройств».
9. Иващенко Д.В. «Безопасность применения транквилизаторов из группы бензодиазепинов при синдроме отмены алкоголя: фармакоэпидемиология и фармакогенетика».
Клинический и терапевтический эффект в чем разница
Механизм действия и спектр психотропной активности препаратов различных классов
Нейролептики. Современная рабочая гипотеза механизма действия нейролептиков предполагает, что в основном они оказывают влияние на дофаминергическую систему. Нейролептики являются антагонистами дофаминовых рецепторов, за счет чего и реализуется их антипсихотический эффект. Однако следствием этого является возникновение ряда неврологических, гормональных, вегетативных и аффективных нарушений.
Исследования показали, что группа дофаминовых рецепторов неоднородна. Лишь некоторые из них участвуют в формировании психотической симптоматики и соответственно в антипсихотическом действии нейролептиков. Воздействие же нейролептиков на другие группы дофаминовых рецепторов приводит к появлению экстрапирамидных нарушений и других побочных эффектов, а их роль в формировании собственно терапевтического ответа крайне незначительна.
В дальнейшем отмечалось, что в развитии психопатологической симптоматики важное значение имеет и серотонинергическая система. Одновременное блокирование дофаминовых и серотониновых рецепторов приводит не только к более быстрой и полной редукции позитивных психопатологических расстройств, но и к уменьшению признаков негативных изменений. Фармакологической реализацией этой гипотезы стало появление так называемых атипичных нейролептиков, или нейролептиков второго поколения (например, клозапина, или лепонекса). Эти препараты при клинически полном нейролептическом спектре активности оказывают по сравнению с классическими нейролептиками более избирательное нейрохимическое действие. Они селективно блокируют только дофаминовые D2- и D3- рецепторы определенных областей мозга (в частности мезолимбической) и имеют некоторое сродство к серотониновым рецепторам, чем объясняются особенности их клинического действия, в частности малая выраженность побочных экстрапирамидных эффектов.
Новейшие Нейролептики (рисперидон, оланзапин) обладают практически равным сродством к дофаминовым и серотониновым рецепторам. По эффективности они сравнимы или даже превосходят классические нейролептики при значительно более высокой переносимости.
Ведущий принцип применения нейролептических средств основывается на зависимости между особенностями психотропного действия (избирательное или общее) и основными характеристиками психопатологического синдрома, такими как сложность, отражающая степень генерализации психического расстройства, выраженность и преобладание в клинической картине позитивных или негативных симптомов.
Признаком большей генерализации нарушений служит полиморфизм клинической картины, т.е. синдрома. Для описания различий в интенсивности действия нейролептиков используется понятие мощности, или потентности, препарата, которое отражает соотношение дозы и эффекта: чем меньше эффективная доза, тем больше потентность препарата (например, трифлюперазин обладает большей потентностью, чем хлорпромазин) (с понятием «мощность нейролептика» тесно связано понятие «хлорпромазиновый эквивалент», которое было введено J.M.Davis (1974). Последнее отражает необходимость создания стандартного показателя для сопоставления мощности действия различных нейролептиков и общей «нагрузки» нейролептиками у одного больного. Хлорпромазиновый эквивалент представляет собой эмпирически установленную дозу нейролептика, эквивалентную по силе действия 100 мг (Davis J.M., 1974] или 500 мг [Cornwall P.L. et al., 1996] хлорпромазина. Хлорпромазиновый эквивалент используется в клинической психофармакологии [Fioritti A., 1997; Tyson P.J. et al., 1998] и особенно широко — в биологической психиатрии, когда требуется унифицировать оценку фармакотерапии у разных пациентов до начала исследования или провести обобщенную оценку ее влияния на тот или иной биологический показатель и т.п. [Benes M. et al., 1991; Kajimura N. et al., 1996]; эквивалентность доз учитывается также при оценке стоимости лечения [Davis J.M. et al., 1989]).
При наличии в клинической картине выраженного психомоторного возбуждения рекомендуется начинать лечение с нейролептиков с выраженной седативной активностью (хлорпромазин, галоперидол). В случае меньшей выраженности психомоторного возбуждения можно начинать терапию с новейших нейролептиков (оланзапин, рисперидон). При незначительной тяжести психотической симптоматики, а также при некоторых видах непсихотических расстройств (тревожные, сенестоипохондрические нарушения) более целесообразно использование препаратов умеренного антипсихотического действия (перициазин, алимемазин и др.).
Антидепрессанты. Современная гипотеза действия антидепрессантов предполагает, что их активность направлена на коррекцию дисбаланса функции серотонинергической и норадренергической систем мозга.
Антидепрессанты первого поколения включают в себя ингибиторы МАО и трициклические антидепрессанты (ТЦА). Они не оказывают избирательного влияния на нейротрансмиттерные системы. Ингибиторы необратимо блокируют внутриклеточную МАО-А и МАО-В, участвующие в обмене норадреналина, серотонина, дофамина и других моноаминов. В настоящее время препараты этой группы применяются лишь в исключительных случаях, так как они плохо сочетаются с антидепрессантами других фармакологических групп, ограничивая возможности смены терапевтической тактики (необходим перерыв при смене антидепрессантов). При их назначении требуются ограничения в диете во избежание выраженных побочных эффектов. Механизм действия ТЦА основывается на ингибировании обратного захвата моноаминов (серотонина и норадреналина). При этом происходит блокирование М-холинорецепторов, а-1-адренорецепторов, Н2-рецепторов. Эффективность ТЦА весьма высока даже при тяжелых депрессиях — достигает 70 %. Но эти антидепрессанты также дают клинически значимые побочные эффекты, в частности связанные с холинолитическим действием. Изучение механизмов действия ингибиторов МАО и ТЦА позволяет сделать заключение, что их антидепрессивное влияние обусловлено воздействием на норадренергическую и серотонинергическую системы, вовлечение же других видов рецепторов и нейротрансмиттерных систем приводит к развитию нежелательных эффектов.
Антидепрессанты второго поколения обладают значительно большей нейрохимической избирательностью. К этой группе относятся ингибиторы обратного захвата серотонина (флуоксетин, флувоксамин, сертралин, пароксетин), а-2-адреноблокаторы (миансерин), а также селективные обратимые ингибиторы МАО (моклобемид), избирательно влияющие только на один подтип фермента — МАО-А, который контролирует метаболизм серотонина и норадреналина, не влияя на дофамин. Эффективность этих препаратов сравнима с таковой классических антидепрессантов (особенно при депрессиях легкой и средней степени тяжести). Но они значительно лучше переносятся и вызывают меньше побочных эффектов.
Современные представления о клиническом влиянии препаратов на различные типы рецепторов представлены в табл. 5.
Из представленных в табл. 5 данных видно, что спектр клинического действия антидепрессантов включает в себя не только собственно антидепрессивный, но и противотревожный эффект. Кроме того, некоторые группы антидепрессантов эффективны при обсессивно-фобических расстройствах.
Таблица 5. Соотношение между характером действия антидепрессантов на рецепторы и клиническим эффектом
Сухость слизистых оболочек, расстройства зрения, сознания, тахикардия, задержка мочевыделения, гипотония кишечника
Серотониновые постсинаптические 5-НТ2-рецепторы
Бессонница, тревога, ажитация, расстройство сексуальной функции
Серотониновые постсинаптические 5-НТЗ-рецепторы
Антидепрессивное и противотревожное действие
1 Серотонин представляет собой 5-окситриптамин [5-hydroxytriptamine (5-HT).
В последнее время А.Б.Смулевичем (1997) было показано, что выбор антидепрессантов должен зависеть от соотношения двух сфер клинических проявлений депрессии — собственно гипотимии (позитивная аффективность: катестетический, голотимный, кататимный аффект) и отчуждения (негативная аффективность: алекситимия, апатия, ангедония). Выявляются три наиболее типичных варианта соотношения позитивной и негативной аффективности, значимые для прогноза терапевтического ответа на антидепрессанты с различными нейрохимическими механизмами действия. В случаях, когда феномены позитивной—негативной эффективности не взаимодействуют, а формируют изолированные стойкие психопатологические образования (тяжелые ажитированные депрессии, депрессии с тоской, идеями греховности, суицидальными тенденциями либо апатические депрессии с выраженной идеаторной и моторной заторможенностью), которые, как правило, оказываются резистентны к терапии, эффективны препараты с мощным нейрохимическим действием и широким охватом нейротрансмиттерных систем различных типов. Это неизбирательные ингибиторы обратного захвата нейромедиаторов (норадреналина и серотонина) — типичные ТЦА (амитриптилин, имипрамин, кломипрамин). При недостаточности эффекта оправдано проведение комбинированной терапии в виде сочетания ТЦА с небольшими дозами нейролептиков.
Если рассмотреть эту клиническую ситуацию с точки зрения современных представлений о нейрохимических основах биологического действия трициклических антидепрессантов и нейролептиков, можно предположить, что при депрессиях с изолированными явлениями позитивной или негативной аффективности наблюдается выраженный дисбаланс практически всех нейротрансмиттерных систем, участвующих в формировании аффективных нарушений. При сочетании антидепрессантов с нейролептиками предполагается дополнительное воздействие на дофаминергические структуры.
При «перекрывании» психопатологических рядов, образующих клиническое пространство депрессии, происходит формирование сложных аффективных синдромов. Манифестация таких полиморфных психопатологических расстройств (например, анестетической депрессии), предполагает, с одной стороны, значительно большую терапевтическую подвижность, а с другой — появление избирательной чувствительности к препаратам различной химической структуры и механизма действия. В этих случаях оправданно использование селективных антидепрессантов, выбор которых определяется соотношением позитивной и негативной аффективности в структуре депрессии. При преобладании явлений позитивной аффективности (тоска с чувством душевной боли, физикальная тоска с тревогой и соматизированными расстройствами, сниженная самооценка, идеи малоценности, вины) эффективны как антидепрессанты с равным норадренергическим и серотонинергическим действием (ТЦА, обратимые ингибиторы МАО-А, например моклобемид), так и препараты с акцентом нейрохимического действия на норадренергические структуры (миансерин, мапротилин). При доминировании в клинической картине негативной аффективности, выражающейся признаками девитализации аффекта (сознание утраты жизненного тонуса и спонтанной активности) и явлениями моральной анестезии (сознание падения психической активности, невозможности концентрации внимания, обедненности воображения), наиболее полный терапевтический эффект достигается при использовании препаратов серотонинергической группы (селективные ингибиторы обратного захвата серотонина, в частности флуоксетин).
При депрессиях, развивающихся на субсиндромальном уровне (стертые, ларвированные, маскированные), когда психопатологически проявления ограничены рамками гипотимии и не дифференцированы на позитивную и негативную эффективность, клиническое действие антидепрессантов реализуется по другим закономерностям. Приоритетными при выборе препарата становятся минимальная выраженность поведенческой токсичности и спектр побочных действий препарата. Особое значение в этом случае приобретают индивидуальная чувствительность и исходное отношение больного к антидепрессанту и психофармакотерапии в целом. В качестве препаратов выбора при субсиндромальных психопатологически недифференцированных депрессиях выступают антидепрессанты различной структуры, сочетающие мягкий тимолептический эффект с хорошей переносимостью (пиразидол и др.).
Транквилизаторы. По современным представлениям, транквилизирующий эффект обусловлен стимуляцией ГАМК-рецепторов, которая осуществляется через усиление выброса ГАМК. Бензодиазепины, транквилизаторы первого поколения, связываются с ГАМК-рецепторами. К некоторым участкам этих рецепторов их сродство оказывается особенно сильным — эти участки названы бензодиазепиновыми рецепторами. Воздействие бензодиазепинов на этот тип рецепторов клинически проявляется противотревожным, антистрессовым, антиагрессивным, гипнотическим, противосудорожным и миорелаксирующим действием.
В настоящее время предполагается, что существуют разные подтипы бензодиазепиновых рецепторов, которые ответственны за конкретные клинические компоненты действия транквилизаторов. Эти рецепторы обозначаются как BZ1 и BZ2 (от англ., «benzodiazepine»). Новое поколение транквилизаторов относится в основном к группе имидазопиридинов (небензодиазепинов). Тем не менее их действие направлено в основном на BZ1-рецепторы, что клинически проявляется в большей избирательности их клинического эффекта.
Спектр клинического влияния транквилизаторов определяется в основном их противотревожным, или анксиолитическим, действием. Однако в той или иной степени транквилизаторы обладают гипнотическими, миорелаксирующими, вегетобалансирующими, а некоторые из них и активирующими свойствами [Александровский Ю.А., 1973]. Они эффективны при астенических (неврастенических), соматоформных и ипохондрических, истероконверсионных, тревожно-фобических, обсессивно-компульсивных и агрипнических расстройствах, т.е. при пограничных состояниях с психопатологическими расстройствами неглубокого уровня и подвижной структуры.
Транквилизаторы показаны в тех случаях, когда клиническая картина определяется такими симптомами, как раздражительность, гиперестезия, эмоциональная и вегетативная лабильность, невротическая агрипния. Для купирования тревожно-фобических расстройств (панические атаки, агорафобия и др.) применяют транквилизаторы с максимальной выраженностью анксиолитической активности (алпразолам, лоразепам, феназепам и др.). При особенно острых состояниях эффективно парентеральное введение бензодиазепиновых производных (диазепам, хлордиазепоксид, транксен и др.).
Использование транквилизаторов при лечении обсессивно-компульсивных расстройств ограничено. Хороший эффект при этих состояниях достигается в тех случаях, когда в структуре синдрома отчетливо проявляются тревожный радикал и соматовегетативные нарушения [Смулевич А.Б. и др., 1994]. Если же ведущими в клинической картине являются идеаторные навязчивости, эффективность транквилизаторов невысокая. Наряду с лечением пограничных состояний транквилизаторы используются в комбинированной терапии депрессий, характеризующихся преобладанием позитивной аффективности (тревожная, невротическая, соматизированная депрессия), а также при психосоматических, малопрогредиентных эндогенных, органических и сосудистых заболеваниях. Вегетостабилизирующее свойство транквилизаторов рекомендуется использовать при нетяжелых нарушениях, возникающих как побочные явления при назначении психотропных средств других групп (нейролептики, антидепрессанты, стимуляторы). Миорелаксирующий эффект отчетливо выражен у таких транквилизаторов, как диазепам, клоназепам и хлордиазепоксид. Они показаны при судорожных и спастических состояниях, в частности развивающихся вследствие побочного действия нейролептиков. Для лечения агрипнических расстройств используют транквилизаторы с максимальной выраженностью гипнотического действия (нитразепам, триазолам, рогипнол). Особого внимания в этом Отношении заслуживают небензодиазепиновые транквилизаторы, выраженный гипнотический эффект которых не сопровождается миорелаксацией и противосудорожным действием (золпидем, зопиклон). В спектре действия некоторых транквилизаторов анксиолитический эффект сочетается с легким активирующим и антидепрессивным действием (лоразепам, алпразолам). Иногда применение транквилизаторов является вынужденной мерой, например в тех случаях, когда больной не переносит препаратов других психофармакологических групп.
Ноотропы. О действии ноотропов на нейрохимическом и физиологическом уровне известно мало. Это действие связывают в основном с их влиянием на ГАМКергическую систему. Они способны неспецифически активировать аденилатциклазу и другие ферменты, участвующие в обмене АТФ, повышать скорость синтеза РНК, ДНК и соответственно белков, повышать обмен нейротрансмиттеров, в частности дофамина, усиливать синтез холина, оказывая холиномиметическое действие. Ноотропы также имеют некоторое сродство к определенным подтипам глутаматных рецепторов и оказывают антигипоксическое действие, которое основано на их способности препятствовать накоплению лактата в нервных клетках. И тем не менее точный механизм их терапевтического эффекта до конца не известен.
Ноотропы активизируют когнитивные функции и повышают адаптацию к длительным физическим нагрузкам, а также к психическому стрессу. В связи с этим ноотропы широко используются при различных психических и неврологических заболеваниях. Они показаны при астенических состояниях различного генеза.
Психостимуляторы. Механизм действия психостимуляторов основан на их способности влиять на энергетический обмен. Они ингибируют фермент фосфодиэстеразу, что приводит к накоплению в нервных клетках цАМФ. Под влиянием цАМФ усиливаются процессы гликогенолиза и происходит активирование клеточного метаболизма. Психостимуляторы, кроме того, связывают аденозиновые рецепторы, естественным лигандом которых является аденозин. Некоторые из них повышают содержание катехоламинов в синаптической щели за счет усиления выброса медиаторов из пресинаптических окончаний, ингибирования их обратного захвата и МАО. Такие психостимуляторы, как фенамин, в большей степени активируют дофаминергическую передачу, а такие, как сиднокарб, — норадренергическую.
Психостимуляторы показаны при явлениях астении, адинамии или апатии, которые могут возникать при невротических реакциях, а также при психосоматических расстройствах, астенических состояниях после затяжных инфекционных, соматических заболеваний или заболеваниях, протекающих с выраженной интоксикацией, при черепно-мозговых травмах, состояниях декомпенсации при личностных расстройствах, явлениях юношеской астенической несостоятельности и явлениях астенического дефекта при ремиссиях у больных шизофренией. В качестве дополнительных средств психостимуляторы используются для коррекции некоторых побочных эффектов нейролептиков и усиления терапевтического эффекта антидепрессантов. В некоторых случаях психостимуляторы применяются у находящихся в экстремальных условиях здоровых лиц с целью повышения их возможностей переносить большие умственные и физические перегрузки.
Однако следует заметить, что в терапии психических нарушений психостимуляторы применяются не столь широко, как препараты других классов. Это связано с большой опасностью привыкания, возникновения зависимости, т.е. развития токсикомании. Кроме того, известно, что при их приеме могут развиться психомоторное возбуждение, бессонница, эйфория, а также вегетативные нарушения (тахикардия, подъемы АД и др.). При длительном использовании психостимуляторов возможно развитие симптомов истощения ЦНС. Иногда психостимуляторы могут вызывать парадоксальные реакции в виде повышенной сонливости и вялости.
Нормотимики. Как уже отмечалось, к классу нормотимиков относятся соли лития и некоторые противосудорожные средства — карбамазепин и соли вальпроевой кислоты (натрия вальпроат).
Соли лития. Механизм терапевтического действия ионов лития до настоящего времени остается неясным. Предполагается, что ионы лития в силу сходства с ионами натрия, калия, кальция и магния могут выполнять до некоторой степени их роль в функционировании нервной клетки. Тем самым ионы лития, вероятно, участвуют в изменении активности различных нейротрансмиттерных систем и структуры мембран. Высказывается предположение, что ионы лития блокируют инозитолфосфатазу в нейроне, снижая чувствительность мембран к нейромедиаторам через вторую мессенджерную систему.
В качестве лекарственного средства наиболее широко используют лития карбонат, лития сульфат (в основном в ретардированной форме), значительно реже — лития оксибутират (есть данные о его эффективности при шизоаффективных расстройствах). Менее известны такие соли лития, как аспартат, глюконат и цитрат. Последний в силу хорошей растворимости применяется в виде питьевого раствора. Были попытки использовать лития оротат.
Наиболее широкое распространение соли лития получили для профилактики приступов аффективных расстройств и для лечения маниакальных состояний [Vencovsky E., Vinaz О., 1980]. Как профилактическое средство соли лития дают лучший стабилизирующий эффект в случае биполярного течения аффективных психозов, особенно для профилактики маниакальных приступов. Назначение солей лития с профилактической целью оправдано уже после второй фазы аффективного психоза. В среднем такая профилактическая терапия снижает вероятность развития последующих фаз с 80 до 35 % [Vestergaard P., Schou М., 1988]. Эффективность профилактической терапии тем выше, чем проще структура аффективного синдрома и чем выраженнее в клинической картине проявления витальности аффекта. Целесообразность применения солей лития при депрессиях остается спорным вопросом. Считается, что эффективность литиевой терапии проявляется при лечении не столько депрессивного, сколько смешанного аффекта, т.е. в том случае, если в структуре депрессивного синдрома имеются вкрапления «маниакальных фаз» [Fieve R., 1975]. При монополярном аффективном психозе (монополярной депрессии) эффективность препаратов лития невысока. Соли лития не назначают при невротических и реактивных депрессиях. Эффективны препараты лития при лечении шизоаффективных психозов. В этих случаях результат терапии тем лучше, чем более выражены в картине психоза аффективные расстройства [Baastrup P., 1975[.
Положительные результаты терапии солями лития получены не только при аффективных и шизоаффективных психозах, но и при аффективных расстройствах в рамках бредовых состояний, в частности при хронических маниях с бредом [Pert M., 1993]. Иногда наблюдается хороший результат при назначении солей лития в сочетании с нейролептиками при шизофрении. Более того при непереносимости нейролептической терапии в последнем случае возможна монотерапия солями лития, которая позволяет снизить агрессивность больных и уменьшить выраженность психомоторного возбуждения. Соли лития используют и для усиления эффекта антидепрессантов; они применяются также при лечении личностных расстройств, нервной булимии и дипсомании.
Дозы солей лития подбираются индивидуально под контролем концентрации лития ъ плазме крови. Чаще всего необходимая концентрация лития в крови поддерживается при назначении дозы от 600 до 1200 мг. Терапевтическое окно для лития варьирует от 0,6 до 1,6 ммоль/л.
Антиконвульсанты. Предполагается, что в основе действия карбамазепина лежит его влияния на бензодиазепиновые рецепторы и кальциевые каналы, что обусловливает угнетение киндлинг-эффекта (эффекта «раскачки»), когда подпороговые сигналы могут приводить к развитию аффективной фазы. Терапевтический эффект солей вальпроевой кислоты обеспечивается в основном влиянием на ГАМКергическую нейротрансмиссию. По данным сравнительных исследований карбамазепин эффективнее лития при профилактике депрессивных фаз в случаях монополярного течения аффективных заболеваний, но как и литий, карбамазепин используется в качестве антиманиакального средства. Препарат назначают при недостаточной эффективности или непереносимости литиевой терапии. Использование карбамазепина предпочтительнее при преобладании в клинической картине дисфорических нарушений, а также при течении аффективного заболевания по типу быстрых циклов. Профилактический эффект обнаруживает и производное карбамазепина — оксикарбазепин [Мосолов С.Н. и др., 1997]. Спектр клинической активности вальпроата такой же, как у карбамазепина и по эффективности они равны.
Терапевтические дозы карбамазепина при проведении профилактической терапии варьируют от 300 до 900 мг в сутки в зависимости от индивидуальной чувствительности больного, причем начальная доза составляет приблизительно */4 терапевтической. Терапевтическая доза вальпроата колеблется от 1200 до 1500 мг в сутки при начальной дозе 250 мг. Для уменьшения вероятности развития побочных эффектов повышение доз карбамазепина и вальпроата осуществляется постепенно в течение 5—7 дней. Для профилактики приступов аффективных расстройств при недостаточной эффективности одного из нормотимиков применяют их комбинацию — лития и карбамазепина, лития и вальпроата, что иногда дает хороший эффект.



