Клеточный трансплантат что это
Клеточная терапия нейродегенеративных заболеваний
Терапия нейродегенеративных заболеваний: возможности и перспективы
Г.НИККА, д.м.н., профессор, Т. ПИРОТ, д.м.н., профессор
Отделение стереотаксической нейрохирургии университетского неврологического центра г. Фрайбурга, Германия
Журнал «Медицинский совет» №7-8 (2010)
Опубликовано на сайте «Ремедиум»
Несмотря на то, что нейротрансплантация опробована на нескольких сотнях пациентов, она является экспериментальным методом лечения нейродегенеративных заболеваний. Пересадка человеческих фетальных тканей при болезни Паркинсона позволяет не только уменьшить симптоматику, прежде всего акинезию и ригидность, но и добиться устранения дискинезии и тремора у многих больных. В отдельных случаях могут развиться тяжелые вторичные двигательные нарушения. В настоящее время изучаются триггерные факторы этих нежелательных явлений и прогностические критерии.
Исследования возможностей нейротрансплантации при болезни Хантингтона показали, что донорские ткани сохраняются в окружении пораженных участков мозга без каких-либо признаков вовлечения в патологический процесс. Данные по изменению функционального статуса оказались неоднозначными. Тем не менее, группе французских трансплантологов, применявших усовершенствованный протокол, удалось продемонстрировать эффективность клеточной терапии.
Нейротрансплантация является многообещающим инновационным способом лечения нейродегенеративных заболеваний. При использовании оптимизированной методики можно достичь стойкой клинической ремиссии. В ходе дальнейших исследований предстоит определить условия, необходимые для проведения успешной терапии с минимальным риском развития побочных эффектов. Одновременно ведется фундаментальная работа по поиску альтернативных источников клеток, а новые стратегии их культивирования позволяют широко внедрять данный метод.
Нейродегенеративные заболевания, особенно идиопатический паркинсонизм и хорея Хантингтона, снижают качество жизни пациентов, ведут к потере самостоятельности и вызывают потребность в постоянном уходе.
Типичными проявлениями болезни Паркинсона являются оскудение двигательной сферы, ригидность мышц и тремор, обусловленные дегенерацией дофаминергических нейронов полосатого тела и, как следствие, дефицитом дофамина в базальных ганглиях. К сожалению, в настоящее время современная медицина не располагает средствами, которые могли бы остановить этот процесс.
Причиной болезни Хантингтона является мутация гена, кодирующего белок хантингтин. Однако механизмы, запускающие гибель клеток и патогенез функциональных ограничений до сих пор полностью не выяснены. Для данной патологии характерна моторная симптоматика (гипер- или брадикинезии), а по мере прогрессирования заболевания – развитие когнитивных и психических нарушений. Лечебные мероприятия ограничиваются проведением симптоматической терапии.
Паркинсонизм и хорея Хантингтона на протяжении многих лет являются краеугольным камнем клинических исследований по нейрореставрационной терапии [1].
Нейродегенеративные заболевания, особенно идиопатический паркинсонизм и хорея Хантингтона, снижают качество жизни пациентов, ведут к потере самостоятельности и вызывают потребность в постоянном уходе.
Интрацеребральная трансплантация на животных моделях
Болезни Паркинсона и Хангтингтона развиваются лишь у человека. Однако их проявления и патогенетические особенности могут быть воспроизведены у животных химическим путем. Для имитации паркинсонизма крысам между передним мозговым трактом и полосатым телом или непосредственно в стриатум вводится нейротоксин – 6-гидроксидофамин. Пересадка в полосатое тело пораженных животных тканей вентрального мезенцефалона уменьшает акинетико-ригидную симптоматику. Комбинированная гомотопическая трансплантация в черное вещество мозга дает дополнительные функциональные преимущества и стабилизирует результат [1].

Рисунок 1. Животная модель болезни Паркинсона (А), полученная путем унилатеральной инъекции 6-гидроксидофамина,
вызывающей потерю дофаминергической иннервации гемисферы при полном сохранении ее с противоположной стороны
и соответствующий контралатеральный дефицит сенсомоторных реакций.
Выделенные микрохирургически ткани вентрального мезенцефалона
обрабатывают механически и ферментативно.
Клеточную суспензию стереотаксически имплантируют в пораженную область мозга.
Аналогичным образом, с помощью введения иботеновой или квинолиновой кислот, моделируется болезнь Хантингтона. Доказано позитивное влияние трансплантации на моторные и когнитивные функции таких животных. Трансгенных мышей с патологией Хантингтона для оценки эффективности подобной терапии использовали редко. Однако проведенные на них эксперименты позволили подтвердить жизнеспособность трансплантата [2].
Клинические исследования по нейротрансплантации
Нейротрансплантация является многообещающим инновационным способом лечения нейродегенеративных заболеваний, при использовании оптимизированной методики можно достичь стойкой клинической ремиссии.
Болезнь Паркинсона стала первым нейродегенеративным заболеванием, на котором апробировали клеточную трансплантацию. В рамках испытаний операции проводились уже в конце 80-х и в 90-е годы прошлого века. Клинические исследования в Европе стартовали с унилатеральной пересадки фетальных человеческих клеток двум пациентам из шведского города Лунд, однако результаты не были впечатляющими. Позднее в неконтролируемом открытом исследовании оперативная техника была оптимизирована. Производилось стереотаксическое вмешательство с намеченной целью в области чечевицеобразного или хвостатого ядер. Улучшение по шкале UPDRS доходило до 40%. Объективно отмечали редукцию акинезии, ригидности, тремора и дискинезий. Появлялась возможность уменьшения доз медикаментозных препаратов [3,4].
Эффект был отсроченным и наступал примерно через 6 мес. Периоды «включения» постепенно удлинялись, и дозировки лекарств существенно снижались. Пациенты, которым в анамнезе для коррекции дискинезии требовалась медикаментозная терапия, после трансплантации обходились без нее [3,4]. По данным позитронной эмиссионной томографии (ПЭТ) наблюдалось долгосрочное восстановление церебрального метаболизма углеводов, в том числе вне базальных ганглиев [4,5].
В ходе двух контролируемых исследований, проведенных в США в 90-е годы, изучали эффективность нейротрансплантации. Некоторым пациентам инъецировали клетки вентрального мезенцефалона, а больным группы контроля делали плацебо-операцию. Первичные конечные точки не были достигнуты в обеих работах. Исследователи зафиксировали тяжелое побочное явление – новую независимую форму дискинезии, возникающую в течение года после трансплантации и, ввиду причинно-следственной связи, обозначенную как трансплантат-ассоциированную (GID, Graft induced dyskinesia). Достоверного улучшения состояния пациентов в группе вмешательства не наблюдалось. В то же время при анализе по подгруппам в одном из исследований имела место положительная динамика, но только на фоне приема иммуносупрессоров (6 мес) и с регрессом после их отмены. При ином подходе к делению выборки значимую пользу от трансплантации получали пациенты младше 60 лет. Исследования были прекращены в связи с развитием у некоторых его участников вторичных дискинезий неустановленной этиологии. В качестве гипотез рассматривались анамнестические указания на дискинезии до операции, иммунологические реакции, способы обработки тканей или пересадка серотонинергических нейронов. У некоторых больных после вмешательства проходили наблюдавшиеся ранее дискинезии [6,7].
Многочисленные методические расхождения в заборе и хранении материала или выборе целевых структур мозга отличали приведенные работы от проводившихся ранее открытых исследований. Международный консорциум из ведущих нейротрансплантационных центров в Северной Америке и Европе анализирует данные подвергшихся трансплантации лиц, чтобы разработать протоколы для будущих исследований, которые позволят достичь стабильного положительного результата лечения и свести к минимуму вероятность осложнений.
Хотя в контролируемых исследованиях клинического улучшения достигали лишь некоторые больные, у большинства оно было очевидным и стойким [3,4,8,9]. Посмертное гистологическое обследование показало, что трансплантированные фетальные ткани сохраняют жизнеспособность, по меньшей мере, в течение 16 лет и трансформируются в зрелые дофаминергические нейроны 11. Донорские клетки устанавливают связи с нервной системой реципиента. При этом у некоторых пациентов уже спустя 3 года после вмешательства возникает полноценная иннервация скорлупы чечевицеобразного ядра за счет трансплантата.

Рисунок 2. А: Трансплантат, окрашенный крезиловым фиолетовым, при небольшом увеличении.
Клетки из темно-фиолетовых скоплений расселяются на периферию (нечеткий край).
B+C: Большое увеличение после иммунофлюорисцентного окрашивания.
Красные клетки – специфический стриальный тип (трансплантат).
Зеленые волокна принадлежат реципиенту и образуют контакты с телами инъецированных нейронов
В отличие от паркинсонизма при болезни Хангтингтона трансплантируются ГАМКергические нервные клетки ганглионарных бугорков. В проведенном в США систематическом исследовании, включившем 3 пациентов [Kopyov, 1998], у 2 и них отмечалось незначительное улучшение двигательной и нейропсихической функций. Использовались клетки латерального ганглионарного бугорка. Как и в случае с болезнью Паркинсона, источником тканей служил абортивный материал. Целевой областью были хвостатое и чечевицеобразное ядра.
В еще одном американском исследовании, охватившем 7 больных из г. Тампа (Флорида), также имплантировали клетки латерального бугорка [13]. Один пациент был исключен из-за объемной субдуральной гематомы, возникшей при падении и существенно утяжелившей его состояние. В отношении остальных прооперированных сообщается об улучшениях в двигательной сфере спустя 12 мес после вмешательства. Между тем ПЭТ, проведенная через 2 года, выявила значительное уменьшение плотности стриальных D1- и D2-рецепторов по сравнению с контрольной группой. Авторы уклонились от однозначной интерпретации этих данных, ссылаясь на отсутствие гистологического подтверждения. Обсуждались варианты отмирания трансплантата или влияния техники диссекции [15].
Обнадеживающие результаты получила группа французских ученых, выполнивших трансплантацию 5 пациентам в рамках пилотного исследования после двухгодичного предоперационного наблюдения. Через 24 мес у 4 больных наблюдалось стойкое улучшение когнитивных и моторных функций [16]. ПЭТ подтвердила повышение метаболизма глюкозы в лобной доле и полосатом теле троих наиболее стабильных больных. У четвертого, выигрывавшего клинически в меньшей степени, в зоне трансплантата образовалась киста. Следует обратить внимание на методические особенности этой работы: с каждой стороны вводились ткани от единственного или максимум двух доноров, ганглионарную область иссекали целиком и проводили 3-кратную иммуносупрессию. По истечении 6 лет эффект сохранился у всех трех пациентов. За эти годы клиника заболевания увеличилась незначительно. Когнитивные расстройства положительно ответили на терапию [17].
Объединение нейротрансплантологов Великобритании под руководством кадриффского центра мозга поставили цель изучить безопасность клеточной трансплантации в исследовании «NEST-UK». У 4 набранных пациентов не было зарегистрировано абсолютно никаких интра- или периоперационных осложнений. Однако в связи с принятием новых правовых норм работа была приостановлена и ее возобновление планируется в конце 2010 г.
В настоящее время проводится контролируемое многоцентровое европейское исследование эффективности клеточной терапии. Дизайн исследования предполагает выполнение трансплантации через 6 или 18 мес после рандомизации, что позволит проверить гипотезу о преимуществах раннего вмешательства.

Рисунок 3. Планирование операции трансплантации человеческих фетальных стволовых клеток
пациентке с болезнью Хантингтона
Во Фрайбургской серии трансплантации были сделаны 18 пациентам. Все операции прошли без осложнений. Риск передачи заболеваний от донора к реципиенту сведен к минимуму благодаря программе тщательного скрининга биологических образцов. Согласно литературным данным, при посмертных гистологических исследованиях отмечалась иннервация трансплантата нейронами реципиента. В пересаженных клетках не было выявлено признаков, характерных для болезни Хангтингтона [18]. На трансплантат не распространялся патологический процесс и в нем идентифицировали зрелые нейроны, экспримирующие регионспецифические маркеры [19]. Во Фрайбурге получен посмертный гистологический препарат одного больного. Его трансплантат был выделен из тканей всей ганглионарной области. На момент изучения пересаженные клетки уже имели признаки региональной дифференцировки, хотя еще не все маркеры зрелых нейронов были налицо. Следует отметить, что данный случай отличался наименьшим сроком после проведения операции из описанных в литературе [20].
Предметом следующего исследования являются массивные патологические реакции со стороны трансплантата. Сообщается о результатах вскрытия 3 пациентов, которым вводили клетки латеральных бугорков [21]. Отличительной особенностью была выраженность поражения церебральных тканей реципиента. Наряду с этим в человеческом препарате впервые были обнаружены кортикостриальные глутаматергические проекции, расцениваемые на основании опыта с животными моделями как признак функциональной интеграции трансплантата. Тем не менее, исследователи пришли к выводу о патологической роли указанных изменений, мотивируя это тем, что болезнетворное окружение посредством таких связей повреждает пересаженные клетки. Похожий механизм обсуждался и при болезни Паркинсона. С другой стороны, в трансплантате не было найдено типичных для болезни Хангтингтона аггрегатов убиквитина.
Кроме того, в исследуемых образцах отмечена массивная локальная иммунная активность, возможно указывающая на реакцию отторжения. Подобное толкование гармонирует с прочими упоминаниями об отторжениях трансплантата и подчеркивает необходимость изучения нейроиммунологических основ аллотрансплантации.
Перспективы нейротрансплантации и задачи будущих исследований
Проведенные исследования показали, что при надлежащей методологии и соблюдении критериев селекции клеточная трансплантация является эффективным и безопасным способом лечения. В будущем изучение стволовых клеток поможет заменить сомнительные с этической точки зрения фетальные ткани иными клеточными ресурсами, например индуцированными плюрипотентными стволовыми клетками. В свою очередь на современном этапе научные исследования с фетальными тканями уже внесли большой вклад в развитие нейротрансплантации: позволили определить показания и противопоказания к ее выполнению, а также оптимизировать методику.
Эксперименты на животных с атипичным синдромом Паркинсона обозначили возможности нейрореставрационной терапии при лечении данной патологии у людей. Положительные результаты клинических исследований должны вдохновить ученых на интенсификацию работы в этой области в ближайшие годы. Тем не менее, учитывая большое число нерешенных проблем и открытых вопросов, клеточная терапия пока не может быть выпущена за рамки научного поиска.
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
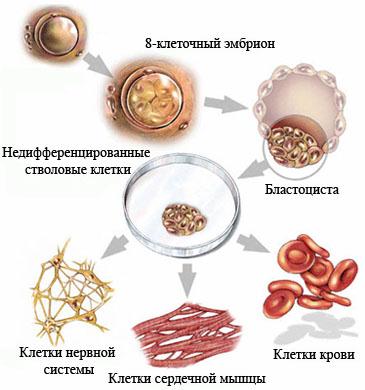
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 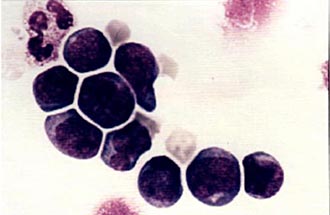 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
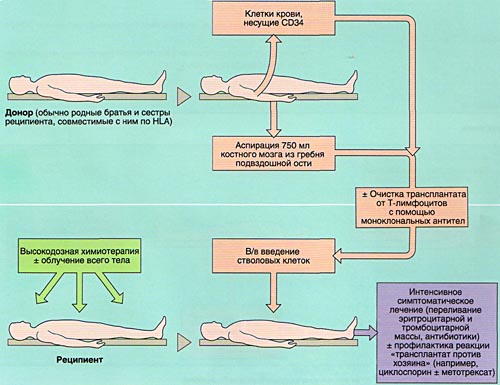
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
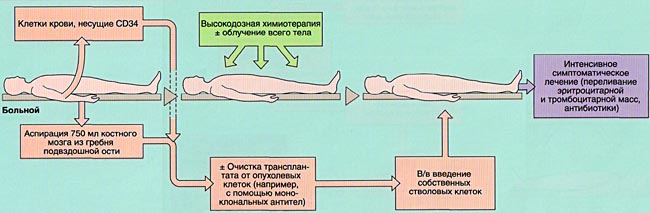
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Информация для пациентов
В названном номере газеты опубликована статья о внедрении « челябинскими кардиологами нового метода лечения ишемической болезни сердца», заключающегося во введении в организм больного так называемых « фетальных тканей». Не касаясь этических вопросов, возникающих при получении данных тканей ( последние можно получить в процессе абортов) и послуживших основой для запрета их использования в ряде стран с развитой медициной, мы хотели бы охарактеризовать данный, в большинстве случаев пока экспериментальный, метод терапии с профессиональных позиций. Хотя авторы публикации называют внедряемую методику « трансплантацией фетальных тканей», имеется более общепринятое название для данных методов – клеточная трансплантация. Клеточная трансплантация широко изучается многими лабораториями мира [1-8,10]. Сущностью применяемых субстанций для клеточной трансплантации, с которой первоначально гипотетически связывался биологический эффект, является так называемая стволовая клетка, « прародитель» всех существующих в организме человека клеток и тканей. На способности стволовой клетки превращаться в любую специфическую ткань и основываются смысл идеи клеточной трансплантации и надежды на возможную ее высокую лечебную эффективность. Естественно, в кардиологии специфической тканью, на восстановление которой направлены все разработки по клеточной трансплантации, является ткань миокарда – кардиомиоциты и капиллярные сосуды, питающие их.
Анализируя предлагаемый « метод лечения ишемической болезни сердца», целесообразно выделить его компоненты в виде вопросов с последующим ответом на них на основе опубликованных в международной литературе данных и сравнении последних с оригинальной челябинской методикой:
1. Каков клеточный и биологический состав вводимых авторами метода « фетальных» тканей?
2. Каковым был способ введения данных тканей в организм пациентов-волонтеров?
3. При каком заболевании вводились « фетальные» ткани и оценивалась эффективность их использования?
4. На основании каких критериев произведена оценка положительного результата введения « фетальных» тканей при данном заболевании?
Из данного описания следует, что, вероятнее всего, полученная в процессе аборта плодная ткань использовалась в виде суспензии всех имеющихся фетальных клеток. В зарубежных странах полипотентная клетка выделяется не из плодных тканей, а из тканей костного мозга, ауто- или аллогенного происхождения [1]. Кроме того, для клеточной трансплантации с целью замещения погибших клеток миокарда используются аутомиобласты ( предшественники миоцитов) скелетных мышц, строго говоря, не являющиеся стволовыми клетками [1,2,3]. Вместе с тем, при выделении клеточного материала из костного мозга человека возникает много вопросов. К примеру, до конца не выявлен оптимальный тип стволовых клеток костного мозга, наиболее приемлемый для клеточной трансплантации: мононуклеарные клетки, мезенхимальные стволовые клетки или предшественники гемопоэза. В целом, установлено, что клетки костного мозга стимулируют формирование кровеносных сосудов в миокарде, т.е. ангиогенез, но механизм этой стимуляции оказался связанным не с превращением введенных стволовых клеток в клетки эндотелиального фенотипа, а с наличием в клеточной субстанции ангиогенез — стимулирующих факторов. Также нет данных о дифференциации введенных стволовых клеток в фенотип кардиомиоцита. Улучшение же функции инфарцированного миокарда экспериментальных животных после трансплантации клеток костного мозга происходит, вероятно, лишь вследствие активизации неоангиогенеза, в связи с чем используется термин биошунтирование ( по аналогии с аорто-коронарным шунтированием) [3].
Экспериментальные данные относительно миобластов более конкретны. Они трансформируются в зрелые мышечные клетки, оставаясь скелетными, т.е. без какого-либо изменения по направлению к кардиомиогенному роду клеток, при одновременном улучшении функции миокарда [1]. Вероятно поэтому имплантация скелетных миобластов названа клеточной кардиомиопластикой по аналогии с динамической кардиомиопластикой [8].
Следует подчеркнуть, что в лабораториях, занимающихся так называемым тканевым инженерингом, т.е. созданием тканей для трансплантации, пока не удалось заставить стволовую клетку превратиться в кардиомиоцит или, к примеру, гепатоцит. Для выращивания этих тканей выделяют бластные дифференцированные клетки сердца или печени. На настоящий момент полипотентная клетка in vitro демонстрирует дифференциацию в клетки тканей, близких к соединительной: костной и хрящевой [8].
Таким образом, механизм действия введенных клеток не совпадает с гипотетическими представлениями о полипотентной стволовой клетке, « спешащей» заменить любую поврежденную ткань пациента или лабораторного животного.
Используемая авторами « нового метода» клеточная субстанция столь не однородна, что разобраться в механизме ее действия, а в случае какой-либо эффективности лечения – связать эту эффективность с трансформацией стволовой клетки в кардиомиоцит или эндотелиальную клетку, по меньшей мере, наивно. Тем не менее, поскольку установлена возможность применения клеток костного мозга для стимуляции неоангиогенеза у лабораторных животных с острым миокардиальным инфарктом или устойчивой к лечению ишемии, нельзя исключить и возможность подобного « биошунтирующего» действия « фетальных тканей», но возникает вопрос о способе их доставки к поврежденному участку сердца.
Касаясь методики введения фетальных тканей авторами « нового метода», можно с уверенностью полагать, что оригинальная субстанция вводилась одним из парентеральных методов, более вероятно внутривенным. Вместе с тем, следует упомянуть тот факт, что ключевым моментом в проведении любой трансплантационной процедуры является доставка прививаемого материала к объекту замещения. Исключением из этого правила может являться лишь трансплантация костного мозга в гематологической практике, проводимая простым неселективным введением трансплантируемых тканей. Но в этом случае следует помнить о вездесущности ретикуло-эндотелиальной системы и о том, что трансплантационная процедура направлена на замещение всеобщего медиума организма – крови. Иная ситуация имеется при попытках лечения клеточной трансплантацией некроза или сниженной сократительной способности миокарда. Единственным способом введения прививаемого материала в этом случае, будь то один из типов стволовых клеток костного мозга, скелетные миобласты или фетальные клетки, является введение его интрамиокардиально, т.е. напрямую в миокард путем пункции зоны повреждения со стороны эпикарда / эндокарда или ее скарификации [5,6,7,10]. Таким образом, доставка трансплантируемых клеток может быть осуществлена только посредством хирургической ( или эндоскопической, катетеризационной) операции. Введение фетальных или иных тканей в вену приведет лишь к « оседанию» единичных клеток и клеточных групп в « чудесной капиллярной сети» легких, а пораженный миокард никогда не получит целебные клетки. Еще менее перспективны в этом смысле подкожные или внутримышечные введения. Таким образом, клеточная трансплантация – хирургический метод лечения и противопоставлять ее любой иной операции на сердце, как это сделано в анализируемой статье, нелепо. Допущение возможности получения эффекта от простого введения тканей в вену означает наивную веру авторов в волшебное превращение фетальной, стволовой клетки в кардиомиоцит или другие клетки, а именно это и не подтверждают международные исследования [1,8].
Если же вернуться к вопросу о выборе патологии для оценки эффективности клеточной трансплантации, то наиболее подходящей для этого категорией больных являются пациенты с кардиомиопатией. Эта патология трудно поддается и консервативной, и хирургической коррекции, что оправдывает любые действия, направленные на помощь этим больным. Кроме того, состояние пациентов и полученные от оценки их гемодинамики данные являются наиболее чувствительными тестами для определения эффективности клеточной трансплантации. Но и здесь существуют проблемы связанные с клиническим использованием клеток костного мозга и, особенно, миобластов из-за выраженного аритмогенного эффекта от их интрамиокардиального введения. В работе Smits PC, van Geuns RJ, Poldermans D et al.[9] из пяти больных, которым было введены аутомиобласты, одному больному пришлось имплантировать кардиовертер-дефибриллятор в связи с возникновением пароксизмов желудочковой тахикардии и фибрилляции. По мнению R.Makkar, M.Lill b Chen ( Университет Калифорнии, США), высказанному в редакционной заметке к данной статье, « возникновение аритмий после клеточной трансплантации является серьезным ограничивающим фактором клинического применения данного метода».
Наконец, касаясь последнего вопроса о критериях оценки положительной эффективности « трансплантации фетальных тканей», совершенно непонятными являются такие показатели, как уровень артериального давления, количество и качество холестерина, биохимические показатели и наиболее непонятный критерий – качество жизни. В целом, не ясно, на каком теоретическом основании авторы методики связывают перечисленные параметры с введением « фетальных тканей». Допуская возможность влияния « трансплантации фетальных тканей» на уровень артериального давления или холестерина, а также на « качество жизни», авторы метода приближаются к признанию реальности существования народно-сказочных « молодильных яблочек» и булгаковских « яичников обезьяны». Неоднократно предупреждая читателя о недопустимости спекуляций в вопросах клеточной трансплантации, они занимаются именно этим, спекулируя данными, почти наверняка не относящимися к эффектам клеточной трансплантации.
В заключение, необходимо констатировать, что « новый метод лечения ишемической болезни сердца», внедренный « челябинскими кардиологами», это еще один шаг на пути создания сонмища самобытных, оригинальных, далеких от данных мировой науки методов, которыми кишит наша современная действительность, методов, уводящих российскую медицинскую науку и практику в тупик лженауки, непрофессионализма и изоляции.
ООО «Центр Хирургии Сердца»
454047, Челябинск, Цветочный тупик, 2А