Клацид или супракс при пневмонии что лучше
Cовременные макролиды в лечении внебольничной пневмонии
Приведена классификация различных видов пневмоний, факторы риска. Показано, что кларитромицин, наряду с высокой антибактериальной активностью, оказывает модулирующее влияние на фагоцитоз, хемотаксис, киллинг и апоптоз нейтрофилов, что обеспечивает регресс
Classification of different forms of pneumonia, factors of risk were given. It is shown that claritromicin, together with the high antibacterial activity, has a modulating influence on the phagocytosis, chemotaxis, killing and apoptosis of neutrophils, which ensures the reduction of symptoms and improvement in the state of patients.
Пневмония — группа различных по этиологии, патогенезу и морфологии острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с внутриальвеолярной экссудацией, выявляемых при физическом и рентгенологическом исследованиях, а также выраженными в различной степени лихорадочной реакцией и интоксикацией (Российское респираторное общество, 2010 г.). По данным ЦНИИ организации и информатизации здравоохранения МЗ РФ в 2008 году пневмонией переболели 424 457 человек, а в 2009 году — 449 673 пациента [1, 2]. Показатель заболеваемости пневмонией значительно выше у пожилых больных и составляет от 25 до 114 на 1000 человек в год [3].
Пневмонии занимают первое место среди причин летальности от инфекционных болезней и шестое место — среди всех причин летальности [4]. Наиболее часто смертельные исходы наблюдаются при пневмониях тяжелого течения, особенно у социально неблагополучных лиц или у пациентов, имеющих тяжелую сопутствующую патологию [5, 6].
Различают следующие виды пневмонии:
Внебольничные пневмонии являются самой многочисленной группой, характеризуются тяжелым течением и высоким риском осложнений, среди которых плеврит, абсцессы и другие гнойно-деструктивные процессы [10].
Все внебольничные пневмонии делятся на следующие группы:
Факторами риска неблагоприятного течения внебольничных пневмоний являются:
1. Возраст старше 60 лет.
2. Сопутствующие заболевания:
3. Неэффективность стартовой антибактериальной терапии.
Неотложная госпитализация в отделения реанимации и интенсивной терапии требуется в тех случаях, когда у пациента имеют место признаки тяжелого течения внебольничной пневмонии, к которым относятся:
Известно, что при внебольничной пневмонии основным возбудителем является пневмококк (Streptococcus pneumoniae) [12], вторым по значимости возбудителем является гемофильная палочка (Haemophilus influenzae) [13].
Кроме обязательных лабораторно-инструментальных исследований в диагностике внебольничных пневмоний в настоящее время применяются различные шкалы PSI и CURB-65/CRB-65 [14].
С целью определения факторов риска, распространенности, структуры и частоты летальных исходов при пневмонии в многопрофильном стационаре скорой медицинской помощи авторами было проведено ретроспективное исследование, в ходе которого было проанализировано 180 727 карт стационарных больных. Из них 172 420 больных (95,5%) были пролечены и выписаны, 1677 (0,9%) пациентов были переведены в другие ЛПУ, а 6630 больных (3,6%) умерли.
Из числа умерших в исследование было включено 1497 случаев подтвержденной на секции внебольничной пневмонии, которые были разделены авторами на две подгруппы: «Внебольничная пневмония как основное заболевание» (I) включала 97 больных (6,4%) и «Внебольничная пневмония как осложнение основного заболевания» (II) включала 1400 (93,6%) пациентов (рис. 1).
Среди 1497 умерших пациентов с внебольничной пневмонией было 768 мужчин (51,4%) и 729 женщин (48,6%) (рис. 2).
Возрастная структура 1497 пациентов с внебольничной пневмонией представлена на рис. 3. Как видно из данной иллюстрации, большинство больных (43%) были старше 75 лет.
Из 1497 случаев внебольничной пневмонии, закончившейся летальным исходом, в 136 наблюдениях (9%) имело место расхождение клинического и патологоанатомического диагнозов (рис. 4).
По характеру поражения плевропневмония встречалась в 49,4% случаев, очагово-сливная пневмония — в 22,6%, абсцедирующая — в 19,5%, а очаговая — в 8,5% наблюдений.
По локализации чаще встречались двусторонние внебольничные пневмонии — 41 (42,2%). Сводная таблица локализаций поражения легочной ткани при внебольничной пневмонии представлена ниже (табл. 1).
Внебольничная пневмония в 71,1% случаев сочеталась с ХАИ, в 56% случаев — с перенесенными ОНМК, в 24,7% случаев — с ХОБЛ, в 32% наблюдений — с мультифокальным атеросклерозом, в 25,7% случаев — с ишемической болезнью сердца (ИБС), в 20,6% событий — с СД 2-го типа (рис. 5).
Таким образом, в подавляющем большинстве наблюдений внебольничная пневмония вторична, т. е. является осложнением основного или фонового заболевания, отягощает его течение и ухудшает прогноз больных. Полученные авторами данные в случае подозрения на пневмонию диктуют необходимость проведения диагностического поиска, направленного на выявление субстрата для развития воспалительного процесса в легочной ткани. В связи с этим диагностика, а зачастую и лечение внебольничной пневмонии остаются одной из актуальных проблем современной терапии. Выбор антибиотика для лечения пневмонии осуществляется обычно эмпирически. При этом ориентирами для его выбора становятся эпидемиологическая ситуация, предполагаемая чувствительность флоры (табл. 2) и некоторые другие отягощающие факторы [15].
Полусинтетический макролид кларитромицин наряду с аминопенициллинами и респираторными фторхинолонами занимает одно из ведущих мест в терапии внебольничной пневмонии и других инфекционных заболеваний нижних отделов дыхательных путей. Многогранное этиопатогенетическое действие кларитромицина на процесс бактериального воспаления обеспечивает его высокую эффективность, подтвержденную в ряде сравнительных исследований. Антимикробный спектр кларитромицина, включающий S. pneumonia, H. influenza, а также новые пролонгированные формы препарата, определяет его востребованность в терапии данной категории пациентов. При наличии атипичных микобактерий и Pseudomonas aeruginosa кларитромицин применяется в комбинации с другими антимикробными препаратами, значительно повышая эффективность проводимой терапии.
Механизм антимикробного действия кларитромицина обусловлен нарушением синтеза белка в микробной клетке. В результате обратимого связывания с 50 S-субъединицей рибосом и ингибирования реакций транслокации и транспептидации происходит торможение формирования и наращивания пептидной цепи [16]. Основной эффект кларитромицина — бактериостатический, но при высоких концентрациях и низкой микробной плотности в отношении S. pyogenes и S. pneumoniae препарат оказывает бактерицидное действие. При этом антимикробная активность в отношении данных возбудителей и метициллиночувствительных штаммов Staphylococcus aureus в 2–4 раза выше, чем у эритромицина [17].
Во многих клинических исследованиях и в результате многолетнего опыта применения выявлена высокая эффективность кларитромицина в терапии инфекций нижних отделов дыхательных путей. Согласно результатам исследования, включавшего 252 пациента с внебольничной пневмонией, 7-дневный курс лечения пролонгированным кларитромицином (1000 мг 1 раз в сутки) оказался столь же клинически эффективным, как и аналогичное по продолжительности назначение левофлоксацина (500 мг 1 раз в сутки). Общая частота эрадикации патогенов (87% и 88% соответственно) и рентгенологического улучшения (95% и 88% соответственно) также не различалась. Оба препарата оказались одинаково эффективными как при типичных, так и при атипичных возбудителях [18].
При тяжелом течении внебольничной пневмонии в условиях стационара более эффективна комбинированная терапия. Это подтверждено многими клиническими наблюдениями. В когортном исследовании с участием 1391 пациента с внебольничной пневмонией установлено, что смертность при лечении комбинацией цефалоспорина III поколения с макролидом в 2 раза ниже, чем при монотерапии бета-лактамом [19]. В другом исследовании показано: комбинация бета-лактама с макролидом эффективнее таковой бета-лактама с фторхинолоном (смертность — 4,9% и 15,0% соответственно) [20].
Независимо от антимикробного эффекта кларитромицин, как и ряд других макролидов, проявляет противовоспалительное, иммуномодулирующее и мукорегулирующее действия на уровне респираторной системы. Кларитромицин оказывает модулирующее влияние на фагоцитоз, хемотаксис, киллинг и апоптоз нейтрофилов. Происходит ингибирование окислительного «взрыва», в результате уменьшается образование высокоактивных соединений, способных повреждать собственные ткани. Ингибируется синтез и/или секреция провоспалительных (интерлейкинов-1, 6, 8, фактора некроза опухоли альфа) и усиливается секреция противовоспалительных цитокинов (интерлейкинов-2, 4, 10) [21].
Таким образом, наличие дополнительных свойств наряду с высокой антибактериальной активностью обеспечивает быстрый регресс симптомов и улучшение состояния пациентов при терапии кларитромицином инфекций дыхательных путей.
Кларитромицин обоснованно занял свою нишу в терапии острых и хронических инфекций респираторного тракта. Он сохраняет одно из лидирующих мест в амбулаторной практике и на фармацевтическом рынке РФ, что обусловлено широким спектром активности, быстрым достижением высоких пиковых концентраций в очаге инфекции и благоприятным профилем безопасности. Лекарственная форма с замедленным высвобождением действующего вещества за счет специального поверхностного слоя и матриксной основы (Клацид СР) идентична по эффективности стандартной, лучше переносится, способствует повышению комплаенса и может рекомендоваться для активного применения. Имеющиеся на сегодня доказательные данные о неантибактериальном действии в совокупности с благоприятными клинико-фармакологическими характеристиками кларитромицина позволяют рассматривать его в качестве адъювантного препарата в терапии многих заболеваний органов дыхания.
Литература
А. Л. Верткин, доктор медицинских наук, профессор
Ж. М. Оралбекова
А. С. Скотников, кандидат медицинских наук
ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
Эффективность цефалоспорина III поколения цефиксима (супракса) при заболеваниях органов дыхания у детей
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Оптимизация антибиотикотерапии при лечении заболеваний органов дыхания должна подчиняться основным принципам, с одной стороны, соответствия строгим показаниям и адекватного выбора наиболее эффективного препарата с учетом антибиотикограммы и, с другой — отказа от необоснованного назначения антибиотика. Необходимо учитывать тяжесть течения и период заболевания, чувствительность микрофлоры бронхов к назначенному препарату, наличие и характер побочных явлений антибиотика, а также дозу препарата с учетом возрастных особенностей. Выбор антибактериального препарата и путей его введения у детей до сих пор представляет сложную задачу для врача, особенно при рецидивирующих и хронических бронхолегочных заболеваниях.
В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в практике в связи с наличием лекарственных форм, предназначенных для детей, в виде суспензий, сиропов, таблеток с соответствующей дозировкой. Оценивая классические пути введения антибиотиков, а именно парентеральный (внутривенный и внутримышечный) и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему психотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя как основной метод лечения болезней органов дыхания, при многих несомненных достоинствах (точность дозирования, высокие пиковые концентрации) не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции, вероятностью послеинъекционных осложнений, а также психотравмирующим действием инъекций как болезненного фактора. Все это диктует необходимость дифференцированного подхода к выбору методов введения антибиотиков и разумного ограничения показаний к парентеральному введению препаратов у детей.
Особого внимания заслуживает также внедрение в детскую практику «ступенчатого» метода лечения, сокращающего сроки парентерального введения антибиотиков до 2–5 дней. Он заключается в переходе на прием адекватного антибиотика внутрь перорально при наметившемся положительном клиническом эффекте.
Трудно переоценить значение создания новых пролонгированных форм антибиотиков, способствующих сокращению кратности их введения и обладающих не только широким спектром действия, но и низкой токсичностью, что особенно важно для детей.
Использование антибиотиков внутрь, особенно пролонгированных форм, значительно уменьшает риск распространения инфекционных заболеваний, снижает нагрузку на медицинский персонал и позволяет шире применять препараты как в стационаре, так и в поликлинических условиях.
Однако следует подчеркнуть, что прием антибиотиков внутрь (оральная антибактериальная терапия) как стартовое лечение наиболее показано при легких и среднетяжелых формах болезни, в том числе при заболеваниях верхних дыхательных путей, неосложненных острых пневмониях и обострениях хронических и рецидивирующих воспалительных бронхолегочных заболеваний.
Многолетний клинико-бактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН, позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном 3 пневмотропными микроорганизмами [1]. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 61–70%, из которых в 27% случаев она находится в ассоциации с Streptococcus pneumonia. Streptococcus pneumoniae выделяется у 36% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis — 4–10%, Рroteus mirabilis — 2,2%, Klebsiella pneumoniae — 1,1%, Streptococcus pyogenes — 1,1%, Staphylococсus aureus — 0,1% [1].
Учитывая распространенность устойчивых к препаратам пенициллинового ряда и макролидам штаммов микроорганизмов, а также их высокую b-лактамазную активность, в том числе Haemophilus influenzae и Branchamella catarrhalis, препаратами выбора при рецидивирующих и хронических заболеваниях органов дыхания являются цефалоспорины II и III поколения.
Сравнительное изучение бактериологической активности цефалоспоринов I, II и III поколений по отношению к пневмотропным бактериям, выделяемым при бронхолегочных заболеваниях у детей, позволило установить высокую бактериологическую активность цефалоспоринов III поколения (табл. 1). При этом четко показано отсутствие существенной разницы в активности парентеральных и пероральных форм антибиотиков по отношению к основным этиологически значимым микробам при данной патологии [2]. Все это обосновывает применение пероральных форм цефалоспориновых антибиотиков III поколения при рецидивирующих и хронических бронхолегочных заболеваниях.
В последние годы внимание педиатров привлечено к полусинтетическому оральному цефалоспориновому антибиотику III поколения цефиксиму (супраксу), характеризующемуся широким спектром действия и высокой активностью в отношении грамотрицательных микроорганизмов: Haemophilus influenzae, Branchamella catarrhalis, в том числе лактамазообразующих бактерий, большинства штаммов энтеробактерий, таких, как Klebsiella pneumoniae, Escherichia coli и пр., а также в отношении протеев [3,4,5].
Супракс обладает бактерицидным механизмом действия, и по степени активности против Haemophilus influenzae и Branchamella catarrhalis он не уступает парентеральным цефалоспоринам III поколения, характеризуется пролонгированной фармакокинетикой, созданием эффективной концентрации в крови и очагах воспаления, в тканях и жидкостях организма. Важным является образование эффективной концентрации цефиксима в мокроте (0,016-0,04), в легочной ткани (0,04-0,22) и в других тканях верхних дыхательных путей. Минимальная подавляющая концентрация цефиксима составляет: в отношении Streptococcus pneumoniae — 0,01-0,25, Haemophilus influenzae — 0,06-0,25, Branchamella catarrhalis — 0,01-0,8 (3,6). Достоинство препарата заключается также в наличии детской лекарственной формы для приема внутрь в виде суспензии (для детей в возрасте от 6 месяцев до 8 лет в дозе 8 мг на 1 кг массы) и капсул (для детей старше 12 лет в дозе 400 мг), обладающих пролонгированным действием, что обеспечивает однократный прием антибиотика.
Основными показаниями для назначения цефиксима (супракса) у детей являются заболевания верхних и нижних дыхательных путей при установленной или вероятной этиологии воспаления, вызванной чувствительными штаммами микробов (табл. 2).
Курс лечения цефиксимом (супраксом) при острой пневмонии составляет 7–10 дней, при обострении рецидивирующего бронхита — 7–10 дней, при обострении хронических воспалительных бронхолегочных заболеваний — 10–14 дней и более.
Высокая клиническая и бактериологическая эффективность цефиксима (супракса) доказана, в том числе при многоцентровых исследованиях у детей при заболеваниях органов дыхания [4, 5, 6, 7, 8].
Нами проведено изучение эффективности и безопасности супракса у 61 ребенка в возрасте 3–15 лет при обострениях рецидивирующего бронхита (15 детей), хронических воспалительных бронхолегочных заболеваний (46 детей), развившихся в результате неблагоприятного исхода острых пневмоний с формированием хронического бронхита на основе пневмосклероза, деформации бронхов и бронхоэктазов, а также на фоне врожденных пороков развития бронхов и легких. Все дети в периоде обострения бронхолегочного процесса получали наряду с супраксом комплексную терапию, включающую муколитические, мукорегуляторные и бронхоспазмолитические препараты по показаниям, кинезитерапию. Клиническая эффективность выявлена у 54 из 61 (88,6%) больного. Она характеризуется:
Клиническая эффективность препарата подтверждается результатами бактериологических исследований. Эрадикация микробов из мокроты или бронхиального секрета к 6-7-му дню лечения супраксом наблюдалась:
Однако у 4 детей при эрадикации Haemophilus influenzae на фоне приема цефиксима был выделен Streptococcus pneumoniae. Возможно, у этих больных имела место реинфекция.
Как правило, дети хорошо переносили препарат, и побочных эффектов не наблюдалось.
В заключение следует отметить высокую эффективность нового перорального цефалоспоринового антибиотика III поколения цефиксима (супракса) при лечении острых, рецидивирующих и хронических воспалительных заболеваний органов дыхания у детей. Наличие детской лекарственной формы (суспензии), пероральный способ приема 1 раз в сутки, широкий спектр действия, высокая чувствительность основных этиологически значимых бактерий, отсутствие выраженных побочных эффектов, щадящий метод лечения — все это ставит препарат в число перспективных антибактериальных средств в педиатрической практике, что особенно важно при нарастании резистентности микробов к другим антибиотикам. Эти качества позволяют применять супракс у детей раннего и старшего возраста не только в стационаре, но и в амбулаторных условиях при заболеваниях органов дыхания, в том числе при лечении рецидивирующих и хронических заболеваний органов дыхания.
По вопросам литературы обращайтесь в редакцию.
Е. В. Середа, доктор медицинских наук, профессор
Л. К. Катосова, доктор биологических наук, профессор
И. К. Волков, доктор медицинских наук
Научный центр здоровья детей РАМН, Москва
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
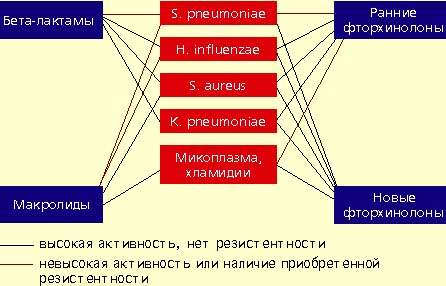 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
.gif)
.gif)
.gif)
.gif)
_575.gif)