Что такое низкодифференцированная карцинома
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
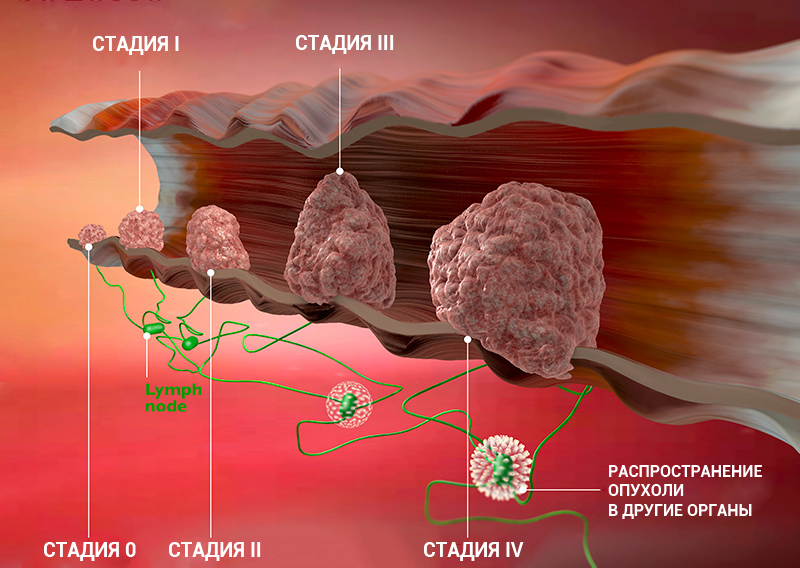
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Что такое низкодифференцированная карцинома
Карцинома с невыявленной первичной локализацией (КНПЛ) — это гистологически подтвержденная метастатическая злокачественная опухоль, для которой первичный источник не был обнаружен при детальном клиническом и лабораторном обследовании [1—3]. Поиск первичного очага затруднен тем, что биология этих опухолей предполагает возможность метастатической диссеминации без роста первичной опухоли, а в случае, когда первичный очаг удалось обнаружить, его размер редко превышает 2 см [1]. Термин «карцинома с невыявленной первичной локализацией» используется с середины прошлого века по сегодняшний день для всех злокачественных опухолей без выявленного первичного очага, несмотря на то что около 5% этих опухолей представлено метастазами меланомы, саркомы или лимфомой [1—4]. Известный первичный опухолевый очаг позволяет применить специфические таргетные схемы лечения, и часто именно патолого-анатомические методы позволяют установить природу клеток-родителей метастаза (например, опухоль с экспрессией иммуногистохимических (ИГХ) маркеров cytokeratin (CK) 20 и CDX2, а также отсутствием экспрессии CK7 практически всегда соответствует метастазу колоректального рака). Отсутствие известного источника метастаза ведет к дополнительным диагностическим исследованиям, задержке химиотерапии, применению неэффективных и/или комбинированных схем лечения (и повышению токсического эффекта терапии), эмоциональному напряжению пациента вследствие отсутствия определенного диагноза, снижению качества жизни и ухудшению прогноза заболевания [1, 3, 5]. В данной статье рассмотрены общие практические подходы к патолого-анатомической диагностике метастатических опухолей без выявленного первичного очага.
Анализ клинической информации
Анализ клинической информации при КНПЛ всегда следует проводить тщательным образом, запрашивая у клинициста результаты всех выполненных обследований, внешнего осмотра пациента, анамнеза болезни, так как любые клинические данные позволяют патологу сузить дифференциальный диагноз источников метастаза, уточнить или уменьшить ИГХ-панель, сократить сроки выдачи заключения, а также материальные затраты лаборатории на диагностику. В совместном клинико-патолого-анатомическом подходе разработана прогностическая классификация КНПЛ, объединяющая две группы: благоприятную и неблагоприятную. Морфологические особенности опухолей в благоприятной группе (она составляет около 20% пациентов с КНПЛ) предполагают возможность постановки определенного диагноза даже при отсутствии анатомически выявленного первичного очага, а ведение таких пациентов соответствует методам, применяемым при опухолях с известной локализацией, что позволяет выбрать определенную тактику лечения и продлить выживаемость этих пациентов до 12 мес и более (табл. 1). 
При метастазах в лимфатическом узле необходимо исключить опухоль в органах, для которых пораженный лимфатический узел является регионарным (например, метастазы в подмышечных лимфатических узлах у женщин в 72% представлены карциномой молочной железы, метастазы в шейных лимфатических узлах выше надключичных в 75% представлены плоскоклеточным раком органов головы и шеи) [8—11]. При метастазах в лимфатических узлах шеи всегда следует уточнять результаты клинического осмотра органов носо- и ротоглотки. Описанный при КНПЛ нетипичный характер метастазирования, например метастазы аденокарциномы легкого в костях или карциномы предстательной железы в лимфатических узлах шеи, можно объяснить более быстрым ростом обнаруженных метастатических очагов по сравнению с метастазами в регионарных лимфатических узлах [10, 12].
Помимо сбора анамнеза и стандартных лабораторно-инструментальных исследований, в расширенный набор клинического обследования пациентов с КНПЛ должны быть включены такие методы, как анализ кала на скрытую кровь, маммография для женщин, определение концентрации некоторых сывороточных маркеров (простатического специфического антигена для мужчин, альфа-фетопротеина, бета-человеческого хорионического гонадотропина, белков СА125, СА19−9) [3].
Морфологическая диагностика КНПЛ
Применение только световой микроскопии при известных данных клинического обследования позволяет патологу предположить один верный источник метастаза КНПЛ примерно в половине случаев, а в некоторых случаях чувствительность морфологического метода стремится к 90% (например, у колоректальной и простатической ацинарной аденокарциномы относительно специфический фенотип с наличием в опухоли «грязных» некрозов или мелких мономорфных желез с крупными ядрышками в округлых ядрах соответственно) [9, 13]. К группе «узнаваемых» также можно отнести метастазы фолликулярной и папиллярной карциномы щитовидной железы с секрецией коллоида и плоскоклеточного рака с наличием «жемчужин» из кератиновых масс. Однако зачастую возможности базовой окраски гематоксилином и эозином недостаточно для проведения дифференциальной диагностики, и целью световой микроскопии становится определение набора ИГХ-маркеров для типирования метастаза.
Существует несколько морфологических классификаций КНПЛ. Классификация Европейского общества медицинской онкологии выделяет следующие группы: высоко- и умеренно дифференцированная аденокарцинома, плоскоклеточная карцинома, нейроэндокринная карцинома, низко-/недифференцированная карцинома, низкодифференцированная опухоль [1]. Для дальнейшего клинического ведения пациента рекомендуется определять метастаз в одну из этих групп, однако, если аденокарцинома, плоскоклеточный рак и нейроэндокринный рак зачастую демонстрируют характерные морфологические признаки в виде железистого паттерна роста, очагов ороговения, типичного хроматина «соль—перец» соответственно, то в группах недифференцированных карцином/опухолей отсутствует специфический фенотип. Это не позволяет однозначно высказаться о возможном источнике опухоли и требует широкой ИГХ-панели для исключения неэпителиальных опухолей.
Классификация, предложенная F. Lin и соавт. [9, 14, 15], разделяет метастазы КНПЛ на: 1) метастазы с наличием признаков, позволяющих предположить тип опухоли (например, очаги ороговения/плоскоклеточной метаплазии, микрососочковая или сосочковая архитектура, продукция пигмента, слизи, коллоида или остеоида, светлоклеточная или перстневидно-клеточная морфология, бифазная морфология, «грязные» некрозы и т. д.); 2) метастазы опухолей с наличием железистой дифференцировки (высоко- и умеренно дифференцированные аденокарциномы); 3) метастазы с неопределенной линией дифференцировки (веретеноклеточные, мелкокруглоклеточные, эпителиоидно-клеточные, плеоморфные или недифференцированные опухоли) (рис. 1). 
Практический алгоритм диагностики источника метастаза КНПЛ, основанный только на гистологической архитектуре и цитологических особенностях клеток метастаза, в настоящее время отсутствует, но разделение на указанные выше морфологические типы опухоли позволяют сузить ИГХ-панель для дальнейшей диагностики первоисточника [9, 10, 16].
Иммуногистохимическая диагностика КНПЛ
ИГХ-исследование остается золотым стандартом в диагностике КНПЛ, так как позволяет работать с фиксированным в формалине и залитым в парафин материалом, является относительно легко интерпретируемым анализом, обладает низкой себестоимостью и обеспечивает быстрый результат [17—19]. В среднем патологу требуется 8—10 маркеров для диагностики одного случая метастаза КНПЛ [6, 7]. В некоторых исследованиях показано, что эффективность ИГХ для метастазов КНПЛ невысока и не превышает 30%, но следует учитывать, что результаты многих исследований не совсем соответствуют современной действительности, так как большинство из них проведено в начале 2000-х годов с применением слабоспецифичных ИГХ-маркеров [20]. В настоящее время в диагностике КНПЛ отдают предпочтение антителам к ядерным транскрипционным факторам, а также некоторым антителам к промежуточным филаментам клеток [15, 18, 21—23]. В рамках данной статьи будут описаны только базовые моменты ИГХ-диагностики, так как данная тема широко изложена на страницах многих руководств [21, 22].
Диагностический ИГХ-алгоритм для КНПЛ основан на приведенной выше морфологической классификации с разделением на метастазы злокачественных опухолей без формирования желез и метастазы аденокарциномы с формированием желез [13, 15, 22, 24]. Для злокачественных опухолей без формирования желез необходимо всегда уточнять линию дифференцировки опухоли и не стремиться назначить широкую панель сразу, а выполнять поэтапное ИГХ-исследование. В тех случаях, когда материала в биоптате крайне мало и есть риск срезать из блока всю опухоль при его тримминге, лучше сразу изготовить несколько запасных срезов, но окрашивать их поэтапно.
На первом этапе диагностики низко- и недифференцированных опухолей большинство авторов предлагают использовать следующие маркеры: антитело широкого спектра действия к нескольким цитокератинам (например, маркеры CAM5.2, OSCAR, AE1/3, MNF116) и маркеры S100, Vimentin и Leukocyte Common Antigen (LCA) (табл. 2) 

Для метастазов карциномы с наличием железистой дифференцировки начальный этап ИГХ-диагностики в настоящее время не отличается от предложенного еще в конце прошлого века алгоритма с применением антител к низкомолекулярным кератинам — СК7 и СК20 (табл. 3) 
Иммунопрофиль CK7/20 дополняется ИГХ-диагностикой с применением антител к ядерным транскрипционным факторам, которые обладают высокой чувствительностью и специфичностью для карцином разной степени дифференцировки. В табл. 4 приведены основные маркеры этой группы, а также опухоли, в которых их экспрессия встречается чаще всего [2, 15, 18, 21, 22, 33]. Некоторые ИГХ-алгоритмы, в которых основную роль играют антитела к факторам транскрипции, а профиль СК7/20 оценивается только на конечных этапах, демонстрируют чувствительность до 65% в метастазах высоко- и умеренно дифференцированных аденокарцином [33]. Следует учитывать, что некоторые карциномы имеют неспецифический или схожий иммунофенотип, например дуктальная аденокарцинома поджелудочной железы и аденокарцинома из билиарного эпителия, в таких случаях можно ограничиться формулировкой «метастаз аденокарциномы панкреатобилиарного типа». Также необходимо обращать внимание на специфические типы экспрессии, например, в метастазах аденокарцином слюнных желез наблюдается экспрессия р63 и других миоэпителиальных маркеров по периферии фокусов аденокарциномы (рис. 3). 
Для идентификации метастазов нейроэндокринных неоплазий (НЭН) наиболее специфичными маркерами являются synapthophysin и chromogranin A, менее специфичен маркер CD56, так как экспрессируется в ряде карцином, однако он обладает высокой чувствительностью к НЭН [22]. Для подтверждения НЭН лучше использовать как минимум два маркера из указанных выше, а также следует обращать внимание на тип экспрессии цитокератинов, который довольно специфичен и проявляется в виде точечного парануклеарного окрашивания в мелкоклеточном нейроэндокринном раке и карциноме из клеток Меркеля. В редких случаях можно определить первичную локализацию нейроэндокринной опухоли, например экспрессия маркера РАХ8 встречается в карциноиде поджелудочной железы, а SATB2 — в карциноиде толстой кишки [35, 37]. Мелкоклеточный нейроэндокринный рак не требует определения первичного очага, так как хорошо реагирует на химиотерапию [34—37]. ИГХ-определение первичной локализации для метастазов плоскоклеточного рака невозможно для большинства локализаций, однако в плоскоклеточном раке орофарингеальной зоны (область небных миндалин и корня языка) наблюдается экспрессия маркера p16, а в тимической плоскоклеточной карциноме часто присутствует экспрессия CD5 и CD117 — эти маркеры могут быть использованы для уточнения источника метастаза [38, 39].
Генетическое исследование — альтернатива ИГХ?
Одна из первых работ, где было показано, что профиль экспрессии генов (ПЭГ) в метастазах может быть использован для обнаружения локализации первичной опухоли, была опубликована еще в 2001 г., а в настоящее время в продаже уже доступно несколько тестов для определения ПЭГ в метастазах КНПЛ и низкодифференцированных карциномах — CancerTYPE ID (от компании bioTheranostics), Cancer Origin Test (Rosetta Genomics), EPICUP (Ferrer, IDIBELL) [6, 7, 40—42]. При валидации тестов на материале опухолей с известной первичной локализацией точность определения клеток-родоначальников опухоли достигает 99%, а при тестировании метастазов КНПЛ (с подтвержденным впоследствии первичным источником) — 87% [6, 21, 43]. Предложенный В. Centero [43] в 2010 г. диагностический алгоритм для КНПЛ с применением комбинации генетических тестов и ИГХ продемонстрировал точность исследования 90%. В случаях, когда установить единственный источник метастаза при ИГХ-диагностике невозможно, последующее применение результатов исследования ПЭГ позволяет лечащему врачу скорректировать схему терапии для 50% КНПЛ-пациентов и изменить диагностическую тактику для 65% [44]. Недостатками методов диагностики с исследованием ПЭГ являются высокая стоимость (около 3000 долл. США), сомнительные результаты теста при малом количестве материала, перекрестные результаты, ограниченный набор последовательностей нуклеотидов в ДНК-микрочипе теста, что не позволяет включить все возможные опухоли в дифференциальный диагноз [6, 24, 44, 45].
Применение генетических методов исследования позволило открыть новые перспективы в изучении природы и лечения КНПЛ. Используя комплексное геномное профилирование, J. Ross и K. Wang [46] в 2015 г. доказали, что в 85% КНПЛ генетические альтерации являются таргетными для химиотерапии (например, в генах ALK, BRAF, EGFR, KRAS и др.), что в целом ставит под сомнение необходимость определения локализации первичной опухоли.
Заключение
Современная патолого-анатомическая диагностика КНПЛ базируется на комплексном анализе клинических, морфологических, иммуногистохимических исследований, но даже всесторонний анализ не всегда приводит врача к одной локализации, в таких случаях следует указать в заключении несколько возможных источников метастаза, чтобы сузить клинический поиск. Для успешной диагностики КНПЛ патолог должен быть знаком как с морфологией различных опухолей, так и с особенностями экспрессии доступных в лаборатории антител, а также учитывать возможные аберрантные типы экспрессии в низкодифференцированных карциномах.
Автор заявляет об отсутствии конфликта интересов.