Что такое натрий оаш
Гидроксид натрия (Е524)

Общая характеристика
Научное название добавки Е524 – гидроксид натрия или едкий натр. Это очень агрессивное вещество синтетического происхождения не имеет аналогов в природе. В естественных для себя условиях оно принимает вид белых чешуек или небольших гранул мыльных на ощупь.
В наше время широко используется в разных отраслях жизнедеятельности, в том числе медицине, фармакологии, пищевой индустрии. В сельском хозяйстве, например, каустическую соду используют для проверки коровьего молока на наличие примесей. Это вещество применяют в производстве разных видов бытовой химии (самые популярные – для прочистки водопроводных и канализационных труб). В косметологии едкий натр добавляют в шампуни, мыло, жидкости для снятия лака, кремы, а также в средства для избавления от ороговевшей кожи. Кроме того, гидроксид натрия – незаменимое вещество в нефтеперерабатывающей, целлюлозно-бумажной промышленности и в производстве дизельного топлива.
В пищевой промышленности гидроксид натрия используют для регуляции кислотности, как стабилизатор и эмульгатор. Несмотря на весьма агрессивные свойства и внушительный список побочных эффектов, каустическая сода в качестве пищевой добавки разрешена во всем мире.
Опасные свойства каустической соды
Каустическая сода – довольно опасное вещество. На коже и слизистых оболочках при контакте с ней образуются глубокие и очень болезненные раны. Очень опасен контакт каустической соды с глазами, так как вызывает атрофию зрительного нерва, что ведет к слепоте. Если случайно вдохнуть порошок едкого натра, начнется приступ сильного кашля, одышка, появится боль в горле и даже возможен отек дыхательных легких. И можно только представить себе, что это вещество способно делать с нашими внутренними органами. Если случайно проглотить каустическую соду, очень быстро в животе появится сильная боль и чувство жжения, возможен анафилактический шок. При малейшем подозрении на отравление гидроксидом натрия важно немедленно вызвать скорую помощь. Участки кожи, пораженные едким натром, следует промыть несильным раствором борной или уксусной кислоты, слизистые оболочки – чистой водой, глаза – сначала обработать очень слабым раствором борной кислоты, а затем водой.
Хоть в пищевой промышленности гидроксид натрия используют в микродозах, но при регулярном употреблении пищи, содержащей Е524, возможны побочные эффекты.
В чем может содержаться

Самая известная сдоба, приготовленная с использованием каустической соды – это немецкие рогалики. Черные консервированные оливки получают свой темный цвет и характерную консистенцию также благодаря добавке Е524. В изделиях из шоколада, какао, сливочного масла или других видов жиров гидроксид натрия ускоряет расщепление белков. Эта добавка приходит на помощь и тогда, когда необходимо быстро и без труда очистить плоды от кожицы. Для этого фрукты, ягоды или овощи просто обрабатывают каустической содой. Кроме того, регулятор кислотности Е524 используют в производстве кисломолочной продукции, маргаринов, мороженого, разных видов сладостей.
Гидроксид натрия – опасное химическое соединение. И хоть в пищевой промышленности Е524 используется в небольших дозах, которые обычно не представляют опасности для человека, излишняя осторожность не повредит. Если не желаете или не можете отказаться от Е-содержащей пищи сами, то постарайтесь хотя бы минимизировать количество «ешек» в рационе маленьких детей. А для этого не забывайте перед покупкой продукта проверять, из чего он состоит.
Что такое гидроксид натрия и где мы с ним сталкиваемся в быту
Сегодня хочу рассказать об очередном интересном химическом веществе, с которым мы часто сталкиваемся в быту. Это гидроксид натрия.
Что это такое
По традиции, как было, например, с глауберовой солью или аммиаком, начинаю с названий. Так уже исторически сложилось, что почти у всех химических веществ не одно, а несколько названий. Посмотрите, как по-другому можно назвать гидроксид натрия:
По своему виду это твердые белые кристаллы, которые очень легко впитывают в себя воду, даже ту, которая есть в воздухе, а вместе с ними – и содержащийся в воздухе углекислый газ. Поэтому, если это вещество хранить в открытой или неплотно закрытой таре, то можно в итоге запросто получить бесформенную, расплывшуюся белую массу, которую весьма проблематично будет добыть из этой тары. Особенно если она была стеклянная.
Впрочем, сейчас каустик уже практически не хранят в стеклянной посуде, перешли на пластмассовую. Почему? Потому что он вступает в химическую реакцию со стеклом и разъедает, разрушает его. Естественно, не мгновенно, а при длительном хранении. Это называется выщелачивание стекла – гидроксид натрия взаимодействует с соединениями кремния, которые входят в состав стекла.
Я уже рассказывала, что, когда организуете свою домашнюю лабораторию и делаете раствор гидроксида натрия, то хранить такой раствор нужно в пластиковой бутылке, но никак не в стеклянной.
Что еще нужно знать про физические свойства этого вещества? Оно хорошо растворяется в воде с выделением достаточно большого количества тепла.
Если вдруг захотите потрогать руками (настоятельно не советую!), то обнаружите эффект мыльных рук. Ну а следом за этим – достаточно чувствительные и долго не заживающие ожоги кожи – едкий натр полностью оправдывает это свое название.
В природе это вещество не встречается, его получают в промышленности химическими или электрохимическими способами. Кстати, используется это вещество в достаточно больших количествах – около 60 миллионов тон в год во всем мире. Для чего? Давайте посмотрим.
Применение
Начнем с самого простого – без едкого натра не обойдется ни одно производство мыла. Любого. Хозяйственное, туалетное, банное, детское, гипоаллергенное, антибактериальное, с запахом, без запаха…
Любое мыло, включая самодельное (если оно делается с самого начала, а не из уже готовых компонентов, которые уже прошли эту химическую реакцию), невозможно без гидроксида натрия, это – основной компонент мыла. Поэтому когда я слышу что-нибудь типа «Это – натуральное мыло, в нем нет никакой химии», меня сразу пробивает на смех.
Мыло – это типичный, классический случай применения химии в жизни человека. И, на мой взгляд, далеко не самый плохой и бесполезный.
Следующая довольно обширная область применения едкого натра – в производстве бумаги, картона и различных искусственных волокон и полимеров.
Не отстает от бумажной и текстильная промышленность – гидроксидом натрия обрабатывают хлопок и шерсть.
Само собой разумеется, что без этого интересного и важного вещества не обходится ни одна химическая лаборатория. Это – стандартный и неотъемлемый реактив любой лаборатории.
Это же касается и химической промышленности. Химические свойства гидроксида натрия позволяют его применять и как катализатор, и для нейтрализации различных кислот, и в производстве масел, и многое-многое другое.
В быту это вещество встречается в составе средств для прочистки канализационных труб. Самый простой пример – «Крот», о котором я в свое время много писала. Гидроксид натрия используют здесь именно из-за его высокой химической активности, «агрессивности», способности растворять сильные загрязнения, в том числе жиры и остатки пищи, которые порой скапливаются в кухонных трубах.
Как ни удивительно, не обошлось без него и в пищевой промышленности. Пусть не в таких масштабных количествах, как в том же производстве бумаги или мыла, но и здесь гидроксид натрия на своем месте. Он даже является пищевой добавкой Е524. Его используют в производстве шоколада, какао, мороженого, газированных напитков, карамели, выпечки. Естественно, в очень небольших количествах, но, тем не менее, без него не обойтись.
Еще одна область использования – в автомобильных щелочных аккумуляторах. Правда, не знаю, насколько такие аккумуляторы сейчас востребованы.
Из своей практики помню случай, когда работала в Курчатове, и военные, охранявшие территорию нашего Института, попросили сделать электролит для аккумулятора с плотностью 1,27. Честь возиться с щелочью выпала мне как молодой, только что пришедшей на работу лаборантке.
До сих пор помню, как тщательно растворяла и фильтровала раствор, а потом замеряла ареометром, будто от этого зависела моя жизнь
Что же касается косметологии, то гидроокись натрия напрямую используется для удаления бородавок. Если вы сталкивались с этим, то наверняка можете вспомнить, как покупали маленькие пластиковые флаконы с надписью «Чистотел» или что-то в этом духе. Растение чистотел здесь совершенно не при чем. В пузырьке налит именно раствор гидроксида щелочи. Аккуратно наносишь его на ороговевшую часть кожи и ждешь – а вдруг поможет.
На своем опыте (давно, правда, это было, еще на третьем курсе университета) могу сказать, что действительно помогает, если делать это регулярно.
Кроме того, все шампуни и моющие средства содержат небольшие количества этого вещества. Именно поэтому косметологи рекомендуют после мытья головы шампунем ополаскивать ее слабым раствором яблочного или обычного уксуса – именно для нейтрализации щелочи, содержащейся в шампуни.
Техника безопасности
Гидроксид натрия – сильная щелочь (второй класс опасности), с которой нужно обращаться осторожно, так как она вызывает сильные химические ожоги, а при длительном воздействии – долго не заживающие язвы.
Вот краткие правила по обращению с ним:
Несмотря на то, что это вещество пожаро- и взрывобезопасно, хранить его нужно, как я уже говорила, в пластмассовой таре или пластиковых мешках, герметично запечатанных. Вдали от источников тепла и прямых солнечных лучей. Помещение для хранения должно быть прохладным и сухим.
Если вы решили прочистить дома канализационные трубы и купили для этого специальное средство, то внимательно прочитайте инструкцию к нему. Как правило, в состав этого средства будет входить гидроксид натрия, а в инструкции будет написано, что с ним необходимо работать в резиновых перчатках и избегать вдыхания паров. Думаю, не нужно объяснять, почему?
Итоги
Итак, я рассказала в общих чертах о гидроксиде натрия, который, оказывается, используют не только химики в лабораториях, но с ним мы сталкиваемся и в быту.
О химических свойствах предлагаю поговорит в следующей статье. Заодно я расскажу и покажу несколько опытов, которые вы легко сможете сделать самостоятельно.
Надеюсь, вам понравилась моя статья. Рассказывайте в комментариях свои случаи из жизни, дополняйте или поправляйте меня, если с чем-то не согласны. Надеюсь, вам, как и мне, всегда интересно узнавать что-то новое.
До встречи в следующей статье!
Гидроксид натрия
| Гидроксид натрия | ||||||||
 | ||||||||
 | ||||||||
| Общие | ||||||||
|---|---|---|---|---|---|---|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь | |||||||
| Химическая формула | NaOH | |||||||
| Физические свойства | ||||||||
| Молярная масса | 39,997 г/моль | |||||||
| Плотность | 1,59 г/см³ | |||||||
| Термические свойства | ||||||||
| Температура плавления | 323 °C | |||||||
| Температура кипения | 1403 °C | |||||||
| Химические свойства | ||||||||
| Растворимость в воде | 108,7 г/100 мл | |||||||
| Безопасность | ||||||||
| Токсичность | Ацетат уранила-цинка | |||||||
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
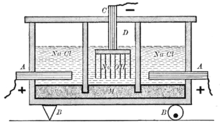
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + е = Na 0 nNa + + nHg − = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: