Что такое мкт и ее основные понятия
Основные положения МКТ
Молекулярно-кинетическая теория – это учение о строении и свойствах вещества, основанное на представлении о существовании атомов и молекул, как наименьших частиц химических веществ.
Основные положения молекулярно кинетической теории строения вещества
Основные положения молекулярно-кинетической теории молекулы:
Основные положения мкт и их примеры были перечислены выше. Между частицами имеется малое гравитационное воздействие.
Броуновское движение молекул и атомов подтверждает существование основных положений молекулярно кинетической теории и опытно обосновывает его. Данное тепловое движение частиц происходит с взвешенными в жидкости или газе молекулами.
Опытное обоснование основных положений молекулярно кинетической теории
Выражение r 2 > = D t объясняет диффузионный закон. По теории имеем, что D монотонно возрастает с увеличением температуры. Беспорядочное движение проглядывается при наличии диффузии.
Диффузия – это определение явления проникновения двух или нескольких соприкасающихся веществ друг в друга.
Данный процесс происходит быстро в неоднородном газе. Благодаря примерам диффузии с разными плотностями можно получить однородную смесь. При нахождении в одном сосуде кислорода O 2 и водорода H 2 с перегородкой то при ее удалении газы начинают смешиваться, образую опасную смесь. Процесс возможен при нахождении вверху водорода, а внизу кислорода.
Процессы взаимопроникновения также протекают в жидкостях, но намного медленней. Если растворить твердое тело, сахар, в воде, то получим однородный раствор, который является наглядным примером диффузионных процессов в жидкостях. При реальных условиях смешивание в жидкостях и в газах замаскировано быстрыми процессами перемешивания, к примеру, при возникновении конвекционных потоков.
Диффузия твердых тел отличается своей замедленной скоростью. Если поверхность взаимодействия металлов очистить, то можно увидеть, что с течением большого периода времени в каждом из них появятся атомы другого металла.
Диффузия и броуновское движение считаются родственными явлениями.
При взаимопроникновении частиц обоих веществ движение беспорядочно, то есть, наблюдается хаотичное тепловое перемещение молекул.
Броуновское движение
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы имеют в своем составе положительные и отрицательные заряды. При больших расстояниях преобладают силы межмолекулярного притяжения, при небольших – силы отталкивания.
Беспорядочное хаотичное движение молекул называют тепловым движением.
В твердых телах молекулы двигаются беспорядочно около фиксированных центров, то есть, положений равновесий. В пространстве может быть распределены нерегулярным образом (у аморфных тел) или с образованием упорядоченных объемных структур (кристаллических тел).
Агрегатные состояния веществ
Свобода теплового движения молекул просматривается в жидкостях, так как у них нет привязки к центрам, что позволяет производить перемещения по всему объему. Этим объясняется ее текучесть.
Если молекулы располагаются близко, то могут образовывать упорядоченные структуры с несколькими молекулами. Данное явление получило название ближнего порядка. Дальний порядок характерен для кристаллических тел.
Расстояние в газах между молекулами намного больше, поэтому действующие силы малы, а их движения идут вдоль прямой, ожидая очередного соударения. Значение 10 – 8 м является средним расстоянием между молекулами воздуха в нормальных условиях. Так как взаимодействие сил слабое, газы расширяются и могут заполнять любой объем сосуда. Когда их взаимодействие стремится к нулю, то говорят о представлении идеального газа.
Кинетическая модель идеального газа
В мкт количество вещества считается пропорциональным числу частиц.
Данная величина совпадает с массой протона и нейтрона.
Отношение массы атома или молекулы данного вещества к 1 12 массы атома углерода называют относительной массой.
Двойкам нет
Молекулярная физика — это один из разделов физики, который изучает физические свойства тел в различных агрегатных состояниях, а также их молекулярное строение, силы взаимодействия между частицами, из которых состоят тела, и характер теплового движения этих частиц.
Молекулярно-кинетическая теория (МКТ) — это раздел молекулярной физики, где объясняется строение и свойства тел за счет движения и взаимодействия частиц, из которых состоят эти тела.
Три положения молекулярно-кинетической теории:
Молекула — это самая наименьшая частица вещества, которая имеет все его химические свойства.
Атом — это самая наименьшая частица химического элемента. Молекула состоит из равного количества положительно и отрицательно заряженных частиц, поэтому она электрически нейтральна.
Молекула состоит из атомов, которые соединены химическими связями.
Макромолекула — это такая молекула, которая имеет тысячи повторяющихся групп атомов.
Относительная атомная или молекулярная масса — это величина, которая равна отношению массы молекулы (атома) к 1/12 массы атома изотопа углерода:
Количество вещества — это такая величина, которая характеризует число структурных элементов, из которых состоит система.
Структурные элементы — это атомы, молекулы, ионы и другие частицы.
Количество вещества определяется формулой:
Число Авогадро (постоянная Авогадро) — это число структурных элементов, содержащихся в одном моле вещества:
В Международной системе единиц единицей количества вещества является моль.
Молярная масса — это величина, которая равна отношению массы однородного вещества к количеству вещества:
В Международной системе единиц единицей молярной массы является килограмм на моль (кг/моль).
Изотермический процесс — это такой процесс, при котором происходит изменение состояния термодинамической системы, если температура не меняется.
Изотерма — это линия на диаграмме состояния, которая является гиперболой, показывает процесс изменения состояния термодинамической системы.
Изобарный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если давление не меняется.
Изобара — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изобарном процессе.
Изохорный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если объем не меняется.
Изохора — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изохорном процессе.
Смесь идеальных газов — совокупность нескольких разнохарактерных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Парциальное давление — это такое давление газа, которое является одним из составляющих газовой смеси, которое он бы оказывал, если бы при той же температуре один занимал объем, равный объему смеси.
Основные положения молекулярно-кинетической теории и их опытное обоснование
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
Эти основные положения подтверждаются экспериментально и теоретически.
Состав вещества
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
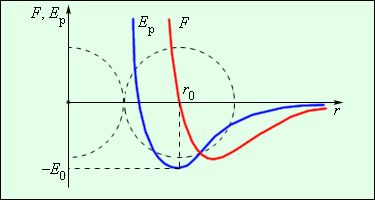
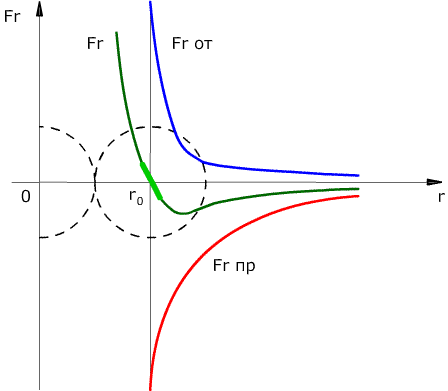
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
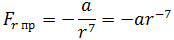 | (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
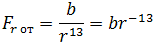 | (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
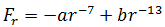 | (1.3) |
При r > r0 притяжение молекул превосходит отталкивание, при r
Броуновское движение (или брауновское движение ) – это непрерывное хаотическое движение малых частиц, взвешенных в жидкости или газе (при этом подразумевается, что сила тяжести не влияет на их движение).
Это явление впервые наблюдал Роберт Броун (Браун, годы жизни 1773 – 1858), когда рассматривал в микроскоп движение цветочной пыльцы, взвешенной в воде. В наше время для таких наблюдений используют маленькие части краски гуммигут, которая не растворяется в воде. В газе броуновское движение совершают, например, взвешенные в воздухе частицы пыли или дыма.
Броуновское движение частицы возникает потому, что импульсы, с которыми молекулы жидкости или газа действуют на эту частицу, не компенсируют друг друга. Молекулы среды (то есть молекулы газа или жидкости) движутся хаотично, поэтому их удары приводят броуновскую частицу в беспорядочное движение: броуновская частица быстро меняет свою скорость по направлению и по величине.
Броуновское движение – это тепловое движение, интенсивность которого возрастает с ростом температуры среды и продолжается неограниченно долго без каких-либо видимых изменений.Интенсивность броуновского движения также возрастает с уменьшением размера и массы частиц, а также при уменьшении вязкости среды.
Броуновское движение служит наиболее наглядным экспериментальным подтверждением существования атомов (молекул) и их хаотического теплового движения. Полнаямолекулярно-кинетическая теория броуновского движения была дана в 1905 – 1906 годах немецким учёным Альбертом Эйнштейном (1879 – 1955) и польским физиком Марианом Смолуховским (1872 – 1917). В 1908 – 1911 годах французский учёный Жан Перрен (1870 – 1942) провёл серию экспериментов по изучению броуновского движения и окончательно подтвердил закономерности этого движения, предсказанные на основе молекулярно-кинетической теории.
Рис. 1.2. Траектория движения броуновской частицы (частиц краски гуммигута в воде по Перрену).
Броуновское движение, например, в метрологии, является основной причиной, по которой точность чувствительных измерительных приборов ограничена, потому что тепловое движение атомов деталей приборов и окружающей среды вызывает дрожание стрелок измерительных приборов.
Масса и размер молекул
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То естьатомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
Молярная масса – это масса вещества, взятого в количестве одного моля:
где m0 – масса молекулы.
Молярная масса связана с относительной молекулярной массой соотношением:
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
Количество вещества равно отношению массы вещества к его молярной массе:
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создаютдавление газа.
Движение молекул в жидкостях
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, кактекучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Тепловое равновесие
Тепловое равновесие (или термодинамическое равновесие) – это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
В состоянии термодинамического равновесия не происходит теплообмен с окружающими телами, не изменяются объём и давление тела, отсутствуют взаимные превращения жидкостей, газов и твёрдых тел.
Температура и её физический смысл
Любая термодинамическая система при неизменных внешних условиях самопроизвольно переходит в состояние термодинамического равновесия.
Температура тела – это физический параметр, одинаковый во всех частях системы тел, которая находится в состоянии термодинамического равновесия.
При тепловом равновесии микроскопические процессы внутри тела (движение частиц и взаимодействие частиц) не прекращаются. Термодинамическая система может находиться в различных состояниях теплового равновесия, каждому из которых соответствует определённое значение температуры. При теплообмене между телами происходит обмен энергией: тела с большей энергией передают свою энергию телам с меньшей энергией. Направление теплообмена между ними указывает разность температур тел. То есть энергия передаётся от более горячего тела к менее горячему.
Температура и её измерение
Для измерения температуры используется тот факт, что с изменением температуры тела изменяются почти все его физические свойства: длина, объём, плотность, электрическое сопротивление, упругие свойства и др. Основой для измерения температуры может являться изменение какого-либо свойства термометрического тела.
Термометрическое тело – это тело, для которого известна зависимость какого-либо свойства данного тела от температуры. Термометрическим телом может быть, например, жидкость или газ, для которого известна зависимость изменения его объёма от температуры.
Эмпирическая шкала – это температурная шкала, установленная с помощью термометрического тела.
Наиболее распространён способ измерения температуры с помощьюжидкостного термометра, в котором используется расширение жидкости (изменение объёма) при нагревании.
При градуировке термометра отмечают опорные точки, расстояние между которыми на шкале делят на равные части, которые называются градусами.
Шкала температур Цельсия
Для практического употребления по решению IX Генеральной конференции по мерам и весам в 1948 году была принята международная стоградусная температурная шкала – шкала Цельсия.
Шведский физик и астроном Андерс Цельсий (1701 – 1744) в 1742 году предложил шкалу термометра, в которой за ноль градусов (начало отсчёта температуры) принял температуру таяния льда, а за сто градусов – температуру кипения воды при нормальном атмосферном давлении в 1,01325 * 10 5 Па. Изменение длины столба жидкости в термометре на одну сотую долю длины между отметками 0 и 100 °С соответствует изменению температуры на 1 °С. По данной шкале единица измерения температуры – градус Цельсия.
Перевести градусы из Цельсия в Фаренгейт можно так:
Перевод из Фаренгейта в Цельсий:
Здесь tF – температура по Фаренгейту, tC – температура по Цельсию