Что такое миелин его значение
Что такое миелин его значение
Перед обсуждением процессов нормальной миелинизации в головном мозге человека необходимо понимать строение миелина и его функции в центральной нервной системе. Миелин имеется и в центральной, и в периферической нервных системах. В ЦНС он находится преимущественно в белом веществе (хотя некоторые его количества имеются и в сером), как раз придавая ему такой цвет. Миелин работает по типу электрического изолятора: скорость проведения потенциала действия возрастает в 10-100 раз по сравнению с немиелинизированными волокнами. Юлия Эдгар и Джессика Гарберн (2004) показали, что отсутствие главного белка миелина (PLP/DM20) в олигодендроцитах приводит к серьезным нарушениям аксонального транспорта у мышей с моделью наследственной спастической параплегией. Также было выяснено, что миелин, вероятно, играет роль в регуляции как состава ионов, так и объема жидкости вокруг аксона.
Миелинизация – процесс образования билипидного миелинового слоя вокруг аксона. Данный процесс обеспечивает в дальнейшем быструю передачу информации, необходимую для когнитивной, поведенческой, эмоциональной функций. Миелинизация начинается во время эмбрионального периода и продолжается после рождения.
Миелин является модифицированным расширением отростков олигодендроглиальных клеток. Олигодендроцит является ключевой клеткой в миелинизации ЦНС и является преобладающим типом нейроглии в белом веществе. Миелиновая оболочка состоит из множественных сегментов миелина, которые обвиваются вокруг аксона. Данная оболочка способна проводить потенциал действия с его увеличением по аксону благодаря перехватам Ранвье, которые представляют собой немиелинизированные участки, содержащие натриевые ионные каналы – они и ответственны за ускорение проведения ПД по аксону. Миелин также находится в некотором симбиозе с аксоном. Миелин участвует в метаболических превращениях своих компонентов и содержит большое количество миелиновых ферментов. Миелин также играет роль в переносе ионов, что способствует буферизации ионов вокруг аксона.
Один олигодендроцит может обеспечивать миелиновой оболочкой до 40 волокон. Миелин примерно на 70% состоит из липидного компонента и на 30% – из белкового. Основной белок миелина (MBP) составляет 30% от всей белковой фракции, протеолипидный белок (PLP) – 50%, а фосфодиэстеразы циклических нуклеотидов – 4%. Липиды миелина в своем составе содержат холестерол, фосфолипиды, гликосфинголипиды.
Миелин и МРТ
Не существует МРТ методики или технологии, которая могла бы визуализировать напрямую миелиновый бислой. Миелин оценивается качественно на основании Т1- и Т2-ВИ, МР-спектроскопии, диффузно-тензорной визуализации (DTI). В клинической практике традиционная анатомическая визуализация является основой из-за своей легкости выполнения. Количественная оценка миелина может быть получена в многокомпонентном релаксационном (MCR или multicomponent relaxation) анализе. MCR-анализ – это объемно-взвешенное суммирование микроскопических компартментов воды. С помощью этого метода определяются два домена воды: медленно-релаксирующий домен, включающий свободную внутри- и внеклеточную воду, и быстро-релаксирующий домен, включающий в себя воду, заключенную в липидном бислое миелина.
На данный момент стандартные МРТ-последовательности не способны специфично подсчитывать количество миелина. Они позволяют оценить изменения в плотности и размерах аксонов, изменения в мембранной структуре, а именно содержание белков, липидов и воды. DTI – ненадежный показатель общего количества миелина, но все же дает информацию о его возможных изменениях.
Джеймс Баркович выделяет две отдельные популяции молекул воды, которые играют главную роль в формировании сигнала от миелина на МРТ – это те молекулы, которые находятся в миелиновой оболочке, и молекулы, находящиеся вне ее. На анатомических изображениях миелин имеет гиперинтенсивный сигнал по отношению к серому веществу на Т1- и гипоинтенсивный на Т2-ВИ. На Т1-ВИ гиперинтенсивность относительно коры определяется вероятнее всего наличием большого количества гликолипидов (особенно галактоцереброзидов) и холестерола в миелиновой оболочке. На Т2-ВИ гипоинтенсивность обусловлена уменьшенным содержанием воды.
Демиелинизирующие заболевания
В отличие от других приматов, люди демонстрируют уникальную картину постпубертатной миелинизации, которая может способствовать развитию психических расстройств и нейродегенеративных заболеваний, возникающих в раннем взрослом возрасте и за его пределами. Продолжительный период кортикального миелинирования у людей предоставляет большую возможность для нарушения процесса миелинизации, в результате чего повышается риск возникновения демиелинизирующего заболевания. Кроме того, было отмечено, что люди имеют значительно больший префронтальный объем белого вещества, чем другие виды приматов, что подразумевает и большую плотность миелина. Таким образом, повышенная плотность миелина у людей в результате длительного процесса миелинирования может повысить риск дегенерации и дисфункции миелина.
Демиелинизацию можно разделить на 2 типа:
Подразделение демиелинизирующих заболеваний на эти две группы условно, так как первые клинические проявления миелинопатий могут быть связаны с воздействием различных внешних факторов, а миелинокластии вероятнее всего развиваются у предрасположенных к ним лиц. Демиелинизирующие заболевания можно также разделить на те, которые затрагивают центральную нервную систему, и те, которые повреждают периферическую нервную систему.
Диагностика демиелинизирующего заболевания периферической нервной системы основывается на результатах электронейромиографии.
Демиелинизирующее заболевание
Демиелинизирующее заболевание представляет собой патологический процесс разрушения миелиновой оболочки, при котором поражаются нейроны головного и спинного мозга. При этом ухудшается проводимость импульсов в нервной системе. Болезнь характеризуется уничтожением миелина мозга. Это опасное состояние влияет на функционирование всего организма. Заболевание встречается с одинаковой частотой как у взрослых, так и детей. Современная медицина не обладает средствами для полного излечения от этого заболевания. Его можно лишь ослабить и замедлить течение.
Демиелинизация
Демиелинизирующее заболевание головного мозга по МКБ-10 имеет коды G35, G36 и G77. Процесс, вызванный поражением нервной ткани, негативно сказывается на функционировании всего организма в целом. Определенные нервные окончания покрыты миелиновой оболочкой, которая выполняет в организме важные функции. Например, миелин обеспечивает быструю передачу электрических импульсов и соответственно при нарушении этого процесса страдает вся система. Миелин состоит из липидов и белковых соединений в пропорции 70/30.
Демиелинизирующее заболевание — это не только рассеянный склероз, это еще и оптиконевромиелит и острый диссеминированный энцефаломиелит. Эти болезни не лечатся, но развитие их можно замедлить. В целом медики дают благоприятный прогноз при лечении этих патологий. Диагноз «рассеянный склероз» сейчас ставят чаще, но само заболевание протекает легче, чем 30-40 лет назад.
Механизмы развития
Нервная система состоит из центрального и периферического отделов. Механизм регуляции между ними работает следующим образом: импульсы от рецепторов периферической системы передаются в нервные центры спинного мозга, а оттуда в головной мозг. Расстройство этого сложного механизма становится причиной демиелинизации.
Нервные волокна покрыты миелиновой оболочкой. В результате рассматриваемого патологического процесса эта оболочка разрушается и на ее месте формируется фиброзная ткань. Она в свою очередь не может проводить нервные импульсы. В условии отсутствия нервных импульсов нарушается работа всех органов, поскольку мозг не может отдавать команды.
Причины
Демиелинизирующие заболевания головного мозга характеризуются поражением периферической и центральной нервной системы. Они чаще всего возникают на фоне генетической предрасположенности. Случается и так, что сочетание определенных генов провоцирует нарушения в функционировании иммунной системы. Выделяются и иные причины возникновения демиелинизирующих заболеваний:
Наиболее подверженной этой патологии считается европеоидная раса, особенно те ее представители, которые проживают в северных географических широтах. Такой тип заболевания может провоцироваться травмой головы или позвоночника, депрессией, вредными привычками. Некоторые типы вакцин также могут стать пусковым механизмом для начала развития таких патологий. Это относятся к прививкам против кори, оспы, дифтерии, гриппа, коклюша, гепатита В.
Классификация
Демиелинизирующее заболевание нервной системы классифицируется на различные типы, в основе которых лежит разрушение миелиновой оболочки. В связи с этим рассматриваемая патология подразделяется соответствующим образом на рассеянный склероз, болезнь Марбурга, болезнь Девика, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре.
Рассеянный склероз
Рассеянный склероз характеризуется как тяжелое хроническое и дезиммуно- нейродегенеративное заболевание ЦНС, склонное к прогрессированию. В большинстве случаев заболевание встречается в молодом возрасте и почти всегда приводит к инвалидности. Этому демиелинизирующему заболеванию ЦНС по МКБ-10 присвоен код G35.
В настоящее время причины развития рассеянного склероза до конца не изучены. Большинство ученых склоняются к мультифакторной теории развития этого заболевания, когда сочетается генетическая предрасположенность и внешние факторы. К числу последних относятся:
Прогрессирование рассеянного склероза характеризуется развитием следующей симптоматики:
Лечение рассеянного склероза осуществляется с помощью таких методов, как:
В период ремиссии пациентам показано санаторно-курортное лечение, массаж, лечебная физкультура. При этом должны быть исключены все тепловые процедуры. Для облегчения симптомов заболевания назначаются препараты: снижающие мышечный тонус, устраняющие тремор, нормализующие мочеиспускание, стабилизирующие эмоциональный фон, противосудорожные средства.
Болезнь Марбурга
Геморрагическая лихорадка или болезнь Марбурга представляет собой острую инфекционную патологию, вызванную марбургским вирусом. Он проникает в организм через поврежденную кожу и слизистую оболочку глаз и полости рта.
Симптоматика заболевания зависит от стадии патологического процесса. Инкубационный период длится от 2 до 16 дней. Болезнь имеет острое начало и характеризуется повышением температуры тела до высоких показателей. Наряду с температурой может появиться озноб. Нарастают признаки интоксикации, такие как разбитость, головная боль, боль в мышцах и суставах, интоксикация и обезвоживание. Через 2-3 дня после этого присоединяются расстройство функционирования ЖКТ и геморрагический синдром.
Все симптомы усиливаются к концу первой недели. Также могут наблюдаться кровотечения, из носа, желудочно-кишечного тракта, половых путей. К началу 2 недели все признаки интоксикации достигает своего максимума. При этом возможны судороги и потеря сознания. По анализу крови происходят специфические изменения: тромбоцитопения, пойкилоцитоз, анизоцитоз, зернистость эритроцитов.
При подозрении у человека болезни Марбурга он экстренно госпитализируется в инфекционное отделение и должен находиться в изолированном боксе. Период выздоровления может затянуться до 21-28 дней.
Болезнь Девика
Оптикомиелит или болезнь Девика по хронической картине похож на рассеянный склероз. Это аутоиммунное заболевание, причины возникновения которого до сих пор не выяснены. В качестве одной из причин его развития отмечается увеличение проницаемости барьера между мозговой оболочкой и сосудом.
Некоторые аутоиммунные заболевания способны спровоцировать прогресс болезни Девика:
Болезнь имеет специфическую симптоматику. Клинические проявления обусловлены нарушением проводящих импульсов. Кроме того, поражается зрительный нерв и ткань спинного мозга. В большинстве случаев болезнь заявляет о себе нарушением зрения:
При прогрессировании заболевания и отсутствии адекватного лечения больной рискует полностью потерять зрение. В некоторых случаях возможен регресс симптоматики с частичным восстановлением функций глаз. Иногда случается так, что миелит предшествует невриту.
Оптиконевромиелит имеет два варианта течения: поступательное нарастание симптоматики с одновременным поражением ЦНС. В редких случаях встречается монофазное течение болезни. Оно характеризуется устойчивым прогрессом и усугублением симптоматики. В этом случае повышен риск летального исхода. При правильно подобранном лечении патологический процесс замедляется, но при этом полное выздоровление не гарантируется.
Второй вариант, наиболее распространенный, характеризуется поочередной сменой ремиссии и обострения и обозначается понятием «рецидивирующее течение». Также сопровождается зрительными нарушениями и расстройством функции спинного мозга. В период ремиссии человек ощущает себя здоровым.
Для выявления болезни Девика проводится комплекс мероприятий. Помимо стандартных диагностических процедур проводится люмбальная пункция с анализом ликвора, офтальмоскопия и МРТ позвоночника и головного мозга.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Люди с иммунным дефицитом могут столкнуться с прогрессирующей многоочаговой мультифокальной лейкоэнцефалопатией. Это инфекционное заболевание, спровоцированное проникновением в организм вируса JC, относящегося к семейству Полиомавирусов. Особенностью патологии является то, что происходит несимметричное и многоочаговое поражение головного мозга. Вирусом поражаются оболочки нервных окончаний, состоящие из миелина. Поэтому данное заболевание принадлежит к группе демиелинизирующих патологий.
Почти 85% пациентов с таким диагнозом являются больными СПИДом или ВИЧ инфицированными. В группу риска входят пациенты со злокачественными опухолями.
Основные симптомы заболевания:
Синдром Гийена-Барре
Острое воспалительное заболевание, характеризующееся «демиелинизирующей полирадикулоневропатией». В ее основе лежат аутоиммунные процессы. Болезнь проявляется сенсорными расстройствами, мышечной слабостью и болью. Для нее характерны гипотония и расстройство сухожильных рефлексов. Также может наблюдаться дыхательная недостаточность.
Все пациенты с таким диагнозом должны госпитализироваться в отделение интенсивной терапии. Поскольку существует риск развития дыхательной недостаточности и может потребоваться подключение к ИВЛ, в отделении должна быть реанимация.
Демиелинизирующее заболевание ЦНС
Демиелинизирующие заболевания головного и спинного мозга – это патологические процессы, приводящие к разрушению миелиновой оболочки нейронов, нарушению передачи импульсов между нервными клетками мозга. Считается, что в основе этиологии заболеваний лежит взаимодействие наследственной предрасположенности организма и определенных факторов внешней среды. Нарушение передачи импульсов приводит к патологическому состоянию центральной нервной системы.
Какие это заболевания
Существуют следующие виды демиелинизирующих заболеваний:
Генетические заболевания
Когда происходит повреждение нервной ткани, организм отвечает реакцией – разрушением миелина. Заболевания, которые сопровождаются разрушением миелина, подразделяются на две группы – миелинокластии и миелинопатии. Миелинокластии – это разрушение оболочки под воздействием внешних факторов.
Миелинопатия – это генетически обусловленное разрушение миелина, связанное с биохимическим дефектом строения оболочки нейронов. В то же время, такое распределение на группы считается условным – первые проявления миелинокластии могут говорить о предрасположенности человека к заболеванию, а первые проявления миелинопатии могут быть связаны с повреждениями под воздействием внешних факторов.
Рассеянный склероз считают заболеванием людей с генетической предрасположенностью к разрушению оболочки нейронов, с нарушением метаболизма, недостаточностью иммунной системы и наличием медленной инфекции. К генетическим демиелинизирующим заболеваниям относятся: невральная амиотрофия Шарко-Мари-Тута, гипертрофическая невропатия Дежерина-Сотта, диффузный периаксиальный лейкоэнцефалит, болезнь Канавана и многие другие заболевания. Генетические демиелинизирующие заболевания встречаются реже, чем демиелинизирующие заболевания с аутоиммунным характером.
Симптомы
Демиелинизация всегда проявляется неврологическим дефицитом. Этот признак свидетельствует о начале процесса разрушения миелина. В него вовлекается и иммунная система. Атрофируются ткани мозга — спинного и головного, а также наблюдается расширение желудочков.
Проявления демиелинизации находятся в зависимости от вида заболевания, причинных факторов и локализации очага. Симптоматика может отсутствовать, когда поражение мозгового вещества незначительное, до 20%. Это обусловлено компенсаторной функцией: здоровые ткани мозга выполняют задачи пораженных очагов. Неврологическая симптоматика проявляется редко — только при повреждении более 50% нервной ткани.
В качестве общих признаков демиелинизирующих заболеваний головного мозга отмечаются следующие:
Нейропсихологические нарушения, характерные для рассматриваемой патологии, вызваны ухудшением памяти и снижением мыслительной деятельности, а также изменениями поведения и личностных качеств. Это проявляется развитием неврозов, депрессии, слабоумием органического генеза, эмоциональными перепадами, выраженной слабостью и снижением работоспособности.
Диагностика
Ранняя стадия течения патологии с отсутствием характерной симптоматики случайно обнаруживается во время диагностического обследования по другому поводу.
Для подтверждения диагноза проводится нейровизуализация, а также невролог определяет степень нарушения проводящей функции мозга. Основным методом диагностики является магнитно-резонансная томография. На снимках можно отчетливо увидеть участки пораженной ткани. Если сделать ангиографию, то можно определить степень повреждения сосудов.
Лечение
Демиелинизирующее заболевание ЦНС относится к категории неизлечимых. Терапевтические меры направлены на улучшение качества жизни пациента и устранение симптоматики. Для проведения симптоматической терапии назначают:
Прогноз
Прогноз относительно жизни больного напрямую зависит от характера течения заболевания, вида патологии и объема пораженной мозговой ткани. Если заболевание было диагностировано на ранней стадии и начато адекватное лечение, то прогноз относительно жизни благоприятный. Тем не менее невозможно полностью излечить болезнь. Она может привести к инвалидности или окончиться летальным исходом.
Как толщина миелина и эпигенетика помогают устойчивости к стрессу
Результаты экспериментов Валентины Боннефил и коллег показывают, что толщина миелина влияет на устойчивость к стрессу — истончение волокна ведет к социальному поражению у мышей
Автор
Редакторы
Статья на конкурс «био/мол/текст»: В недавней работе Валентины Боннефил и коллег были получены новые данные касательно молекулярных и опосредованных ими морфологических различий в мозге. По предположениям исследователей, именно они обусловливают различия реакций на сильный стресс. Для изучения этого явления была использована модель социального поражения, когда к испытуемой мыши подводят агрессивную мышь. После десяти дней исследуемые грызуны начинают вести себя по-разному — одни продолжают проявлять интерес к общению с другими особям, в то время как другие «замыкаются» в себе. Авторы работы показали, что вторая группа мышей характеризуется более высоким уровнем нарушений в нервной ткани из-за медленного ее восстановления, что, по-видимому, связано с эпигенетическими особенностями.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Согласно опросу 2017 года, проведенному Американской психологической ассоциацией, три из четырех американцев сообщают о симптомах стресса в течение тридцати дней, предшествующих опросу [1]. Мы сталкиваемся со всевозможными стрессами — личными, финансовыми, карьерными, новостными и т.д. — все чаще и чаще. Более того, с популярностью интернета появляются и новые виды потребностей и связанных с ними стрессов, например, в 2016 году было проведено исследование по изучению «синдрома упущенной выгоды» (fear of missing out) у подростков. Результаты показали, что увеличившаяся потребность в популярности связана с возросшим использованием Facebook и что эта связь опосредована страхом пропустить какое-либо событие. Появление этого страха, в свою очередь, вызывает повышение уровня стресса [2].
Но растет научное понимание влияния избыточного стресса в долгосрочной перспективе. Исследования показывают, что воздействие стрессовых факторов, начиная от физического насилия и заканчивая социальными конфликтами, значительно увеличивает риск возникновения нарушений психики, таких как депрессия или посттравматическое стрессовое расстройство (ПТСР).
Однако люди по-разному реагируют на один и тот же уровень стресса: некоторые могут проявить устойчивость и быстро восстановиться, в то время как другие борются за выживание и ощущают себя подавленными и потерянными. Механизмы этого различия всё еще вызывают вопросы. Кроме того, исследователи всё еще оценивают, как развиваются долгосрочные последствия индивидуального воздействия стресса.
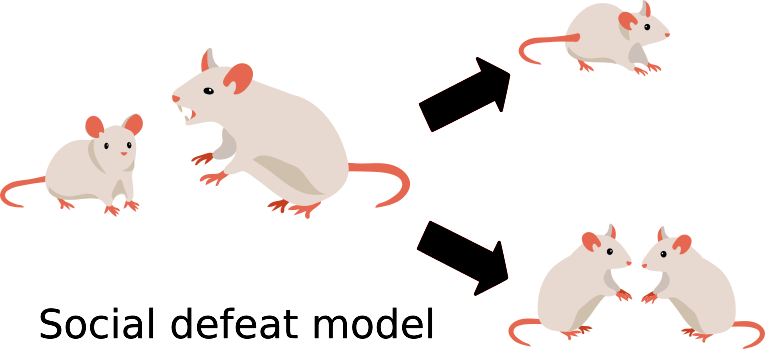
В работе Валентины Боннефил и коллег 2019 года показано, что поведение, характерное для депрессии, может быть выявлено после социального поражения (рис. 1) в виде повторных атак агрессивных мышей по пять минут в день в течение десяти дней, а также после очаговой демиелинизации в медиальной префронтальной коре [3].
Миелин — защитное покрытие из отростков ненервных клеток (олигодендроцитов), которое изолирует нейроны, а также способствует увеличению скорости проведения сигнала между ними. Разрушение миелина (иначе — демиелинизация) связывают с прогрессией нарушения координации и равновесия и многими другими заболеваниями. Подробнее можно почитать в статье на «Биомолекуле» «Обертка для аксона» [4].
Рисунок 1. Модель социального поражения основана на различной реакции мышей на агрессора.
иллюстрация автора статьи
Ученые, в основном сосредоточившись на роли нейронов, давно проводят исследования того, как различия в реакции на стресс могут найти объяснение в биологических процессах. Тем не менее нейроны представляют собой только один тип клеток головного мозга, и появляется все больше доказательств того, что взаимодействия между нейронными и ненейронными клетками играют важную роль в ответе на стресс.
Исследования выявили, что умеренный уровень ацетилирования гистонов требуется для дифференцировки олигодендроцитов, в то время как высокие уровни ацетилирования гистонов связаны с нарушением миелинизации (из-за отсутствия молодых олигодендроцитов, создающих миелин) [5], [6]. Позднее обнаружили, что уровень миелинизации связан с приспосабливаемостью к изменяющимся условиям (в статье — к социальной изоляции) [7]. В той же работе показано, что истончение миелина связано с незрелым ядерным хроматином, а также повышенным уровнем ацетилирования и пониженным уровнем метилирования. Все изменения в данном исследовании были зафиксированы в префронтальной коре.
Что было сделано?
Сотрудники Центра перспективных научных исследований (ASRC) выяснили, что олигодендроциты, которые образуют миелиновые оболочки в центральной нервной системе, являются ключевыми факторами, определяющими, влияет ли на нас стресс. Эпигенетика позволяет объяснить всё больше вещей, которые ранее не смогла объяснить генетика (подробнее в статье «Эпигенетика: невидимый командир генома» [8]). И дифференцировка олигодендроцитов может зависеть от понижения уровня метилирования (а конкретно, метки H3K9me3 — метилирования гистона H3 в положении 9), сопряженного с разрыхлением (снижением плотности) хроматина и запуском экспрессии генов, специфичных для взрослых олигодендроцитов [9].
Исследователи подвергли мышей (10 — в экспериментальной группе; и 8 — в контрольной) воздействию социального поражения [3]. В итоге мышь либо оставалась социально вовлеченной (активно контактировала с другими особями) и потому была классифицирована как «устойчивая», либо избегала социальных контактов после встречи с агрессором, что позволяло отнести ее к группе «восприимчивых» животных. При этом невосприимчивые мыши были практически неотличимы от контрольной группы, которая не контактировала с агрессором.
Пристальное внимание было уделено прилежащему ядру (NAc) и медиальной префронтальной коре (mPFC), поскольку результаты предыдущих исследований свидетельствуют, что именно эти зоны определяют реакцию на стресс [10].
Что это за области мозга и что про них известно?
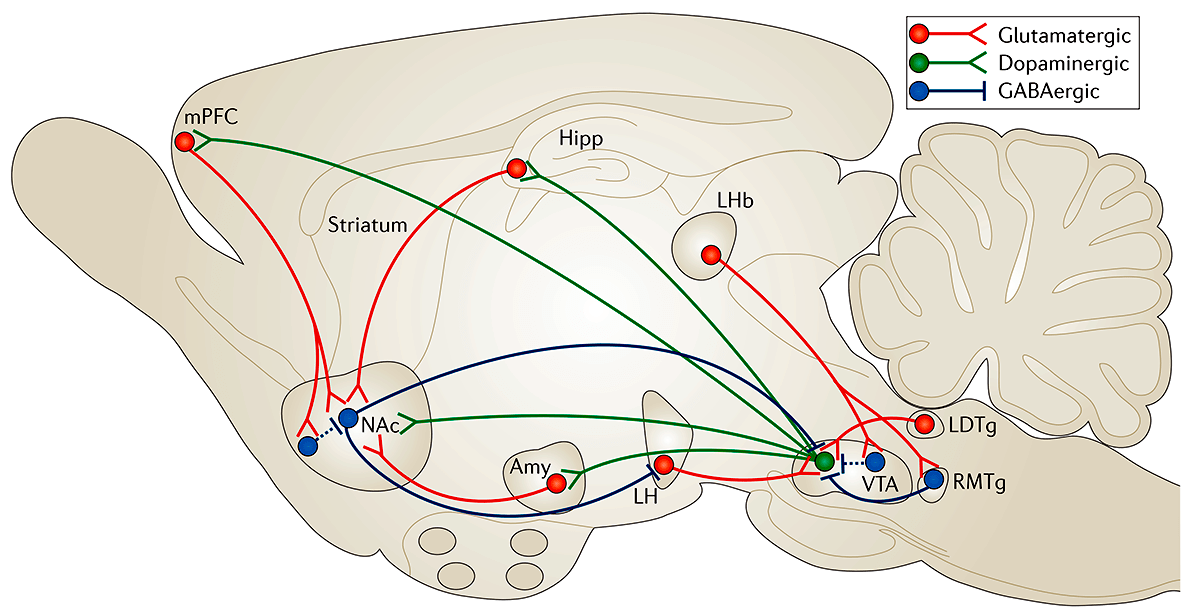
Прилежащее ядро является частью взаимосвязанной системы вентральной области — прилежащего ядра (VTA—NAc). Эта система имеет решающее значение для получения «наград» за счет выделения дофамина. VTA-дофаминергические нейроны также иннервируют несколько областей префронтальной коры (PFC), центральной миндалины, базолатеральной миндалины (BLA) и гиппокампа, а также другие области (рис. 2). Все эти так называемые области вознаграждения мозга сложным образом взаимосвязаны: например, NAc получает плотную глутаматергическую иннервацию из PFC, миндалины и гиппокампа; PFC, миндалина и гиппокамп образуют взаимные глутаматергические связи друг с другом. Функциональный выход каждой из этих областей модулируется несколькими типами ГАМКергических интернейронов.
Рисунок 2. Схема системы вознаграждения вентральной области — прилежащего ядра (VTA—NAc). Упрощенная схема основных дофаминергических, глутаматергических и ГАМКергических связей вокруг вентральной области (VTA) и прилежащего ядра (NAc) в головном мозге грызунов. Первичная схема системы вознаграждения включает дофаминергические связи из VTA в NAc, которые высвобождают дофамин в ответ на стимулы, связанные с вознаграждением (и в некоторых случаях стимулы, связанные с отвращением). Есть также ГАМКергические проекции от NAc до VTA; NAc также получает плотную иннервацию из глутаматергических моносинаптических контуров медиальной префронтальной коры (mPFC), гиппокампа (Hipp) и миндалины (Amy), а также из других областей. VTA получает глутаматергические стимулы от латерального дорсального сегмента (LDTg), латерального поводка эпиталамуса (LHb) и латерального гипоталамуса (LH). Эти различные глутаматергические входы контролируют аспекты восприятия и памяти, связанные с вознаграждением. Пунктирные линии показывают внутренние тормозные проекции. Красные линии — глутаматергические связи; зеленые — дофаминергические; синие — ГАМКергические.
Выделение дофамина в прилежащее ядро — это способ, с помощью которого мозг получает сигналы удовольствия. Чувство удовольствия побуждает нас повторять поведение, жизненно важное для выживания [11], а нарушения в получении дофаминовой награды связаны с такими симптомами, как ангедония и нарушение восприятия и воспоминаний, связанных с вознаграждением [12].
Медиальная префронтальная кора — часть префронтальной коры, которая также связана с системой вознаграждений, как было показано выше. Согласно результатам исследований, пациенты с депрессией имеют меньший объем коры, включая уменьшенный объем белого вещества в этой области, что и ведет к нарушению восприятия событий, которые раньше приносили радость [13].
Что обнаружили и какие сделали выводы?
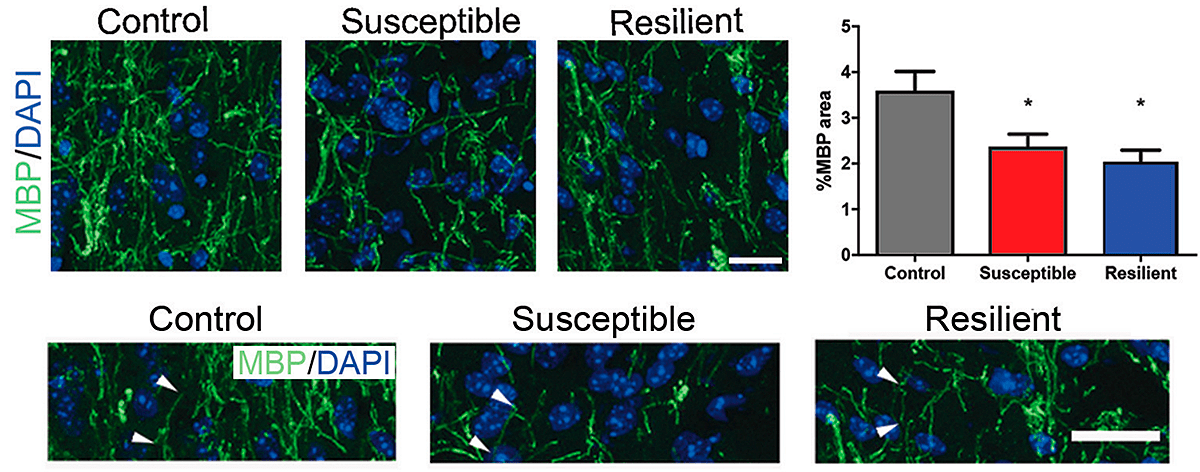
В обсуждаемой работе было показано, что поведение, связанное с социальным избеганием, может быть выявлено после социального поражения, а также после очаговой демиелинизации в mPFC, и поэтому может быть вызвано гипомиелинизацией. Обнаружили также, что миелин в прилежащем ядре истончается у обеих групп мышей (рис. 3). Но только у «восприимчивых» мышей выявили меньшее количество зрелых олигодендроцитов, а охват миелином оказался короче и тоньше.
Рисунок 3. Изображения с конфокального микроскопа и количественные оценки, показывающие иммуногистохимию основного белка миелина (МВР), контрастирующего с DAPI (4′,6-диамидино-2-фенилидолом, флюоресцентным красителем), 20-кратное увеличение. Control — контрольная группа; susceptible — «восприимчивая» группа; resilient — «устойчивая» группа. Статистический анализ проведен по одностороннему ANOVA с тестом Тьюки.
Более того, исследователи обнаружили снижение уровня метилирования гистонов (а именно метки H3K9me3, связанной с дифференцировкой незрелых олигодендроцитов) в предшественниках олигодендроцитов у «восприимчивых» мышей.
Метилирование гистонов представляет собой присоединение метильных групп к положительно заряженной аминокислоте лизину или аргинину с целью нейтрализации заряда. Связывание происходит с помощью фермента гистонметилтрансферазы. Это универсальный эпигенетический механизм, так как он приводит к активации или репрессии гена в зависимости от функции последнего. Метилирование гистонов в разных остатках служит маркером для связывания различных белковых активаторов/репрессоров, которые регулируют экспрессию гена.
Снижение уровня метилирования гистонов у предшественников олигодендроцитов, по-видимому, указывает на то, что эпигенетическая модификация может быть как причиной нарушения программы дифференцировки, так и ее следствием. Полученные данные позволяют нам говорить только о корреляции этих двух наблюдений, но не о причинно-следственной связи. Авторы говорят о возможности существования механизма эпигенетического переключения. Согласно этой концепции, стресс способен влиять на эпигенетическую модификацию предшественников олигодендроцитов, контролируя их развитие, а также отражается в миелиновых паттернах человека. В пользу этого говорит тот факт, что при образовании нового миелина его характеристики возвращаются к норме. Это свидетельствует о том, что изменения в результате этого стресса зачастую не вызывают повреждения ДНК, а только (обратимые) эпигенетические изменения.
Лизолецитин (иначе — лизофосфатидилхолин) является сильнодействующим растворяющим мембрану химическим веществом, которое обычно вводят в белое вещество мозга в виде 1%-ного раствора, чтобы вызвать очаговую демиелинизацию. В 1972 г. Сьюзан Холл была первой, кто продемонстрировал использование лизолецитина для создания демиелинизирующих поражений в белом веществе спинного мозга взрослой мыши [14].
Таким образом, мы можем говорить о том, что дефектная миелинизация воспринимается как дезадаптивный механизм (нарушение адаптации), возникающий только у «восприимчивых» мышей после воздействия повторяющегося социального стресса. Ранее было обнаружено, что дефекты миелинизации появляются у социально изолированных взрослых мышей еще до проявлений поведения социального избегания, что связано с нарушениями в системе получения удовольствия, вплоть до ангедонии [7].
Ангедония — неспособность чувствовать удовольствие, по определению французского физиолога Теодюля Рибо [15]. Сейчас определение включает также пониженную мотивацию к действиям, которые раньше вызывали радость [16]. Это различие важно, например, для животных моделей ангедонии, в которых эмоциональный опыт удовольствия сложно измерить, но мотивацию получения вознаграждения гораздо легче исследовать [17]. Ангедонию встречают у людей с различными психическими заболеваниями и состояниями — депрессией, шизофренией, болезнью Альцгеймера; она также играет важную роль в посттравматическом стрессовом синдроме и расстройствах пищевого поведения.
Почему у мышей различная устойчивость к стрессу?
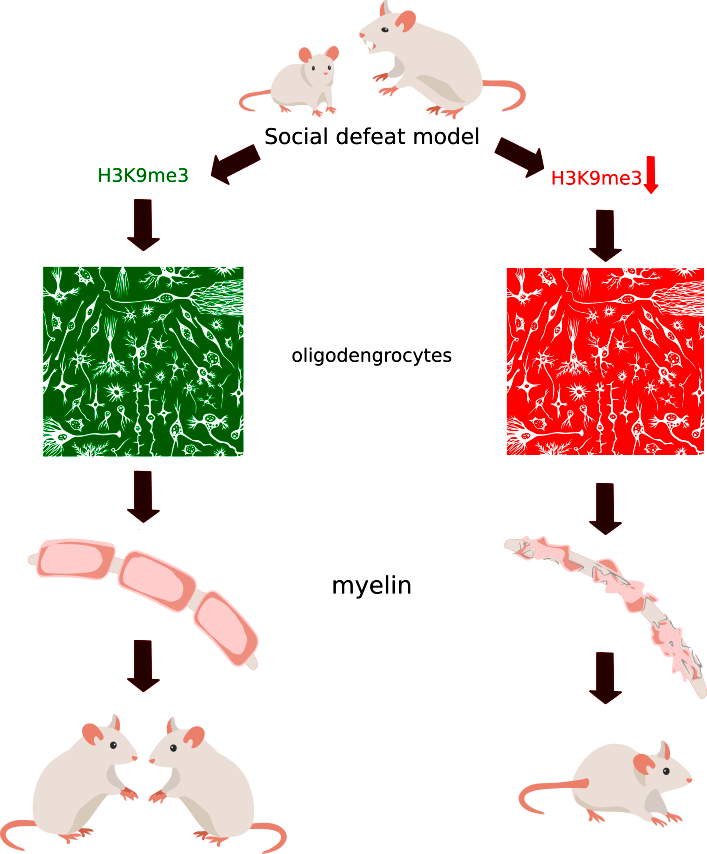
По-видимому, потому что у них различно число зрелых олигодендроцитов. Снижение уровня метилирования гистонов в предшественниках олигодендроцитов связано с нарушением дифференцировки (превращению в функциональные клетки), которая связана (коррелирует, по неподтвержденной гипотезе, ведет к) с истончением миелиновых волокон, что, в свою очередь, приводит к отсутствию адаптации к стрессу. Вот картинки с одной из гипотез о том, как все устроено (рис. 4).
Рисунок 4. Возможная схема различий реакции на социальное поражение, когда у одних мышей наблюдается пониженный уровень метилирования гистона H3 в положении 9, сниженный уровень зрелых олигодендроцитов и истончение миелина, а потому и избегание контактов с другими особями. В это же время другие мыши имели неотличимый от контрольных уровень метилирования гистона, их миелин не подвергся сильным изменениям, и они продолжали выражать интерес к общению с другими мышами. Social defeat model — модель социального поражения; oligodendrocytes — олигодендроциты; myelin — миелин.
иллюстрация автора статьи
Устойчивость к стрессу может возникнуть в результате активных стратегий преодоления, а не пассивного бездействия, определяемого как отсутствие адаптивного ответа. Одна из возможностей образования нового миелина в качестве стратегии преодоления связана с повышенной нейронной активностью у устойчивых мышей в нейронах префронтальной коры после социального поражения. Было показано, что оптогенетическая стимуляция префронтальной коры помогает формированию «устойчивого» фенотипа у мышей с социальным поражением.
Оптогенетическая стимуляция — использование света для контроля клеток на участке нервной ткани. Подконтрольные клетки предварительно генетически модифицированы для экспрессии светочувствительных ионных каналов. Метод позволяет осуществить оптическую модуляцию нейронной активности с высокой временной и пространственной разрешающей способностью, доходящей до размера единичного нейрона.
В то же время снижение качества и количества олигодендроцитов не является постоянным. Это говорит о том, что также вовлечен какой-то другой механизм, помимо обусловленного генетически, который централизованно регулирует развитие олигодендроцитов.
Глия — ненейронные клетки нервной системы, осуществляющие поддержание гомеостаза нейронов, обеспечивая их защиту и питание, а также формирование миелина. В центральной нервной системе к глиальным клеткам относят, например, олигодендроциты, астроциты и микроглию.
А что про воспаление, связанное со стрессом?
Альтернативный механизм может быть основан на различиях в воспалительных компонентах между двумя группами. Изучение интерлейкинов при расстройствах настроения ведется уже более двадцати лет [20]. Центральный вопрос заключается в том, в какой из частей нервной системы — периферической или центральной — синтезируются цитокины, играющие главную роль в формировании воспалительного компонента расстройств настроения.
Интерлейкины — группа цитокинов, изначально известных как часть иммунного воспалительного ответа; но также найдено, что они регулируют нейронную функцию в центральной и периферической нервных системах.
Анализ маркеров периферического воспаления последовательно выявляет увеличение интерлейкинов-6 (IL-6), интерлейкинов-1β (IL-1β) и фактора некроза опухолей-α (TNFα) у пациентов с расстройствами настроения. Измененные центральные уровни этих факторов также были определены.
Известно, что снижение уровня синтеза IL-6 во всем организме или только в лейкоцитах способствует развитию «устойчивого» фенотипа [21]. Используя компьютерное моделирование, Скотт Руссо с коллегами показал, что одновременная тревожность, уменьшение объема гиппокампа и повышение уровня системного интерлейкина-6 характеризовали восприимчивый фенотип, у которого развились поведенческие и нейробиологические нарушения после социального поражения [22].
Транскрипционный фактор — белок, связывающий ДНК в особых участках и регулирующий или инициирующий транскрипцию гена.
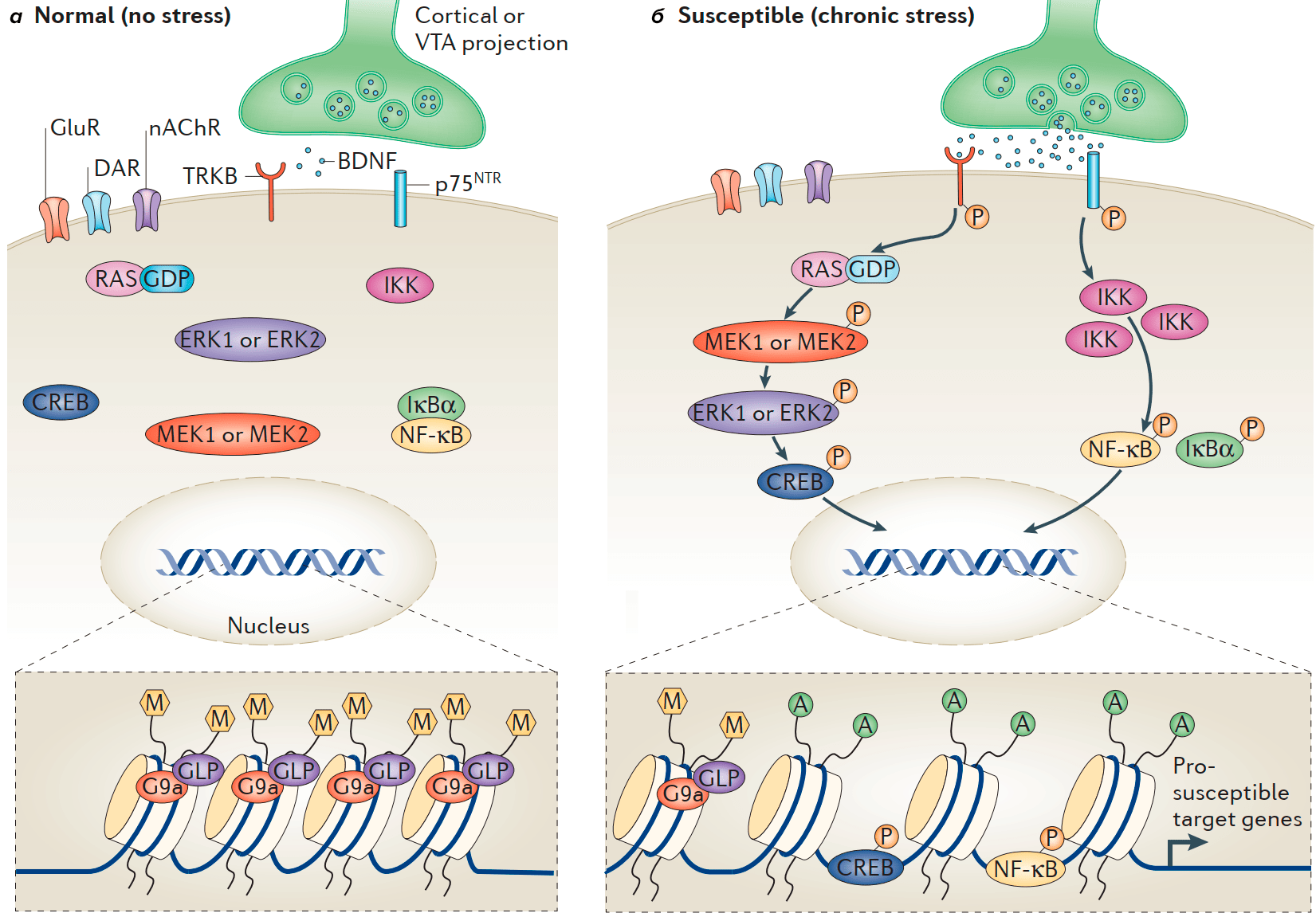
Например, в гиппокампе активация NF-κB участвует в нарушении нейрогенеза и индукции ангедонии [25]. В NAc хронический стресс после социального поражения увеличивает уровни киназы ингибитора NF-κB (IKK), что способствует активации NF-κB, который связывается с ДНК и изменяет транскрипцию группы генов. Одновременно меняется и эпигенетика — снижается уровень метилирования и повышается уровень ацетилирования. Это стимулирует образование новых незрелых шипиков на дендритах NAc. Данный процесс происходит только у восприимчивых животных, но не наблюдается у устойчивых особей (рис. 5). Прямое ингибирование IKK в NAc «обрезает» эти новые синапсы и обращает вспять связанные с ними депрессивные фенотипы [26]. Текущие исследования фокусируются на внутриклеточных сигнальных путях, посредством которых цитокины регулируют активность NF-κB, связанную со стрессом, а также нацелены на выявление транскрипционных мишеней NF-κB, которые опосредуют эти эффекты.
Шипики — выросты мембраны дендритов, играют важную роль в формировании и регуляции глутаматного синапса.
Другим механизмом, связывающим воспаление с развитием депрессивной симптоматики, является влияние цитокинов на гипоталамо-гипофизарную ось (HPA). Цитокины могут действовать на глюкокортикоидные рецепторы и косвенно активировать синтез кортикотропин-рилизинг-гормона (CRH), адренокортикотропного гормона (ACTH) и кортизола [27]. Степень, в которой цитокины индуцируют высвобождение ACTH и кортизола, является прогностическим фактором развития симптомов депрессии [28]. Это означает, что чувствительность оси HPA к воспалительной стимуляции особенно важна для развития аффективно-когнитивных симптомов депрессии.
Заключение
Отцом исследований стресса считают Ганса Селье, который определял стресс как «неспецифическую реакцию организма на любую потребность» и впервые предположил о наличии связи между стрессом и развитием заболеваний. Сейчас исследования стресса базируются на стыке фармакологии, патологии и нейронаук и направлены на изучение на молекулярном уровне.
Понимание изменений, которые вызывают стресс в организме, позволяет исследователям начать составлять карту потенциальных клинических вмешательств с конечной целью снижения его негативных последствий и предотвращения психических расстройств. Большинство современных методов лечения фокусируются на здоровье нейронов, но это исследование подтверждает возможность вмешательства в глиальные клетки, по крайней мере, в случае психических заболеваний, связанных со стрессом.
Несмотря на то, что данная статья добавляет ясности в наше понимание формирования двух групп в реакциях на социальное поражение, при переносе результатов на людей мы должны помнить о невозможности полностью смоделировать депрессию у животного по ряду причин. Во-первых, депрессия у людей — это не одно заболевание, а очень неоднородный синдром. Во-вторых, ключевые симптомы человеческой депрессии (то есть вина, суицидальность и грусть) не могут быть оценены (и могут не существовать вовсе в зависимости от того, как мы эти эмоции определяем [29]) у животных. И в-третьих, биология, лежащая в основе многих типов человеческой депрессии, остается плохо изученной. Однако ясно, что воздействие стресса увеличивает риск депрессии у людей, и, следовательно, большинство моделей депрессии грызунов полагаются на стрессовые факторы окружающей среды, чтобы вызвать симптомы, подобные депрессии, которые можно изучать механически.
Важное предостережение в отношении работы, описанной в этой статье (и в большинстве работ, использующих мышиные модели), заключается в том, что было использовано небольшое количество мышей, недостаточное для высокой достоверности результатов. Более того, исследование проводили исключительно на самцах грызунов, несмотря на тот факт, что в человеческом мире женщины в два раза чаще страдают расстройством настроения, чем мужчины [30]. И модели грызунов демонстрируют, что особи женского пола испытывают более депрессивное поведение после хронического стресса [31]. Было высказано предположение, что различия в развитии связанных с вознаграждением нейронных цепей могут предрасполагать женщин к депрессии [32]. Кроме того, прямое воздействие циркулирующих половых гормонов на систему вознаграждения может изменить чувствительность женщины к стрессу во время менструального цикла [33]. Исследования на грызунах действительно показали, что гормоны яичников изменяют пороги вознаграждения за стимуляцию мозга, что означает, что во время определенных фаз эстрального цикла женщины более склонны к ангедонии [34]. Это должно быть чрезвычайно высоким приоритетом для будущих исследований; мы должны определить, в какой степени рассмотренные выше механизмы применимы к моделям женской депрессии.
Важно также помнить, что наши реакции часто обусловлены опытом наших предков, который закодирован в эпигеноме (на «Биомолекуле» этому посвещена статья «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах» [35]), что позволяет напомнить о важности поддержания психического здоровья во всех поколениях. И самый простой, ставший почти скучным совет (который все еще работает): достаточное количество сна, отдых и режим питания — это то, что мы уже сейчас можем сделать для улучшения своей эпигенетики.