Что такое мезофильные клостридии
Клостридия клостридии волк: С. difficile vs С. scindens
Клостридия клостридии волк: С. difficile vs С. scindens
Автор
Редактор
Тело человека населено триллионами микроорганизмов, совокупность которых называют микробиомом. Микробиом выполняет множество важных функций — от синтеза витаминов до расщепления сложных компонентов пищи. «Здоровая» микрофлора постоянно конкурирует за ограниченные питательные ресурсы с патогенными микроорганизмами, тем самым подавляя их рост. Однако из-за приема антибиотиков или других причин нормальный состав микробиома может нарушаться, и тогда патогены получают возможность размножаться неконтролируемо, вызывая болезни. Один из таких патогенов — бактерия Clostridium difficile, возбудитель псевдомембранозного колита. Борьба с С. difficile осложняется ее устойчивостью к большинству известных антибиотиков. Но недавно было показано, что рост С. difficile можно успешно подавлять не лекарствами, а при помощи родственного ему вида — С. scindens. Это открытие послужит основой для создания «умных» лекарств-пробиотиков: эффективных против С. difficile, но безопасных для полезной микрофлоры.
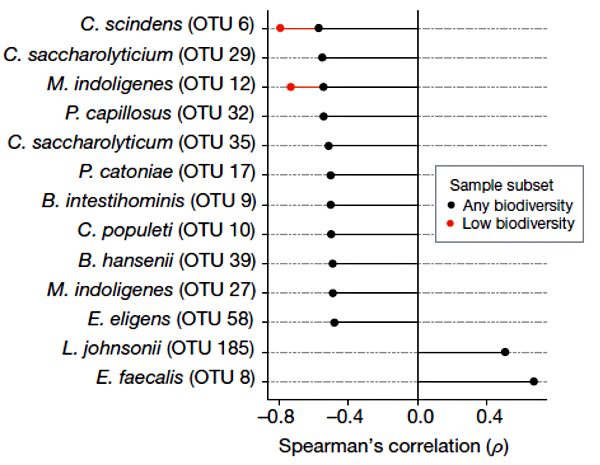
Рисунок 1. Корреляция между присутствием конкретных бактериальных таксонов в микробиоме и устойчивостью к заражению C. difficile [3].
Антибиотики эффективны в борьбе со множеством смертельных заболеваний, но вместе с тем они наносят существенный урон микробиому человека. После курса антибиотиков человек, как правило, более подвержен заражению различными патогенами. Clostridium difficile — грамположительная подвижная бактерия, основной возбудитель острых внутрибольничных кишечных инфекций. За последние 15 лет число смертельных случаев, обусловленных размножением С. difficile, возросло по меньшей мере в 10 раз, особенно среди пожилых и ослабленных людей [1]. Борьба с С. difficile осложняется тем, что при неблагоприятных условиях этот вид образует споры, выдерживающие действие антибиотиков. Такая особенность позволяет бактериям повторно колонизировать кишечник спустя несколько недель и даже месяцев после окончания лечения.
Недавно было показано, что трансплантация микробиомов здоровых доноров вылечивает тяжелые инфекции C. difficile [2]. Однако оставалось неизвестным, какие именно члены микробиома восстанавливают устойчивость организма к инфекции C. difficile и какими механизмами. И вот наконец вышла статья, которая проливает свет на довольно необычный механизм межвидовых взаимодействий в микробиоме [3].
О мышах и людях
C. difficile — не только человеческая беда, но и мышиная. Для начала микробиомы мышей пробовали травить разными антибиотиками и смотрели, как от этого меняется восприимчивость к C. difficile. В целом антибиотики не столько уменьшают суммарное число бактерий в кишечнике, сколько существенно нарушают расстановку сил — соотношение разных таксономических групп. Оказалось, что восприимчивость к C. difficile четко коррелирует с общим снижением видового разнообразия микробима. Удалось выделить горстку из 11 условных видов (операционных таксономических единиц), ассоциированных с устойчивостью к заражению C. difficile (рис. 1). Многие из них оказались тоже клостридиями (кластер Clostridium XIVa). Ученые обратили внимание на один таксон, присутствие которого сильнее всего коррелировало с резистентностью к C. difficile, даже у животных с экстремально низким видовым разнообразием микробиома. Героем оказался Clostridium scindens.
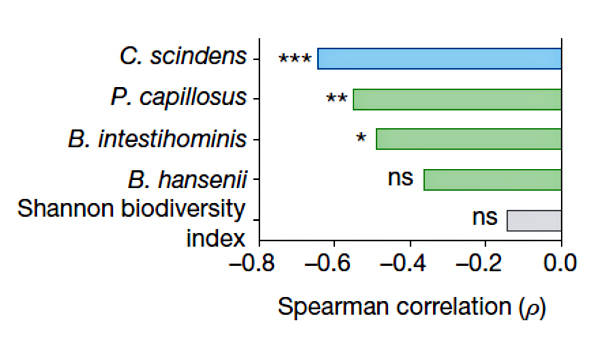
Рисунок 2. Корреляция между приживлением видов-кандидатов в микробиоме и устойчивостью к C. difficile [3].
Но то у мышей. Как же обстоят дела у человека? Для определения видов, связанных с устойчивостью к инфекции C. difficile, исследовали микробиомы пациентов, перенесших аллогеную трансплантацию гемопоэтических стволовых клеток. Большинство из них проходило химиотерапию и/или лучевую терапию одновременно с курсом антибиотиков во время трансплантации. Ослабленный иммунитет и снижение видового разнообразия микробиома делают этих пациентов легкой мишенью для C. difficile. У человека удалось найти два основных вида, с которыми не уживались C. difficile. Наиболее сильным ингибитором оказался C. scindens, как и у мышей. Как будто бы победа?
Для проверки ингибирующего эффекта C. scindens вместе с несколькими другими перспективными бактериями запустили в кишечники животных, недавно принимавших антибиотики (рис. 2). Оказалось, что такая микробная трансплантация существенно облегчила течение инфекции, вызванной C. difficile, а также положительно сказалась на снижении смертности и увеличении массы тела по сравнению с контролем. Наиболее заметную устойчивость к C. difficile обеспечивал, как и ожидалось, C. scindens. Приживление трасплантированных бактерий в микробиоме отслеживали по наличию гена соответствующей 16S рРНК. Устойчивость к C. difficile росла прямо пропорционально обилию C. scindens. То есть улучшение приживаемости C. scindens может повысить защиту против C. difficile. Примечательно, что такая аккуратная замена плохой клостридии на очень похожую, но хорошую, не нарушает существующий в микробиоме баланс (ни качественный, ни количественный). Своеобразная антидотная терапия, только на уровне микробиома. Все это открывает искрящиеся горизонты для разработки безопасных лекарств против C. difficile. Но как именно C. scindens противостоит C. difficile?
Механизм ингибирующего действия
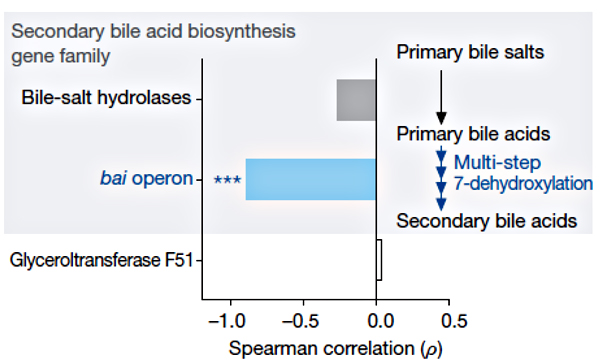
Рисунок 3. Корреляция между устойчивостью к C. difficile и наличием семейств генов, необходимых для синтеза вторичных желчных кислот [3].
Известно, что некоторые вторичные желчные кислоты могут ухудшать рост C. difficile in vitro [4]. У очень большого числа микробиомных бактерий есть ген bsh, кодирующий гидролазу желчных кислот. Однако у редкой бактерии (ужасно малой доли микробиомных организмов) есть все гены, необходимые для осуществления полного пути биосинтеза желчных кислот. Редкой бактерией, конечно же, оказалась C. scindens, обладающая критическим для синтеза вторичных желчных кислот геном 7α-гидроксистероид-дегидрогеназы (рис. 3). Именно на этой уникальной биохимической особенности и зиждется защитный механизм C. scindens против C. difficile. Внедрение C. scindens в микробиом животных, восприимчивых к C. difficile, восстанавливает необходимый уровень и соотношение вторичных желчных кислот: дезоксихолевой (DCA) и литохолевой (LCA). Обе эти кислоты подавляют рост C. difficile пропорционально своей концентрации. Примечательно, что C. scindens повышает количество вторичных желчных кислот до физиологического уровня и препятствует росту C. difficile даже у животных, прошедших курс антибиотикотерапии. Этот механизм консервативен — реализуется как в микробиоме мыши, так и в микробиоме человека.
Терапевтические перспективы
* — О черных делишках кишечных микробов-диверсантов, сокращающих пул желчных кислот и стимулирующих развитие атеросклероза, читайте в статье «Не доверяйте рекламе, или потенциальная связь метаболизма и развития атеросклероза» [6] — Ред.
Clostridium (клостридии)
Клостридии (лат. Clostridium) — род грамположительных спороносных бактерий. Клостридии входят в состав нормальной микрофлоры человека. Однако некоторые виды клостридий могут быть причиной заболеваний. Название «клостридии» происходит от греческого κλοςτεδ (веретено), так как при спорообразовании клостридии раздуваются в центре и приобретают форму веретена.
Клостридии — нормальная микрофлора человека
Клостридии — возбудители заболеваний
Большинство клостридий не патогенны, но некоторые виды клостридий могут быть причиной различных болезней человека, часть которых протекает тяжело и может приводить к летальному исходу. В частности, клостридии вида Clostridium botulinum могут быть причиной ботулизма, Clostridium tetani — столбняка, Clostridium perfringens, Clostridium novyi, Clostridium oedematiens и Clostridium septicum — газовой гангрены.

Clostridium perfringens типа А могут вызывать антибиотикоассоциированную диарею или псевдомембранозный колит. Clostridium perfringens типа F может быть причиной некротического энтерита.

Clostridium tetani являются возбудителем столбняка — острого инфекционного заболевания человека и животных, характеризующегося поражением нервной системы и проявляющееся тоническим напряжением скелетной мускулатуры и генерализованными судорогами.
Клостридии могут вызывать заболевания мочеполовых органов человека, в частности, острый простатит.
Приказом Минздравсоцразвития России №1664н от 27 декабря 2011 г. «Об утверждении номенклатуры медицинских услуг» медицинские услуги «A26.02.002 Бактериологическое исследование раневого отделяемого на возбудителей газовой гангрены (Clostridium spp.)» и «A26.19.007 Бактериологическое исследование кала на клостридии (Clostridium spp.)» включены в номенклатуру медицинских услуг, раздел 26.
Антибиотики, активные в отношении клостридий
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении клостридий: метронидазол, тинидазол, рифаксимин, тетрациклин, доксициклин, линкомицин.
Виды клостридий, устойчивые к клиндамицину: Clostridium sporogenes и Clostridium tertium.
Клостридии в систематике бактерий
По современной классификации род клостридии входит в семейство Clostridiaceae, порядок Clostridiales, класс Clostridia, тип Firmicutes, Terrabacteria group, царство Бактерии.
К роду клостридии относится более 100 видов: С. aceticum, C. acetireducens, C. acetobutylicum, C. acidisoli, C. aciditolerans, C. aestuarii, C. akagii, C. alcalibutyricum, C. alcaliphilum, C. algidicarnis, C. algifaecis, C. algoriphilum, C. amazonense, C. aminobutyricum, C. aminovorans, C. amylolyticum, C. arbusti, C. argentinense, C. aurantibutyricum, C. autoethanogenum, C. baratii, C. beijerinckii, C. bogorii, C. boliviensis, C. bornimense, C. botulinum, C. bovipellis, C. bowmanii, C. butyricum, C. cadaveris, C. caliptrosporum, C. caminithermale, C. carboxidivorans, C. carnis, C. cavendishii, C. celatum, C. cellulovorans, C. chartatabidum, C. chauvoei, C. chromiireducens, C. cochlearium, C. colicanis, C. collagenovorans, C. corinoforum, C. coskatii, C. crotonatovorans, C. cylindrosporum, C. diolis, C. disporicum, C. drakei, C. elmenteitii, C. estertheticum, C. fallax, C. favososporum, C. felsineum, C. filamentosum, C. formicaceticum, C. frigidicarnis, C. frigoriphilum, C. frigoris, C. fusiformis, C. ganghwense, C. gasigenes, C. grantii, C. guangxiense, C. haemolyticum, C. halophilum, C. homopropionicum, C. huakuii, C. hveragerdense, C. hydrogeniformans, C. hydrolyticum, C. ihumii, C. intestinale, C. isatidis, C. islandicum, C. kluyveri, C. kogasensis, C. lacusfryxellense, C. liquoris, C. ljungdahlii, C. longisporum, C. lundense, C. luticellarii, C. magnum, C. malenominatum, C. massiliodielmoense, C. maximum, C. merdae, C. moniliforme, C. neonatale, C. neuense, C. nitrophenolicum, C. novyi, C. oceanicum, C. oryzae, C. paraputrificum, C. pascui, C. pasteurianum, C. peptidivorans, C. perfringens, C. phoceensis, C. polyendosporum, C. polynesiense, C. proteolyticus, C. psychrophilum, C. punense, C. puniceum, C. putrefaciens, C. quinii, C. ragsdalei, C. roseum, C. saccharobutylicum, C. saccharoperbutylacetonicum, C. sardiniense, C. sartagoforme, C. saudiense, C. scatologenes, C. schirmacherense, C. senegalense, C. septicum, C. sordelli, C. sporogenes, C. subterminale, C. sulfidigenes, C. swellfunianum, C. taeniosporum, C. tagluense, C. tarantellae, C. tepidiprofundi, C. tepidum, C. tertium, C. tetani, C. tetanomorphum, C. thermobutyricum, C. thermopalmarium, C. thermophilus, C. thiosulfatireducens, C. tunisiense, C. tyrobutyricum, C. uliginosum, C. uzonii, C. ventriculi, C. vincentii, C. vulturis, [Butyribacterium] methylotrophicum.
Клостиридии C. sporogenes и другие имеют активные протеолитические ферменты и способны использовать в качестве субстратов белки и пептиды, гидролизуя их до аминокислот и подвергая затем последние сбраживанию. Такие клостридии относят к группе протеолетических клостридий.
Ранее клинически важный вид Clostridium perfringens назывался Clostridium welchii.
Изменения в составе рода Clostridium
В последние годы клостридии были серьёзно реклассифицированы, в частности:
Важнейший клинически вид Clostridium difficile был перенесён во вновь созданный род Clostridioides семейства Peptostreptococcaceae и ему присвоено наименование Clostridioides difficile. В этот же род был перенесён вид Clostridium mangenotii.
Вид Clostridium litorale перемещён в род Peptoclostridium того же семейства Peptostreptococcaceae и переименован в Peptoclostridium litorale.
Вид Clostridium sticklandii перемещён в род Acetoanaerobium семейства Peptostreptococcaceae и переименован в Acetoanaerobium sticklandii.
Вид Clostridium dakarense перемещён в род Romboutsia семейства Peptostreptococcaceae.
Clostridium hiranonis, Clostridium paradoxum, и Clostridium thermoalcaliphilum, их современные наименования: [Clostridium] hiranonis, [Clostridium] paradoxum и [Clostridium] thermoalcaliphilum, перенесены в семейство Peptostreptococcaceae без уточнения рода.
Вид Clostridium histolyticum был перемещён в род Hathewaya семейства Clostridiaceae и ему присвоено наименование Hathewaya histolytica. В этот же род были перенесены виды Clostridium limosum и Clostridium proteolyticum с изменением наименования на Hathewaya limosa и Hathewaya proteolytica, соответственно.
Вид Clostridium ramosum перемещён в род Erysipelatoclostridium, семейство Erysipelotrichaceae, порядок Erysipelotrichales, класс Erysipelotrichia и ему присвоено наименование Erysipelatoclostridium ramosum.
Виды Clostridium aerotolerans, Clostridium aldenense, Clostridium algidixylanolyticum, Clostridium aminophilum, Clostridium amygdalinum, Clostridium asparagiforme, Clostridium bolteae, Clostridium celerecrescens, Clostridium citroniae, Clostridium clostridioforme, Clostridium fimetarium, Clostridium glycyrrhizinilyticum, Clostridium herbivorans, Clostridium hylemonae, Clostridium indolis, Clostridium lavalense, Clostridium methoxybenzovorans, Clostridium polysaccharolyticum, Clostridium populeti, Clostridium saccharolyticum, Clostridium scindens, Clostridium sphenoides, Clostridium symbiosum, Clostridium xylanolyticum были перенесены в род Lachnoclostridium семейства Lachnospiraceae и они в настоящее время именуются [Clostridium] aerotolerans, [Clostridium] aldenense, [Clostridium] algidixylanolyticum, [Clostridium] aminophilum, [Clostridium] amygdalinum, [Clostridium] asparagiforme, [Clostridium] bolteae, [Clostridium] celerecrescens, [Clostridium] citroniae, [Clostridium] clostridioforme, [Clostridium] fimetarium, [Clostridium] glycyrrhizinilyticum, [Clostridium] herbivorans, [Clostridium] hylemonae, [Clostridium] indolis, [Clostridium] lavalense, [Clostridium] methoxybenzovorans, Lachnoclostridium phytofermentans, [Clostridium] polysaccharolyticum, [Clostridium] populeti, [Clostridium] saccharolyticum, [Clostridium] scindens, [Clostridium] sphenoides, [Clostridium] symbiosum, [Clostridium] xylanolyticum, соответственно.
Виды Eubacterium moniliforme и Eubacterium tarantellae перенесены из рода Eubacterium и названы Clostridium moniliforme и Clostridium tarantellae.
Университет
Материал адресован врачам: инфекционистам, гастроэнтерологам, терапевтам, общей практики
Микроорганизм Сlostridium difficile — ведущая причина диарейных заболеваний, ассоциированных с назначением системных антибиотиков и действием ряда других предрасполагающих факторов. C. difficile-ассоциированная инфекция (далее — КДАИ) имеет вариабельный диапазон клинических проявлений от легкой самолимитирующейся диареи до тяжелых, порой жизнеугрожающих состояний — псевдомембранозного колита, токсического мегаколона и септического шока с летальностью до 50–60% и более.
Игорь Карпов, заведующий кафедрой инфекционных болезней БГМУ, доктор мед. наук, профессор;
Юрий Горбич, декан медико-профилактического факультета БГМУ, доцент, кандидат мед. наук;
Никита Соловей, доцент кафедры инфекционных болезней БГМУ, кандидат мед. наук;
Наталия Левшина, заведующая микробиологической лабораторией Минского горЦГЭ.
В последнее время в клинической практике наблюдается заметное увеличение частоты развития тяжелых, а также рецидивирующих и фульминантных форм КДАИ, что во многом связано с внедрением методов высокотехнологической медпомощи, ростом числа иммуносупрессированных лиц и пациентов, нуждающихся в частых и/или длительных курсах антибиотиков. По меньшей мере у 10% страдающих КДАИ развиваются осложнения, у 18–25% пациентов заболевание характеризуется рецидивирующим течением.
В Европе летальный исход регистрируется в среднем в 22% случаев подтвержденной КДАИ, причем в 40% случаев непосредственно обусловлен C. difficile.
Этиология и эпидемиология
C. difficile — грамположительная спорообразующая токсин-продуцирующая анаэробная палочка, широко распространенная в почве, воде, а также ЖКТ животных. В части случаев данный микроорганизм может являться компонентом нормальной микробиоты ЖКТ человека, особенно у новорожденных и пожилых. У большинства же пациентов C. difficile способна колонизировать ЖКТ только в случаях, когда состав его нормальной микробиоты существенно нарушен, например, из-за длительной системной антибактериальной терапии, при выполнении хирургических манипуляций на органах брюшной полости, после химиотерапии и т. д.
Частота колонизации ЖКТ C. difficile коррелирует с длительностью госпитализации, применением антибиотиков и ряда других средств, с общей тяжестью состояния пациентов.
В учреждениях здравоохранения возбудитель распространяется преимущественно в виде спор, высоко устойчивых к действию некоторых антисептиков и дезинфектантов. Основными факторами переноса служат объекты окружающей среды (постельные принадлежности, полотенца, мебель, инструментарий) и руки медперсонала. Механизм инфицирования C. difficile фекально-оральный, реализуется при заглатывании спор возбудителя. Пациенты, колонизированные C. difficile и особенно имеющие клинические проявления КДАИ, являются источником возбудителя для других пациентов и способствуют поддержанию распространения C. difficile в учреждении здравоохранения, что требует применения мер контактной изоляции и тщательного соблюдения принципов инфекционного контроля.
Патогенез и факторы риска развития симптомной КДАИ
Развитие заболевания возможно представить в виде нескольких ключевых звеньев. Вначале под воздействием ряда предрасполагающих факторов (системная антибактериальная терапия, прием цитостатиков, ингибиторов протонной помпы и блокаторов Н2-рецепторов, лучевая терапия, операции на органах брюшной полости и малого таза) нарушаются состав и видовое разнообразие микробиоты ЖКТ, теряются колонизационная резистентность и другие защитные механизмы слизистой кишечника. Затем идет колонизация C. difficile. Микроорганизм активно пролиферирует в просвете толстой кишки и начинает продуцировать токсины А (энтеротоксин), В (цитотоксин), бинарный, что приводит к развитию водянистой диареи и колита. В особо тяжелых случаях возможен выраженный некроз колоноцитов вплоть до псевдомембранозного колита, токсического мегаколона, сепсиса и септического шока.
Несколько ключевых факторов риска предрасполагают к развитию симптомных форм КДАИ:
Ошибочно полагать, что антибактериальная терапия в ближайшем анамнезе является обязательным условием развития КДАИ. Более того, первый случай C. difficile-ассоциированного псевдомембранозного колита был описан американским хирургом J. Finney в 1893 году, т. е. за несколько десятилетий до появления антибиотиков. Болела 22-летняя пациентка, перенесшая операцию на желудке.
Заболевание может иметь ряд ключевых клинических проявлений.
1. C. difficile-ассоциированная диарея с частотой неоформленного стула более 3 раз в сутки, обусловленная действием факторов патогенности C. difficile. Это наиболее часто встречающееся клиническое проявление КДАИ. Тяжесть C. difficile-ассоциированной диареи может варьировать от легкой, саморазрешающейся после окончания антибиотикотерапии, до тяжелой профузной холероподобной, быстро приводящей к дегидратации.
2. C. difficile-ассоциированный колит проявляется учащенными дефекациями от 3 до 15 и более раз в сутки с водянистыми испражнениями, спастическими болями преимущественно в нижних отделах живота, субфебрильной либо фебрильной температурой и умеренным лейкоцитозом в периферической крови. При ректосигмоидоскопии или колоноскопии изменения стенки толстой кишки варьируют от очаговых участков гиперемии слизистой до изъязвлений — в зависимости от тяжести процесса.
3. Псевдомембранозный колит по клинической картине напоминает C. difficile-ассоциированный колит, однако имеет более тяжелое течение. Эндоскопическое обследование выявляет формирование на слизистой толстой кишки псевдомембран — округлых, слегка возвышающихся желтоватых бляшек из некротизированного эпителия, пропитанного фибрином.
Псевдомембраны считаются патогномоничным признаком КДАИ и обнаруживаются в большинстве случаев в ректосигмоидном отделе толстой кишки. Однако у трети пациентов типичные патоморфологические симптомы псевдомембранозного колита имеются лишь в проксимальных отделах толстой кишки при интактной слизистой ректосигмоидной области, поэтому предпочтительнее фиброколоноскопия, а не ректосигмоидоскопия. КТ органов брюшной полости с контрастированием и в некоторых случаях УЗИ также позволяют обнаружить резко выраженное утолщение стенки толстой кишки, что является достаточно чувствительным маркером этого состояния.
Манифестация фульминантного C. difficile-ассоциированного псевдомембранозного колита — выраженные боли, локализованные в нижних отделах живота, либо диффузного характера, диарея (чаще водянистая, в редких случаях с примесью крови), напряжение мышц передней брюшной стенки, лихорадка, гиповолемия, лактат-ацидоз и выраженный лейкоцитоз (до 40х109/л и более). В некоторых случаях диарея может быть малозаметной либо вовсе отсутствовать вследствие развития кишечной непроходимости и накопления жидкости в дилатированной атоничной толстой кишке.
4. Токсический мегаколон — одно из осложнений фульминантного C. difficile-ассоциированного псевдомембранозного колита. Клинически характеризуется выявлением атонии и дилатации толстой кишки (свыше 7 см в наибольшем диаметре), сопровождающейся транслокацией бактерий из просвета ЖКТ в системных кровоток, развитием септического шока и часто — полиорганной недостаточности. На обзорной рентгенографии органов брюшной полости в этом случае регистрируются перерастяжение поперечной ободочной кишки с исчезновением гаустр, зубчатая исчерченность стенки толстой кишки, уровни жидкости и газа, иногда небольшая дилатация тонкой кишки.
5. Перфорация толстой кишки — осложнение фульминантного C. difficile-ассоциированного псевдомембранозного колита, проявляющееся напряжением мышц передней брюшной стенки, исчезновением кишечных шумов, выраженной болезненностью в левом или правом нижнем квадранте живота с последующим развитием клиники разлитого перитонита. На обзорной рентгенографии органов брюшной полости выявляется свободный воздух.
Критерии тяжелого C. difficile-ассоциированного колита приведены в таблице.
Согласно рекомендациям Европейского общества по клинической микробиологии и инфекционным болезням (ESCMID), следует расценивать КДАИ как тяжелую, если есть как минимум один признак тяжелого колита (см. табл.) либо хотя бы один неблагоприятный прогностический фактор:
Таким образом, клинические проявления КДАИ обладают значительной вариабельностью, при этом легкие формы заболевания при неадекватной тактике ведения пациентов могут прогрессировать с развитием жизнеугрожающих осложнений. Особое внимание следует обратить на возможность возникновения признаков острой кишечной непроходимости и полиорганной недостаточности как первого клинического проявления тяжелой КДАИ без предшествующей диареи у лиц, получающих системную антибактериальную терапию, т. к. в этом случаи нередки диагностические ошибки и неадекватная тактика ведения (необоснованное хирургического вмешательство и назначение системной антибактериальной терапии, что ухудшает состояние пациента и зачастую становится причиной неблагоприятного исхода).
Лабораторная диагностика
Для верификации диагноза можно использовать несколько методов: реакция нейтрализации цитотоксина в культуре клеток, выделение токсигенной культуры C. difficile, определение глутамат-дегидрогеназы, иммунологическая детекция токсинов C. difficile, молекулярно-генетическая детекция генов токсигенности C. difficile (ПЦР). Реакция нейтрализации цитотоксина в культуре клеток и выделение токсигенной культуры возбудителя являются достаточно трудоемкими, дорогостоящими и длительными методами, поэтому не получили широкого распространения в современной клинической практике, хотя и являются золотым стандартом верификации диагноза при проведении научных исследований. Наиболее часто для верификации диагноза в практических условиях используются методы иммунологической детекции токсина C. difficile (иммунохроматографический анализ, иммуноферментный анализ) и молекулярно-генетическая детекция генов токсигенности. Следует отметить неприменимость рутинного бактериологического выделения возбудителя из образца испражнений как метода лабораторного подтверждения КДАИ в связи с высокой частотой бессимптомного носительства C. difficile в ЖКТ пациентов, госпитализированных в стационар или часто обращающихся за медпомощью.
ИФА-детекция токсинов А и В C. difficile доступна в лаборатории отделения инфекционной иммунологии Минского горЦГЭ. Метод обладает высокими чувствительностью (89,8%) и специфичностью (96,7%) и позволяет получить окончательный результат в течение 6 часов от начала исследования. Оптимально доставлять образцы неоформленных испражнений в лабораторию как можно раньше от момента забора, однако допускается хранение образцов при температуре +2… +8 °С в течение трех суток. При отсутствии диареи (кишечная непроходимость, перитонит) иногда исследуют смывы из дистальных отделов толстой кишки. Необходимо помнить, что имеет смысл тестировать только неоформленные образцы испражнений и только пациентов, имеющих симптомы, потенциально связанные с КДАИ.
Если лабораторные методы верификации КДАИ технически недоступны, следует ориентироваться на клинические проявления заболевания, которые могут быть сопряжены с C. difficile, и наличие у пациентов перечисленных выше факторов риска. В этом случае рекомендуется назначать терапию эмпирически, а потом оценивать эффект. Клинический ответ пациента на этиотропное лечение КДАИ — подтверждение диагноза ex juvantibus.
Клинический случай. Пациентка М., 34 года. Беременность 22 недели. Обратилась к врачу-терапевту с жалобами на лихорадку до 38,5 °С, слабость, спастические боли в левой подвздошной области, ложные позывы на дефекацию, скудный частый стул до 10–15 раз в сутки в виде слизи с примесью видимой крови.
Госпитализирована в многопрофильный стационар с диагнозом «Гемоколит неуточненной этиологии. Дебют язвенного колита?». Выполнена ректороманоскопия, эндоскопически выявлена картина язвенного колита. Приглашен инфекционист для исключения инфекционных причин гемоколита (шигеллеза).
При сборе эпидемиологического анамнеза выяснилось, что пациентка месяц назад госпитализировалась в многопрофильный стационар с клиникой острого аппендицита, где ей провели вмешательство, назначили системную антибактериальную терапию цефтриаксоном. Во время лечения антибиотиком появились водянистая диарея до 4–5 раз в сутки без патологических примесей, субфебрильная температура. Самостоятельно лечилась пробиотиками, о своих жалобах врачам не сообщала. После выписки из стационара на фоне продолжающейся терапии пробиотиком диарея постепенно разрешилась.
Через 2 недели после нормализации состояния — повторное появление водянистой диареи до 3–4 раз в сутки, разлитых спастических болей в животе, субфебрильной температуры, затем клинической картины гемоколита. Пациентка обратилась в поликлинику.
Предположительный диагноз: «C.difficile-ассоциированная инфекция, рецидивирующее течение: гемоколит».
Переведена в инфекционный стационар, начата этиотропная терапия ванкомицином 250,0 мг 4 раза в день перорально 10 дней. Верифицирован диагноз методом ИФА-детекции токсинов C. difficile в образце испражнений. Разрешение лихорадки, уменьшение частоты дефекаций и исчезновение примеси крови в испражнениях — на второй день терапии; разрешение абдоминальных болей и полная нормализация стула — на 5–6-й день лечения.
При появлении клинических признаков C. difficile-ассоциированной инфекции (далее — КДАИ) на фоне системной антибактериальной терапии ее следует прекратить, если позволяет состояние пациента и нет жизненных показаний для ее продолжения, т. к. большинство исследований демонстрируют уменьшение вероятности клинического излечения и значительное увеличение частоты рецидивов в случае продолжающейся антибиотикотерапии. Если врач вынужден продолжать системную антибактериальную терапию и при этом назначать этиотропное лечение КДАИ — предпочтение должно отдаваться схемам как при тяжелой КДАИ.
Оптимально также воздержаться от терапии антацидными лексредствами (ингибиторами Н2-рецепторов, блокаторами протонной помпы). Категорически запрещается использование препаратов, угнетающих перистальтику ЖКТ, в частности лоперамида, — это может приводить к утяжелению состояния пациента с КДАИ, предрасполагать к развитию псевдомембранозного колита, токсического мегаколона и перитонита.
Выбор схемы этиотропной терапии КДАИ определяется прежде всего тяжестью, а также особенностями течения заболевания (первичный эпизод или рецидив) — см. табл.
Таблица. Выбор оптимальной схемы этиотропной терапии КДАИ
Следует отметить, что согласно исследованиям применение метронидазола внутрь для терапии легкой и среднетяжелой КДАИ превосходит по эффективности его назначение внутривенно. Применение ванкомицина при данной патологии должно осуществляться только перорально: внутривенное клинически неэффективно. При пероральном использовании ванкомицина он не всасывается из просвета ЖКТ в клинически значимых концентрациях, соответственно, не обладает нефротоксичностью и другими нежелательными эффектами и может безопасно использоваться у беременных, пациентов с нарушенной функцией почек без коррекции исходной дозы.
Фекальная трансплантация микробиоты (введение донорских фекалий в просвет ЖКТ пациента путем удерживающих клизм, дуоденального зонда или при фиброколоноскопии) является перспективным методом терапии многократно рецидивирующих форм КДАИ и направлена на восстановление нормальной микробиоты кишечника и колонизационной резистентности. В систематическом обзоре Gough et al., включавшем анализ эффективности данного метода у 317 пациентов с КДАИ, разрешение заболевания отмечено в 92% случаев. Исследование van Nood et al., сравнивающее эффективность дуоденальных инфузий донорских фекалий со стандартной терапией рецидивирующих форм КДАИ, было досрочно прекращено в связи с крайне низким процентом выздоровления в группе ванкомицина (30,8% — в сравнении с 93,8% в группе фекальной трансплантации микробиоты). Несмотря на то, что в настоящее время имеются трудности и нерешенные вопросы с техническим выполнением данной процедуры, метод является крайне перспективным и, возможно, займет свое место в клинической практике уже в ближайшей перспективе.
Помимо этиотропной терапии КДАИ при наличии водянистой диареи пациенту следует проводить регидратационную терапию перорально или внутривенно полиионными растворами по принципам лечения других острых кишечных инфекций.
Эффективность проводимой терапии КДАИ должна оцениваться через 48 часов и более от ее начала. В первые 24–48 часов клинических признаков улучшения состояния (уменьшение частоты дефекаций, разрешение симптомов тяжелой и осложненной КДАИ, имевших место в дебюте заболевания) может и не быть даже на фоне адекватно проводимой терапии, и, согласно существующим рекомендациям, в эти сроки важны только стабильность и отсутствие ухудшения состояния. К признакам, указывающим на неэффективность антибактериальной терапии, относится отсутствие клинического улучшения после 3 дней проводимой терапии либо появление в процессе лечения новых симптомов тяжелой КДАИ.
В случае, если КДАИ оценивается как тяжелая, необходим динамический мониторинг уровня лактата и креатинина сыворотки крови, а также оценка степени выраженности лейкоцитоза. Отрицательная динамика по данным маркерам должна приводить к пересмотру тактики ведения пациента, в т. ч. с привлечением хирургов для решения вопроса о необходимости хирургического вмешательства.
Другие показатели, которые рекомендуется оценивать у пациентов с тяжелой КДАИ, — водно-электролитный баланс, уровень альбумина и маркеры органной недостаточности (как при сепсисе).
У части пациентов с тяжелыми проявлениями КДАИ консервативная терапия не позволяет добиться улучшения состояния и предотвращения неблагоприятного исхода лечения. Показаниями к выполнению хирургического вмешательства служат перфорация толстой кишки, появление признаков синдрома системного воспалительного ответа и ухудшения клинического состояния, не отвечающего на адекватную этиотропную терапию (включая токсический мегаколон и тяжелую кишечную непроходимость).
Выполнение операции оптимально в течение 48 часов после начала консервативной терапии (в случае отсутствия клинико-лабораторного ответа на ее проведение) или при появлении признаков полиорганной недостаточности или перфорации кишечника. Для хирургического лечения инфекций, вызванных C. difficile, чаще используются колэктомия или формирование илеостомы с возможным последующим кишечным лаважом ванкомицином.
Профилактика КДАИ
Таким образом, C. difficile является одним из самых распространенных нозокомиальных патогенов XXI века, встречающимся в учреждениях здравоохранения всего мира и вызывающим большинство случаев антибиотик-ассоциированных диарей и диарей, связанных с оказанием медпомощи.
КДАИ имеют широкий спектр клинических проявлений от саморазрешающейся легкой диареи до тяжелых жизнеугрожающих состояний, зачастую с фульминантным течением, развитием серьезных осложнений и быстрым летальным исходом.
Знание особенностей течения заболевания, принципов лабораторной верификации диагноза и этиотропной терапии позволит существенно улучшить исходы КДАИ в современной клинической практике.
Медицинский вестник, 30 декабря 2016, 9 января 2017