Что такое макрофаги в крови
Макрофаги
Что такое клетки макрофаги и откуда они берутся?
Клетки макрофаги в самом деле большие: хотя их размер составляет всего 15-80 мкм, и человеческому глазу они не видны, однако они гораздо больше их предшественников: максимальный размер моноцита составляет всего 20 мкм. У них неправильная, «плавающая», меняющаяся форма, а их мембрана может образовывать ложноножки. Внутри макрофага находится ядро, а еще в нем обнаруживаются «осколки» эритроцитов и других клеток, жировые капельки, фрагменты бактерий и прочий «мусор». Как все это туда попадает? Очень просто, ведь макрофаги – это клетки, которые осуществляют процесс фагоцитоза.
Функции макрофагов:
При попадании в тело чужеродного объекта, будь то микроб или инородное тело, иммунная система сразу «спускает на него собак»: его атакуют фагоциты. Эти клетки, среди которых и макрофаги, распознают, улавливают и пожирают чужаков, угрожающих благополучию внутренней среды организма.
Кроме того, макрофаги уничтожают погибшие клетки, которые завершили свое существование процессом апоптоза (запрограммированная, естественная, нормальная гибель клеток). Также функции макрофагов заключаются в обеспечении противоопухолевого иммунитета: зафиксировав появление в организме атипичных, раковых клеток, макрофаги нападают на них и поедают.
Виды макрофагов:
Макрофаги – тканевые фагоциты, и в разных типах тканей нередко 
1. Альвеолярные макрофаги – находятся в стенках альвеол легких, очищают вдыхаемый воздух от различных загрязняющих и вредоносных частиц.
2. Купферовские клетки – в печени. Их назначение в основном заключается в уничтожении старых клеток крови.
4. Селезеночные макрофаги – располагаются в синусоидных сосудах этого органа. Как и у клеток Купфера, их задача заключается в том, чтобы вылавливать из крови и уничтожать отжившие клетки крови. Недаром селезенка называется кладбищем погибших эритроцитов!
5. Дендритные клетки – макрофаги, находящиеся под слизистыми оболочками и в коже, то есть фактически на границе с внешней средой.
6. Перитонеальные макрофаги – фагоциты, «живущие» в брюшине.
7. Где находятся макрофаги лимфатических узлов, понятно по названию. Это благодаря им лимфоузлы известны в качестве фильтров, очищающих лимфу.
Макрофаги и иммунная система:
Клетки макрофаги не просто бездумно уничтожают вредоносные объекты: расщепляя их на фрагменты, они осуществляют процесс презентации их антигенов. Антигены – это молекулы вредоносных частиц, которые говорят об их генетической чужеродности и вызывают соответствующую защитную реакцию со стороны иммунитета. Сами по себе они не представляют угрозы заражения или иного негативного воздействия, но это – метка чужака, поэтому организм реагирует на их присутствие защитной реакцией, как на полноценных агрессоров.
К сожалению, иногда личного опыта наших макрофагов или других фагоцитов недостаточно для того, чтобы иммунная система работала должным образом и правильно реагировала на вредоносные объекты. Чтобы повысить ее эффективность и заодно улучшить состояние здоровья в целом, рекомендуется принимать препарат Трансфер Фактор. Он содержит цитокины, несущие в себе данные о всевозможных возбудителях заболеваний, токсинах и прочих вредоносных агентах. Препарат обучает иммунитет полноценной работе, что немедленно и благоприятным образом отражается на течении имеющихся заболеваний, состоянии обмена веществ и функции органов. Средство можно использовать в лечебных и профилактических целях.
МАКРОФАГИ – ПЕРСПЕКТИВНАЯ МИШЕНЬ ДЛЯ РАЗРАБОТКИ НОВЫХ МЕТОДОВ ЛЕЧЕНИЯ РЯДА ТЯЖЕЛЫХ ЗАБОЛЕВАНИЙ
Более ста тридцати лет назад выдающийся русский ученый И. И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе – он открыл блуждающие клетки, которые назвал фагоцитами (от греч. Φάγος — пожиратель). Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека.
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
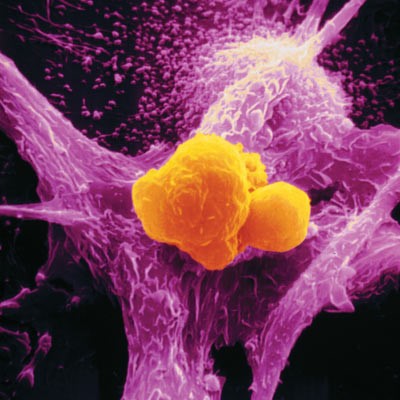
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрес¬сивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстанов¬ления поврежденных тканей [1].
В настоящее время макрофаги подразделяют на клетки М1, М2 и М0 типа или «классического» (провоспалительного), «альтернативного» (противовоспалительного) и неактивированного фенотипа соответственно [2]. О свойствах и функциях М1 и М2 макрофагов сообщается в ряде обзоров [3], [4].
Как отмечено выше, в ходе иммунного ответа макрофаги могут менять свой фенотип – этот процесс смены фенотипа получил название «репрограммирование».
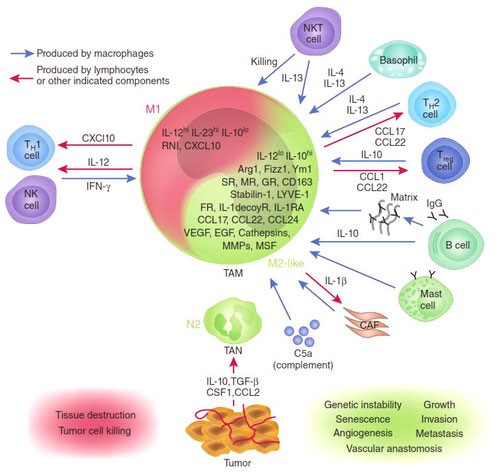
Известно, что присутствие в опухоли большого количества М1-макрофагов тормозит ее рост, а в некоторых случаях может вызвать даже практически полную ремиссию. И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки. Под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип. Они перестают синтезировать противоопухолевые цитокины, такие как интерлейкин-12 или фактор некроза опухолей (TNF), и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис.).
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [5]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50. Таким способом, опухоль превращает «агрессивные» М1-макрофаги в помощников, участвующих в ее развитии: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса их ингредиентов. Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять иммунитет, ученые могут разрабатывать контрмеры и сдвинуть баланс в сторону уничтожения опухолей.
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов.
Примером такого подхода служит технология, разработанная в новосибирском НИИ клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование М0 фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг Ml превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
Еще один пример использования макрофагов – а именно генетически модифицированных аутологичных клеток для лечения пациентов с болезнью Паркинсона предложили в Center for Nanotechnology in Drug Delivery при университете Северной Каролины.
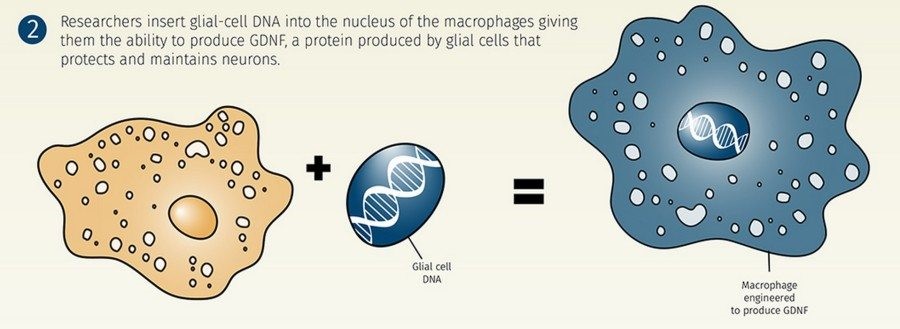
Болезнь Паркинсона (БП) – это самое частое нейродегенеративное заболевание, от которого страдает примерно 1% всех людей, достигших 60 лет. В основе БП лежит потеря (гибель, дегенерация) дофаминергических нейронов в структуре мозга substantia nigra pars compacta (SNpс) и появление телец Леви (это агломераты белка внутри нейронов). Группа Елены Батраковой в Center for Nanotechnology in Drug Delivery занимается разработкой методов клеточного транспорта ростовых факторов и антиоксидантов в структуры мозга через поврежденный гемато-энцефалический барьер с тем, чтобы уменьшить воспаление и защитить гибнущие нейроны. Для этой цели они берут (пока у животных) макрофаги и при помощи лентивирусного вектора вводят им ген, кодирующий ростовой фактор, обычно вырабатываемый глиальными клетками.
Этот фактор называется glial-derived neurotropic factor или GDNF. Известно, что GDNF уменьшает воспаление и улучшает способность нейронов выживать в тяжелой ситуации, в частности способствует восстановлению утраченных нервными клетками аксонов.
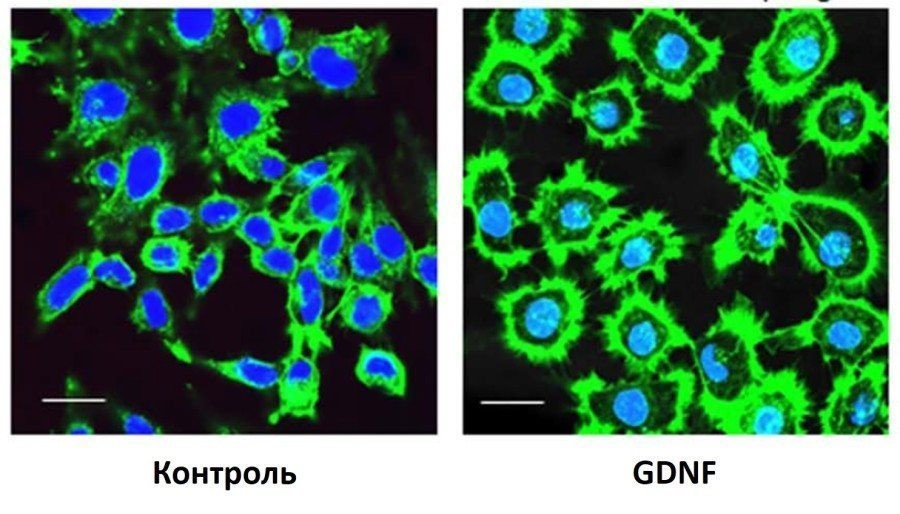
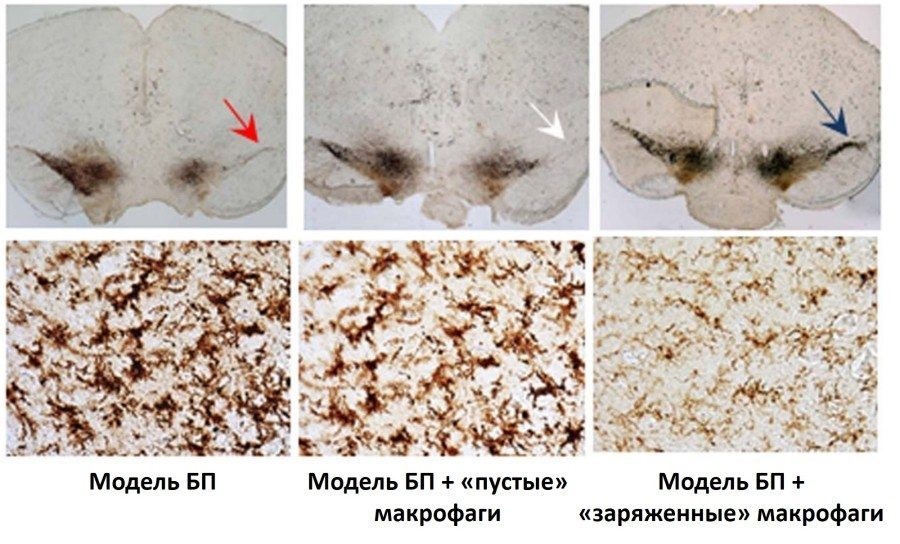
Так, на этой фотографии показано, как добавление GDNF в культуру нейронов стимулирует рост аксонов нервных клеток – зеленые ниточки, расходящиеся от тел нейронов.
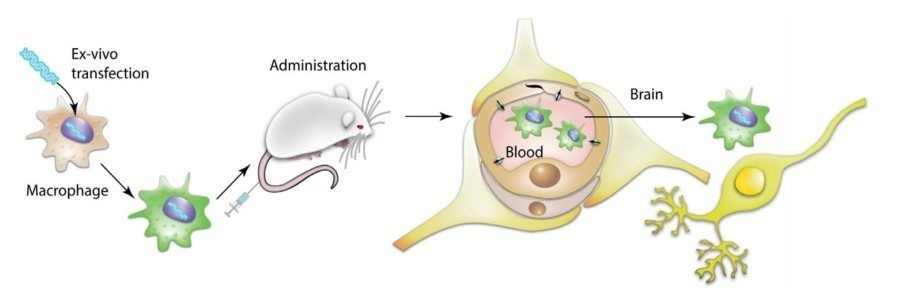
Почему исследователи выбрали макрофаги? Эти клетки обладают хорошей способностью активно двигаться в сторону очага воспаления и проникать сквозь тканевые барьеры. Генетически-модифицированные макрофаги вводили внутривенно мышам с моделью БП и через некоторое время изучали у них симптоматику заболевания, а также влияние макрофагов на регенерацию поврежденных нейронов.
Исследования показали, что применение «заряженных» GDNF макрофагов улучшало двигательную активность и равновесие у животных с моделью БП. На тканевом уровне была показана регенерация нейронов в SNpc с одновременным снижением воспаления, оцененного по морфологии микроглиальных клеток.
Верхний ряд картинки – это срез головного мозга экспериментальных животных. Слева – нелеченые животные с моделью БП, посередине – БП мыши, получившие «пустые» макрофаги (то есть без гена GDNF), а справа – БП мыши, получившие «заряженные» GDNF макрофаги.
Стрелкой показана регенерация нервных клеток SNpc, у животных в группе исследуемого лечения. Темная полоска – это покрашенные специальным маркером дофаминергические нейроны. На двух левых срезах они погибли, справа – живы. В нижнем ряду интенсивность коричневого маркера показывает активированные микроглиальные клетки, которые, меняют свою форму, когда чувствуют повреждение и воспаление ткани. В группе «заряженных» макрофагов микроглиальные клетки выглядят значительно «спокойнее», а воспаление слабее.
Следует добавить, что GDNF выделяется из макрофагов не «просто так», а в особых маленьких мембранных пузырьках экосомах (рис. ниже), обеспечивающих стабильность молекулы GDNF во внеклеточном пространстве и прицельное движение в сторону нейронов.
В 1996 году выяснилось, что иммунные клетки посылают друг другу экосомы, а их содержимое может влиять на регуляцию адаптивного иммунного ответа. Кроме того, оказалось, что экзосомы способны распознать «адрес», по которому их «послали». Это происходит благодаря специфическому взаимодействию адгезиновых молекул на мембранах экзосом и их клеток-мишеней. Тогда возникла идея использовать экзосомы для регуляции клеточной жизнедеятельности.
О возможности терапии с использованием трансплантации макрофагов легких для лечения легочного альвеолярного протеиноза у детей сообщается в работе [6].
Поскольку пересадка костного мозга требует предварительного подавления иммунитета, что несет риск инфекций и повышает уровень смертности, то особый интерес представляет органная терапия, специфичная к отдельным типам клеток. Поэтому в данном исследовании использовали мышей с дефицитом β-рецептора колониестимулирующего фактора макрофагов и гранулоцитов GM-CSF. У таких мышей наблюдаются те же дефекты миелоидных клеток, что и при наследственном легочном альвеолярном протеинозе у детей с мутациями генов CSF2RA и CSF2RB. Это заболевание связано с избыточным накоплением сурфактанта в альвеолах вследствие нарушения его утилизации макрофагами. Было показано, что при легочном альвеолярном протеинозе пересадка легочных макрофагов дикого типа (предварительно проверенных на предмет экспрессии необходимых маркеров и способности утилизировать сурфактант) или с мутациями гена CFS2RB без предварительной иммуносупрессии не представляет опасности и практически полностью удаляет гистопатологические эффекты заболевания. Одно введение этих клеток принесло облегчение при вторичных системных проявлениях заболевания, устранив характерную полицитемию. Это лечение нормализовало экспрессию генов и содержание маркеров заболевания и снизило смертность, продлив среднюю продолжительность жизни больных мышей на 107 дней. Популяция альвеолярных макрофагов, полученных при пересадке, сохранялась в течение одного года, и все это время продолжали проявляться терапевтические эффекты. При этом макрофаги дикого типа проявили более высокую выживаемость и интенсивность пролиферации in vitro по сравнению с макрофагами с мутантным CFS2RB. При трансплантации они более эффективно накапливались у мышей с мутацией CFS2RB, нежели у животных дикого типа. Иммуногистохимическое окрашивание по маркеру пролиферации Ki67 после пересадки GFP-маркированных макрофагов мыши дикого типа к мыши с мутацией CFS2RB показало, что пересаженные клетки успешно продолжают размножаться в организме реципиента: через месяц после трансплантации доля Ki67+-клеток составляла в среднем 32,2%. Через год средний показатель снизился до 11,29%; при этом численность макрофагов, экспрессирующих CD131 — продукт гена CFS2RB — слабо различалась у дикого типа и мутантных мышей-реципиентов. Это позволяет предположить, что пересаженные макрофаги дикого типа способны постепенно вытеснять мутантные макрофаги.
С помощью поточной цитометрии и ПЦР было установлено, что пересаженные макрофаги локализуются в легких, преимущественно между альвеолами, и отсутствуют в крови, костном мозге и селезенке. В данном исследовании [6] объяснен механизм поддержания численности популяций альвеолярных макрофагов при трансплантации и показано значение рецептора GM-CSF для их выживаемости.
Полученные японскими учеными результаты свидетельствуют о возможности применения трансплантации макрофагов для лечения легочного альвеолярного протеиноза у детей.
Таким образом, макрофаги – перспективная мишень, которая может применяться для выработки стратегии лечения ряда тяжелых заболеваний человека. В результате фармакологических и генетических манипуляций с макрофагами появляется реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Литература
1. Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия. – 2012. – Т. 77. – С. 419-432.
2. Mosser, D.M. Exploring the full spectrum of macrophage activation / D.M. Mosser, J.P. Edwards // Nat. Rev. Immunol. – 2008. – Vol. 8. – P. 958–969.
3. Murray, P.J. Protective and pathogenic functions of macrophage subsets / P.J. Murray, T.A. Wynn // Nat. Rev. Immunol. – 2011. – Vol. 11. – P. 723–737.
4. Малышев, Ю.И. Матричное репрограммирование иммунных клеток и роль его нарушения в патогенезе опухолей / Ю.И. Малышев //Вестник РОНЦ им. Н.Н. Блохина РАМН. – 2012. – Т. 23. – № 2. – С. 21–33.
5. Biswas, S.K. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm / S.K. Biswas, A. Mantovani // Nat. Immunol. – 2010. – Vol.11. – P. 889–8967.
6. Pulmonary macrophage transplantation therapy /Takuji Suzuki [et al.] // Nature – 2014. – Vol. 514. – N 7523. – P. 453–470.
В статье использованы материалы сайта slipups.ru

© Елена Кадукова, старший научный сотрудник лаборатории комбинированных воздействий
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
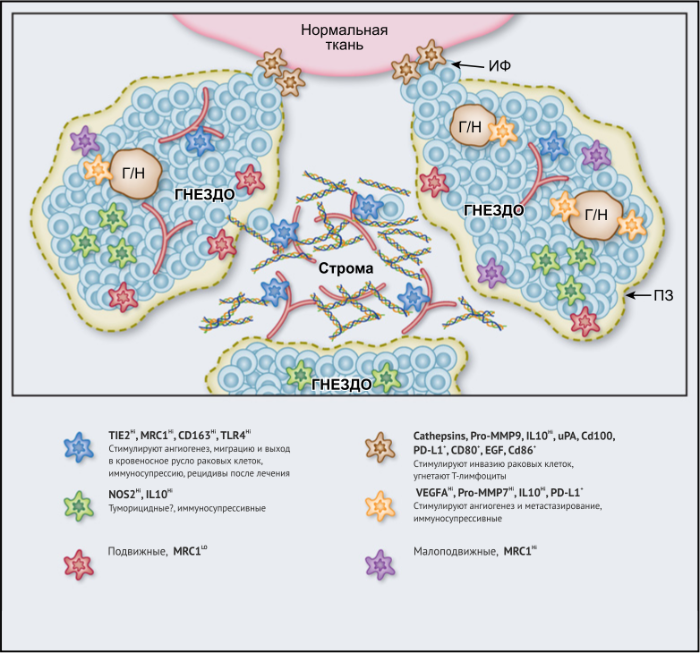
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
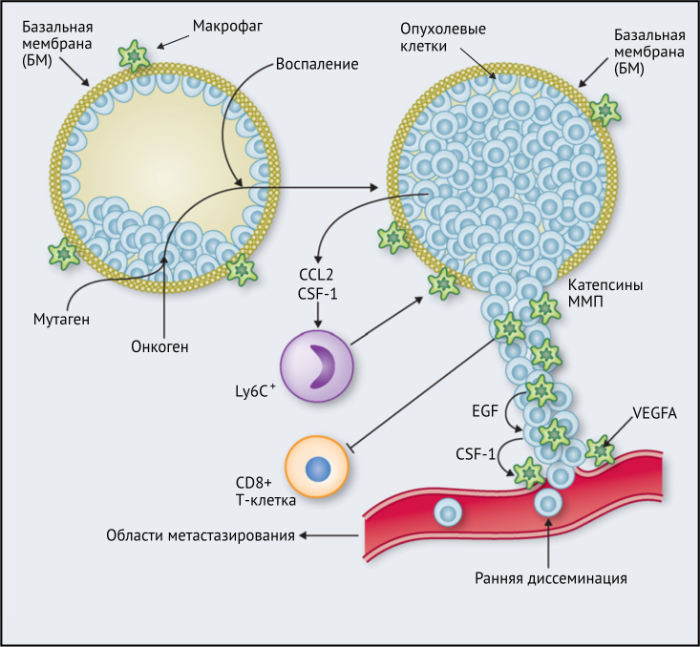
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.