Что такое каталитические реакции
Каталитические реакции
Полезное
Смотреть что такое «Каталитические реакции» в других словарях:
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ — (от греч. «katalysis» разрушение), гомогенные (см. ГОМОГЕННЫЕ РЕАКЦИИ) и гетерогенные (см. ГЕТЕРОГЕННЫЕ РЕАКЦИИ) химические реакции, протекающие с участием катализатора (см. КАТАЛИЗАТОРЫ). В зависимости от положительного или отрицательного… … Энциклопедический словарь
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Каталитические яды — контактные яды, вещества, вызывающие «отравление» катализаторов (См. Катализаторы) (обычно гетерогенных), т. е. снижающие их каталитическую активность или полностью прекращающие каталитическое действие. Отравление гетерогенных… … Большая советская энциклопедия
Химические реакции — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
Сложные реакции — такие Реакции химические, элементарные акты которых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно, направлением превращения, если… … Большая советская энциклопедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — (р ции окисления восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в в. При окислении в в степень окисления элементов возрастает, при восстановлении понижается. Первоначально окислением называли… … Химическая энциклопедия
СЛОЖНЫЕ РЕАКЦИИ — Хим. р ция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из к рых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов р ции имеются химически различающиеся, то р ция наз.… … Химическая энциклопедия
ГАЗОФАЗНЫЕ РЕАКЦИИ — (от газ и греч. «phasis» появление), химические реакции между газообразными веществами, происходящие в результате столкновения частиц. Скорость газофазных реакций зависит от температуры и давления. Часто реализуются как гетерогенно каталитические … Энциклопедический словарь
КАТАЛИЗ — ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами,… … Энциклопедия Кольера
Катализ — (от греч. katálysis разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после… … Большая советская энциклопедия
Каталитические реакции
1.4. Каталитические реакции
Каталитическими называются реакции, протекающие с участием веществ-катализаторов, не входящих в состав конечных продуктов. Катализаторы вступают во взаимодействие с участниками данной реакции, образуют с ними те или иные промежуточные вещества, включаются в состав активного комплекса, а после реакции вновь выделяются. Различают положительный катализ (ускорение реакции) и отрицательный катализ (замедление реакции, или ингибирование).
В некоторых случаях катализатором является один из продуктов реакции. Такая реакция называется автокаталитической. При гомогенном катализе катализатор и все реагирующие вещества составляют одну фазу. Различают следующие типы гомогенного катализа: кислотно-основной катализ органических реакций, катализ d-переходными ионами и катализ металлорганическими комплексами. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных фазах, а каталитическая реакция протекает на поверхности раздела фаз. Гетерогенный катализ включает пять обратимых стадий: диффузию реагентов, адсорбцию (сначала физическую, затем химическую), химическую реакцию, десорбцию продуктов и их диффузию.
Все гетерогенные катализаторы можно подразделить на четыре класса: d-переходные металлы, полупроводниковые оксиды, изоляторы (диэлектрики) и кислотные катализаторы.
Эти катализаторы характеризуются следующими свойствами:
-фермент способен катализировать только одну специфическую реакцию или реакцию одного типа;
-обладают высокой эффективностью даже в очень небольших количествах;
-наибольшей активностью обладают при температуре 310 К (температуре человеческого тела, при температуре выше 323-333 К разрушаются;
-ферменты очень чувствительны к присутствию каталитических ядов.
Каталитические реакции характеризуются следующими общими особенностями:
1) Катализатор не влияет на термодинамическое равновесие. Он изменяет лишь скорость достижения состояния равновесия.
2) Действие катализатора специфично. Из всех возможных реакций данных реагирующих веществ определенный катализатор избирательно усиливает лишь некоторые.
3) Скорость гомогенной каталитической реакции чаще всего пропорциональна концентрации катализатора.
4) Действие катализатора зависит от его физического состояния и от присутствия посторонних веществ. Промоторы усиливают действие катализатора, а каталитические яды снижают активность катализатора.
5) Смесь катализаторов часто действует значительно сильнее, чем отдельные катализаторы.
1.5 Сущность каталитического действия
Если энергия активации высока, то лишь небольшая доля сталкивающихся молекул имеет энергию, достаточную для того, чтобы произошла реакция, а если она низка, то реагирует большая часть молекул, и поэтому константа скорости будет большой. Из этого следует, что если каким-либо образом можно снизить энергию активации, то реакция должна протекать с более высокой скоростью.
К(катализатор)/К(без катализатора) = е 7,6 ≈ 2000 раз.
Более существенное изменение энергии активации происходит при добавлении ферментов к биохимическим системам.
Фермент является биологической молекулой, которая обладает большой эффективностью. Это иллюстрируется изменением энергии активации в реакции гидролиза сахарозы от 107 кДж/моль в присутствии иона гидрооксония до 36 кДж/моль при добавлении небольшого количества фермента сахаразы. Такое изменение энергии активации соответствует изменению значения скорости на 22 порядка.
1.6 Методы расчета энергии активации и предэкспоненциального множителя
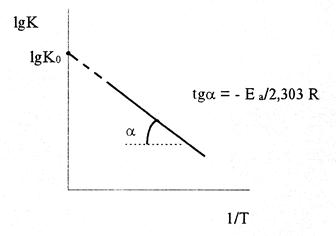
В большинстве случаев для расчета энергии активации Еа по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса (6) или его запись в виде:
Следовательно, lgK линейно зависит от обратной абсолютной температуры (см. рисунок)
Предэкспоненциальный множитель К0 определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить:
Энергия активации Еа имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0 совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа и К зависят от температуры. Однако эту зависимость можно не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа предполагает, что константы скорости реакций при различных температурах известны.
Однако, есть способ расчета Еа, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1 и T2 в смесях одного и того же начального состава протекает химическая реакция. Если к моментам времени τ1 и τ2 реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением (4)
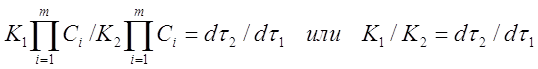
Таким образом, отношение K1 /K2 можно заменить отношением τ1 / τ2
Подставим в отношение (11а) значения констант скорости при температурах T1 и Т2, используя уравнение Аррениуса (5):
Полагая, что для узкого температурного интервала К0 и Еа= const находим
Разделение переменных и интегрирование дают:
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Реакция иодирования ацетона
В качестве объекта исследования в данной работе выбрана реакция иодирования ацетона. Реакция
СНзСОСНз + I2 = СНзСОСH2I + HI (15)
катализируется кислотами Бренстеда(донорами протонов). Эта реакция катализируется сильной минеральной кислотой.
Затем (вторая стадия ) енол реагирует с иодом:
равное количеству вновь образовавшихся оксоний-ионов.
Подставляя (19) в (18), находим:
После интегрирования этого уравнения в пределах от х=0 до х и от τ=0 до х, разрешения относительно K1 получим выражение:
Если перейти к концентрациям веществ, участвующих в реакции, то уравнение (20) приобретет вид:
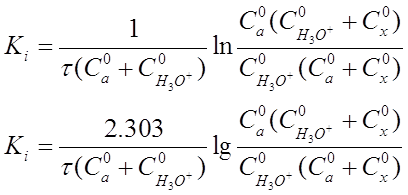
реакции т, моль-экв/л;
По уравнениям (20) и (21) можно рассчитать константу скорости реакции, используя данные о концентрации веществ, участвующих в реакции.
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
Смотреть что такое «КАТАЛИТИЧЕСКИЕ РЕАКЦИИ» в других словарях:
Каталитические реакции — (циклические) К. реакциями называются многочисленные химические превращения, вызываемые в различных химических системах веществами, которые, не подвергаясь сами каким либо постоянным изменениям, одним своим присутствием обусловливают… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Каталитические яды — контактные яды, вещества, вызывающие «отравление» катализаторов (См. Катализаторы) (обычно гетерогенных), т. е. снижающие их каталитическую активность или полностью прекращающие каталитическое действие. Отравление гетерогенных… … Большая советская энциклопедия
Химические реакции — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
Сложные реакции — такие Реакции химические, элементарные акты которых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно, направлением превращения, если… … Большая советская энциклопедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — (р ции окисления восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в в. При окислении в в степень окисления элементов возрастает, при восстановлении понижается. Первоначально окислением называли… … Химическая энциклопедия
СЛОЖНЫЕ РЕАКЦИИ — Хим. р ция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из к рых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов р ции имеются химически различающиеся, то р ция наз.… … Химическая энциклопедия
ГАЗОФАЗНЫЕ РЕАКЦИИ — (от газ и греч. «phasis» появление), химические реакции между газообразными веществами, происходящие в результате столкновения частиц. Скорость газофазных реакций зависит от температуры и давления. Часто реализуются как гетерогенно каталитические … Энциклопедический словарь
КАТАЛИЗ — ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами,… … Энциклопедия Кольера
Катализ — (от греч. katálysis разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после… … Большая советская энциклопедия
Предмет каталитической химии
Явление катализа широко распространено в природе: почти все процессы, происходящие в живых организмах, являются каталитическими. Наверное, нет ни одного человека, который не слышал бы слова «катализ» или «катализаторы».
Сейчас, если спросить любого человека на улице: «Что такое катализатор?», вам ответят: «Это то, что используют в автомобилях для нейтрализации (очистки) выхлопных газов».
А современную промышленность нельзя представить себе без использования катализаторов. Только в химической промышленности каталитические процессы обеспечивают более 80% продукции и около 20% ВВП развитых стран. Не менее 90-95% промышленных реакций – это каталитические процессы в химических и нефтехимических производствах,
Каталитические процессы применяются не только в химических и нефтехимических производствах, но и в пищевой, фармацевтической, металлургической, строительной и многих других отраслях промышленности. А что касается биотехнологии, которая в настоящее время бурно развивается, – там все процессы каталитические.
Где используются катализаторы?
Катализаторы незаменимы в следующих областях:
Рис. 1.1. Производство крупнотоннажной химической продукции в 2005 г.
Следует также отметить, что ежегодно на заводах всего мира производится примерно 200 тыс. тонн катализаторов общей стоимостью около
15 млрд. долл. США. Это гигантский рынок.
Предметом каталитической химии являются явления катализа методы подбора катализаторов, их синтеза и применения в различных областях науки, технологии и техники.
Катализ – явление, которое в настоящее время достаточно хорошо осмыслено на концептуальном уровне.
Каталитическая химия – раздел химии, изучающий явление катализа, методы подбора катализаторов, их синтеза и применения в различных областях науки, технологии и техники.
Катализаторы и реагенты могут быть как неорганическими, так и органическими, поэтому каталитическая химия – междисциплинарная область (рис. 1.2). Она использует представления неорганической, органической, физической химии.
Для подбора эффективных катализаторов учѐные и инженеры пользуются также методами электрохимии, квантовой химии, химии металлоорганических соединений. Для исследования катализаторов применяются разнообразные физические методы и приборы. Поэтому можно с полным правом утверждать, что каталитическая химия находится «на стыке наук», т.е. это интенсивно развивающаяся область химии.
Рис. 1.2. Междисциплинарные связи каталитической химии
Часто говорят об органическом катализе. Что подразумевают под этим термином? Органический катализ является той областью катализа, когда либо реагент, либо катализатор являются органическими соединениями.
Какие же задачи стоят перед каталитической химией?
Открытие явления катализа
Ещѐ в XV в. алхимики обнаружили, что в присутствии серной кислоты, которая при этом не расходуется, этиловый спирт превращается в диэтиловый эфир (в гомогенной системе):
Тем не менее, первые научные сведения о катализе относятся к началу XIX в. В 1806 г. французские учѐные Н. Клеман и Ш. Дезорм открыли реакцию окисления сернистого ангидрида до серного под действием диоксида азота, который в процессе не расходовался:
Это открытие было использовано для промышленного способа получения серной кислоты (так называемый камерный способ).
В 1811 г. петербуржский академик К.С. Кирхгоф открыл, что разбавленные кислоты способны вызывать превращение крахмала в сахар (глюкозу). И в этом случае кислота не расходовалась. В 1814 г. им же было установлено, что эту реакцию также может катализировать фермент диастаза из ячменного солода. Так было положено начало применению биологических катализаторов – ферментов.
Французский химик Л. Тенар в 1813 г. установил, что аммиак при нагревании разлагается на азот и водород под влиянием некоторых металлов (железо, медь, серебро, платина):
В 1818 г. он же показал, что большое число твѐрдых тел оказывает ускоряющее действие на разложение растворов перекиси водорода, а английский химик Г. Дэви открыл способность паров спирта и эфира окисляться кислородом на поверхности платины. В 1822 г. немецкий химик И. Дѐберейнер установил, что водород и кислород соединяются на платине при обычной температуре. За этим последовало открытие и других фактов сильного положительного воздействия веществ на скорость химических реакций.
Все это привело к выделению особой группы явлений, названных немецким химиком Э. Митчерлихом контактными (1833 г.). Термин катализ (от греч. καταλύειν — разрушение) для таких явлений был введѐн только в 1835 г. великим шведским химиком Й. Берцелиусом, который систематизировал и обобщил все известные к тому времени сведения об ускорении химических реакций под действием катализаторов. В.Ф. Оствальд (1909 г.) показал, что катализатор ускоряет только термодинамически разрешенные процессы. За нахождение связи катализа с термодинамикой ему была присуждена Нобелевская премия.
Развитие понимания явления катализа отставало от его практического применения (рис. 1.3).
Рис. 1.3. К истории гетерогенного катализа
Лишь в начале XX в. стали появляться работы, посвященные попыткам объяснения явления катализа. Так, П. Сабатье (1912 г.) предложил теорию промежуточных соединений и показал, что в присутствии катализаторов реакция идет по иному маршруту, чем в отсутствие катализатора. В 1912 г. он получил Нобелевскую премию за метод гидрогенизации органических соединений в присутствии мелкодисперсных металлов, который резко стимулировал развитие органической химии.
В 1910-1920 гг. практическое применение катализа было развито в работах В.Н. Ипатьева, который ввел в практику катализ при высоком давлении. В 1913 г. впервые был получен в промышленном масштабе аммиак каталитическим синтезом из азота и водорода. Автором каталитического синтеза аммиака является немецкий ученый Ф. Габер. За разработку научных основ процесса синтеза аммиака и за промышленное оформление его Ф. Габеру и К. Бошу в 1918 г. была присуждена Нобелевская премия.
Исследования механизма каталитических реакций стали возможны после работ И. Ленгмюра и С.Н. Хиншельвуда, посвященных изучению процессов адсорбции и созданию кинетической теории. Развитие теоретических представлений (например, теория переходного состояния) и приход в эту область спектральных методов (ИК спектроскопия) открыли новые возможности в установлении связи между каталитическими свойствами и составом и структурой материала. Современное состояние науки о поверхности позволяет выявить структуру адсорбционных центров и их реакционную способность. Разработанная в конце ХХ в. туннельная микроскопия позволяет изучать структуру поверхности и адсорбционных слоев на атомном уровне; некоторые современные методы позволяют изучать катализаторы в процессе их работы (in situ). Развитие получили и численные методы.
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
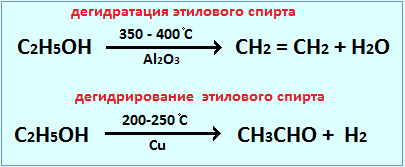
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.