Что такое изотопы простыми словами
Изотопы
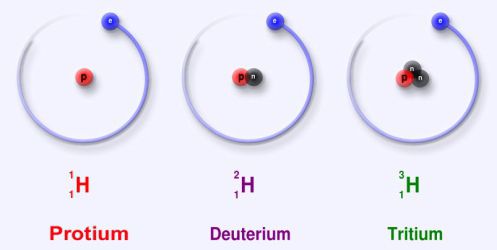
Изото́п (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидность атома (и ядра) какого-либо химического элемента, отличающаяся от других изотопов только количеством нейтронов в ядре. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N ). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
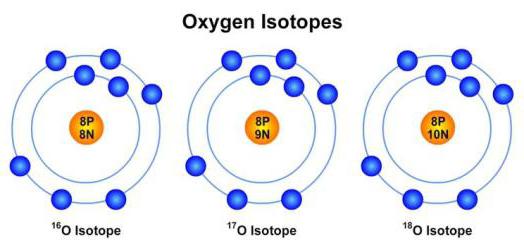
Пример изотопов: 16 8 O, 17 8 O, 18 8 O — три стабильных изотопа кислорода.
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
Изотопы 60 Co и 137 Cs используются в стерилизации Υ-лучами (лучевая стерилизация) как один из методов физической стерилизации инструментов, перевязочного материала и прочего. Доза проникающей радиации должна быть весьма значительной — до 20-25 мкГр, что требует особых мер безопасности. В связи с этим лучевая стерилизация проводится в специальных помещениях и является заводским методом стерилизации (непосредственно в стационарах она не производится). [1]
Изотоп
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12 C, 222 Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Содержание
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
См. также
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
Урок 2. Изотопы элементов
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
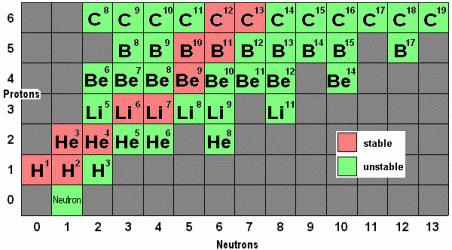
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24 Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25 Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26 Mg. Средняя атомная масса магния находится следующим образом:
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
изотопы
Полезное
Смотреть что такое «изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Наверное, нет на земле такого человека, который не слышал бы об изотопах. Но далеко не все знают, что это такое. Особенно пугающе звучит словосочетание «радиоактивные изотопы». Эти непонятные химические элементы нагоняют ужас на человечество, но на самом деле они не так страшны, как это может показаться на первый взгляд.
Определение
Чтобы разобраться с понятием радиоактивных элементов, необходимо для начала сказать, что изотопы – это образцы одного и тот же химического элемента, но с разной массой. Что это значит? Вопросы исчезнут, если для начала мы вспомним строение атома. Состоит он из электронов, протонов и нейтронов. Число первых двух элементарных частиц в ядре атома всегда постоянно, тогда как нейтроны, имеющие собственную массу, могут встречаться в одном и том же веществе в разных количествах. Это обстоятельство и порождает разнообразие химических элементов с разными физическими свойствами.
Теперь мы можем дать научное определение исследуемому понятию. Итак, изотопы – это совокупный набор похожих по свойствам химических элементов, но имеющих разную массу и физические свойства. Согласно более современной терминологии, они носят название плеяды нуклеотидов химического элемента.
Немного истории
В начале прошлого века ученые обнаружили, что у одного и того же химического соединения в разных условиях могут наблюдаться разные массы ядер электронов. С чисто теоретической точки зрения, такие элементы можно было посчитать новыми и начать заполнять ими пустые клеточки в периодической таблице Д. Менделеева. Но свободных ячеек в ней всего девять, а новые элементы ученые открывали десятками. К тому же и математические подсчеты показали, что обнаруженные соединения не могут считаться ранее не известными, ведь их химические свойства полностью соответствовали характеристикам уже существующих.
После длительных обсуждений было решено назвать эти элементы изотопами и помещать их в одну клеточку с теми, ядра которых содержат с ними одинаковое количество электронов. Ученым удалось определить, что изотопы – это всего лишь некоторые вариации химических элементов. Однако причины их возникновения и длительность жизни изучались еще почти целое столетие. Даже в начале XXI века утверждать, что человечество знает абсолютно все об изотопах, нельзя.
Стойкие и нестойкие вариации
Каждый химический элемент имеет несколько изотопов. Из-за того, что в их ядрах есть свободные нейтроны, они не всегда вступают в стабильные связи с остальными составляющими атома. Через некоторое время свободные частицы покидают ядро, из-за чего меняется его масса и физические свойства. Так образуются другие изотопы, что ведет в конце концов к образованию вещества с равным количеством протонов, нейтронов и электронов.
Те вещества, которые распадаются очень быстро, называются радиоактивными изотопами. Они выпускают в пространство большое количество нейтронов, образующих мощное ионизирующее гамма-излучение, известное своей сильной проникающей способностью, которая негативно влияет на живые организмы.
Более стойкие изотопы не являются радиоактивными, поскольку количество выделяемых ими свободных нейтронов не способно образовывать излучения и существенно влиять на другие атомы.
Достаточно давно учеными была установлена одна важная закономерность: у каждого химического элемента есть свои изотопы, стойкие или радиоактивные. Интересно, что многие из них были получены в лабораторных условиях, а их присутствие в естественном виде невелико и не всегда фиксируется приборами.
Распространение в природе
В естественных условиях чаще всего встречаются вещества, масса изотопа которых напрямую определяется его порядковым числом в таблице Д. Менделеева. К примеру, водород, обозначаемый символом Н, имеет порядковый номер 1, а его масса равна единице. Изотопы его, 2Н и 3Н, в природе встречаются крайне редко.
Даже человеческий организм имеет некоторое количество радиоактивных изотопов. Попадают они внутрь через пищу в виде изотопов углерода, который, в свою очередь, впитывается растениями из почвы или воздуха и переходит в состав органических веществ в процессе фотосинтеза. Поэтому и человек, и животные, и растения излучают определенный радиационный фон. Только он настолько низкий, что не мешает нормальному функционированию и росту.
Источниками, которые способствуют образованию изотопов, выступают внутренние слои земного ядра и излучения из космоса.
Как известно, температура на планете во многом зависит от ее горячего ядра. Но только совсем недавно стало понятно, что источником этого тепла выступает сложная термоядерная реакция, в которой участвуют радиоактивные изотопы.
Распад изотопов
Поскольку изотопы – это нестойкие образования, можно предположить, что они по прошествии времени всегда распадаются на более постоянные ядра химических элементов. Это утверждение верно, поскольку ученым не удалось обнаружить в природе огромного количества радиоактивных изотопов. Да и большинство из тех, которые были добыты в лабораториях, просуществовали от пары минут до нескольких дней, а потом снова превратились в обычные химические элементы.
Но есть в природе и такие изотопы, которые оказываются очень устойчивыми к распаду. Они могут существовать миллиарды лет. Образовались такие элементы в те далекие времена, когда земля еще формировалась, а на ее поверхности не было даже твердой коры.
Радиоактивные изотопы распадаются и вновь образуются очень быстро. Поэтому с той целью, чтобы облегчить оценку стойкости изотопа, учеными было принято решение рассматривать категорию периода его полураспада.
Период полураспада
Не всем читателям может быть сразу понятно, что имеется в виду под этим понятием. Определим же его. Период полураспада изотопа – это время, за которое перестанет существовать условная половина взятого вещества.
Это не означает, что оставшаяся часть соединения будет уничтожена за такое же количество времени. Применительно к этой половине необходимо рассматривать иную категорию – период времени, за который исчезнет ее вторая часть, то есть четверть изначального количества вещества. И такое рассмотрение продолжается до бесконечности. Можно предположить, что время полного распада изначального количества вещества посчитать просто невозможно, поскольку этот процесс практически бесконечен.
Однако ученые, зная период полураспада, могут определить, какое количество вещества существовало вначале. Эти данные успешно используются в смежных науках.
В современном научном мире понятие полного распада практически не используется. Относительно каждого изотопа принято указывать время его полураспада, которое варьирует от нескольких секунд до многих миллиардов лет. Чем меньше показатель полураспада, там большее излучение исходит от вещества и тем выше его радиоактивность.
Обогащение ископаемых
В некоторых отраслях науки и техники использование относительно большого количества радиоактивных веществ считается обязательным. Но при этом в естественных условиях таких соединений совсем немного.
Известно, что изотопы – это нераспространенные варианты химических элементов. Количество их измеряется несколькими процентами от самой стойкой разновидности. Именно поэтому ученым необходимо проводить искусственное обогащение ископаемых материалов.
За годы исследований удалось узнать, что распад изотопа сопровождается цепной реакцией. Освобожденные нейтроны одного вещества начинают влиять на другое. В результате этого тяжелые ядра распадаются на более легкие и получаются новые химические элементы.
Это явление получило название цепной реакции, в результате которой можно получить более стойкие, но менее распространенные изотопы, которые в дальнейшем используются в народном хозяйстве.
Применение энергии распада
Также учеными было выяснено, что в ходе распада радиоактивного изотопа выделяется огромное количество свободной энергии. Ее количество принято измерять единицей Кюри, равной времени деления 1 г радона-222 за 1 секунду. Чем выше этот показатель, тем больше энергии выделяется.
Это стало поводом для разработки способов использования свободной энергии. Так появились атомные реакторы, в которые помещается радиоактивный изотоп. Большая часть энергии, выделяемой им, собирается и превращается в электричество. На основании этих реакторов создаются атомные станции, которые дают самое дешевое электричество. Уменьшенные варианты таких реакторов ставят на самоходные механизмы. Учитывая опасность аварий, чаще всего такими машинами выступают подводные лодки. В случае отказа реактора количество жертв на подлодке будет легче свести к минимуму.
Изотопы в медицине
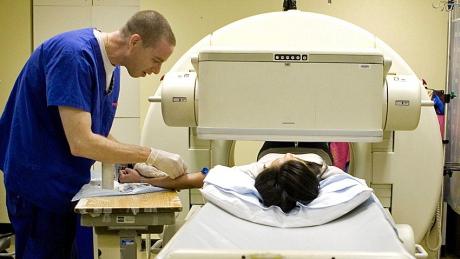
В мирных целях распад радиоактивных изотопов научились использовать в медицине. Направив излучение на пораженный участок организма, можно приостановить течение болезни или помочь пациенту полностью излечиться.
Но чаще радиоактивные изотопы используют для диагностики. Все дело в том, что их движение и характер скопления проще всего зафиксировать по излучению, которое они производят. Так, в организм человека вводится определенное неопасное количество радиоактивного вещества, а по приборам медики наблюдают, как и куда оно попадет.
Таким образом проводят диагностику работы головного мозга, характера раковых опухолей, особенности работы желез внутренней и внешней секреции.
Применение в археологии
Известно, что в живых организмах всегда есть радиоактивный углерод-14, полураспад изотопа которого равен 5570 лет. Кроме того, ученные знают, какое количество этого элемента содержится в организме до момента его смерти. Это значит, что все спиленные деревья излучают одинаковое количество радиации. Со временем интенсивность излучения падает.
Это помогает археологам определить, как давно умерло дерево, из которого построили галеру или любой другой корабль, а значит, и само время строительства. Этот метод исследования получил название радиоактивного углеродного анализа. Благодаря ему ученым легче установить хронологию исторических событий.