Что такое ионы металлов
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
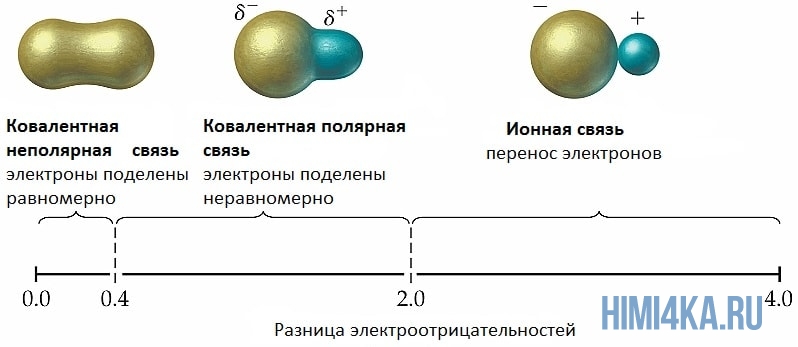
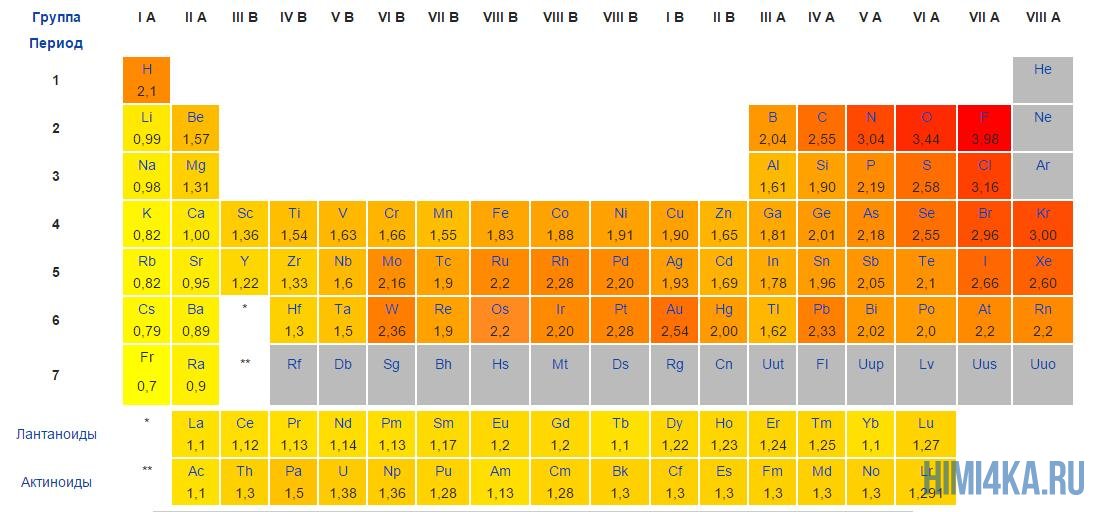
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
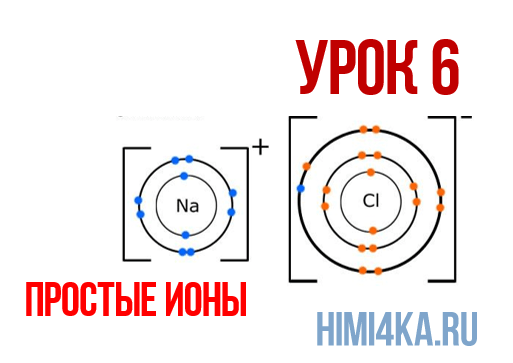
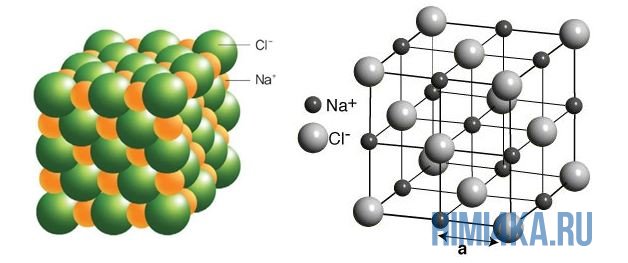
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
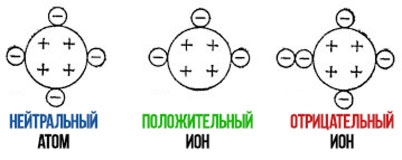
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Глава 3. Комплексные соединения
Cоли металлов под действием воды
Следовательно, в водных растворах солей находятся катионы металлов, им-то и надо приписать все те свойства, с которыми встречается ученый, исследующий роль металлов в организмах.
Так ли это? Не совсем так!
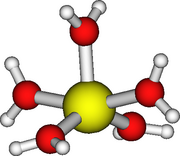
Ион металла, находящийся в водном растворе того или иного вещества, вовсе не безразличен к своему окружению. Он вступает во взаимодействие с молекулами воды и образует соединения, в которых на один ион приходится от 4 до 8 (а в отдельных случаях и более) молекул воды. Казалось бы, нет прямой связи между валентностью металла и числом присоединяемых молекул, да и вообще непонятно, как нейтральная (т. е. не имеющая свободных валентностей) молекула воды может присоединяться к иону.
Теория валентности приписывала каждому атому определенное число единиц валентности (обозначаемых черточками), причем предполагалось, что атом водорода одновалентен. Если какие-либо другие атомы присоединяли к себе, например, два, три или четыре атома водорода, то это означало, что данные атомы двух-, трех- и четырехвалентны: двухвалентна сера в сероводороде H2S, трехвалентен азот в аммиаке NH3, четырехвалентен углерод в метане СН4 и т. д. Величина валентности изменяется от 1 до 8, и если в молекуле соединения все валентности насыщены (нет свободных единиц-черточек), то такая молекула уже не может соединяться с другой частицей. Поэтому молекула воды, структурная формула которой 
Фактически дело обстоит не так, и молекулы воды образуют с ионами металлов разнообразные соединения. Они отличаются рядом характерных свойств, в частности окраской.
Но не только вода, а и другие соединения могут взаимодействовать с ионами металлов в растворах. Добавим, например, к водному раствору какой-либо соли меди (можно взять раствор хлорида СuСl2) избыток водного аммиака. Сначала появится зеленовато-голубой осадок, затем он быстро исчезнет, а жидкость приобретет красивый темно-синий цвет. Что произошло? Первые порции водного аммиака вступили в реакцию с хлоридом меди, и получился осадок гидроксида меди (II):
Реакция водного аммиака с хлоридом меди
Взаимодействие гидроксида меди с молекулами аммиака
Это соединение способно диссоциировать, отщепляя ионы ОН-:
Диссоциация аммиаката меди
* ( В современной научной литературе комплексные соединения часто называют координационными; оба термина равнозначны.)
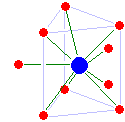
Величина координационного числа определяется относительными размерами иона и лигандов и величиной электрического заряда центрального иона. Большой заряд и малые размеры иона благоприятствуют высоким координационным числам.
Иногда в молекуле органического соединения находятся две или более групп, способных присоединяться к иону металла. В таких случаях одна молекула-лиганд занимает вблизи от иона (в так называемой координационной сфере иона) не одно, а два или более мест.
Cоединение иона меди с молекулами этилендиамина
Как видно из формулы, комплексообразование в этом случае приводит к возникновению циклов: ион меди, соединяясь с атомами азота, замыкает два цикла (пунктир обозначает связи между ионом и атомами азота лиганда). Такие комплексы называют хелатными («клешнеобразными»).
В таблице 3 указано соединение иона циркония с анионами щавелевой кислоты. Здесь лигандом является отрицательно заряженный ион С2O4-. Формула щавелевой кислоты:
Формула щавелевой кислоты
Формула аниона щавелевой кислоты
Каждый анион занимает два координационных места; всего четыре таких частицы-лиганда занимают восемь мест, поэтому координационное число циркония равно 8.
По мере расширения круга исследований неорганических и органических веществ число комплексных соединений металлов с различными лигандами все увеличивалось. Постепенно выяснилось, что перед химиками открывается совершенно новая область науки, имеющая первостепенное значение для решения целого ряда теоретических и практических вопросов. Ученым пришлось заново пересмотреть теорию химической связи и понятие валентности. Большой вклад в учение о комплексных соединениях внесли русский ученый Л. А. Чугаев и его ученики, синтезировавшие множество новых веществ и изучившие их свойства. Позже успешная работа над координационными соединениями была продолжена в исследованиях школы акад. И. И. Черняева, А. А. Гринберга, физико-химиков Л. Полинга, Р. Пирсона, К. Бальхаузена и др.
Для биохимии особенно важны комплексные соединения железа и магния, в которых четыре координационных места занимает одна частица, называемая порфином:
Комплексные соединения железа и магния
Устойчивость геометрической формы комплексного нона ведет к двум важным следствиям.
Во-первых, оказывается, что одно и то же координационное соединение, содержащее лиганды нескольких видов, может существовать в нескольких формах, различающихся способом размещения лигандов и соответственно физическими и химическими свойствами. Так, соединение Pt(NH3)2(NO2)2Cl2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):

Соединение Pt(NH3)2(NO2)2Cl2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):
Все пять форм были получены советскими учеными И. И. Черняевым и Г. С. Муравейской. Это явление аналогично явлению изомерии, характерному для органических соединений. Очевидно, все вышенаписанные формулы представляют строение изомеров одного и того же координационного соединения Pt(NH3)2(NO2)2Cl2.
Во-вторых, геометрическая форма комплекса влияет на способность центрального иона металла вступать в те или иные взаимодействия с дгими молекулами. Если ион металла имеет координационное число 6 и находится в центре октаэдра, то он, конечно, довольно хорошо изолирован от внешней среды, и молекулам, с которыми о бы вступить в соединение, трудно до него добраться. Но если тот же ион располагается в центре плоского квадрата и имеет КЧ, равное 4, то он открыт с двух сторон. Даже в том случае, когда с одной стороны ион уже присоединил какую-либо частицу (например, частицу белка), все равно с другой стороны к нему открыт доступ.
Именно так обстоит дело с гемоглобином. Комплекс железа с протопорфирином (замещенным порфином) имеет плоское строение, КЧ равно 4. Кроме того, с одной стороны к иону железа присоединена молекула белка (глобин), но шестое место в координационной сфере свободно. Это место и занимает молекула кислорода, переносимого гемоглобином в процессе дыхания. Если бы комплекс железа имел КЧ, равное 6, и ион железа был бы изолирован от среды, гемоглобин не мог бы переносить кислород, необходимый для дыхания клеток.
Как видно, даже геометрические особенности координационных соединений имеют жизненно важное значение. Одной из самых характерных особенностей химии координационных соединений является глубокое различие между свойствами простого иона и иона, окруженного лигандами. Иначе говоря, свойства комплексного иона существенно зависят от химической природы как центрального иона, так и лигандов (табл. 4).
| Ион металла | Лиганд | Свойство комплексов с данным лигандом | Свойства гидротированного иона |
|---|---|---|---|
| Медь | Аммиак, амины | Реагируют с целлюлозой, темно-синяя окраска; бурно разлагают пероксид водорода | Не реагируют с целлюлозой, слабоголубая окраска; медленно разлагают пероксид водорода |
| Железо | Порфин (его производные) | Переносят кислород. Энергично разлагают пероксид водорода, ускоряют окисление различных веществ | Не способен переносить кислород. Окислительные свойства выражены относительно слабо |
| Цинк | Белки То же | Ускоряют разложение гидрокарбонатов. Способствуют усвоению белков | Не влияет на разложение гидрокарбонатов и усвоение белков |
| Молибден | Белки | Способствуют усвоению бактериями атмосферного азота | Не влияет на усвоение атмосферного азота |
| Магний | Производное порфина | Хлорофилл обусловливает превращение диоксида углерода и воды в углеводы (фотосинтез) | Не ускоряет фотосинтез |
Ионы металлов, не связанные с лигандами, встречаются редко. В сущности, химик может наблюдать свойства такого «простого» иона металла разве что при очень высоких температурах в газообразной среде, нагревая ту или иную соль до температур порядка тысяч градусов. В растворах солей ионы металлов связаны с молекулами воды (гидратированы) и, следовательно, находятся там в виде комплексов. Но заменим молекулы воды на молекулы аммиака, например в растворе соли меди CuCl2. Как мы уже знаем, при этом получится темно-синий комплекс, имеющий свойства, которых нет у гидратированного иона.
Суммируем вкратце, что мы узнали о том, каким образом действуют ионы металлов в клетках организма.
Металлы находятся в клетках в виде комплексных соединений с различными органическими, веществами: белками, различными производными порфина и др. Комплексные ионы присоединяют к себе частицы-лиганды так, что получается правильная геометрическая форма: треугольник, тетраэдр, октаэдр и т. п. Одно или два места около иона могут остаться свободными, и туда попадают другие молекулы, например молекула кислорода в частицу гемоглобина. Все лиганды занимают определенные положения и относительно иона, и относительно друг друга; они, как говорят, правильно ориентированы в пространстве.
Вопрос об электронном строении координационных соединений вызывал споры среди ученых на протяжении не одного десятка лет. Казалось очень странным, что к соединению, в котором явно насыщены все валентности, можно присоединить нейтральные молекулы. Придумывали очень сложные структурные формулы, приписывали атомам несвойственные им валентности, но все это не привело к успеху. Только развитие теории строения атома и химической связи, а также достижения квантовой химии помогли понять, почему образуются координационные соединения и какова их роль в процессах обмена веществ в организмах.
Почему вообще возникает химическая связь? Рассмотрим простой пример: соединяются атомы лития и фтора. В атоме лития, как известно, содержится три электрона. Два из них связаны очень прочно, а третий находится во втором слое и связан слабее. В атоме фтора во втором слое уже семь электронов (а всего их в атоме фтора девять). При взаимодействии атома лития с атомом фтора слабо связанный электрон лития переходит к атому фтора и занимает место во втором слое. Этот процесс сопровождается уменьшением запаса потенциальной энергии атомов и происходит легко. Избыток энергии выделяется в виде теплоты и частично в виде света. После перехода электрона атом фтора приобретает отрицательный заряд, так как у него теперь один «лишний» электрон, а атом лития заряжается положительно (у него не хватает одного электрона). Оба заряженных атома (их надо называть уже не атомами, а ионами) притягиваются друг к другу и образуют молекулу фторида лития:
Молекула фторида лития
Атом азота, вступающий в соединение с тремя атомами водорода
В атоме азота пять внешних электронов. Три из них использованы для соединения с атомами водорода. Каждый атом водорода отдает по одному электрону для образования пар, связывающих оба атома. Схема электронного строения аммиака выглядит так:
Схема электронного строения аммиака
Если число электронов на данном уровне мало (или если на уровне вообще нет электронов, хотя они могли бы там находиться), то другая частица, имеющая свободную (неподеленную) пару электронов, вполне может передать эту пару на свободный (вакантный) уровень.
В примере с фторидом лития было указано, что электроны, связывающие ионы лития и фтора, образуют общую систему и движутся так, что в своем движении они охватывают оба атома. Квантовая механика ничего не говорит о движении электрона, ее методы позволяют вычислить только вероятность того, что электрон находится в данной части пространства. Поэтому вместо того чтобы рисовать пути движения электрона в атоме или молекуле (траектории или орбиты), ограничиваются геометрическим описанием той области пространства около ядра атома, где вероятность найти электрон достаточно велика. Эта область пространства может иметь форму сферы (s-электроны), или гантели (р-электроны), или розеткообразной фигуры (d-электроны). Часто поэтому говорят об электронных «облаках», когда хотят приближенно представить себе распределение электронных зарядов в атоме или молекуле.
В координационных соединениях, имеющих электроны электронных пар различных лигандов и электроны иона металла, существуют электронные облака, охватывающие сразу несколько частиц (ион и отдельные группы атомов в лигандах). Точные расчеты распределения вероятностей найти электрон в этом облаке очень сложны и требуют знания волновых функций электронов во всех частицах. Волновой функцией называют математическую зависимость между координатами электрона в атоме (именно к волновой функции относится термин «орбиталь», который не надо путать с «орбитой» прежних теорий строения атома).
Что такое ионы металлов
(от греч. ión — идущий)
электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И. Понятие и термин «И.» ввёл в 1834 М. Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением И. Положительно заряженные И., движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду), — анионами.
В газах И. образуются большей частью под действием ударов частиц большой энергии или при фотоионизации под действием ультрафиолетовых, рентгеновских и гамма-лучей (см. Ионизирующие излучения). Образовавшиеся таким путём И. в обычных условиях недолговечны вследствие способности соединяться, взаимно нейтрализуясь. При высокой температуре ионизация атомов и ионов (термическая ионизация, т. е. термическая диссоциация с отделением электрона) может происходить также как равновесный процесс, в котором степень ионизации возрастает с повышением температуры и с понижением давления. Газ переходит при этом в состояние плазмы (См. Плазма).
И. в газах играют большую роль во многих явлениях. В природных условиях И. образуются в воздухе под действием космических лучей, солнечного излучения или электрического разряда (молнии). Присутствие И., их вид и концентрация влияют на многие физические свойства Воздуха, на его физиологическую активность (см. Ионы в атмосфере). На использовании И. основаны многие методы экспериментального исследования (Масс-спектроскопия, применение Вильсона камеры (См. Вильсона камера) и др.). И. в газах обладают высокой химической активностью, легко вступая во взаимодействие с другими частицами и вызывая те или иные химические реакции. Низкотемпературная плазма, состоящая из ионизированных частиц, используется в работе магнитогидродинамических генераторов. Высокотемпературная плазма — при разработке методов осуществления управляемой термоядерной реакции.
И. в организме — непременные участники обмена веществ. Они, в частности, участвуют в механизмах, обусловливающих проницаемость биологических мембран (См. Биологические мембраны), в регуляции мышечного сокращения, в проведении импульса возбуждения по нервному волокну и т. д. Постоянно протекающая диссоциация молекул на И. и противоположный процесс — ассоциация И. в молекулы — так сбалансированы в организме, что содержание И. в клетках и тканевых жидкостях в норме поддерживается на определённом уровне (см. Гомеостаз). Однако при некоторых воздействиях этот уровень может сдвигаться.
СОДЕРЖАНИЕ
Введение в акваионы металлов
| ЧАС | Он | ||||||||||||||||||||||||||||||
| Ли | Быть | B | C | N | О | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | п | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge * | В виде | Se | Br | Kr | ||||||||||||||
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | Компакт диск | В | Sn | Sb * | Te | я | Xe | ||||||||||||||
| CS | Ба | Ла | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По * | В | Rn |
| Пт * | Ра * | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es * | Fm * | Мкр * | Нет* | Lr * |
* Нет экспериментальной информации о структурах акваионов.
Молекулы воды в первой и второй сольватных оболочках могут меняться местами. Скорость обмена сильно различается в зависимости от металла и степени его окисления. Акваионы металлов всегда сопровождаются в растворе сольватированными анионами, но о сольватации анионов известно гораздо меньше, чем о сольватации катионов.
Встречаемость в природе
Экспериментальные методы
Информация, полученная о природе ионов в растворе, зависит от типа используемого экспериментального метода. Некоторые методы выявляют свойства катиона напрямую, другие выявляют свойства, которые зависят как от катиона, так и от аниона. Некоторые методы предоставляют информацию статического характера, своего рода снимок средних свойств, другие предоставляют информацию о динамике решения.
Ядерный магнитный резонанс (ЯМР)
Ионы, для которых скорость водообмена низкая по шкале времени ЯМР, дают отдельные пики для молекул в первой сольватной оболочке и для других молекул воды. Число сольватации получается как отношение площадей пиков. Здесь это относится к количеству молекул воды в первой сольватной оболочке. Молекулы во второй сольватной оболочке быстро обмениваются с молекулами растворителя, вызывая небольшое изменение значения химического сдвига некоординированных молекул воды по сравнению с самой водой. Основным недостатком этого метода является то, что он требует достаточно концентрированных растворов, что связано с риском образования ионной пары с анионом.
| Ион | Быть 2+ | Мг 2+ | Al 3+ | Ga 3+ | Через 3+ | Fe 2+ | Co 2+ | Ni 2+ | Zn 2+ | Чт 4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| Номер | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Ядро | 1 Н 17 О | 1 ч | 1 ч | 1 Н 17 О | 1 ч | 17 O | 1 ч | 1 Н 17 О | 1 ч | 1 ч |
Рентгеновская дифракция (XRD)
Раствор, содержащий акваион, не имеет дальнего порядка, который присутствовал бы в кристалле, содержащем тот же ион, но есть ближний порядок. Дифракция рентгеновских лучей на растворах дает функцию радиального распределения, из которой можно определить координационное число иона металла и расстояние металл-кислород. С помощью акваионов с большим зарядом можно получить некоторую информацию о второй сольватной оболочке.
Этот метод требует использования относительно концентрированных растворов. Рентгеновские лучи рассеиваются электронами, поэтому рассеивающая способность увеличивается с атомным номером. Это делает атомы водорода почти невидимыми для рассеяния рентгеновских лучей.
Нейтронная дифракция
| Поваренная соль | LiCl | CaCl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Моляльность соли | 27,77 | 9,95 | 3,57 | 4,49 | 2,80 | 1.0 | 3,05 | 0,85 | 0,46 | 0,086 |
| Число гидратации катионов † | 2,3 (2) | 3,0 (5) | 5,5 (3) | 6,4 (3) | 7,2 (2) | 10,0 (6) | 5,8 (2) | 6,6 (5) | 6,8 (8) | 6,8 (8) |
| θ / град ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| Поваренная соль | Ni (ClO 4 ) 2 | Cu (ClO 4 ) 2 | Fe (NO 3 ) 3 | NdCl 3 | DyCl 3 |
|---|---|---|---|---|---|
| Моляльность соли | 3,80 | 2,00 | 2.0 | 2,85 | 2.38 |
| Число гидратации катионов † | 5,8 (2) | 4,9 (3) | 5,0 (2) | 8,5 (2) | 7,4 (5) |
| θ / град ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
† Цифры в скобках представляют собой стандартные отклонения последней значащей цифры значения. ‡ угол между связью M-OH 2 и плоскостью молекулы воды.
Большинство этих данных относятся к концентрированным растворам, в которых очень мало молекул воды, которые не находятся в сферах первичной гидратации катиона или аниона, что может объяснить некоторые вариации сольватационного числа с концентрацией, даже если нет контактного иона. спаривание. Угол θ дает угол наклона молекул воды относительно плоскости в акваионе. На этот угол влияют водородные связи, образующиеся между молекулами воды в первичной и вторичной сольватных оболочках.
Измеренное сольватационное число представляет собой усредненное по времени значение для раствора в целом. Когда измеренное число первичной сольватации является дробным, два или более частиц с целыми числами сольватации находятся в равновесии друг с другом. Это также относится к числам сольватации, которые являются целыми числами в пределах экспериментальной ошибки. Например, сольватационное число 5,5 для раствора хлорида лития можно интерпретировать как результат присутствия двух разных акваионов с равными концентрациями.
лежащий целиком в пользу ионной пары.
Колебательные спектры
Инфракрасные спектры и спектры комбинационного рассеяния могут быть использованы для измерения частоты растяжения МО в акваионах металлов. Рамановская спектроскопия особенно полезна, потому что спектр комбинационного рассеяния воды слаб, тогда как инфракрасный спектр воды интенсивен. Интерпретация частот колебаний несколько усложняется наличием в октаэдрических и тетраэдрических ионах двух колебаний: симметричного, измеренного в спектре комбинационного рассеяния, и антисимметричного, измеренного в инфракрасном спектре.
| ион металла | Быть 2+ | Мг 2+ | Mn 2+ | Fe 2+ | Ni 2+ | Cu 2+ | Zn 2+ | Hg 2+ | Al 3+ | Ga 3+ | Через 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| волновое число / см −1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Хотя связь между частотой колебаний и силовой постоянной непроста, общий вывод, который можно сделать из этих данных, заключается в том, что прочность связи МО увеличивается с увеличением заряда иона и уменьшением размера ионов. Частоту растяжения МО акваиона в растворе можно сравнить с его аналогом в кристалле известной структуры. Если частоты очень похожи, можно сделать вывод, что координационное число иона металла в растворе такое же, как и в соединении в твердом состоянии.
Динамические методы
| Ли + | Na + | CS + | Мг 2+ | Ca 2+ | Ba 2+ | Zn 2+ | Cr 3+ | Al 3+ | |
|---|---|---|---|---|---|---|---|---|---|
| Ионный транспортный номер | 13–22 | 7-13 | 4 | 12–14 | 8–12 | 3-5 | 10-13 | ||
| Ионная подвижность | 3–21 | 2-10 | 10-13 | 7-11 | 5-9 | 10-13 | |||
| Диффузия | 5 | 3 | 1 | 9 | 9 | 8 | 11 | 17 | 13 |
Сольватационные числа и структуры
Водород
Щелочные металлы
Щелочноземельные металлы
Металлы 3 группы, лантаноиды и актиниды
Металлы 4-12 группы
Сольватационное число 6 с октаэдрической структурой хорошо установлено для цинка (II) и кадмия (II) в разбавленных растворах. В концентрированных растворах ион Zn 2+ может принимать четырехкоординатную тетраэдрическую структуру, но доказательства неубедительны из-за возможности образования пар и / или гидролиза ионов. Сольватационное число ртути (II), скорее всего, равно 6.
Металлы 13-17 группы
Олово (II) и свинец (II) имеют 3-х и 6-ти координатную полукорпусную направленность соответственно. Для олова (II) первая координационная сфера рассчитана так, чтобы разделиться на две полусферы на разных расстояниях от иона. На практике эти катионы имеют тенденцию быть полиядерными. Висмут (III) представляет собой 8-координатную искаженную квадратную антипризматическую форму.
Хотя на структуры таллия (I), германия (II), олова (II), свинца (II) и сурьмы (III) влияют неподеленные пары, это не так для висмута (III).
Оксо-аква-катионы
Некоторые элементы в степени окисления выше 3 образуют стабильные, водные оксо-ионы. Хорошо известными примерами являются ионы ванадила (IV) и уранила (VI). Их можно рассматривать как особо стабильные продукты гидролиза в гипотетической реакции, такой как
Термодинамика
M z + (газ) + растворитель → M z + (в растворе)
Энтальпию этой реакции нельзя измерить напрямую, потому что во всех измерениях используются солевые растворы, содержащие как катион, так и анион. Большинство экспериментальных измерений относятся к теплу, выделяющемуся при растворении соли в воде, которое дает сумму энтальпий сольватации катионов и анионов. Затем, рассматривая данные для разных анионов с одним и тем же катионом и разных катионов с одним и тем же анионом, получают значения для одного иона относительно произвольного нуля.
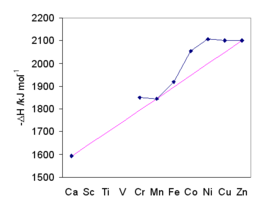
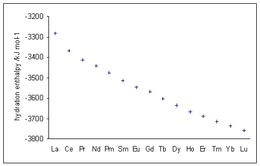
Может быть получена энтропия гидратации одного иона. Значения показаны в следующей таблице. Чем отрицательнее значение, тем больше упорядоченности в образовании акваиона. Примечательно, что тяжелые щелочные металлы имеют довольно низкие значения энтропии, что позволяет предположить, что как первая, так и вторая сольватационные оболочки несколько нечеткие.
Гидролиз акваионов
Есть два способа взглянуть на равновесие, связанное с гидролизом акваиона. Учитывая равновесие диссоциации
активность продукта гидролиза, пропуская молекулы воды, дается
Альтернативой является запись равновесия в виде реакции комплексообразования или замещения.
На практике первое определение более полезно, потому что константы равновесия определяются из измерений концентраций ионов водорода. В целом,
Моделирование реакций гидролиза, протекающих в растворе, обычно основано на определении констант равновесия по данным потенциометрического (pH) титрования. Этот процесс далеко не прост по целому ряду причин. Иногда частицы в растворе могут выпадать в осадок в виде солей, и их структура подтверждается рентгеновской кристаллографией. В других случаях осажденные соли не имеют никакого отношения к тому, что предполагается в растворе, потому что определенные кристаллические вещества могут иметь как низкую растворимость, так и очень низкую концентрацию в растворах.
Первая константа гидролиза
показывает линейную зависимость от отношения заряда к расстоянию до МО, z / d. Ионы делятся на четыре группы. Наклон прямой линии одинаков для всех групп, но точка пересечения A различается.
Стандартное изменение энтальпии для первой стадии гидролиза обычно не сильно отличается от изменения энтальпии при диссоциации чистой воды. Следовательно, стандартное изменение энтальпии для реакции замещения
близко к нулю. Это типично для реакций между твердым катионом и твердым анионом, например гидроксид-ионом. Это означает, что стандартный энтропийный заряд вносит основной вклад в изменение стандартной свободной энергии и, следовательно, в константу равновесия.
Изменение заряда иона отвечает за этот эффект, поскольку акваион оказывает большее упорядочивающее действие на раствор, чем гидроксокомплекс с меньшим зарядом.
Множественные реакции гидролиза
Полная реакция потери двух протонов из акваиона может быть записана как
Однако константа равновесия потери двух протонов одинаково хорошо применима к равновесию
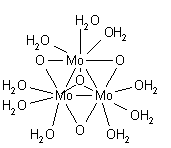
потому что концентрация воды считается постоянной. Это применимо в целом: любая константа равновесия одинаково действительна для продукта с оксидным ионом, как и для продукта с двумя гидроксильными ионами. Эти две возможности можно различить только путем определения структуры соли в твердом состоянии. Оксомосты обычно возникают при высокой степени окисления металла. Примером может служить комплекс молибдена (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+, в котором есть треугольник из атомов молибдена, соединенных σ-связями с оксидным мостиком на каждом краю треугольника и четвертый оксид, связывающий все три атома Мо.
Оксианионы
Оксо-акваионов металлов в степени окисления +5 и выше очень мало. Скорее, разновидностями, обнаруженными в водном растворе, являются мономерные и полимерные оксианионы. Оксианионы можно рассматривать как конечные продукты гидролиза, в которых к металлу присоединены не молекулы воды, а только ионы оксидов.
Кинетика обмена
Символ * означает, что это переходное состояние в химической реакции. Скорость этой реакции пропорциональна концентрации акваиона [A].
Обмен растворителя обычно происходит медленнее для трехвалентных ионов, чем для двухвалентных ионов, поскольку более высокий электрический заряд на катионе способствует более прочным связям M-OH 2 и, как следствие, более высокой энергии активации стадии диссоциативной реакции, [M (H 2 O) n ] 3+ → [M (H 2 O) n-1 ] 3+ + H 2 O. Значения в таблице показывают, что это связано как с энтальпией активации, так и с энтропийным фактором.
Формирование комплексов
pM x + (aq) + qL y− → [M p L q ] (px-qy) +
Электрохимия
| H + 0 | |||||||||||||
| Li + −3,040 | Be 2+ −1,85 | ||||||||||||
| Na + -2,71 | Mg 2+ -2,372 | Al 3+ -1,66 | |||||||||||
| К + −2,931 | Ca 2+ −2,868 | Sc 3+ -2,90 | . | Zn 2+ -0,751 | Ga 3+ −0,53 | Ge 2+ +0,1 | |||||||
| Rb + −2,98 | Sr 2+ −2,899 | Y 3+ −2,37 | . | Cd 2+ -0,403 | В 3+ −0,342 | Sn 2+ -0,136 | Сб 3+ +0,15 | ||||||
| Cs + −3,026 | Ba 2+ −2,912 | Лю 3+ −2,25 | . | Hg 2+ −0,854 | Tl 3+ +0,73 | Pb 2+ -0,126 | Би 3+ +0,16 | По 4+ +0,76 | |||||
| Fr + −2,9 | Ra 2+ −2,8 | Lr 3+ -1,96 | |||||||||||
| La 3+ −2,52 | Ce 3+ −2,32 | Pr 3+ −2,34 | Nd 3+ −2,32 | Рт 3+ -2,30 | См 3+ −2,28 | Eu 3+ -1,98 | Gd 3+ −2,27 | Tb 3+ −2,27 | Dy 3+ −2,32 | Но 3+ −2,37 | Er 3+ −2,33 | Тм 3+ −2,30 | Yb 3+ −2,23 |
| Ас 3+ −2,18 | Чт 4+ -1,83 | Па 4+ -1,46 | U 4+ -1,51 | Np 4+ -1,33 | Pu 4+ -1,80 | Am 3+ −2,06 | Cm 3+ -2,07 | Бк 3+ −2,03 | Cf 3+ −2,01 | Es 3+ -1,99 | Fm 3+ -1,97 | Md 3+ -1,65 | Нет 3+ -1,20 |
| Пара | Ti | V | Cr | Mn | Fe | Co | Ni | Cu |
|---|---|---|---|---|---|---|---|---|
| M 2+ / M | -1,63 | −1,18 | -0,91 | −1,18 | -0,473 | −0,28 | -0,228 | +0,345 |
| M 3+ / M | −1,37 | -0,87 | -0,74 | −0,28 | -0,06 | +0,41 |
| Ag + / Ag | Pd 2+ / Pd | Pt 2+ / Pt | Zr 4+ / Zr | ВЧ 4+ / ВЧ | Au 3+ / Au | Ce 4+ / Ce |
|---|---|---|---|---|---|---|
| +0,799 | +0,915 | +1,18 | −1,53 | -1,70 | +1,50 | -1,32 |