Что такое двухатомный спирт
Спирты
Карточка контроля знаний (скачать PDF 255КБ)
Спирты – производные углеводородов, в молекулах которых есть одна или несколько гидроксильных групп (ОН-), непосредственно связанных с атомом углерода в углеводородном радикале.
Классификация спиртов
Спирты классифицируются по разным структурным признакам:
1) По числу гидроксильных групп:
— одноатомные спирты – спирты, у которых имеется одна гидроксильная группа;
— многоатомные – спирты, имеющие несколько гидроксильных групп: например, двухатомные спирты (гликоли), трёхатомные спирты (глицерины) и т.д.;
2) В зависимости от насыщенности углеводородного заместителя:
— предельные (насыщенные) спирты, содержащие в молекуле лишь предельные углеводородные радикалы, например: метанол СН3ОН, этанол CH3 – CH2OH.
— непредельные (ненасыщенные) спирты, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
пропен-2-ол-1 (аллиловый спирт) CH2 = СН – CH2OH.
— ароматические спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
3) В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— ациклические (алифатические) спирты (этанол);
— алициклические спирты (циклогексанол).
4) В зависимости от числа заместителей при α-углеродном атоме:
Номенклатура
CH3ОН метанол (метиловый спирт)
CH2OH – CH3 этанол (этиловый спирт)
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила: углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы:
Изомерия спиртов
1) Структурная изомерия
а) Положения функциональной группы (начинается с третьего члена гомологического ряда)
пропанол-1 (пропиловый спирт) пропанол-2 (изопропиловый спирт)
б) Изомерия углеродного скелета (начинается с четвертого члена гомологического ряда)
бутанол- 1 2-метилпропанол-1
в) Межклассовая изомерия (начинается со второго члена гомологического ряда) – спирты изомерны простым эфирам:
этанол (этиловый спирт) диметиловый эфир
2) Пространственная изомерия – оптическая (зеркальная).
Например, бутанол-2 СH3 – CH(OH) – СH2 – CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух зеркальных изомеров.
Физические свойства спиртов
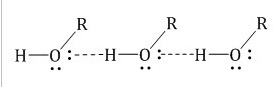
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, – жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре – твёрдые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, хорошо растворимы в воде. Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней. Например, октанол-1 растворяется лишь в пропорции 1 мл в 2 л воды. Температура кипения также возрастает с увеличением атомной массы, например, tкип.СН3ОН 65°С, а tкип.С2Н5ОН 78°С. Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется. Данные физические свойства насыщенных спиртов с одной гидроксильной группой можно объяснить возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды.
При всей пользе этиленгликоля нужно учитывать, это очень сильный яд!
Глицерин представляет собой вязкую бесцветную жидкость, сладковатую на вкус. Он очень хорошо растворим в воде, кипит при температуре 220 0 C. Его химическая формула CH2OH–СНОН–CH2OH – это трёхатомный спирт.
Строение спиртов
Двухатомные спирты
Вы будете перенаправлены на Автор24
Определение и номенклатура двухатомных спиртов
Органические соединения, содержащие две гидроксильные группы ($-OH-$) называются двухатомными спиртами или диолами.
1,2-пропандиол транс-1,2-циклогександиол 1-циклогексил-1,4-пентадиол
В систематической номенклатуре существует дифференциация между 1,2-, 1,3-, 1,4- и т.д. диолами.
Если соединение содержит гидроксильные группы у соседних (вициеальных) атомов углерода, то двухатомные спирты называют гликолями.
В названиях гликолей отображается способ их получения путем гидроксилирования алкенов, например:
Из спиртов, соответствующих нормальному бутану, возможно существование следующих соединений:
Готовые работы на аналогичную тему
Изобутану соответствуют следующие диолы:
Двухатомные спирты можно классифицировать на основании того, какие спиртовые группы входят с состав их частицы:
Например: изопентану соответствует вторично-третичный гликоль
Гексану (тетраметил-этану) соответствует двутретичный гликоль:
Геминальные диолы
Равновесие смещено в сторону образования кетона, поэтому геминальные диолы также называют гидратами альдегидов или кетонов.
$HO-CH_2-OH \leftrightarrow H_2C=O + H_2O$
Например: Не может существовать в свободном состоянии двухатомный спирт, соответствующий этану, если обе гидроксильные группы находятся при одном атоме углерода. Сразу выделяется вода и образуется уксусный альдегид:
Незначительное количество гем-диолов могут существовать не в растворенном состоянии. Это соединения, которые содержат сильные электроноакцепторные заместители, например хлоральгидрат и гидрат гексафотрацетон
Физические свойства гликолей
Для гликолей характерны следующие физические свойства:
Двухатомные спирты
Двухатомные спирты (гликоли, или диолы) — что это за соединения
Спирты представляют собой класс органических веществ, в состав которых входит одна или несколько гидроксильных групп (—OH), связанных с атомом углерода (C) в углеводородном радикале (R—OH).
Двухатомные спирты (диолы, или гликоли) — органические соединения, содержащие в структуре молекулы две гидроксильные группы.
Основные формулы с примерами
Основные формулы гликолей:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Диолы легко выстраиваются в гомологический ряд, сформулировать который можно с помощью гомологического ряда насыщенных углеводородов, заменяя в структуре их молекул два атома водорода на OH-группы.
Номенклатура гликолей
В номенклатуре ИЮПАК для названия двухатомных спиртов вместо окончания «-ол» используют «-диол» (пропандиол, этандиол и т. д.), а цифрами обозначают атомы углерода главной цепи, к которым присоединены две группы (OH).
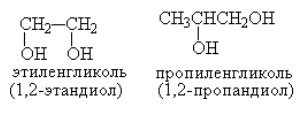
1,2-этандиол (этиленгликоль), 1,3-пропандиол, 1,2-пропандиол (пропиленгликоль), транс-1,2-циклогександиол и т. д.
Подобная систематическая номенклатура осуществляет дифференциацию 1,2-, 1,3-, 1,4-диол, т. к. от взаимного расположения OH-групп зависят химические и физические свойства веществ.
Пропиленгликоль представлен двумя изомерами:
При этом способность к вступлению в химическую реакцию и склонность к полимеризации у 1,2-пропиленгликоля выражены в меньшей степени, чем у 1,3-пропиленгликоля.
Гликоли, в структуре которых гидроксильные группы находятся возле разных атомов углерода, являются устойчивыми:
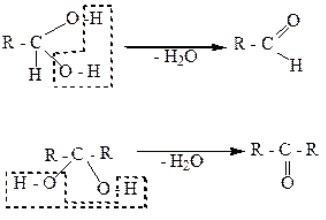
Геминальные диолы содержат две OH-группы возле одного углеродного атома, что обуславливает их неустойчивость. Такие гликоли легко разлагаются. В результате за счет гидроксильных групп отщепляется вода, и образуются альдегиды или кетоны:
Физические свойства гликолей
Гликоли чаще всего представляют собой густые, бесцветные, жидкости малой летучести, без запаха. Хорошо смешиваются с водой (особенно низшие диолы) и органическими растворителями (спиртами, кетонами, кислотами и аминами). Высокий показатель растворимости в воде объясняется образованием водородных связей между молекулами воды и спиртов — гидратацией:
Для всех спиртов характерно образование межмолекуляр ных водородных связей, вызывающих при тяжение и ассоциацию молекул спиртов:
Из-за наличия двух гидроксильных групп диолы имеют более высокую температуру кипения и плотность в сравнении с соответствующими им одноатомными.
Большинство диолов имеют сладкий, а некоторые — горьковатый вкус.
Химические свойства гликолей и их применение
Гликоли участвуют в тех же химических реакциях, что и одноатомные спирты, но отличаются тем, что в реакцию вводится либо одна, либо обе спиртовые группы. Поэтому у них бывают два ряда производных: полные и неполные.
При взаимодействии этиленгликоля с натрием (Na) получаются гликоляты:
При этом водород в диолах замещается легче, чем в одноатомных спиртах.
В результате межмолекулярного отсоединения воды в реакции по перегону этиленгликоля с серной кислотой \((<\mathrm H>_2<\mathrm
С помощью реакции гидратации получают этиленгликоль — самый простой двухатомный спирт и самое востребованное химическое соединение в промышленности и быту.
Этиленгликоль (1,2-этандиол, 1,2-диоксиэтан) — органическое соединение, простейший двухатомный спирт. Представляет собой жидкость без цвета и запаха, прозрачную и немного маслянистую со сладковатым вкусом. Легковоспламеняемый и токсичный (3-й класс опасности).
Химическая формула этиленгликоля:
Способность этиленгликоля понижать температуру замерзания воды нашла широкое применение в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Из-за коррозийной активности применяется с ингибиторами.
Благодаря высокой гигроскопичности этиленгликоль используется в растворении и изготовлении красок для печати, производстве чернил для шариковых ручек и т. д. Крайне популярен этиленгликоль в производстве пленкообразующих материалов, лаков, волокон (лавсана, например), в органическом синтезе простых и сложных эфиров.
Виды спиртов по характеру углеводородного радикала
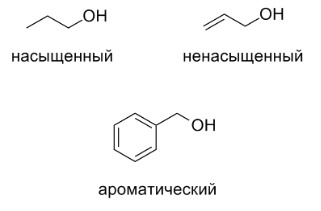
По структуре углеводородного радикала, связанного с атомом кислорода, спирты бывают следующих видов: предельные (насыщенные), непредельные (ненасыщенные), ароматические.
Предельные спирты
Предельные (насыщенные, алканолы) спирты — органические вещества, производные предельных углеводородов, в структуре которых атом водорода замещен на гидроксильную группу.
Для предельных спиртов характерна:
Изомерия — явление различия химических и физических свойств веществ при идентичности их количественного и качественного состава.
Начиная с бутанола, прослеживается изомерия углеродного скелета (1-бутанол: \(<\mathrm<СН>>_3-<\mathrm<СН>>_2-<\mathrm<СН>>_2-<\mathrm<СН>>_2-\mathrm<ОН>\) ; 2-метилпропанол-1: \(<\mathrm<СН>>_3-\mathrm<СН>(<\mathrm<СН>>_3)-<\mathrm<СН>>_2\mathrm<ОН>\) ), при которой наименование спирта записывается с использованием двух цифр. Первая из них показывает положение метильной группы, вторая — гидроксильной.
Непредельные спирты
Непредельные (ненасыщенные) содержат кратные (двойные и тройные) межуглеродные связи:
Непредельные спирты подразделяются на два основных типа:
Спирты первого типа неустойчивы и сразу же превращаются в соответствующие изомерные карбонильные соединения.
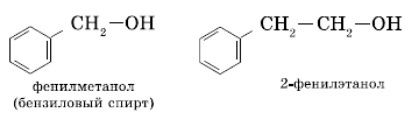
Ароматические спирты
Ароматические спирты являются производными жирноароматических углеводородов, имеющими в структуре фенильный радикал (производную от бензола), иными словами — ароматическое кольцо и гидроксильную группу, не связанные напрямую, а через атомы углерода.
К ароматическим спиртам относятся фенилметанол (бензиловый спирт) и 2-фенилэтанол.
Ароматические спирты не следует путать с фенолами, у которых группа (OH) связана с бензольным кольцом без посредников.
Дополнительная (внутренняя) классификация
Спирты также дифференцируют по следующим признакам.
В зависимости от местонахождения OH-группы в молекуле:
По числу OH-групп в молекуле соединения:
По количеству углеродных атомов в структуре молекулы спирта:
Спирты и фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
Классификация по строению углеводородного радикала
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
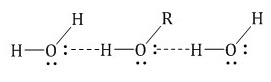
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
Например, пропандиол-1,2 (пропиленгликоль):
Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.