Что такое двойной электрический слой
Дзета-потенциал. Двойной электрический слой.
В дисперсных системах на поверхности частиц (на границе раздела частица-дисперсионная среда) возникает двойной электрический слой (ДЭС). Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд. Эти ионы называют потенциалопределяющими (ПОИ). К поверхности частицы из жидкой среды притягиваются ионы противоположного знака, их называют противоионами (ПИ).
Таким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде. Слой противоионов состоит из двух слоев:
Теории двойного электрического слоя широко используются для интерпретации поверхностных явлений. Однако не существует прямых методов измерения потенциалов на границе адсорбционного слоя. Для количественного определения величины электрического заряда в двойном электрическом слое широко используется дзета-потенциал. Дзета-потенциал не равен адсорбционному потенциалу или поверхностному потенциалу в двойном электрическом слое. Тем не менее, дзета-потенциал часто является единственным доступным способом для оценки свойств двойного электрического слоя. Знание дзета-потенциала важно во многих областях производственной и исследовательской деятельности.
Строение двойного электрического слоя
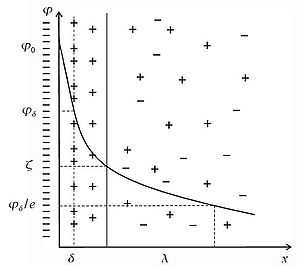
Образование двойного электрического слоя приводит к появлению электрического потенциала, который убывает с расстоянием, и его значение в разных точках соответствует:
Важность определения дзета-потенциала
Важность дзета-потенциала состоит в том, что его значение может быть связано с устойчивостью коллоидных дисперсий. Дзета-потенциал определяет степень и характер взаимодействия между частицами дисперсной системы.
Для молекул и частиц, которые достаточно малы, высокий дзета-потенциал будет означать стабильность, т.е. раствор или дисперсия будет устойчивы по отношению к агрегации. Когда дзета-потенциал низкий, притяжение превышает отталкивание, и устойчивость дисперсии будет нарушаться. Так, коллоиды с высоким дзета-потенциалом являются электрически стабилизированными, в то время, как коллоиды с низким дзета-потенциалом склонны коагулировать или флокулировать.
Значение дзета-потенциала равное 30 мВ (положительное или отрицательное) можно рассматривать как характерное значение, для условного разделения низко-заряженных поверхностей и высоко-заряженных поверхностей. Чем больше электрокинетический потенциал, тем устойчивее коллоид.
Двойной электрический слой
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Механизм образования ДЭС
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
Строение ДЭС
В отсутствие теплового движения частиц, строение двойного электрического слоя подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
Электрической характеристикой ДЭС является потенциал φ. Существует несколько характеристических потенциалов:
Ссылки
Полезное
Смотреть что такое «Двойной электрический слой» в других словарях:
двойной электрический слой — – тонкий слой, образующийся на границе двух фаз из пространственно разделенных электрических зарядов противоположного знака, что сопровождается возникновением электрической разности потенциалов. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности. Возникает на границе раздела двух фаз. Строение слоя существенно влияет на механизм и кинетику электро химических… … Большой Энциклопедический словарь
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — совокупность электрич. зарядов противоположных знаков, распределённых вдоль границы соприкосновения двух фаз. В образовании Д. э. с. могут принимать участие эл ны, ионы и ориентированные полярные (обладающие собств. дипольным моментом) молекулы.… … Физическая энциклопедия
Двойной электрический слой — два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический… … Большая советская энциклопедия
двойной электрический слой — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, например твердого электрода и жидкости … Энциклопедический словарь
двойной электрический слой — Термин двойной электрический слой Термин на английском electrical double layer Синонимы double layer Аббревиатуры ДЭС, EDL, DL Связанные термины коллоидная химия, коллоидный раствор, наночастица Определение тонкий поверхностный слой из… … Энциклопедический словарь нанотехнологий
двойной электрический слой — dvigubasis elektrinis sluoksnis statusas T sritis chemija apibrėžtis Du priešingų krūvių sluoksniai fazių sąlyčio riboje. atitikmenys: angl. double electric layer rus. двойной электрический слой … Chemijos terminų aiškinamasis žodynas
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств. разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, Д … Химическая энциклопедия
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрич. зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, напр. тв. электрода и жидкости в… … Естествознание. Энциклопедический словарь
Двойной электрический слой (ДЭС): понятие и теории строения
Содержание:
1. Электрокинетические явления.
В начале XIX века Рейс, проводя электролиз воды, обнаружил явления электрокинетики.
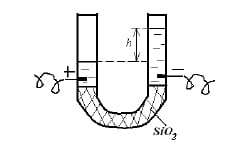
В одном из опытов Рейсс заметил, что если дно U-образной трубки наполнить кварцем, то при наложении разности потенциалов на систему совершается смещение столба воды в область «-» электрода. Явление получило название электроосмос.
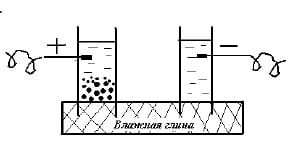
После этого Рейс сделал схему из двух стеклянных трубок, заполненных водой и опущенных концами в мокрую глину. Под действием электрического тока глина передвигалась к электроду, имеющему заряд «+», что получило название «электрофорез».
В 1879 г. Дорном был открыт потенциал седиментации. Разность потенциалов возникала, когда частички кварца свободно осаждались в столбе жидкости.
Итак, различают электрокинетические явления двух родов:
• I рода, в которых происходит взаимное перемещение фаз при воздействии электрического поля;
• II рода, в которых разность потенциалов возникает за счет перемещения двух фаз.
Присутствие одноименно заряженных частиц на поверхности дисперсной фазы и противоположно заряженных частиц на поверхности дисперсной среды и есть причина возникновения электрокинетических явлений. Совокупность же всех зарядов, сконцентрированных на границе раздела фаз, образует структуру, называемую двойным электрическим слоем (ДЭС).
2. Механизмы образования ДЭС.
Формирование ДЭС происходит в результате стремления системы уменьшить энергию Гиббса межфазного слоя. Межфазный слой – это слой, в котором происходит взаимодействие двух различных фаз, в результате соприкосновения которых свойства поверхности каждой фазы станут отличаться от их индивидуальных свойств.
Различают два типа ДЭС, в которых:
ДЭС будет играть весомую роль при:
Выделяют несколько механизмов образования ДЭС:
а) Формирование ДЭС при наступлении электрохимического равновесия, посредством прохода заряженных частиц между фазами. Основные разновидности этого механизма формирования ДЭС:
• Переход заряженных частиц на границе металл – газ. В этом варианте происходит переход электронов с поверхности металла в газовую фазу, из-за чего поверхность металла заряжается положительно, а со стороны газовой фазы образуется электронное облако. Появляется препятствие для дальнейшего перехода электронов (положительный заряд поверхности металла), в результате чего наступает равновесное состояние.
• В системе «малорастворимое соединение – жидкость» переход заряженных частиц будет происходить в результате поверхностного растворения частицы малорастворимого соединения, при чем в жидкую фазу преимущественно будет выполняться переход тех ионов, электрохимический потенциал которых выше. В данном случае равновесие будет выражаться электрохимическими потенциалами:
При установлении равновесия происходит переход ионов из фазы с большим электрохимическим потенциалом, в фазу с меньшим потенциалом. При этом возникает межфазный скачок потенциалов, который препятствует дальнейшему переходу ионов. В результате этого равновесие будет выражаться уравнением
б) ДЭС может формироваться за счет адсорбции ионов из раствора, этот механизм формирования можно разделить на несколько вариантов:
• В соответствии с правилом Фаянса – Панета ионы могут адсорбироваться на поверхности частиц, сообщая им соответствующий заряд, если эти ионы входят в состав кристаллической структуры этих частиц. Около заряженной поверхности будут концентрироваться противоположно заряженные ионы (противоионы).
• Заряд поверхности может образовываться за счет избирательной адсорбции ионов из растворов, не входящих в состав твердой фазы. В пример можно привести раствор хлорида натрия, в котором на металлах адсорбируются хлорид-ионы и придают его поверхности «-» заряд, а ионы натрия, в свою очередь, являются противоионами создавая с хлорид-ионами ДЭС
в) ДЭС может создаваться в том случае, если поверхность образована двумя фазами, молекулы которых не могут диссоциировать, но обладают дипольными моментами. Согласно правилу Кёна, из двух соприкасающихся фаз, не способных обмениваться зарядами, положительно заряжается та фаза, которая имеет большую диэлектрическую проницаемость.
3. Модели строения двойного электрического слоя.
Авторы моделей придерживались следующих положений:
Основное различие между моделями строения ДЭС заключается в постепенном усложнении представлений о структуре слоя противоионов.
3.1 Модель Гельмгольца – Перрена.
В конце XIX века Г. Гельмгольц предложил первую модель строения ДЭС, далее ее развивал Ж.Б. Перрен, но уже в 1904 г.
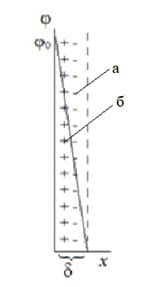
Модель Гельмгольца – Перрена основывалась на представлении ДЭС как плоского конденсатора, в котором обкладки представлялись как два ряда ионов (потенциалопределяющих ионов и противоионов) (рисунок 1). Потенциал в ДЭС линейно уменьшался с расстоянием, как в плоском конденсаторе, а плотность заряда на поверхности η0 определялась уравнением:
где:
δ – толщина ДЭС;
ε0ε – диэлектрическая проницаемость среды между обкладками конденсатора;
(ε0ε /δ)= С – емкость плоского конденсатора;
φ0 – потенциал поверхности относительно объема раствора.
Рисунок 1. Схема строения двойного электрического слоя по модели Гельмгольца – Перрена: а) слой потенциалопределяющих ионов, б) слой противоионов.
Модель Гельмгольца – Перрена подтверждена несколькими экспериментальными фактами:
У этой модели есть и ряд недостатков:
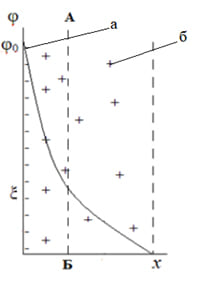
3.2 Модель Гуи – Чапмена.
В начале XX века Л. Гуи и С. Чампен (Чэпмен) предположили более сложную структуру ДЭС (рисунок 2), предположив, что слой противоионов имеет диффузное строение и обусловлен противоположно направленным действием двух факторов:
По закону Больцмана концентрация противоионовв диффузном слое изменяется, за счет установления динамического равновесия:
где:
ciX – концентрация i-иона в ДЭС на расстоянии xот поверхности;
ci0 – концентрация i-иона за пределами ДЭС;
Z – заряд иона;
F – число Фарадея (96500);
φ – потенциал на расстоянии x от поверхности;
R – универсальная газовая постоянная (8,31);
Е – абсолютная температура.
Если взять в пример плоский конденсатор (модель Гельмгольца – Перрена), то все противоионы будут располагаться около поверхности (при температуре близкой к абсолютному нулю), так как диффузность слоя будет определяться тепловым движением ионов.
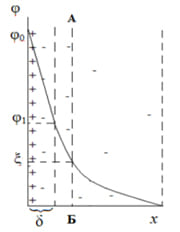
Вторая представленная модель позволила описать явления электрокинетики. При перемещении твердой и жидкой фаз относительно друг друга плоскость скольжения (АБ) лежит внутри двойного слоя, поэтому на границе скольжения φ≠0. Потенциал в плоскости скольжения соответствует той доле заряда поверхности, которая нескомпенсирована противоионами и вызывает перемещение фаз при наложении электрического поля. Часть общего скачка потенциала в двойном электрическом слое, которая приходится на границу скольжения и проявляется в электрокинетических явлениях, называется электрокинетическим, или ξ – потенциалом.
Можно описать изменение структуры ДЭС при повышении концентрации индифферентного электролита (рисунок 3). Введение индифферентного электролита повышает концентрацию противоионов в диффузном слое. Но, так как на компенсацию поверхностных зарядов потенциалопределяющих ионов необходимо то же количество противоионов, что и до введения электролита, часть противоионов окажется в избытке и это приведет к таким изменениям как:
или, с учетом уравнения Больцмана (2):
Если ДЭС считать плоским и учитывать изменение потенциала только по одной координате, х, то:
Подставив (4) в уравнение (5), получим уравнение Пуассона – Больцмана:
В основе данной модели лежит уравнение (6), так как из него можно получить уравнение, выражающее зависимость потенциала от свойств и концентрации электролита:
При двойном интегрировании уравнения (6) в пределах от 0 до х и от φ0 до φх, получаем:
С увеличением расстояния потенциал ДЭС уменьшается по кривой, это определяется уравнением (8).
Емкость ДЭС разделяют на:
Недостатки модели Гуи-Чапмена:
Все эти недостатки были учтены в теории Штерна, которая стала новым этапом в развитии представлений о двойном электрическом слое.
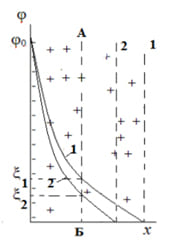
3.3 Модель Штерна.
Дальнейшее изучение строения ДЭС проводил физик О.Штерн, который ввел два условия о его структуре:
В своей схеме Штерн объединил две прошлые модели и ввел представления о плотном и диффузионном слое (рисунок 4). Часть противоионов, притягиваясь к заряженной потенциалопределяющими ионами поверхности электростатическими и адсорбционными силами, образует с потенциалопределяющими ионами плотный слой – плоский конденсатор. В плотном слое потенциал падает с расстоянием от поверхности практически по прямой, как в плоском конденсаторе. Остальные противоионы, в количестве необходимом для полной компенсации поверхностного заряда, образуют диффузный слой, в котором потенциал падает по экспоненте от φ1 до φ=0. Плоскость скольжения АБ расположена в диффузной части ДЭС.
Уравнения (3) – (6) так же применимы и для модели Штерна, но возникает еще одно условие: функция расстояния х= δ описывает распределение противоионов.
После интегрирования уравнения Пуассона – Больцмана в этом случае справедливо уравнение:
Данные уравнения не берут во внимание адсорбционные силы, а выражение (9) называется уравнением Гуи. И если расстояние отсчитывать от начала диффузионного слоя ДЭС, то уравнение (8) преобразуется в:
С ростом температуры растет энергия теплового движения, а с увеличением диэлектрической проницаемости среды усиливается диссоциация электролитов. Оба фактора увеличивают толщину ДЭС.
В отсутствии электрического поля происходит перенос ионов на поверхность под влиянием адсорбционных сил, такое явление Штерн назвал адсорбционным потенциалом иона (Фi). Это считается главным достижением данной модели.
По модели Штерна плотный слой заряжается за счет заряда ионов при адсорбции:
При учете этих факторов Штерн вывел уравнение для плотного слоя Гельмгольца:
Таким образом, модель Штерна позволяет рассчитать заряд как в плотном, так и в диффузионном слое.
Модель Штерна позволила решить ряд вопросов, ответы на которые не смогли дать предыдущие теории строения ДЭС:
Зависимость структуры двойного слоя за счет введения не- и индифферентных электролитов;
3.4 Модель Грэма.
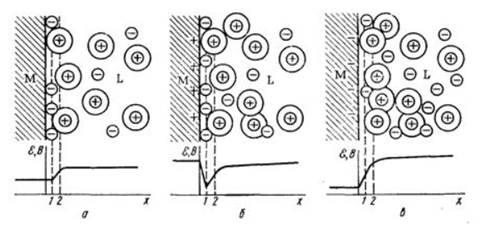
Грэм развил предыдущие модели и выделил три части в ДЭС (рисунок 5):
В первой плоскости Гельмгольца находятся только специфически адсорбирующиеся анионы, причем их поверхностная концентрация растет при переходе от незаряженной поверхности (рисунок 5, а) к заряженной положительно (рисунок 5, б). При достаточно отрицательном заряде поверхности (рисунок 5, в) во внутреннем слое Гельмгольца остается лишь растворитель, и заряд его становится равным нулю. В этих условиях ДЭС электрически равен двум последовательно включенным конденсаторам.
Грэм разработал метод расчета кривых емкости ДЭС, где dη0/dφ0 при различных концентрациях электролита, так как он посчитал, что данная ёмкость будет зависеть не от концентрации раствора.
Таким образом модель Грэма может рассматриваться как модель, отражающая основные черты и особенности структуры ДЭС «металл – электролит».
3.5 Модель Фрумкина при адсорбции органических веществ.
Модель Фрумкина была разработана в 1926 году, она была рассмотрена в целях определения формы электрокаппилярных кривых и влияния органических веществ на ДЭС.
Адсорбцию органических соединений можно рассматривать как замену в двойном слое воды на органическое вещество. Так как размеры органических молекул больше, чем молекул воды, то, как это следует из теории плоского конденсатора, удельная емкость воды будет больше емкости исходного вещества в растворе, такая замена вызывает необходимость отвода заряда с обкладок конденсатора.
В случае перехода от исходного раствора к раствору с органическим веществом возникает разность потенциала равная сдвигу потенциала на электрокаппилярной кривой. Все это происходит так как молекулы органического вещества обладают дипольным моментом.
По версии Фрумкина в данном случае двойной слой напоминает два параллельно присоединенных конденсатора (это является одним из его исходных положений). В одном из конденсаторов будет находиться вода, между обкладками, а у другого – органические вещества. Другое положение теории связано с выбором изотермы адсорбции.
В качестве еще одного исходного предположения Фрумкин допускает, что адсорбция органического вещества подчиняется уравнению Ленгмюра:
В согласии с законом распределения Больцмана, можно записать в виде:
Из основного уравнения электрокаппилярности следует, что снижение пограничного натяжения σ под влиянием адсорбции органического вещества при данном δ равно:
Из данных уравнений Фрумкин вывел уравнение новой изотермы:
а – константа аттракционного взаимодействия.
Полученное уравнение назвали изотермой Фрумкина.
3.6 Модель Алексеева–Попова–Колотыркина (АПК).
На случай смешанных растворов была разработана модель Алексеева – Попова – Колотыркина типа:
В 60-х годах ХХ века Пейн сделал открытие, которое не описывалось ни одним физическим явлением. В системах типа нитрата калия зависимость энергии от заряда носила линейный характер, но, если рассмотреть границу Hg/H2О (xM NH4NO3 + (1–x)M NH4F), то можно было увидеть, что эта зависимость приобретала параболический вид.
После 20 лет попыток решения этой проблемы был дан ответ. В смешенных растворах выделяют скачок потенциала, а не заряд электрода. Это легло в основу модели АПК.
В смешанных растворах с постоянной ионной силой типа:
При значениях m выше m≤0.2, отсутствуют экспериментальные данные для количественного определения адсорбции ионов.
При использовании модели АПК некоторые параметры находят из экспериментальных данных. При этом она очень хорошо описывает некоторые свойства ДЭС при специфической адсорбции, но только на идеально поляризуемых электродах.
4. Влияние различных факторов на структуру ДЭС.
4.1 Влияние индифферентных и неиндифферентных электролитов.
Влияние концентрации индифферентного электролита на структуру ДЭС показано в разделе 3.2. При увеличении концентрации электролита увеличивается заряд противоионов, это приводит к уменьшению ξпотенциала. Учитывая все это уравнение (9) преобразуется в:
Уравнение (17) показывает, что при неизменном заряде поверхности η0 увеличение концентрации индифферентного электролита с и заряда противоионов z приводит к снижению потенциала φ1. При этом происходит уменьшение диффузионного слоя, снижение ξ-потенциала.
Неиндифферентным электролитом называют электролит, в котором хотя бы один ион может влиять на потенциал поверхности φ0, то такой ион будет называться потенциалопределяющим. При увеличении заряда поверхности η0, то также повышается и ξ-потенциал. Появление этих двух факторов приводит к зависимости ξ-потенциала от с: при малых с главным фактором является рост адсорбции потенциалопределяющих ионов, η0 и ξ-потенциал растут, затем наступает насыщение поверхности, рост заряда прекращается и главным фактором выступает сжатие диффузного слоя за счет повышения концентрации противоионов, ξ-потенциал уменьшается.
4.2 Явление перезарядки ДЭС под влиянием многозарядных противоионов.
Явление перезарядки ДЭС возникает в плотном слое посредством того, что многозарядные анионы могут превысить заряд потенциалопределяющих ионов. Так как происходит перезарядка, то потенциалы в двух слоях ДЭС приобретают отличные друг от друга знаки. Так как происходит смена знаков потенциалов, то изменяется и ξ-потенциал. Вследствие этого явления изменяется направление движения частиц дисперсной фазы.
4.3 Влияние температуры, рН и других факторов.
Увеличение температуры приведет к нескольким факторам:
5. Заключение.
Первой теорией строения ДЭС была теория Гельмгольца – Перрена: ДЭС состоит из двух плоских зарядов и взаимодействующих между собой только за счет электростатических сил притяжения. Структура подобна плоскому конденсатору, падение потенциала между слоями происходит линейно.
Модель Гуи – Чэпмена предполагала диффузное расположение противоионов, находящихся под воздействием сил, действующих в противоположных направлениях: электростатических сил притяжения и сил теплового движения ионов, приводящих к диффузии и размыванию внешнего слоя. Теория вводит понятие диффузионного слоя, ионы рассматриваются как точечные заряды, не имеющие собственных размеров.
Грэм усовершенствовал модель Штерна и разделил ДЭС на три части: внутренний плотный слой, или же внутренняя плоскость Гельмгольца, внешний плотный слой и диффузионный слой. В этом случае ДЭС представляется в виде двух последовательно соединенных конденсаторов.
Фрумкин изучал строение ДЭС при адсорбции органических соединений. В этом случае ДЭС представлял собой два параллельно подсоединенных между собой конденсатора, в одном из них между обкладками находятся молекулы воды, в другом – молекулы органического вещества.