Что может поменять днк человека
Редактирование людей: как и зачем ученые проводят операции с геномом
Каждый из живых организмов на Земле носит в клетках наследственный материал своих предков. Эти данные называются геномами, и они нужны непосредственно для создания и поддержания деятельности организма. Генная инженерия работает над изменениями в наследственной информации. Рассказываем, что происходит с редактированием геномов прямо сейчас.
Читайте «Хайтек» в
Применение генной инженерии в научных исследованиях
Для изучения функции того или иного гена может быть применён нокаут гена. Так называется техника удаления одного или большего количества генов, что позволяет исследовать последствия подобной мутации.
Для нокаута синтезируют такой же ген или его фрагмент, измененный так, чтобы продукт гена потерял свою функцию. Основные методы реализации: цинковый палец, морфолино и TALEN.
Для получения нокаутных мышей полученную генно-инженерную конструкцию вводят в эмбриональные стволовые клетки, где конструкция подвергается соматической рекомбинации и замещает нормальный ген, а измененные клетки имплантируют в бластоцисту суррогатной матери. У плодовой мушки дрозофилы мутации инициируют в большой популяции, в которой затем ищут потомство с нужной мутацией. Сходным способом получают нокаут у растений и микроорганизмов.
Логичным дополнением нокаута является искусственная экспрессия, то есть добавление в организм гена, которого у него ранее не было. Этот способ генной инженерии также можно использовать для исследования функции генов. В сущности процесс введения дополнительных генов таков же, как и при нокауте, но существующие гены не замещаются и не повреждаются.
Используется, когда задачей является изучение локализации продукта гена. Одним из способов мечения является замещение нормального гена на слитый с репортерным элементом, например, с геном зеленого флуоресцентного белка GFP. Этот белок, флуоресцирующий в голубом свете, используется для визуализации продукта генной модификации.
Хотя такая техника удобна и полезна, её побочными следствиями может быть частичная или полная потеря функции исследуемого белка. Более изощрённым, хотя и не столь удобным методом является добавление к изучаемому белку не столь больших олигопептидов, которые могут быть обнаружены с помощью специфических антител.
В таких экспериментах задачей является изучение условий экспрессии гена. Особенности экспрессии зависят прежде всего от небольшого участка ДНК, расположенного перед кодирующей областью, который называется промотор и служит для связывания факторов транскрипции.
Этот участок вводят в организм, поставив после него вместо собственного гена репортерный, например, GFP или фермента, катализирующего легко обнаруживаемую реакцию. Кроме того, что функционирование промотора в тех или иных тканях в тот или иной момент становится хорошо заметным, такие эксперименты позволяют исследовать структуру промотора, убирая или добавляя к нему фрагменты ДНК, а также искусственно усиливать его функции.
Зачем нужна генная инженерия человека
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора.
Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента.
Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах.
Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — обыкновенная игрунка ( Callithrix jacchus).
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем. В 2016 в США группа учёных получила одобрение на клинические испытания метода лечения рака с помощью собственных иммунных клеток пациента, подвергаемых генной модификации с применением технологии CRISPR/Cas9.
В конце 2018 года в Китае родились двое детей, геном которых был искусственно изменён (выключен ген CCR5) на стадии эмбриона методом CRISPR/Cas9, в рамках исследований, проводимых с 2016 года по борьбе с ВИЧ. Один из родителей (отец) был ВИЧ-инфицированным, а дети, по заявлению, родились здоровыми.
Поскольку эксперимент был несанкционированным (до этого все подобные эксперименты на человеческом эмбрионе разрешались только на ранних стадиях развития с последующим уничтожением экспериментального материала, то есть без имплантации эмбриона в матку и рождением детей), ответственный за него учёный не предоставил доказательств своим заявлениям, которые были сделаны на международной конференции по редактированию генома.
В конце января 2019 года властями Китая были официально подтверждены факты проведения данного эксперимента. Тем временем учёному было запрещено заниматься научной деятельностью и он был арестован.
Как редактируют человеческий геном?
«Цинковые пальцы» встречаются и в составе человеческих белков. Благодаря этому методу можно сконструировать цепь ZFN так, что она будет узнавать определённый участок ДНК. Это дает возможность точечного воздействия на заданные участки в составе сложных геномов.
Домены «цинковые пальцы» встречаются в составе человеческих факторов транскрипции – белков, регулирующих процесс синтеза РНК с матрицей ДНК. При создании искусственных нуклеаз можно сконструировать цепочку из «цинковых пальцев» так, что она будет узнавать определенный участок ДНК.
Если такая цепочка будет достаточно длинной, она может распознавать относительно протяженные последовательности ДНК, состоящие из ряда тринуклеотидных фрагментов. Это означает реальную возможность точечного воздействия на заданные участки в составе больших сложных геномов.
Однако у метода «цинковых пальцев» обнаружились и серьезные недостатки: во-первых, это не вполне строгое распознавание тринуклеотидных повторов, что приводит к заметному числу расщеплений ДНК в «нецелевых» участках.
Во-вторых, метод оказался весьма трудозатратным и дорогостоящим, поскольку для каждой последовательности ДНК необходимо создать свою оптимизированную белковую структуру zinc-finger нуклеазы. Поэтому система «цинковые пальцы» широкого распространения не получила.
В 2011 году журнал Nature Methods назвал систему TALEN (Transcription Activator-like Effector Nucleases) «методом года» благодаря широкому спектру возможных применений в разных областях фундаментальной и прикладной науки.
TALEN — один из способов направленного внесения разрыва в ДНК с последующим его «залечиванием» — для выключения генов у мышей. Сразу после них эту технологию применили для внесения в мышиный геном мутации, приводящей к развитию одного из наследственных синдромов. Авторам метода моделирования генетически обусловленных болезней удалось не только «испортить» мышиный геном, но и исправить его обратно.
Метод обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
В основе этой системы — особые участки бактериальной ДНК — CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, или короткие палиндромные кластерные повторы). Разделяют эти повторы спейсеры — короткие фрагменты чужеродной ДНК. Последние встраиваются в геном после того, как ДНК рекомбинирует с её геномом.
Примеры редактирования человека
Заболевание 44-летнего жителя Аризоны Брайана Мадо проявилось еще в раннем детстве. Оно неизлечимо и наследуют его в основном мужчины. Мукополисахаридоз II типа — это метаболическое расстройство: у людей с ним есть мутация в гене, ответственном за производство фермента, который участвует в расщеплении сложных углеводов. В итоге они накапливаются в клетках и вызывают многочисленные патологии органов.
Мужчина решил принять участие в клиническом испытании нового метода — генной терапии. Это лишь первая фаза исследования, а всего до регистрации терапии (то есть до разрешения применять этот метод для всех больных с синдромом Хантера) их должно быть три.
Метод, который использовали в случае Брайана Мадо, позволяет редактировать геном прямо в теле человека — и при этом достаточно точно попадать в конкретный участок ДНК. Редактирование происходит с помощью так называемых «цинковых пальцев».
Китайский исследователь Хэ Цзянькуй отредактировал геномы человеческих эмбрионов перед процедурой искусственного оплодотворения, в результате чего на свет появились двое детей с измененной ДНК.
С помощью системы CRISPR/Cas9 исследователь отредактировал геномы эмбрионов семи пар во время репродуктивного лечения. В результате одной из беременностей от здоровой матери и ВИЧ-инфицированного отца родились две девочки-двойняшки с измененной ДНК. Хэ Цзянькуй пояснил, что удалил у детей ген CCR5, благодаря чему они получили пожизненный иммунитет к ВИЧ.
Для восстановления зрения можно использовать оптогенетические технологии, с помощью которых работой нейронов можно управлять с помощью светочувствительных белков бактерий и вспышек лазера.
Руководствуясь этой идеей, биологи создали вирус, который может проникать в ганглионарные нейроны. Эти нервные клетки отвечают за передачу сигналов из сетчатки в мозг человека. Попавший в ганглионарный нейрос вирус заставляет его производить подобные сигнальные молекулы. Однако эта процедура не возвращает зрение сама по себе, так как белки бактерий реагируют на свет не так, как палочки и колбочки сетчатки.
Чтобы решить эту проблему, профессор Базельского университета Ботонд Роска и профессор Питтсбургского университета Хосе Сахель создали специальные очки, которые преобразуют поступающие в них изображение в понятный мозгу формат и стимулируют ганглионарные клетки вспышками лазера. В результате пациент может видеть силуэты крупных предметов и объектов и совершать другие сложные действия
Человек генно-модифицированный / Homo genere mutatio
Человек генно-модифицированный / Homo genere mutatio
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
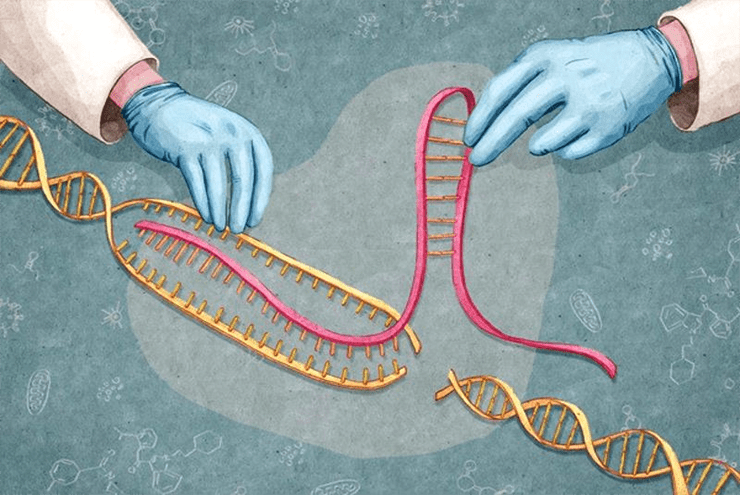
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].
Рисунок 1. Схема работы CRISPR/Cas9.
Это уже не совсем так. В начале ноября 2017 года появилось сообщение о том, что мальчику, больному буллезным эпидермолизом, заменили 80% площади кожи на трансплантаты из его собственных клеток, в которых дефектный ген, вызывающий болезнь, заменили нормальным. — Ред.
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
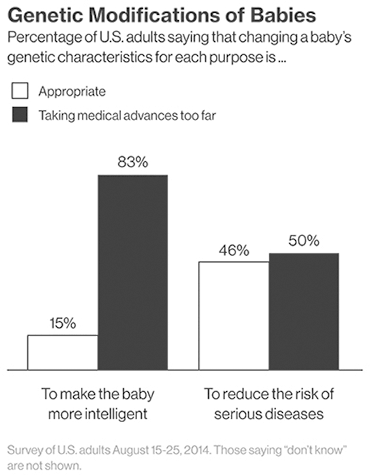
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
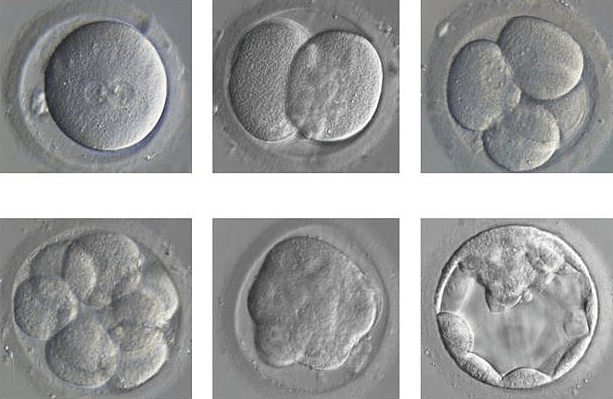
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].
Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].
Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
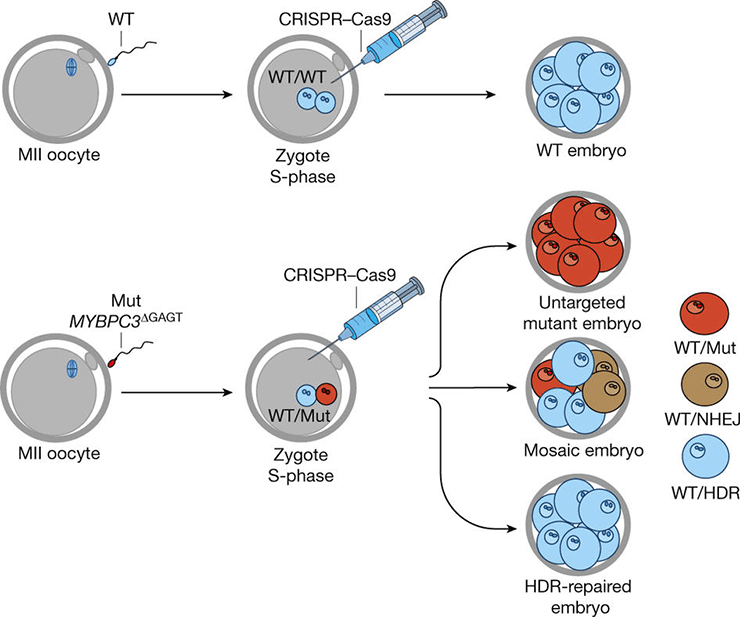
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
Рисунок 6. Руками врача буквально лечится геном.
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
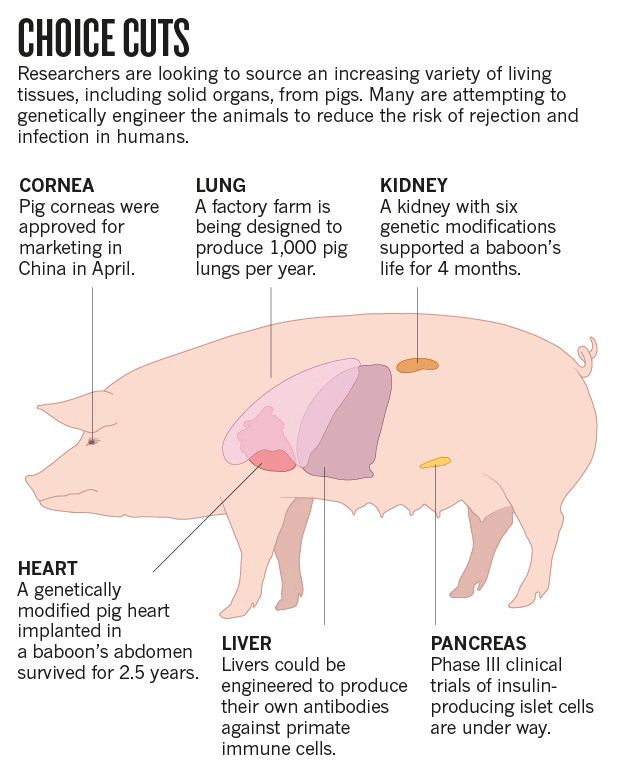
Рисунок 8. Схема возможного использования органов свиней.
Рисунок 9. ГМ-пища.
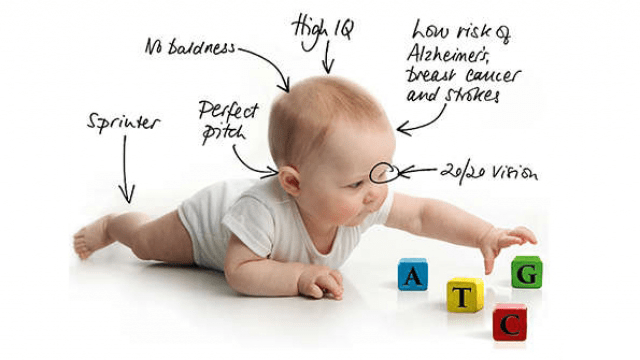
Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).
Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?
Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).
Рисунок 13. Безграничные возможности CRISPR/Cas9.