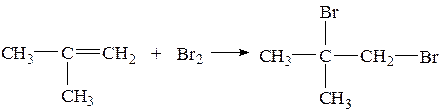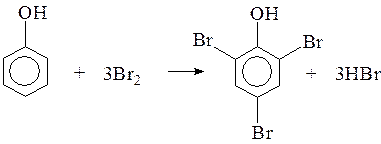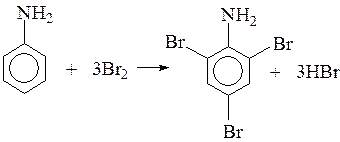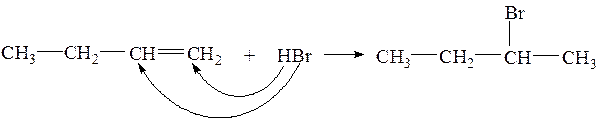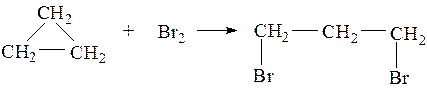Что может обесцветить бромную воду
Кто может обесцвечивать бромную воду и что это значит? (алкены, алкины, диены, фенол, анилин, стирол почему именно они)



Обесцвечивать бромную воду – это значит взаимодействие с бромом Br2 растворенным в воде при обычных условиях.
Алкены (также стирол) алкины и диены могут реагировать с бромной водой, присоединять бром с разрывом кратных связей, при этом бурая вода обесцвечивается. Также циклопропан и циклобутан может присоединять бром, при этом цикл разрывается, так как они имеют очень слабый цикл.
|
Анилин и фенол могут обесцвечивать бромную воду, вступают в реакции замещения с бромом, при этом бурая вода обесцвечивается и выпадают белые осадки.
|
|
34. Правило Зайцева и Марковникова. (хим св-ва алкенов)
Правило Марковникова: в реакциях гидрогалогенирования и гидратации водород присоединяется всегда к более гидрированному атому углерода при двойной связи(к атому углерода с большим числом атомов водорода).
|
|
Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрированного атома углерода по соседству с функциональной группой (-ОН или –Cl, к примеру)
Бромная вода: что это такое и чем опасна для человека, химическая формула брома, методы очистки, взаимодействие с другими веществами
Рассмотрим раствор, активно используемый в промышленности. В фокусе внимания – бромная вода: что это такое, состав, как выглядит, структурная химическая формула и свойства, чем опасен бром для человека – пройдемся по всем этим вопросам, чтобы вы имели полное представление.
Сразу отметим, что особенно важна и востребована оно в лабораториях, где используется для выявления алкенов, которые она идентифицирует, изменяя свой цвет. И развеем один старый миф: что ее якобы давали советским солдатам для снижения потенции. Вряд ли, потому что для этого не было поводов, она не уменьшает либидо и не оказывает отрицательного влияния на мужскую силу. Если ее и подливали в напитки, то лишь в качестве мягкого снотворного, хотя и этому нет никаких доказательств. Ну а теперь сосредоточимся на более специфических моментах.
Определение
Это раствор, состав которого можно записать по схеме:
«бром плюс вода и кислоты» (бромоводородная и бромноватистая)
В обычных условиях это желто-оранжевая по своему цвету жидкость с высокой степенью прозрачности. Является достаточно активным веществом, успешно сочетающимся как с органикой, так и с неорганическими соединениями. Довольно сильный окислитель, быстро воздействующий в щелочной среде на катионы Mn+3, Ni+3, Cr+3, Co+2, Fe+2, а также в отдельном порядке на фенолы.
Формула
Записывается максимально просто – Br2, – не только соответствуя встречающейся в природе молекуле элемента, но и отражая ее количественный и качественный состав.
Но также содержит HBr и HBrO, которые тоже заслуживают внимания, так как определяют особенности хранения. За счет наличия этих свободных кислот значительно снижает pH-уровень той технологической среды, в которую добавлена (и эта ее особенность имеет ключевое значение при фильтрации, естественно, при соблюдении должной дозировки). И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
Формула бромной воды в химии
Br2 позволяет определить молекулярную массу – из следующих уравнений:
Mr(Br2) = 2 х Ar(Br), то есть Mr(Br2) = 2 х 80 = 160
Одна из наиболее частых реакций:
Br2 + H2O ⇌ HBr + HBrO
Если развернуть это описание и осветить его более подробно, система уравнений приобретет вид:
Br2(K) + nH2O ⇌ Br2 x nH2O(P),
что, в свою очередь, можно преобразовать в:
Br2 x nH2O ⇌ HBr + HBrO + (n – 1) x H2O,
из этого вырастает:
HBrO + H2O ⇌ BrO- + H3O+
К тому, как взаимодействуют оксид брома и вода, нужно добавить, что массовая доля элемента в составе в норме не превышает 3,5%, но при наличии бромидов степень растворимости увеличится благодаря появлению следующих комплексов:
которые подвергаются постепенному разложению под воздействием света:
MBFT-75 Мембрана на 75GPD
SF-mix Clack до 0,8 м3/ч
SF-mix Runxin до 0,8 м3/ч
Последний процесс запускает бромноватистая кислота и, чтобы его предупредить, следует держать вещество в затемненной таре или хотя бы не подвергать его воздействию прямых лучей. При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
Электронная формула
Оставим на время в стороне вещества, которые взаимодействуют с бромной водой, и посмотрим на строение атома Br. При массовом числе 80 у него 4 орбиты, по которым вокруг ядра вращаются 35 электронов. Также у него есть 45 нейтронов и 35 протонов.
Распределение можно записать так:
История открытия
Сам Br был впервые описан в 1826 году Антуаном Баларом – препаратором из Монпелье. Молодой ученый получил темно-бурую жидкость из сожженных морских водорослей и назвал ее муридом (по аналогии с латинским muria, то есть «рассол»). Хотя немногим раньше, в 1825м, ассистент профессора Гмелина, студент Левиг с помощью хлора выделил элемент из кройцнахского источника. Правда, пока немец собирал достаточное количество материала для проведения исследований, француз его опередил, заявив о своем открытии.
В любом случае заседатели специально собранной комиссии (среди которых был и знаменитый Гей-Люссак) из Парижской академии наук посовещались и признали название Балара неудачным. Дело в том, что в то время семейству солей хлороводородной кислоты было дано имя муриаты. Вот ученые и посчитали, что слишком созвучные термины вызовут путаницу, и вместо этого предложили вариант Brome (с греческого переводится как «зловонный»), потому что открытие неприятно пахло. Его и ввели в употребление по всему миру, естественно, с поправкой на языковые особенности.
Приготовление бромной воды: получение, применение, цвет
Сначала – несколько слов о самом Br. При стабильно комнатной температуре он является жидким (и это единственный неметалл с таким состоянием) и обладает теми же характеристиками, что и галогены. По своей реакционной способности он находится между хлором и йодом. Визуально он тягучий и красно-коричневый, прямо как NO2, но спутать их невозможно из-за запаха, ярко выраженного и негативно воспринимаемого обонянием.
Элемент повсеместно распространен и сегодня, причем наивысшее его содержание фиксируется в соленых озерах и морях (откуда он может попадать и в пресные источники). За счет более высокой плотности бром растворяется в воде очень легко, делая ее оранжевой.
Есть два способа приготовления – рассмотрим каждый. Согласно первому методу, нужно:
При всей кажущейся простоте действия важно соблюдать предельную осторожность и работать только в защитной одежде и в вытяжном шкафу. Все потому, что при соединении двух компонентов выделяются ядовитые испарения.
Более безопасный, а значит и удобный вариант – расщепление порошка NaBr и помощью отбеливателя (с хлором, но без добавок и ароматизаторов) и HCl. Происходит следующим путем:
Чем отличается бромная вода от брома: состав
Растворяясь, рассматриваемый нами элемент запускает реакции оксидации, которые приводят к диспропорциональному выделению бромида и гипобромита – в соответствии с представленной ниже закономерностью:
Br2 + H2O → BrO- + Br- + 2H+
Это продолжается таким же неравным образованием бромата и бромида – следующим образом:
3Br2 + 6OH → BrO3- + 5 Br- + 3H2O
Поведение присутствующих кислот определяет условия хранения. Содержать данный продукт необходимо в затемненной стеклянной посуде и не вынося на свет. Если пренебречь этими правилами и поднести жидкость под прямые солнечные лучи (или в тепло), это спровоцирует выделение кислорода. Что происходит с бромной водой в этом случае? Она не только теряет свои полезные характеристики, но и начинает испускать газ HBr, пары которого ядовиты и очень неприятно пахнут.
SF-mix ручной до 0,8 м3/ч
Аэрационная установка AS-1054 VO-90
Химические свойства
Подобно галогеновым смесям является замечательным оксидантом, хотя и немного проигрывает в этом плане хлорному раствору. Эффективно окисляет марганец, железо, никель, кобальт, хром, другие металлы. Отдельной строкой идут фенолы, при добавлении которых замещенные соединения выпадут в осадок. Эта операция выполняется с небольшим вливанием H2O в роли катализатора (иначе она протекала бы несколько дней).
Важнейшей особенностью является качественная реакция взаимодействия с бромной водой: если она обесцветится при введении органического соединения, значит, в добавке есть как минимум одна двойная связь СС, и взятый в качестве образца углеводород непредельный.
В каждом из случаев происходит именно радикальная замена, поэтому обязательным условием для эффективного течения эксперимента является наличие катализаторов и/или яркий свет.
Все объясняется электрофильным сложением, и особенно четко эта закономерность видна по пропусканию через среду любого алкина или алкена, допустим, этилена. По местам разрыва начнут присоединяться атомы Br, продолжая цепи. А если в качестве примера взять муравьиную кислоту, то будет также выделяться H и CO2 (диоксид серы, бром, вода – характерная комбинация).
Физические свойства
Тягучая желто-оранжевая жидкость, возможно, с красновато-коричневым оттенком с явным и сразу узнаваемым неприятным запахом. Внимание, ее пары ядовиты, поэтому хранить ее следует не просто в темноте, а в герметично закрытой емкости.
Также необходимо избегать ее попадания на кожу. В случае непродолжительного контакта пораженное место будет достаточно сильно зудеть, а вот длительное воздействие уже грозит болезненными ожогами или даже появлением язвочек. Поэтому, если вы вдруг допустите неосторожность, как можно скорее промойте поврежденный участок, а если рана еще и глубокая, смажьте ее мазью с NaHCO3.
Применение
1. Актуальна в лабораторных условиях, при проведении анализов на наличие непредельных углеводородов и масел. Используется ключевая особенность – делается ставка на то, что раствор брома в воде обесцветится при добавлении алкинов или алкенов. Например, при взаимодействии с этиленом (эффективном и в ситуации с перманганатом калия) будут образованы двойные и тройные связи ионов Br с p-электронами и выделится дибромэтан.
2. В медицинской сфере на основе данной жидкости изготавливают широкий ряд препаратов, применять которые необходимо строго по предписанию врача. Почему? Из-за накопительного эффекта элемента, при передозировке вызывающего целый ряд неприятных последствий (их мы отдельно разберем ниже).
3. Еще одна ниша – производство антипиренов, востребованных в строительстве. Br2 входит в состав многих пропиток, которыми обрабатывают древесину, ткани и другие материалы для придания им огнеупорных свойств.
Отдельно отметим, что ракетное топливо часто подвергается процедуре окисления бромной водой, что помогает сократить его расход, а соли рассматриваемого вещества востребованы при выпуске инсектицидов и пестицидов.
Способы получения
По характеру использования оборудования их можно разделить на два вида – рассмотрим оба.
Механический – мы уже описывали его раньше, но для закрепления предоставим еще один пример с другими концентрациями. Итак, потребуется:
В числе минусов, напоминаем, ядовитые испарения. После приготовления жидкость необходимо хранить в непрозрачной и герметичной стеклянной емкости.
Электрохимический – в данном случае схема такая:
Преимущество данной технологии в том, что все ее этапы можно проводить, не находясь в непосредственной близости с веществами, а значит и не вдыхая ядовитые испарения и не рискуя получить ожог от капли, случайно попавшей на кожу. Еще один плюс – в промышленных масштабах, ведь при производстве жидкости объем не ограничен размером колбы.
Методы очистки воды от брома
Каждый из них представляет собой комплекс последовательно осуществляемых воздействий: аэрирование, удаление углекислот, фильтрование, регенерацию и воплощается в жизнь на специализированном оборудовании. Поэтому рассмотрим их тезисно.
Примеры реакций, при которых бромная вода обесцвечивается
Все они являются качественными, то есть сопровождающимися ощутимым эффектом.
Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Диспенсер магистральный настольный AquaPro 929CH/RO (охлаждение/нагрев)
Диспенсер напольный AquaPro 311 (пустой, без охлаждения)
Первый случай – с алкеном, но также можно провести и другие аналогии:
CH2=CH2 – Br2 → Br – CH2–CH2 – Br
Второй – уже с алкином:
CH≡CH + Br2 → CHBr=CHBr
Есть еще одна показательная ситуация и связана она с этиленом, который нужно пропустить через рассматриваемую жидкость; тогда получим:
CH2=CH2 + Br2 → CH2Br–CH2Br
Алкадиены отличаются только тем, что у них сразу пара двойных связей, но взаимодействие будет таким же, как в примере №1. С кратными и тройными та же история.
Особняком стоит соединение, через которое зачастую пропускают изопрен, технический карбид кальция, нитраты алюминия и хрома. Это избыток бромной воды, формула которого записывается как 3Br2, и сочетание с ним приводит к самым разным результатам, в том числе и к выпадению осадка, и к образованию производных.
Значение Br для организма человека
Данный биогенный элемент оказывает важное влияние на здоровье, так как задействован в ряде реакций и входит в состав большинства тканей (мышечной, костной, зубной), содержится в крови, щитовидке, почках, а выводится с естественными выделениями.
У него комплексная роль:
Отдельно отметим, как бромная вода реагирует с эякулятом: она повышает количество сперматозоидов. Таким образом, она не просто не снижает половое влечение – этот миф мы развенчали в самом начале обзора, – а даже способствует сохранению мужской силы и укреплению либидо.
Как сказывается недостаток Br на человеческом здоровье
У детей также может наблюдаться отставание в росте. Но обычно элемента вполне хватает – он в достаточном количестве поступает с пищей, причем даже тогда, когда питание не самое сбалансированное.
Передозировка Br
Рассуждая о том, какие вещества взаимодействуют с бромной водой, нельзя забывать, что это жидкость, которая может вызвать серьезнейшую интоксикацию – в силу следующих причин:
Кроме того, элемент может накапливаться в организме и со временем спровоцировать бромизм, то есть хроническую интоксикацию, для которой характерны:
В обоих случаях нужно идти к врачам, просто в первом – в срочном порядке, а во втором – не затягивая.
Воспользовавшись услугами компании «Вода Отечества», поставляющей высококачественное оборудование для водоочистки, вам не придется беспокоиться о здоровье ваших близких и собственном. Своевременное обнаружение и устранение причин опасного превышения веществ очень важно.
Всегда следует внимательно следить за чистотой скважины (или другого источника), регулярно проводя проверки на наличие примесей. Если в очередном заборе будет обнаружена повышенная концентрация Br, обращайтесь к нам. У нас вас проконсультируют опытные специалисты, не просто знающие, какого цвета бромная вода, какие у нее свойства и с чем она взаимодействует, но и в каждой конкретной ситуации подбирающие лучшее оборудование для эффективной фильтрации.
Почему обесцвечивается бромная вода
Бромная вода представляет собой водный раствор брома. Она способна окислять металлы, а также ряд органических соединений. При реакции с соединениями, содержащими кратные связи, она обесцвечивается. Этот процесс представляет собой качественную реакцию на непредельность органических соединений. Исчезновение окраски раствора является доказательством непредельности.
Примеры реакций обесцвечивания бромной воды
При реакции бромной воды с алкинами и алкенами, полученный раствор обесцвечивается. Алкенам свойственна ненасыщенная двойная связь, а для алкинов – тройная связь, чем определяются их свойства. В ходе взаимодействия разрываются двойные и тройные связи, присоединяется бром. В результате образуются бромистые соединения. Алканы не обесцвечивают бромную воду.
Водный раствор брома также теряет цвет при взаимодействии с непредельными маслами, которые также имеют двойные и тройные связи.
При реакции йодистого калия и водного раствора брома, выводятся молекулы свободного йода, и происходит обесцвечивание раствора.
Для того, чтобы убедиться в приведенных примерах, достаточно простого смешивания указанных веществ в лабораторных условиях. Нагревание, воздействие света, участие катализаторов при этом не требуется. Такие эксперименты проводят во время обучения в школе и учреждениях профессионального образования, а вот проводить их в домашних условиях не стоит, так как бром токсичен и обладает сильным неприятным запахом.
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 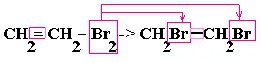 2. Изменение окраски раствора 2. Изменение окраски раствора3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 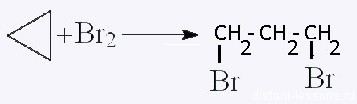 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 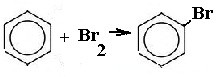
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 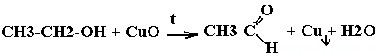 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 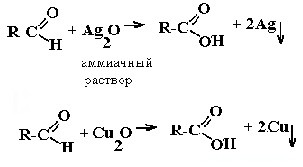 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Кто может обесцветить бромную воду
Кто может обесцвечивать бромную воду и что это значит? (алкены, алкины, диены, фенол, анилин, стирол почему именно они)


Обесцвечивать бромную воду – это значит взаимодействие с бромом Br2 растворенным в воде при обычных условиях.
Алкены (также стирол) алкины и диены могут реагировать с бромной водой, присоединять бром с разрывом кратных связей, при этом бурая вода обесцвечивается. Также циклопропан и циклобутан может присоединять бром, при этом цикл разрывается, так как они имеют очень слабый цикл.
Анилин и фенол могут обесцвечивать бромную воду, вступают в реакции замещения с бромом, при этом бурая вода обесцвечивается и выпадают белые осадки.
34. Правило Зайцева и Марковникова. (хим св-ва алкенов)
Правило Марковникова: в реакциях гидрогалогенирования и гидратации водород присоединяется всегда к более гидрированному атому углерода при двойной связи(к атому углерода с большим числом атомов водорода).
Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрированного атома углерода по соседству с функциональной группой (-ОН или –Cl, к примеру)
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды:  2. Изменение окраски раствора 2. Изменение окраски раствора |
3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH

2. Образование ацетиленидов серебра и меди:

3. Изменение окраски перманганата калия: (KMnO4 → MnO2)
C2H2 → HOOC-COOH
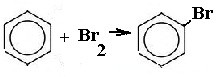
2. реакция с аммиачным раствором цианида никеля (II).Выпадает осадок комплексного соединения бензоцианоаммината никеля Ni(CN)2NH3(C6H6).
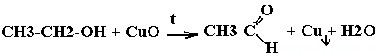

Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Обесцвечивание бромной воды является качественной реакцией на. Бромную воду обесцвечивают оба вещества в ряду
Бром и бромную воду используют в медицине, строительстве, сельском хозяйстве и многих других сферах жизни человека.
Бромная вода представляет собой жидкость жёлто-оранжевого цвета, однако она обесцвечивается в ходе некоторых реакций. Почему так происходит? И какие вещества способны влиять на изменение её цвета?
Бромная вода представляет собой водный раствор брома. Она способна окислять металлы, а также ряд органических соединений. При реакции с соединениями, содержащими кратные связи, она обесцвечивается. Этот процесс представляет собой качественную реакцию на непредельность органических соединений. Исчезновение окраски раствора является доказательством непредельности.
Примеры реакций обесцвечивания бромной воды
При реакции бромной воды с алкинами и алкенами, полученный раствор обесцвечивается. Алкенам свойственна ненасыщенная двойная связь, а для алкинов – тройная связь, чем определяются их свойства. В ходе взаимодействия разрываются двойные и тройные связи, присоединяется бром. В результате образуются бромистые соединения. Алканы не обесцвечивают бромную воду.
Водный раствор брома также теряет цвет при взаимодействии с непредельными маслами, которые также имеют двойные и тройные связи.
При реакции йодистого калия и водного раствора брома, выводятся молекулы свободного йода, и происходит обесцвечивание раствора.
Для того, чтобы убедиться в приведенных примерах, достаточно простого смешивания указанных веществ в лабораторных условиях. Нагревание, воздействие света, участие катализаторов при этом не требуется. Такие эксперименты проводят во время обучения в школе и учреждениях профессионального образования, а вот проводить их в домашних условиях не стоит, так как бром токсичен и обладает сильным неприятным запахом.
Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp — гибридизации.
Взаимодействие ацетилена с бромной водой
Молекула ацетилена содержит тройную связь, бром разрушает её и присоединяется к ацетилену. Образуется терабромэтан. Бром расходуется на образование тетрабромэтана. Бромная вода (жёлтая) — обесцвечивается.
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br 2 → CHBr = CHBr + Br 2 → CHBr 2 — CHBr 2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Реакция ацетилена с раствором перманганата калия
В растворе перманганата калия происходит окисление ацетилена, при этом происходит разрыв молекулы по месту тройной связи, раствор быстро обесцвечивается.
3НC ≡ СН + 10KMnO 4 + 2H 2 O → 6CO 2 + 10КОН + 10MnO 2
Эта реакция является качественной реакцией на двойную и тройную связь.
Реакция ацетилена с аммиачным раствором оксида серебра
Если ацетилен пропустить через аммиачный раствор оксида серебра, атомы водорода в молекуле ацетилена легко заместятся металлами, так как обладают большой подвижностью. В данном опыте атомы водорода замещаются атомами серебра. Образуется ацетиленид серебра — осадок жёлтого цвета (взрывоопасен).
CH ≡ СН + OH → AgC≡CAg↓ + NH 3 + H 2 O
Эта реакция является качественной реакцией на тройную связь.
3.Укажите соединение, содержащее карбоксильную группу:
1) ароматический спирт
4.Укажите соединение, содержащее карбонильную группу:
1) ароматический спирт
4) непредельная многоосновная кислота
5.Дайте название соединению: О
6. Реакция СН3СНО+Ag2O СН3СООН+2 Ag:
3) «серебряного зеркала»
7. Функциональная группа карбоновых кислот называется:
8. Уксусная кислота не реагирует со следующим металлом:
9. Как называется альдегид:
1) 2-Метил-3-пропилбутаналь;
2) 2,3-диметилгексаналь;
3) 4,5-диметилгексаналь;
4) 2-метил-2-пропилбутаналь
10. Укажите общую формулу углеводов:
11. Укажите углевод, являющийся основной частью древесины:
12. Укажите формулу фруктозы:
13.Пентоза, входящая в состав ДНК – это:
14. Молочный сахар – это дисахарид:
15. Свекловичный или тростниковый сахар – это дисахарид:
16. Солодовый сахар:
17. В клетках растений крахмал выполняет функцию:
1) Передачи наследственной информации
2) Запаса питательных веществ
3) Строительную и структурную
4) Катализатора биологических процессы
18. В клетках растений целлюлоза выполняет функцию:
1) Запаса питательных веществ
2) Катализатора биологических процессов
3) Строительную и структурную
4) Передачи наследственной информации
19. Дайте название соединению:
1) 3-метилбутанол-2 3) 3-метилпропанон-2
2) 2-метилбутанол-3 4) 2 –метилпропаналь-2
20. Допишите уравнение химической реакции и дайте ей название:
1) гидратация 3) присоединения
2) реакция этерификации 4) замещения
Среди нижеперечисленных характеристик выберите те, которые, как правило, относятся к жидким жирам — маслам:
1) Имеют растительное происхождение
2) Имеют животное происхождение
3) Хорошо растворимы в воде
4) Хорошо растворимы в органических растворителях
7) Обесцвечивают бромную воду
8) Являются эфирами глицерина
Ответ дайте в виде последовательности цифр в порядке их возрастания.
В-2 Установите соответствие между характеристикой жира и примером жира, соответствующего этой характеристике. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
А) твердый жир растительного происхождения
Б) твердый жир животного происхождения
В)Жидкий жир животного происхождения
Г)Жидкий жир растительного происхождения
2) При растворении в воде 1 моль уксусного ангидрида образуется:
в) 2 моль уксусной кислоты
г) 1 моль метилацетата
3) С какими веществами реагирует ацетат натрия:
а) Солярная кислота
б) Гидроксид натрия при нагреве
в) Угольная кислота
4) При взаимодействии этанола и оксида углерода (II) соответствующих условиях получается?
в) пропановая кислота
5) В реакции какого типа могут вступать непредельные карбоновые кислоты: а) Окисление
6) С какими веществами реагирует муравьиная кислота:
в) Гидрокарбонат калия
г) аммиачный раствор оксида серебра I
7) В отличие от стеариновой кислоты олеиновая кислота:
а) Жидкая при комнатной температуре
б) растворима в воде
в) Обесцвечивает бромную воду
г) Реагирует с щелочами
8) Какие вещества реагируют с водой:
а) линолевая кислота
9) С помощью какого одного реактива можно различить растворы глицерина, пропаналя, и этановой кислоты:
в) гидроксид меди II
10) В реакциях с какими веществами с участием уксусной кислоты от ее молекулы отщепляется гидросильная группа: