Бурый жир у новорожденных для чего
Что такое бурый жир и как он помогает новорожденным: объяснение врача-педиатра
Бурый жир составляет примерно 5% от массы тела новорожденного и находится в районе шеи, почек, вдоль верхней части спины, на плечах. Что такое бурый жир и какую функцию он выполняет в организме, рассказывает педиатр.
Адаптироваться к холодному позадиматочного среды ребенку после рождения – не простая задача, сообщает семейная врач и педиатр и сертифицирована консультантка по грудному вскармливанию Анна Серова. Кроме того, у новорожденных отсутствует развитая костно-мышечная масса, чтобы поддерживать температуру тела путем дрожание (дрожащего термогенеза), который является важным источником тепла у взрослых, подвергшихся воздействию холода.
Здесь на помощь приходит бурый жир.
Что такое бурый жир
Название этот тип жира получил из-за своего специфического вида. Своим цветом он обязан большим количеством кровеносных сосудов. Накапливается такой жир в шее, подмышечных впадинах, спине, средостении, животе и бедрах новорожденного. Кстати, именно он составляет примерно 5% массы тела младенца. Однако с возрастом его количество существенно уменьшается.
Как работает бурый жир
Такой вид жировой ткани помогает ребенку поддерживать температуру тела, особенно в холодное время года. Дело в том, что отдельные клетки заполнены митохондриями – органеллами внутри клеток, которые производят тепло (возвращаясь к школьной биологии: митохондрии являются «электростанцией» клетки и производят энергию с помощью синтеза АТФ).
Когда младенец подвергается воздействию низких температур, именно эти клетки активируют свои митохондрии и начинают выделять тепло. Это производство тепла помогает согреть детей даже при очень низких температурах.
Анатомо-физиологические особенности кожи у детей
Кожа ребенка, как и взрослого человека, состоит из эпидермы, дермы (собственно кожи) и гиподермы (подкожной клетчатки). Однако по своим морфологическим и функциональным особенностям она отличается значительным своеобразием, особенно у детей раннего возраста.
Хороший детский дерматолог Москва — поликлиника «Маркушка».
Эпидермис имеет очень тонкий роговой слой, состоящий из 2-3 рядов слабо связанных между собой и слущивающихся клеток, и активно разрастающийся основной слой. Основная перепонка, разделяющая эпидермис и дерму, у детей раннего возраста недоразвита, рыхла, вследствие чего при патологии эпидермис может отделяться от дермы пластами (десквамативная эритродермия). Для детской кожи особенно характерно хорошее кровенаполнение, связанное с густой сетью широких капилляров, что придает кожным покровам вначале ярко-розовый, затем нежно-розовый цвет.
Дерма состоит из сосочкового и ретикулярного слоев, в которых слабо развиты эластические, соединительнотканные и мышечные элементы.
Сальные, потовые железы у ребенка, волосы на голове новорожденных детей
Сальные железы у ребенка хорошо функционируют уже внутриутробно, образуя творожистую смазку, покрывающую его тело при рождении. У новорожденных и детей 1-го года жизни на коже лица заметны желтовато-белые точки — избыточное скопление секрета в кожных сальных железах. У детей, предрасположенных к экссудативному диатезу, на щеках образуется тонкая, так называемая молочная корка, а на волосистой части головы — гнейс (жирная себорея).
Потовые железы у новорожденных сформированы, но в течение первых 3-4 мес. жизни обнаруживается их некоторая функциональная недостаточность, что связано с несовершенством центра терморегуляции.
Волосы на голове новорожденных детей вполне развиты, но не имеют сердцевины, сменяются несколько раз на 1-м году жизни. Кожа на спине и плечах покрыта пушком, более выраженным у недоношенных. Брови и ресницы выражены слабо, рост их усиливается на 1-м году, а к 3-5 годам жизни они становятся, как у взрослых людей. Ногти обычно хорошо развиты и доходят до кончиков пальцев у доношенных новорожденных.
Подкожная жировая клетчатка у ребенка, детей
Подкожная жировая клетчатка начинает формироваться на 5-м месяце внутриутробной жизни, но интенсивно откладывается в течение последних 1,5-2 мес. внутриутробной жизни. У доношенного новорожденного подкожная жировая клетчатка хорошо выражена на щеках, бедрах, голенях, предплечьях и слабо — на животе, а в течение первых 6 мес. жизни она интенсивно развивается на лице, конечностях, туловище. Позже, до 8-летнего возраста, происходят колебания в формировании жирового слоя, а затем снова начинается нарастание его, более выраженное у девочек. У детей раннего возраста подкожная жировая клетчатка составляет около 12 % массы тела, у взрослых этот показатель более 8 %.
Особенностью детей раннего возраста является наличие у них скоплений бурой жировой ткани в задней шейной области, супраилеоцекальной зоне, вокруг почек, в межлопаточном пространстве, вокруг магистральных сосудов. У доношенного новорожденного ее количество составляет около 1—3 % всей массы тела. Она обеспечивает более высокий уровень теплопродукции за счет так называемого несократительного термогенеза (не связанного с мышечным сокращением).
Малым количеством жировой клетчатки объясняется большая смещаемость внутренних органов у детей до 5-летнего возраста, так как только к этому возрасту увеличивается количество жира в грудной, брюшной полостях, в забрюшинном пространстве. Жировые клетки у детей раннего возраста мельче и содержат ядра, с возрастом они увеличиваются в размере, а ядра, наоборот, уменьшаются. Округлость форм тела у девочек обусловлена тем, что более 70 % жировой ткани приходится на подкожный жир, в то время как у мальчиков — лишь около 50 %.
Функции кожи у ребенка, детей: защитная, дыхательная, резорбционная
Функции кожи многообразны, но главная из них — защитная. У детей эта функция выражена слабо, о чем свидетельствуют легкая ранимость кожи, частая инфицируемость из-за недостаточной кератинизации рогового слоя и его тонкости, незрелости местного иммунитета (детский иммунолог — поликлиника «Маркушка») и обильного кровоснабжения. Эти особенности делают детскую кожу легкоранимой и склонной к воспалениям, в частности при плохом уходе (мокрые, грязные пеленки).
Дыхательная функция кожи у детей раннего возраста имеет большее значение, чем у взрослых. Кожа активно участвует в образовании ферментов, витаминов, биологически активных веществ. Тесно связаны между собой выделительная и терморегулирующая функции, которые становятся возможными лишь к 3—4 мес. при созревании нервных центров. До этого возраста плохая регуляция температуры тела связана с большой относительной поверхностью тела, хорошо развитой сетью сосудов, из-за чего новорожденный ребенок, особенно недоношенный, может легко перегреваться или переохлаждаться при недостаточном уходе.
Резорбционная функция кожи у детей раннего возраста повышена (тонкость рогового слоя, богатое кровоснабжение), в связи с чем следует осторожно применять лекарственные средства в мазях, кремах, пастах, так как накопление их может вызвать неблагоприятный эффект. Кожа является органом с многочисленными и разнообразными рецепторами, обеспечивающими осязательную, температурную, поверхностную болевую чувствительность.
Отеки кожи ребенка, детей
При осмотре кожи ребенка, детей обращается внимание на наличие отеков и их распространенность (на лице, веках, конечностях, общий отек или местный, истинный или слизистый).
Причины генерализованных отеков многообразны. К факторам, влияющим на развитие отеков, относятся: повышение гидростатического давления в сосудистом русле, что способствует усиленному пропотеванию жидкости через сосудистую стенку в межклеточное пространство (сердечная недостаточность — консультации детского кардиолога, портальная гипертензия, слипчивый перикардит, тромбофлебит и др.); снижение онкотического давления, обусловленное уменьшением содержания белка в сыворотке крови (нефротический синдром; общие отеки часто возникают при острых и хронических почечных заболеваниях, при сердечной недостаточности).
Развитию общего отека в случае сердечной недостаточности у детей предшествуют отечность нижних конечностей и увеличение печени. По мере развития декомпенсации отеки становятся более распространенными, сочетаются с накоплением жидкости в серозных полостях (плевральной, перикардиальной, брюшной). В отличие от отеков сердечного происхождения отеки при заболеваниях почек сначала возникают на лице, а затем захватывают все новые и новые участки кожи. Особенно массивные отеки наблюдаются при нефротической форме гломерулонефрита. Общие отеки алиментарного происхождения появляются при недостаточности в рационе белковой пищи (преимущественное питание мучной, углеводистой пищей), при общей дистрофии.
Алиментарные отеки могут появляться при тяжелых хронических заболеваниях (циррозе печени), при расстройствах процессов расщепления и всасывания в кишечнике (целиакии, дисахаридазной недостаточности и др.). Безбелковые отеки зависят от гидростатического давления, то есть более выражены в соответствующих частях тела, например, односторонний легочный отек у лежачих больных при вынужденном или предпочтительном положении.
Своеобразный отек кожи и подкожной жировой клетчатки наблюдается при гипотиреозе. Кожа при этом становится сухой и утолщенной, в надключичных ямках в виде «подушечек» располагаются муцинозные (слизистые) отеки. Стероидные отеки возникают при лечении кортикостероидами и АКТГ в высоких дозах, при синдроме Кушинга.
Распространенные отеки наблюдаются при отечной форме гемолитической болезни новорожденных.
Местные отеки, иногда массивные, наблюдаются после укусов насекомых, змей, особенно в тех случаях, когда ребенок имеет аллергическую настроенность (консультация детский аллерголог поликлиника «Маркушка»). Они возникают также вследствие ангионевротических расстройств, типичным проявлением которых является отек Квинке, локализующийся в любом месте: на губах, веках, ушных раковинах, языке, наружных половых органах и т.д. Реже отек Квинке локализуется в области голосовых связок, что приводит к синдрому острого стеноза гортани.
Изолированные отеки в области лица у детей бывают после приступов кашля при коклюше, после интенсивного растирания глаз. Известно, что локальная инфекция в области придаточных пазух носа, зубов, миндалин может вызвать затруднение оттока и застой лимфы в лимфатических узлах угла нижней челюсти и симулировать односторонний или двусторонний отек лица, который исчезает по мере стихания воспалительного процесса.
К редким причинам отека лица относятся начинающийся дерматомиозит, склеродермия и тромбоз кавернозного синуса. Наиболее часто в детской практике встречаются сердечные и почечные отеки.
Бурый жир у новорожденных для чего
Наиболее выраженные изменения метаболизма липидов происходят при рождении. Эти изменения касаются скорости поступления в организм жирных кислот, их роли как источников энергии и значения для накопления жировой ткани. Плод получает жирные кислоты от матери путем переноса их через плаценту.
В случае преждевременных родов этот путь передачи прерывается. После рождения ребенка способность усваивать энергетические субстраты и нутриенты зависит от степени зрелости и функциональных возможностей ЖКТ. У недоношенных детей, которые способны усваивать энтеральное питание, всасывание жирных кислот происходит через стенку кишечника после переваривания жира, находящегося в составе грудного молока или молочной смеси. К детям, находящимся на парентеральном питании, жирные кислоты поступают в форме внутривенных липидов.
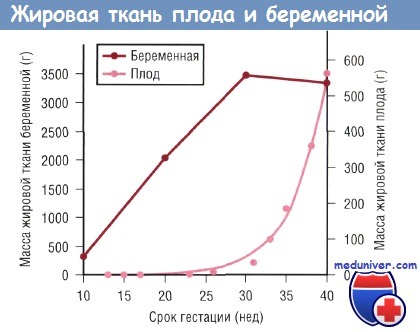
В процессе развития плода основным источником энергии является глюкоза, меньшее значение имеют лактат и излишек аминокислот. Жирные кислоты играют минимальную роль в энергетическом обеспечении плода, но после рождения ребенка они становятся основными источниками энергии. Накопление жировой ткани у плода происходит преимущественно в конце III триместра. Следовательно, преждевременно рожденные младенцы имеют ограниченный запас жировой ткани при рождении.
После рождения жирные кислоты, находящиеся в жировых депо, расходуются в качестве источников энергии и структурных компонентов новых клеточных мембран. Недоношенные дети, у которых при рождении запасы жировой ткани недостаточны, в большей степени по сравнению с доношенными младенцами зависят от поступления липидов с пищей или с парентеральным питанием для удовлетворения потребности в жирных кислотах. В перинатальном периоде ребенку необходимо большое количество жирных кислот для обеспечения высокой скорости роста, что особенно актуально для головного мозга.
При формировании мембран в нервной ткани нужно большое количество жирных кислот для образования фосфолипидов. Кроме того, необходимы стеролы и сложные липиды. Серое вещество головного мозга содержит в большом количестве как 22:6 n-3, так и 20:4 n-6. Палочки и колбочки сетчатки также содержат много 22:6 n-3. Около 50% всех жирных кислот в наружном сегменте палочек составляют жирные кислоты 22:6 n-3. Поскольку в организме млекопитающих образование омега-6 и омега-3 ПНЖК невозможно, они должны поступать с пищей или отдельно в виде DHA и ARA либо «родительских» жирных кислот — ALA и LA соответственно.
Многие смеси, предназначенные для вскармливания детей, содержат добавки ARA и DHA. Кроме того, стало возможным дополнительное обогащение DHA специализированных продуктов питания для беременных и кормящих женщин.
За последние два десятилетия наибольший интерес в исследованиях потребности в липидах вызывает роль омега-6 и омега-3 ДЦПНЖК в развитии зрительного анализатора и когнитивной функции ребенка. Особое внимание уделяется жирным кислотам 22:6 n-3 и 20:4 n-6. Они обнаружены в грудном молоке, причем уровни DHA колеблются от 0,1 до 1% общего количества жирных кислот. Уровни ARA менее вариабельны и составляют обычно 0,3—0,7% общего количества.
Переход от внутриутробного к внеутробному периоду жизни подразумевает смену глюкозы как основного энергетического источника на жиры, которые, поступая с грудным молоком или молочной смесью, обеспечивают около 50% необходимого ребенку суточного количества калорий. Плод получает липиды и другие питательные вещества трансплацентарно, в то время как новорожденный зависит от функции ЖКТ, где пища (грудное молоко или смесь) переваривается и всасывается. После рождения изменяется и процесс передачи омега-6 и омега-3 жирных кислот ребенку. До родов отмечается более активный перенос 20:4 n—6 и 22:6 n—3 по сравнению с переносом их 18-карбоновых предшественников — 18:2 n—6 и 18:3 n—3 соответственно. После рождения ребенок получает из грудного молока или искусственных смесей большее количество 18-карбоновых омега-6 и омега-3 жирных кислот по сравнению с ARA и DHA соответственно. Жировая ткань формируется в основном в последние 10 нед гестации и после рождения, особенно в ранний постнатальный период; она помогает в обеспечении ребенка не только энергией, но и омега-6 и омега-3 ДЦПНЖК, необходимыми для нормального развития ЦНС. Недоношенные дети имеют ограниченные запасы жировой ткани, а их органы могут быть функционально незрелыми. Адаптация к постнатальной жизни в большей степени зависит от функциональной зрелости ЖКТ в плане расщепления и всасывания липидов.
Кишечник ребенка может повреждаться при различных патологических состояниях, что приводит к нарушению усвоения пищи и возникновению ЯНЭК. Чем меньше срок гестации и масса тела при рождении, тем больше риск возникновения различных заболеваний. Клиническими показателями здоровья (или отсутствия заболевания) служат нутритивный статус (антропометрические и физиологические параметры) и функциональные возможности ребенка, связанные с физическим ростом и неврологическим развитием. Клиническая оценка питания заключается в оценке общего состояния ребенка, его толерантности к пищевой нагрузке, а также в наличии симптомов недостаточного или избыточного питания. Сниженные запасы жировой ткани и питательных веществ, связанные с недоношенностью или задержкой внутриутробного развития, необходимость в парентеральном питании, эпизоды ограниченного поступления в организм энергии и высокая потребность в питательных веществах могут влиять на рост и развитие ребенка.
Способ энтерального кормления для каждого конкретного ребенка выбирают с учетом срока гестации, массы тела при рождении и клинического состояния. Прежде чем начать энтеральное кормление, необходимо убедиться в отсутствии структурных аномалий, а также учесть состояние ЖКТ и респираторной системы. Для создания алгоритма энтерального кормления недоношенного ребенка необходимо ответить на следующие вопросы: когда начинать кормление, чем кормить ребенка (грудным молоком или смесью), каким способом, а также определить частоту приемов пищи и скорость увеличения объема питания. Некоторые дети до начала энтерального кормления получают парентеральное питание. Другими словами, выбор режима питания ребенка основывается на многих факторах, что обусловливает разнообразие индивидуальных подходов в отношении недоношенных детей и детей с задержкой внутриутробного развития.
Недоношенные дети с незрелым ЖКТ и ограниченными запасами жировой ткани составляют группу риска по постнатальной задержке физического развития. Плохая переносимость энтерального питания может привести к уменьшению поступающей к ребенку энергии, развитию дефицита питательных веществ, мальабсорбции жиров и клиническим симптомам дефицита незаменимых жирных кислот. Плохая переносимость питания может быть следствием незрелости ЖКТ и пищеварительных ферментов, получения ребенком питательной смеси с повышенной осмолярностью, слишком быстрого увеличения объема питания, а также следствием таких патологических состояний, как ЯНЭК или сепсис. К симптомам непереносимости пищи относят учащение периодов апноэ и брадикардии, связанных с питанием, увеличение остаточного объема содержимого желудка, вздутие живота, рвоту, обильные срыгивания, наличие в стуле крови или непереваренной пищи. Плохой сосательный рефлекс или неспособность координировать одновременно сосание и глотание также ограничивают возможность ребенка получать адекватное количество энергии и питательных веществ. Как было показано, первичное питание (питание небольшими объемами грудного молока или искусственной смесью) в первые несколько дней может стимулировать активность ЖКТ и улучшить толерантность к энтеральному кормлению. Для оптимального роста и развития очень важна возможность обеспечивать адекватное питание, одним из компонентов которого являются пищевые жиры.
Мальабсорбция жиров может привести к дефициту незаменимых жирных кислот, жирорастворимых витаминов (A, D, Е, К). Наиболее часто у недоношенных детей отмечают дефицит кальция, фосфора, витаминов D и Е, железа, цинка, карнитина, незаменимых жирных кислот и белка. Заподозрить мальабсорбцию жиров можно по изменению характера стула, который становится обильным, жирным, приобретает зловонный запах. В случае недостаточной функции поджелудочной железы или дефицита желчных кислот стул может стать белым, серым или цвета глины. Клинические симптомы дефицита незаменимых жирных кислот включают чешуйчатый дерматит, тромбоцитопению, повышенный риск возникновения инфекций, недостаточный рост и алопецию.
В течение неонатального периода, особенно у недоношенных детей или детей с задержкой внутриутробного развития, может отмечаться несовершенство терморегуляции. Новорожденные адаптируются к холодовому стрессу, вырабатывая тепло за счет калорий, необходимых для роста. Сокращение во время холодового стресса запасов бурой жировой ткани обеспечивает организм энергией за счет недрожательного термогенеза. Тепло также образуется, когда ребенок плачет и двигается. Метаболизм бурой жировой ткани, обеспечивающий производство тепла, характерен только для новорожденных. Дети с малой массой тела или менее зрелые к моменту рождения имеют неадекватные запасы жира, большую площадь поверхности по отношению к массе тела и большее содержание воды в организме. Это способствует большим потерям жидкости и, соответственно, тепла. Среди недоношенных детей нарушение температурного контроля встречается чаще, чем у доношенных.
Преждевременные роды обрывают передачу омега-3 и омега-6 жирных кислот от матери плоду. После рождения дети получают эти жирные кислоты из грудного молока или искусственных смесей, обогащенных ARA и DHA либо их 18-карбоновыми предшественниками — LA и ALA соответственно. Накопление 20:4 n—6 и 22:6 n—3 в головном мозге и 22:6 n—3 в сетчатке глаза начинается в середине гестации и продолжается после рождения ребенка. Было показано улучшение зрительных функций и неврологического развития в случае получения недоношенным ребенком после выписки на протяжении первого года жизни смесей, обогащенных ARA и DHA. Не являясь клинически значимыми в период нахождения недоношенного ребенка в ОИТН, эти жирные кислоты, однако, имеют значение для долгосрочного прогноза. Заставляют задуматься недавние сообщения о низких концентрациях как ARA, так и DHA у младенцев, родившихся от женщин с сахарным диабетом типов I и II, а также гестационным сахарным диабетом. Это особенно важно, учитывая количество женщин молодого возраста, находящихся в группе риска по гестационному сахарному диабету или сахарному диабету типа II.
Все больше доказательств важной роли омега-6 и омега-3 ДЦПНЖК в становлении иммунной системы человека. Однако в настоящее время многие вопросы пока остаются без ответов. Один из них — вопрос об оптимальном соотношении специфических омега-6 и омега-3 ДЦПНЖК, что может быть важным для ускорения созревания адаптивного и гуморального иммунных ответов. Недоношенные дети составляют группу повышенного риска возникновения сепсиса. Это означает, что улучшение иммунного созревания в перинатальный период может иметь очевидную клиническую пользу. Аллергические заболевания и астма могут быть обусловлены как генетическими предпосылками, так и какими-либо внешними факторами, что делает возможным иммунное программирование во время беременности и раннего младенческого возраста.
Суммируя сказанное, можно сделать вывод о значимом различии между физиологией и метаболизмом липидов у плодов и недоношенных детей. Жиры пищи являются важнейшими источниками энергии после рождения. Существенными для развития ЦНС и, возможно, иммунной системы являются омега-6 и омега-3 ДЦПНЖК, которые ребенок получает постнатально в виде ARA и DHA или которые образуются in situ из незаменимых жирных кислот пищи LA и ALA. Преждевременно родившиеся дети зависят от функциональной зрелости ЖКТ, т.к. она определяет способность ребенка получать адекватное количество энергии для роста и необходимое количество омега-6 и омега-3 жирных кислот для развития ЦНС. За последние несколько лет произошли значительные сдвиги в понимании физиологии фетального и постнатального периодов, вопросов питания и лечения недоношенных детей, что мы представили в следующих статьях на нашем сайте МедУнивер. Тем не менее остается еще много нерешенных вопросов. Дальнейшие исследования могут помочь улучшить качество нутритивной поддержки недоношенных младенцев.
Мышцы выделяют гормон, превращающий белый жир в бурый
Рис. 1. Распределение бурого жира у новорожденных. Изображение с сайта www.thehealthblog.net
Международная команда ученых из США, Дании и Италии установила, что при физической нагрузке скелетные мышцы выделяют ранее не известный гормон, названный иризином. Иризин действует на клетки белой жировой ткани, в которых у млекопитающих запасается жир. Воздействие гормона превращает их в клетки бурой жировой ткани, отвечающие за производство тепла. При введении в кровь иризин повышал расход энергии у мышей даже без изменения их подвижности и диеты. Это вызывало снижение массы тела и содержания сахара в крови у мышей, страдающих ожирением. Возможно, иризин найдет применение как лекарство для людей, страдающих ожирением и диабетом.
В наши дни ожирение и избыточный вес — одна из серьезных медицинских проблем. Распространяется ожирение со скоростью эпидемии, а по некоторым данным, действительно может быть заразным (см, например, Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity, Nature, 2012). Это один из главных факторов риска развития сердечно-сосудистых болезней и диабета второго типа. Вот почему на борьбу с ожирением направлены силы науки и здравоохранения.
Давно было известно, что при физической нагрузке затраты энергии возрастают непропорционально сильно: энергии тратится больше, чем требуется для выполнения упражнений или работы. Известно было также, что при нагрузке в скелетных мышцах повышается содержание белка — фактора транскрипции PGC1-α.
Исходно было установлено, что вместе с другим белком он усиливает производство белка термогенина, или UCP 1, в бурой жировой ткани («буром жире»). Бурый цвет ей придает большое количество митохондрий. Эта замечательная ткань не запасает энергию, а тратит ее. Происходит это потому, что при окислении органики митохондрии этой ткани не синтезируют АТФ, а переводят всю энергию в тепло. За это как раз и отвечает термогенин — он образует во внутренней мембране митохондрий поры, пропускающие протоны, что препятствует синтезу АТФ.
Бурый жир хорошо развит у новорожденных (рис. 1): относительная поверхность тела у них большая, дрожать они умеют плохо, а бурый жир помогает им греться. У взрослых людей почти весь бурый жир заменяется обычным, белым жиром (лишь небольшие участки бурого жира сохраняются в верхней части груди и на шее).
Однако в подкожном белом жире тоже могут развиваться клетки бурого жира (рис. 2). По своему строению и работе они не отличаются от «настоящих» бурых жировых клеток. Кроме того, зрелые клетки белой жировой ткани («белые» адипоциты) могут превращаться в клетки бурого жира («бурые» адипоциты).

Рис. 2. Клетки в белой (слева) и бурой (справа) жировой ткани развиваются из разных предшественников и под влиянием разных генов. Из статьи: Denis Richard, Frederic Picard. Brown fat biology and thermogenesis // Frontiers in Bioscience. 2011. V. 16. P. 1233-1260
В то же время, было известно, что, когда при физической нагрузке в мышцах возрастает количество белка PGC1, это благоприятно воздействует не только на сами мышцы, но и на весь организм. У трансгенных мышей с повышенным уровнем PGC1 под старость не развивается ожирение и диабет, и живут они дольше обычных.
Международная группа ученых из шести научных учреждений США, Дании и Италии решила выяснить, как повышение количества PGC1 в мышцах влияет на другие ткани. В результате удалось открыть важный механизм, который может помочь бороться с ожирением.
Сначала было установлено, что после 3 недель бегания в колесе или плавания у тех же трансгенных мышей (с повышенным уровнем PGC1) резко (в 25–65 раз) возрастает количество термогенина в подкожном белом жире, и там увеличивается число «бурых» адипоцитов. Чтобы показать прямое воздействие мышечных клеток на жировые, ученые обработали культуру «белых» адипоцитов жидкостью, в которой культивировали мышечные клетки с повышенным содержанием PGC1. В результате белые адипоциты «побурели». В то же время, среда из-под обычных мышечных клеток не имела такого эффекта.
Затем с помощью сложной методики исследователи отобрали пять секретируемых клетками белков-«кандидатов», чей синтез в мышцах усиливается под действием PGC1. Оказалось, что количество всех этих белков в мышцах увеличивается при физической нагрузке и у мыши, и у человека. Ученые проверили их воздействие на адипоциты. Оказалось, что один из этих белков — FNDC5 — повышал уровень мРНК термогенина в 77–500 раз уже при концентрации 20 нМ; при большей концентрации эффект еще усиливался. При этом увеличилось и количество других белков, характерных для «бурых» адипоцитов. Количество белков, характеризующих «белые» адипоциты, наоборот, снизилось. Значит, действие FNDC5 было специфичным. Изменилась и морфология адипоцитов — они стали больше похожи на бурые. А главное, они стали потреблять вдвое больше кислорода и почти перестали синтезировать АТФ, то есть стали тратить больше энергии.
Было известно, что у FNDC5 есть гидрофобный участок, а значит, этот белок, скорее всего, встраивается в мембрану клеток. Возникла гипотеза, что затем его наружную часть отрезает фермент, и она-то и попадает во внешнюю среду. Похожим способом высвобождаются из клеток, например, эпидермальный фактор роста и другие сигнальные вещества.
И действительно — меченую внутреннюю часть белка выявить во внешней среде не удалось. А вот с помощью антител к FNDC5 его легко было выявить в среде, где культивировали мышечные клетки. Молекулярная масса у секретированного белка при этом оказалась больше, чем у внутриклеточного. Объяснить это удалось, показав, что белок гликозилируется — к нему присоединяются добавочные углеводные цепи. Ученые расшифровали аминокислотную последовательность белка. Оказалось, что секретируемый полипептид содержит 112 аминокислот. Он-то и получил название «иризин» — в честь богини Ириды, вестницы богов.
Затем ученые доказали, что иризин содержится в плазме крови мышей и людей. При физических упражнениях через несколько недель его уровень повышается в 1,5–2 раза. Терапевтический эффект иризина проверяли на мышах, вводя ген FNDC5 с помощью аденовирусного вектора, так что этот ген попадал в клетки печени. В результате печень мышей начинала в больших количествах производить иризин, и его уровень в крови повышался в 3–4 раза. Побочных реакций при этом не возникало. Через 10 дней уровень мРНК термогенина в подкожном белом жире увеличился в 13 раз, и там появились типичные бурые адипоциты.
Тогда исследователи тем же способом увеличили содержание иризина в крови мышей особой генетической линии, страдающих ожирением и диабетом II типа (их клетки слабо реагируют на инсулин). Уровень иризина в крови у них повысился в три раза. При этом резко возросло потребление кислорода, а через десять дней слегка снизился вес, заметно упала концентрация глюкозы в крови после приема пищи и средняя концентрация инсулина.
Ученые обнаружили еще одно замечательное свойство иризина. Его аминокислотная последовательность необычайно консервативна (у мыши и человека она вообще совпадает на 100%). Это означает, что данный белок играет очень важную роль для всех млекопитающих. При этом на первый взгляд его действие необъяснимо. Ведь при физической нагрузке, когда затраты энергии возрастают, ее надо экономить. А иризин еще сильнее их увеличивает! Возможное объяснение, предложенное в работе, — то, что иризин играет определенную роль в терморегуляции. Если он выделяется при мышечной дрожи, то продукция тепла будет расти быстрее. Так что, возможно, он помогает не замерзнуть. В связи с этим интересно было бы сравнить секрецию иризина у млекопитающих из разных природных зон.
Авторы отмечают, что многое еще предстоит сделать. Например, нужно установить, как повлияет более длительный прием иризина на массу тела и другие показатели. Нужно также найти рецептор, через который иризин действует на клетки. Так или иначе, а терапевтический потенциал этого белка очевиден. Но в клиническую практику он войдет еще не скоро. А пока — выход один. Нет, даже два: бегать или плавать!
Источник: Pontus Boström, Jun Wu, Mark P. Jedrychowski, Anisha Korde, Li Ye, James C. Lo, Kyle A. Rasbach, Elisabeth Almer Boström, Jang Hyun Choi, Jonathan Z. Long, Shingo Kajimura, Maria Cristina Zingaretti, Birgitte F. Vind, Hua Tu, Saverio Cinti, Kurt Højlund, Steven P. Gygi, Bruce M. Spiegelman. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis // Nature. Published online 11 January 2012.




