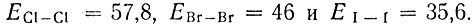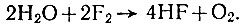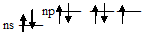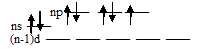В группе галогенов фтор является наиболее электроотрицательным элементом потому что
На чем основан общий принцип получения свободных галогенов в технике и лаборатории? Какова особенность получения фтора и где его применяют? Что
Подгруппа фтора – ГАЛОГЕНЫ.
Дайте общую характеристику p-элементов VII группы, исходя из их положения в периодической системе и сравнивая: электронные конфигурации атомов, радиусы, энергию ионизации и энергию сродства к электрону, электроотрицательность. Какие степени окисления характерны для атомов галогенов? Какие из них являются наиболее устойчивыми? Почему? В виде каких соединений эти элементы встречаются в природе?
Астат 85Аt (иногда его называют астатином) получен бомбардировкой ядер висмута 
Таблица 1.Некоторые характеристики атомов галогенов.
| Атом | Электронная конфигурация | Орбитальный атомный радиус (  ) ) | Еср Сродство к электрону эВ (кДж/моль) | Eион Первая энергия ионизации эВ(кДж/моль) | О Электроотрица- тельность* ) | Устойчивые Степени окисления |
| 9F | [He]2s 2 2p 5 | 0.39 | 3.45(333) | 17.42(1682) | 4.1 | -1; 0 |
| 17Cl | [Ne]3s 2 3p 5 3d 0 | 0.73 | 3.7 (348) | 12.97(1255) | 2.9 | -1;0;+1;+3; (+4); +5; (+6); +7. |
| 35Br | [Ar]3d 10 4s 2 4p 5 4d 0 | 0.85 | 3.4(325) | 11.81(1143) | 2.8 | -1; 0; +1; +3; (+4); +5; +7. |
| 53I | [Kr]4d 10 5s 2 5p 5 5d 0 | 1.04 | 3.1(295) | 10.47(1012) | 2.2 | -1; 0; +1;+3; +5; +7. |
Галогены проявляют положительные степени окисления в соединениях с более электроотрицательными элементами, например, с фтором (ClF7, IF7) и кислородом. Соединения, в которых атом галогена выступал бы как одновалентный катион Х+, неизвестны, поскольку энергетические затраты на ионизацию не компенсируются энергией кристаллической решетки и сольватации. Однако для иода и брома известны комплексные соединения, например, 
Астат по своим свойствам напоминает иод, например, идентифицированы соединения HAt, CH3At, BiAt, Ba(AtO3)2. Однако соединения с высшей степенью окисления At (VII) не получены.
2. Дайте сравнительную характеристику образуемых галогенами простых веществ, указав тип химической связи, характер изменения стандартных энтальпий образования (DH 0 обр.) и диссоциации молекул Hal2. агрегатного состояния простых веществ при обычных условиях. Как изменяются межъядерное расстояние и энергия связи в ряду F2-Cl2-Br2-I2? Чем это объясняется?
В парообразном, жидком и твердом состояниях галогены построены из двухатомных молекул Х2. Для оценки энергий молекулярных орбиталей полезна информация об энергиях исходных атомных орбиталей.
На рис.1 представлено изменение энергии ns- и np-атомных орбиталей для атомов элементов первого, второго, третьего и четвертого периодов периодической системы Д.И.Менделеева.
Рис.1. Энергия Е (эВ) ns- и np-атомных орбиталей атомов элементов 1-го, 2-го, 3-го 4-го периодов.
Рис.2. Схема энергетических диаграмм молекулярных орбиталей F2 (a) и Cl2 (б).
Таблица 2.Сравнение свойств молекул и простых веществ.
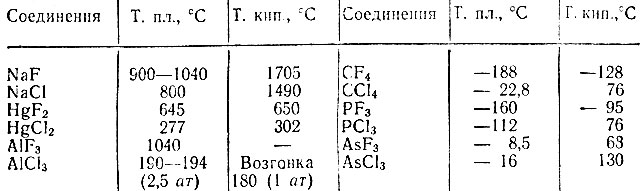
Температуры плавления (Тпл.) и кипения (Ткип.) (табл.2) монотонно увеличиваются от фтора к иоду. Этот факт связан с ростом размеров молекул и усилением межмолекулярного взаимодействия (сил Ван-дер-Ваальса).
3. Охарактеризуйте химические свойства свободных галогенов: отношение к металлам и неметаллам, воде, щелочам (при
20 0 С и при нагревании). Сравните их окислительную активность. Особенности химии фтора. Фторид ктслорода. В чем выражается отличие в поведении фтора по отношению к воде и щелочам от поведения остальных галогенов? Что представляют собой интергалогениды (межгалоидные соединения)?
Фтор в отличие от других галогенов воду окисляет:
Равновесие можно сместить вправо добавлением щелочных реагентов, например, Na2CO3:
Приведенные реакции используют для получения HClO, HBrO, HIO.
Диспропорционирование гипогалогенит-ионов термодинамически наиболее вероятно до галогенид- и галогенат-ионов. Скорости реакций и, значит, состав продуктов взаимодействия галогенов с водой существенно зависят от температуры. Несмотря на близость величин констант равновесия реакций и для хлора, скорость первой из них существенно больше, чем второй. Высокая энергия активации реакции обусловлена повышением прочности связи и увеличением экранирования хлора в ряду
Скорость реакции сильно зависит от температуры. Так, при действии хлора на эффективно охлаждаемый раствор щелочи образуются гипохлориты, например, жавелевая вода:
2NaOH + Cl2 
6KOH + 3Cl2 



4. В какой последовательности галогены вытесняют друг друга из водных растворов галидов? Объясните характер и причины изменения окислительно-восстановительных свойств свободных галогенов. Почему нельзя получить F2 окислением фторид-иона хлором? Ответ подтвердите величинами окислительно-восстановительных потенциалов.
2 NаBr + С12 = 2 NаС1 + Br2
2 NаI + С12 = 2 NаС1 + I2
2 К I + Br2 = 2 КBr + I2
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F – | E o = + 2,87В |
| Cl2 + 2e=2Cl – | E o = +1,36В |
| Br2+ 2e= 2Br – | E o = + 1,06В |
| I2 +2e = 2I – | E o = + 0,54В |
На чем основан общий принцип получения свободных галогенов в технике и лаборатории? Какова особенность получения фтора и где его применяют? Что
Свойства и особенности элементарного фтора
В Периодической системе Менделеева фтор находится во втором периоде. Атомный вес фтора 19 и атомный номер 9.
При низкой температуре (-187°С) фтор конденсируется в жидкость канареечно-желтого цвета.
Фтор обладает наибольшей реакционной способностью среди неметаллических элементов, его окислительный потенциал выше потенциала озона. Высокая электроотрицательность фтора обусловлена максимальным (по сравнению с другими элементами) сродством к электрону и очень большим потенциалом ионизации. Нормальный электродный потенциал фтора 2,85 в, тогда как для хлора и кислорода эта величина составляет 1,36 и 1,22 в. Если электроотрицательность фтора, выраженную в условных единицах, сравнить с электроотрицательностью некоторых других элементов, получается следующий ряд: фтор (4), кислород (3,5), азот и хлор (3,0), углерод (2,5), литий (1).
Причиной большой реакционной способности атомов фтора является стремление завершить октет внешнего электронного слоя, и сила этого стремления настолько велика, что фтор взаимодействует со всеми веществами за исключением некоторых инертных газов. Все реакции с участием фтора отличаются очень высоким тепловым эффектом. Например, на 1 кг эквимолекулярной смеси лития и фтора выделяется 5650 ккал, бериллия и фтора 4830, углерода и фтора 1830 ккал. При взаимодействии фтора с водородом выделяется 128,4 ккал/моль, тогда как присоединение водорода к кислороду сопровождается выделением только 57,8 ккал/моль.
Фтор при комнатной и даже при пониженной температуре реагирует с бромом, кремнием, аморфным углем и некоторыми металлами. Тепловой эффект реакции настолько велик, что пламя сгорающих в среде фтора веществ по яркости напоминает кислородно-ацетиленовое пламя или пламя электросварки.
Оригинальность химического поведения фтора и часто удивительные результаты его взаимодействия с другими элементами и их соединениями в известной степени объясняются тем, что он является наиболее электроотрицательным элементом и, входя в состав молекулы, вызывает резкое изменение распределения электронной плотности. Так, введение фтора в неорганические и органические кислоты превращает «их в более сильные кислоты, чем те, которые не содержат фтора. Неорганические фториды азота (трехфтористый азот, тетрафтор гидразин и перфторамины) не обладают основными свойствами. Фтор в любых соединениях имеет отрицательную степень окисления. Только в молекулярном фторе степень окисления равна нулю. Даже в соединении с кислородом F2O фтор имеет отрицательную степень окисления.
Большая электроотрицательность фтора обусловливает возникновение водородной связи во фтористом водороде.
Особенностью молекулы фтора является малая величина энергии связи, равная 37 ккал/моль. Если сопоставить ее с энергиями связей в молекулах других галогенов, то она окажется близкой к энергии диссоциации йода:
Именно это обстоятельство наряду с большими энергиями связей, образуемых атомом фтора с другими атомами (за исключением азота и кислорода), обусловливает исключительно высокую химическую активность элементарного фтора по сравнению с другими галогенами и неметаллами.
При взаимодействии элементарного фтора с другими галоидами образуются галоидофториды. Известны фториды иода, брома и хлора.
Алюминий, железо, хром, никель при обычной температуре образуют защитную пленку фторида. Коррозионная устойчивость деталей из этих металлов снижается с увеличением содержания в них углерода, кремния, титана и других легирующих добавок. Из стали можно изготовлять трубопроводы, используемые только при обычной температуре. Однако пленка фторида не всегда защищает металлы от фтора. Серебро и железо загораются во фторе при температуре около 500°С, но «никель, покрытый фтористым никелем, не реагирует с фтором даже при 600°С.
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем, при этом образуется фтористый водород и элементарный кислород:
В этой реакции, в отличие от обычных случаев горения, кислород не причина, а продукт горения.
Таблица 1
Действуя ксеноном на фтор при 400°С, исследователи получили четырехфтористый ксенон XeF4, представляющий собой бесцветные кристаллы. Это вещество устойчиво при комнатной температуре и плавится около 100°С. Были получены также фторид и гаксафторид ксенона, соединения криптона и радона (KrF4 и RnFx.) и такие вещества, как XeRnF6, XeF2(SbF5).
Таким образом, оказалась развенчанной легенда о полной инертности элементов нулевой группы, недавно казавшаяся аксиомой, и подтверждена способность фтора давать соединения со всеми элементами.
Сравнительная характеристика строения атомов галогенов
Валентные состояния атомов галогенов
Нормальное состояние атома фтора:
Нормальное состояние атома галогена (хлора, брома и йода):
Состояние атомов галогенов (хлора, брома и йода) при возбуждении:
За исключением некоторых оксидов (ClO2, Cl2O6) галогены кроме фтора (-1), проявляют нечётные степени окисления в своих соединениях.
Сравнительная характеристика атомов галогенов
Задача 809.
Дать сравнительную характеристику атомов галогенов, указав: а) характер изменения первых потенциалов ионизации; 6) характер энергии сродства к электрону.
Решение:
а) Первые потенциалы ионизации у атомов галогенов закономерно уменьшаются с увеличением порядкового номера элемента, что свидетельствует об усилении металлических свойств. Так у фтора потенциал ионизации I равен 17,42 эВ, у хлора – 12,97 эВ, у брома – 11,48 эВ, у йода – 10,45 эВ. Эта закономерность связана с возрастанием радиусов атомов, так как с увеличение порядкового номера элемента появляются новые электронные слои. Увеличение числа промежуточных электронных слоёв, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т. е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и удаление его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению потенциала ионизации.
б) Энергия сродства к электрону – это энергия, выделяющаяся при присоединении к свободному атому. У атомов галогенов с ростом порядкового номера элемента сродство к электрону закономерно уменьшается в ряду: F, Cl, Br, I. У атома хлора сродство к электрону больше, чем фтора, потому что у хлора появляется на внешнем энергетическом уровне d-подуровень. Уменьшение энергии сродства к электрону с ростом заряда ядра атома объясняется ростом радиуса атома элемента и, следовательно, уменьшением при этом эффективного заряда ядра.
Сравнительная характеристика свойств галогенов
Задача 810.
Дать сравнительную характеристику свойств образуемых галогенами простых веществ, указав характер изменения: а) стандартных энтальпий диссоциации молекул Г2; б) агрегатного состояния простых веществ при обычной температуре и давлении; в) окислительно-восстановительных свойств. Назвать причины, вызывающие эти изменения.
Решение:
а) В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами.
б) В обычных условиях фтор и хлор, газообразные вещества, бром – жидкость, а йод – кристаллическое вещество. Температуры плавления и кипения галогенов закономерно увеличиваются в ряду F — Cl — Br — I. Объясняется это тем, что с увеличением радиуса атомов возрастает Поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обуславливает возрастание температур плавления и кипения простых веществ галогенов.
в) Окислительно-восстановительные свойства галогенов закономерно изменяются в ряду F2 — Cl2 — Br2 — I2. Окислительные свойства уменьшаются в ряду галогенов от фтора к йоду, самый слабый окислитель – йод. Восстановительные свойства в ряду галогенов увеличиваются, самый слабый восстановитель – фтор. Происходит так, потому что в группе с увеличением порядкового номера элемента последовательно возрастают радиусы атомов и анионов Г- и уменьшается сродство к электрону и электроотрицательность элементов. Поэтому способность отдавать электроны увеличивается, а принимать – уменьшается в ряду
F2 — Cl2 — Br2 — I2.
Энергия диссоциации молекул галогенов
Задача 811.
Энергия диссоциации молекул галогенов по схеме Г2 ↔ 2Г составляет для фтора, хлора, брома и йода соответственно 155, 243, 190, 149 кДж/моль. Объяснить наибольшую прочность молекул хлора.
Решение:
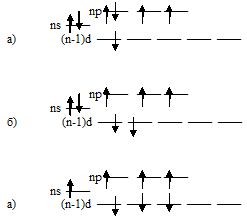
В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами. К тому же у хлора радиус атома ещё сравнительно мал, только чуть больше, чем у фтора, но значительно меньше, чем у брома и йода. Поэтому энергия связи в молекуле Cl2 значительно больше, чем у F2. Дополнительные донорно-акцепторные связи называют дативные.
Схема образования связей в молекулах F2 и Cl2:
Помогите мне пожалуйста сделать тест.
1. Электронная формула внешнего энергетического уровня атома брома соответствует электронной конфигурации:
А. ns^2np^3
Б. ns^2np^4
В. Нс2нп3
Г. Нс2нп5
2. из перечисленных хим. элементов наименьший радиус у атома:
а. Брома
б. Йода
в. Фтора
г. Хлора
3. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает атом:
а. Br
б. I
в. F
г. Cl
4. Положение элемента фтора в Периодической системе:
А. 2й период, главная подгруппа 7 группа
Б. 3й период, главная подгруппа 7 группа
В. 4й период, главная подгруппа 7 группа
Г. 5й период, главная подгруппа 7 группа
5. Из перечисленных веществ наиболее выраженные окислительные свойства имеют:
а. Бром
б. Йод
в. Фтор
г. Хлор
7. Химическая связь в молекуле брома:
а. Ионная.
Б. Ковалентная неполярная.
В. Ковалентная полярная.
Г. Металлическая
8. Пара формул веществ, в каждом из которых связь в молекулах только ионная:
А. NaCl, HCl
Б. HCl, Cl2.
В. NaCl, KBr.
Г. Br2, HBr
9. Фтор НЕ обладает свойством:
А. Самый активный
Б. Самый агрессивный
В. Самый легкий
Г. Имеет наименее интенсивную окраску из всех галогенов
10. Хлор взаимодействует с веществом, формула которого:
А. HCl
Б. NaF
В. NaCl
Г. H2
1. Электронная формула внешнего энергетического уровня атома брома соответствует электронной конфигурации:
Г. Нс2нп5
2. из перечисленных хим. элементов наименьший радиус у атома:
в. Фтора
3. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает атом:
в. F
4. Положение элемента фтора в Периодической системе:
А. 2й период, главная подгруппа 7 группа
5. Из перечисленных веществ наиболее выраженные окислительные свойства имеют:
в. Фтор
7. Химическая связь в молекуле брома:
Б. Ковалентная неполярная.
8. Пара формул веществ, в каждом из которых связь в молекулах только ионная:
В. NaCl, KBr.
10. Хлор взаимодействует с веществом, формула которого:
Г. H2
мне В группе галогенов фтор является наиболее электроотрицательным
элементом потому что:
а) имеет наибольшее число протонов;
б) имеет наименьший радиус;
в) имеет наибольший радиус;
г) имеет наименьшую атомную массу;
д) имеет 7 электронов на внешнем энергетическом уровне.
2. Максимальное число электронов на энергетическом уровне определяется
по формуле: а)N = A – Z; б) N = 2n
2
; в) N = 2n
2 + 2; г)N = 2n
2 – 2; д) N = 2n.
3.Спиновое квантовое число:
а) определяет ориентацию электронного облака в пространстве;
б) собственное вращение электрона вокруг своей оси;
в)характеризует энергетический подуровень и форму электронного облака;
г)характеризует энергетический уровень, или общий запас энергии
электрона, а также размеры электронного облака;
д) определяет число электронов, находящихся вокруг ядра.
4. Физический смысл номера периода заключается в том, что он показывает :
а) число нейтронов в ядре атома элемента;
б) заряд ядра атома элемента;
в) число электронов на внешнем энергетическом уровне;
г) число энергетических уровней;
д) число электронов в атоме элемента
Ответы 8
2) высшую валентность (максимально возможную степень окисления, количество электронов на внешнем энергетическом уровне)- варианты в скобках тоже, но оги далее встречаются в вопросах 5) и 8)
5) количество электронов на последнем энергетическом уровне
8) номеру группы, в котором находится хим.элемент
10) из 4-х энергетических уровней (смотрим на номер периода, в котором расположен хим.элемент
11) +7 (по номеру группы)
12) у стронция, поскольку сверху вниз в группе( в главной подгруппе) металлические свойства увеличиваются
13) 6 электронов (по номеру группы)
14) это два изотопа кислорода;
O(18): р(+)= 8, е= 8, n°=18-8=10
То есть отличаются количеством нейтронов в ядре
15) у N, в периоде справа налево неметаллические свойства увеличиваются;
17) Ar(+18), p(+)=18, e=18, n°=40-18=22;
18) 8 электронов (теория октета)
21) восстановительными (чаще всего они отдают электроны)