Tumor budding bd1 что означает
Intratumoural budding (ITB) в предоперационной биопсии предсказывает наличие лимфатического узла и отдаленных метастазов у пациентов с толстой и прямой кишками
При колоректальном раке (CRC) опухоли, начинающие на фронте инвазии, связаны с лимфатическим узлом (LN) и отдаленным метастазом. Интересно, что опухолевое почкование также может быть обнаружено при биопсии (внутриутробное почкование, ITB) и может иметь сходное клиническое значение. Здесь мы исследуем, может ли ITB в предоперационной биопсии CRC быть переведена в повседневную диагностическую практику.
Предоперационные биопсии у 133 пациентов с CRC (без неоадъювантной терапии) подвергались иммуногистохимии для маркера панцитокератина AE1 / AE3. Во всех биопсиях для каждого пациента была идентифицирована самая плотная область почек при × 40 (высокомощное поле, HPF) и подсчитывались почки.
Большее количество опухолевых почек в биопсии было связано с pT-стадией (P = 0,0143), метастазами LN (P = 0,0007), лимфатическими (P = 0,0065) и венозной венозной сосуд (P = 0,0318) и отдаленным метастазом (cM1) ( Р = 0,0013). Используя логическую регрессию, была разработана «шкала» для оценки вероятности LN и отдаленных метастазов с использованием количества опухолевых почек (например, 10 почек на HPF: вероятность 64% метастазирования LN, 30 почек на HPF: вероятность 86%). Соглашение между наблюдателями для ITB было превосходным (коэффициент внутриклассовой корреляции: 0,813).
Опухолевание почек можно оценить при предоперационной биопсии пациентов с CRC. Это практичный, воспроизводимый и прогнозирующий LN и отдаленный метастаз. Intratumoural budding подходит для дальнейшего исследования в перспективных условиях.
Предоперационное лечение колоректального рака (CRC) основано на междисциплинарном сотрудничестве между онкологами, гастроэнтерологами, хирургами, радиологами и патологоанатомами. Действительно, пациенты с ректальным раком с расширенной Т-стадией (cT3 или cT4) и / или наличием метастазов лимфатических узлов (LN) (N +) обычно выбирают для неоадъювантной терапии (Schmoll et al, 2012). В предоперационной постановке роль патологоанатома ограничивается подтверждением диагноза злокачественности от предоперационной биопсии, поскольку неопластическая природа поражения уже с большой долей вероятности подозревается с клинической точки зрения. Хотя в повседневной практике следует сообщать о многих гистоморфологических параметрах, таких как степень опухоли, лимфатическая и сосудистая инвазия, конфигурация границы опухоли, периневральная инфильтрация, внутри- и перитумуральное воспаление и гистологический подтип (Bosman et al, 2010), их использование ограничено резекция; следовательно, эти функции не влияют на предоперационное лечение пациента, поскольку они не могут применяться к биопсии.
Все пациенты с первичной CRC, хирургически обработанные в период между 2002 и 2011 годами в университетской больнице Инсел, Берн, Швейцария, были первоначально введены в это исследование. Было идентифицировано триста сорок шесть пациентов. Из них 185 имело сопоставимую предоперационную диагностическую биопсию. Для этих 185 случаев слайды Hematoxylin и Eosin (H & E) из хирургических резекций были рассмотрены одним опытным патологоанатомом (AL) и двумя жителями в процессе обучения (HD и VK), ослепленным результатами предоперационной биопсии. Были пересмотрены следующие гистопатологические параметры: TNM (7-е издание), гистологический подтип, уровень опухоли, лимфатическая инвазия (L), венозная инвазия (V), количество опухолевых отложений, периневральная инвазия (Pn), количество собранных LN и степень регрессии в соответствии с Колледжем американских патологов (CAP) для пациентов, ранее подвергшихся радиотерапии и / или химиотерапии. Все случаи были собраны в соответствии с национальными руководящими принципами обеспечения качества, предоставляемыми Швейцарским обществом патологии: все локо-региональные LN были идентифицированы макроскопически путем тщательного и тщательного изучения периколинового жира. Лимфатические узлы с диаметром менее 0,5 см полностью внедрены и исследованы на H & E. Узлы диаметром от 0,5 до 0,7 см делят пополам, а узлы диаметром более 0,7 см разделяют с интервалами 0,2 см и полностью внедряют. Клинические данные были получены из записей пациентов и включали возраст в диагноз, пол, местоположение опухоли, клиническую стадию TNM, информацию о неоадъюванте и адъювантной терапии. Клиническая постановка выполнялась в основном компьютерной томографией (КТ) (включая ПЭТ-ТТ) с последующей магнитно-резонансной томографией (МРТ) и ультразвуком. Тридцать пациентов, получавших неоадъювантную или предоперационную терапию, были исключены из дальнейшего анализа. Также было проведено гистопатологическое повторное исследование предоперационных биопсий. Кроме того, была определена информация о количестве биопсий на пациента и количестве биопсий, содержащих опухоль.
Все биопсии фиксировали в 10% забуференном формалине, вставляли парафином и архивировали в Институте патологии Бернского университета, Швейцария. Блоки опухолей извлекали и разделяли на 4 мкм. Иммуногистохимическое двойное пятно для панцитокератинового маркера AE1 / AE3 (Dako, Glostrup, Дания, мышиный моноклональный, 1: 200, предварительная обработка фермента 5 мин, DAB-хромоген;) и CD8 + (Dako C8 / 144B, 1: 100, предварительная обработка с Tris-буфером при 95 ° в течение 20 мин, хронометром AEC) с использованием автоматизированного прибора Leica Bond III и контрастирующего с гематоксилином. Для оценки опухолевых почек использовали окрашивание панцитокератином. Это исследование было одобрено местным комитетом по этике больницы Инсел (16 марта 2012 г.).
Опухоль опухоли оценивали по следующему методу. Все биопсии у одного пациента были отсканированы, а оценки, содержащие опухоль, были оценены. Было идентифицировано одно единственное опухолевое пятно, содержащее наибольшую плотность опухолевых почек (микроскоп Nikon Eclipse 50i с увеличением × 40, площадь поля 0,963 мм2) при окрашивании пан-цитокератином AE1 / AE3, и подсчитывали и регистрировали количество почек опухоли. Опухолевые почки определяли как одну опухолевую клетку кластеров до пяти клеток или одиночных опухолевых клеток с определенным ядром и диффузным цитоплазматическим окрашиванием для AE1 / AE3 (рисунок 1). Для определения соглашения между наблюдателями метода подсчета использовались подсчеты опухолей от двух независимых наблюдателей (AL и HD).
Схема исследования приведена на рисунке 2. Из 346 пациентов, изначально идентифицированных как хирургическое лечение первичного CRC с 2002 по 2011 год, 185 соответствовали биопсии. Из них 23 пациента были дополнительно исключены, поскольку они получали предоперационную радио- или химиотерапию. Иммуногистохимия была проведена в оставшихся случаях и была забита для почкования опухолей с использованием метода «горячей точки». После повторного рассмотрения окрашенных биопсий 29 случаев были дополнительно исключены, поскольку из-за секционирования биопсии осталось только несколько опухолевых клеток для оценки. Окончательное количество сопоставимых предоперационных биопсий с оценками опухолей и полностью пересмотренными хирургическими резекциями составило 133. Характеристики пациентов приведены в таблице 1.
Непараметрическая оценка уровня Уилкоксона или критерий Крускала-Уоллиса была использована для сравнения рангов оценки почек опухоли для категориальных переменных. Для сбора собранного возраста и общего количества LN использовалась оценка опухолевых почек по модели линейной регрессии. Соглашение между наблюдателями было определено с использованием коэффициента корреляции внутрикласса (ICC) со значениями, приближающимися к 1.0, что указывает на улучшенное согласие. Логистический регрессионный анализ был выполнен для расчета вероятности метастазирования LN и отдаленного метастаза в зависимости от количества опухолевых почек в биопсии. Вкратце, вероятность P = e (βo + β1x) / (1-e (βo + β1x)), где βo и β1 — оценки логистического уравнения, а x — количество почек опухоли. Кроме того, коэффициенты шансов (ORs) и 95% доверительные интервалы (CI) использовались для определения влияния опухолевого почкования на каждую значимую переменную. Область под кривой ROC (AUC) использовалась для определения дискриминационной способности почкования для данной функции.
В среднем по 12 опухолевых почек на горячее пятно было найдено срединное число пяти почек. Девяносто процентов всех случаев показали 50 почек на горячую точку, и все четыре были гистологией клеточных клеток. Оценка между наблюдателями проводилась по 133 случаям. МУС составлял 0,801, что свидетельствует о прекрасном согласии между независимыми наблюдателями. Все случаи с> 50 почками на горячую точку были удалены и снова оценены на предмет согласия. МУС был 0,72, что свидетельствует о сильном согласии.
Связь между большим количеством опухолевых почек в биопсии и клиническими и гистопатологическими особенностями хирургической резекции приведена в таблице 2. Большее количество опухолевых почек в биопсии было значительно связано с более продвинутой стадией pT (P = 0,0143 ), Метастазы LN (P = 0,0007), инвазия лимфатического сосуда (P = 0,0065) и инвазия венозного сосуда (P = 0,0318), как определено из хирургического образца. Кроме того, у пациентов с отдаленным метастазом (cM1) (P = 0,0013) наблюдалось большее количество почек.
Настоящее исследование демонстрирует, что присутствие ITB в биопсии толстой кишки и прямой кишки (без лечения неоадъювантной терапией) связано с более высокой стадией T (P = 0,0143), лимфатической (P = 0,007) и сосудистой инвазией (P = 0,032), LN (Р = 0,001) и отдаленных метастазов (Р = 0,001). Результаты подчеркивают диагностическую значимость ITB и соответствуют результатам из литературы (Morodomi et al, 1989; Lugli et al, 2011; Giger et al, 2012; Rogers et al., 2014). Практический подход к ITB удобен, понятен и понятен, три характеристики, которые важны для перевода гистопатологического биомаркера в повседневную диагностическую практику.
Мородоми и др. (Morodomi et al., 1989) ранее показали в 1989 году корреляцию почкования в предоперационной биопсии и наличие метастазов LN у 112 пациентов с ректальным раком. Эти результаты были подтверждены Giger et al (2012), анализируя предоперационные биопсии и соответствующие резекции 72 пациентов с CRC; Rogers et al (2014) дополнительно подчеркнули прогностическую способность ITB для узловых метастазов у 89 пациентов с ректальным раком, получавших неоадъювантную терапию. И Гигер, и Роджерс полагались на О-окрашенные участки предоперационной биопсии и использовали полуколичественную трехуровневую систему подсчета очков. В 2011 году наша исследовательская группа систематически анализировала наличие почкования на 511 участках цельной ткани после окрашивания цитокератином CRC, что привело к концепции расслоения опухоли в ITB и PTB (Lugli et al, 2011). Фактически наличие опухолевого почкования в предоперационных биопсиях (ITB) и в соответствующих резекциях (PTB) сильно и положительно коррелирует, предполагая, что общий подсчет опухоли (OTB) может быть полезен. Мы также показали, что ITB является независимым прогностическим фактором. Таким образом, все эти исследования подчеркивают диагностический, прогностический и прогностический потенциал ИТБ.
Исходя из фактического числа опухолевых почек, была разработана прогнозная шкала для LN и отдаленных метастазов. Таким образом, фактическая вероятность обоих исходов может быть визуализирована. Такой подход имеет явное преимущество в том, что он не полагается на оценку отсечки для низкоуровневого или полноценного почкования, что облегчит диагностику ИТБ для патологоанатомов, а также интерпретацию результатов для всех членов междисциплинарной команды. Для фактического количества почек соответствующие вероятности могут быть определены таким образом, что дает «относительность» результатам. Более того, мы показываем, что межотраслевое соглашение ITB является сильным с использованием метода «горячей точки», что еще раз подчеркивает преимущество этого подхода.
Существует, по крайней мере, три сценария, в которых ИТБ обнаружил предоперационную биопсию, может иметь клиническое значение. Первый — у пациентов с ректальным раком клинической стадии II. Хотя большинству пациентов с опухолями стадии II предлагается неоадъювантная терапия, присутствие ITB в биопсии предварительной обработки является оценкой поведения опухоли, которая может помочь расслоить пациентов в группы с высоким и низким уровнем риска. Второй может быть в предоперационном лечении пациентов с клиническими стадиями рака толстой кишки II стадии. Хотя эти раковые заболевания обычно не лечатся в неоадъювантной обстановке, данные недавнего экспериментального этапа исследования FOXTROT для локально продвинутых больных раком толстой кишки показывают целесообразность и возможную выживаемость предоперационной химиотерапии (Foxtrot Collaborative G, 2012). Внутричерепное почкование может помочь выявить пациентов с раком стадии II, которые подвержены высокому риску развития узловых метастазов, которые могут быть кандидатами на неоадъювантную химиотерапию. Третий — у пациентов с субтукально-инвазивными (Т1) CRC после эндоскопической резекции, которые могут быть подвержены высокому риску позитивности LN и, таким образом, выиграют от последующей хирургической резекции. В этом контексте, по крайней мере, десяток исследований (см. (Zlobec et al., 2012b)) показали, что опухоли почки, обнаруженные в образце хирургической резекции, предсказывают будущее развитие положительности LN в этих ранних раковых опухолях T1.
Одной из слабых сторон нашего исследования является размер выборки (особенно число случаев рака прямой кишки). Однако в дополнение к уже опубликованным результатам в литературе и учитывая тот факт, что также при раке толстой кишки ITB будет играть важную роль в предоперационном управлении, слабость может считаться маргинальной. Фактически, это, по-видимому, самое крупное исследование на сегодняшний день для оценки ITB в предоперационных биопсиях.
В заключение наши результаты подчеркивают ITB как гистоморфологический параметр при предоперационной биопсии пациентов с раком прямой кишки и прямой кишки. Это исследование вместе с предыдущими работами заложило прочную ретроспективную основу для будущих крупных перспективных исследований.
Мы благодарим Мэри Эконом и Кэролайн Хаммер из Отделения переводческих исследований Института патологии Бернского университета за отличную техническую поддержку. Это исследование было поддержано Бернской раковой лигой.
Эта работа публикуется по стандартной лицензии для публикации соглашения. Через 12 месяцев работа станет свободно доступной, и условия лицензии перейдут на лицензию Creative Commons Attribution-NonCommercial-Share Alike 3.0 Unported.
Авторы объявили, что нет никаких конфликтов интересов.
Оценка внутриутробного почкования. Предоперационная биопсия толстой кишки, окрашенная для панцитокератина (коричневого цвета), чтобы выделить отдельные опухолевые почки. Определяется наиболее плотная область (горячая точка) внутрипопуляционного почкования. При увеличении × 40 учитывается общее количество опухолевых почек в одном HPF. Полноцветную версию этой фигуры можно найти в British Journal of Cancer в Интернете.
Дизайн исследования. Из исходной когорты из 346 пациентов сопоставимые предоперационные биопсии были доступны для 185. Случаи были пересмотрены. Пациенты, получавшие предоперационную терапию, были дополнительно исключены. Биопсии подвергались иммуногистохимии, а окончательное число анализируемых случаев — 133.
Шкала вероятности. Чем больше количество почек, тем больше риск метастазов.
Сокращения: AUC = площадь под кривой ROC; CI = доверительный интервал; коэфф = коэффициент; ITB = внутрипопуляционное почкование; OR = отношение шансов.
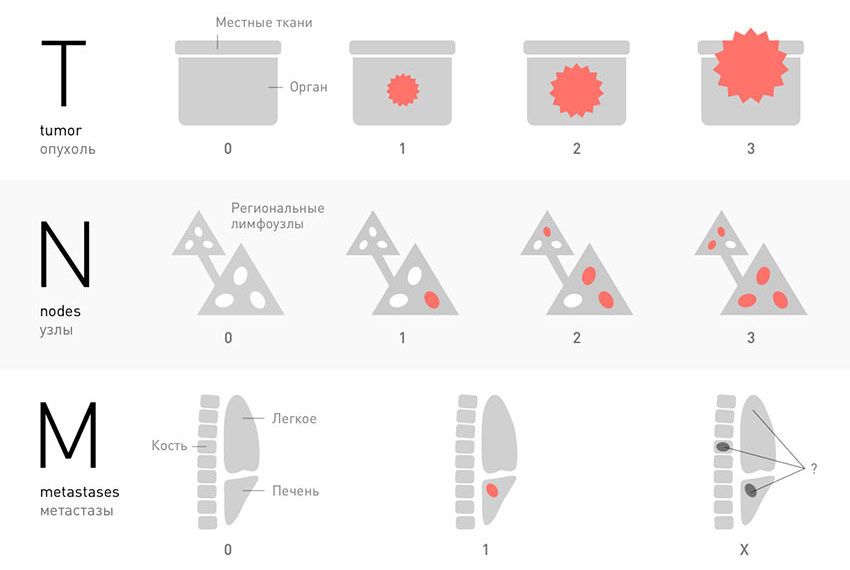
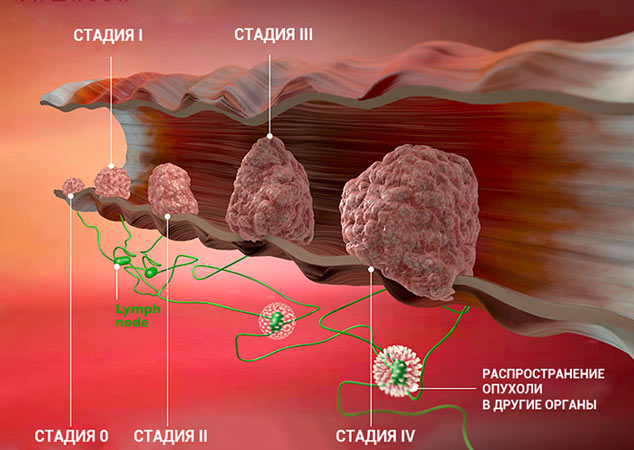
Стадии рака
Все опухоли (или, на языке врачей — новообразования) делят на две большие группы: доброкачественные и злокачественные. Первые обычно не опасны для жизни, а вторые, если человек не получает лечения, приводят к гибели. В 2015 году от рака во всем мире умерло почти 9 миллионов человек.
Фатальность злокачественных опухолей связана с двумя их главными свойствами, которые, собственно, и отличают их от доброкачественных новообразований:
Для врача важно понимать, насколько сильно рак успел распространиться в организме пациента. Ведь от этого зависит лечение и прогноз. Для того чтобы упростить эту задачу и внести четкость, в течении каждого онкологического заболевания принято выделять определенные стадии.
Классификация TNM
В большинстве случаев, для того чтобы установить стадию рака, ориентируются на три характеристики злокачественной опухоли, которые соответствуют трем буквам аббревиатуры TNM. К каждой букве приписывают индекс в виде цифры или специального обозначения.
T — tumor. Эта буква обозначает первичную опухоль, ее размеры, прорастание в стенку органа, соседние ткани:
N — nodus. Когда раковые клетки отрываются от первичной опухоли и мигрируют с током лимфы, в первую очередь они попадают в близлежащие (регионарные) лимфатические узлы. Можно сказать, что это первые баррикады на пути распространения рака в организме. В зависимости от того, обнаружены ли опухолевые клетки в регионарных лимфатических узлах, N может принимать значения:
M — metastasis. Эта буква показывает, обнаружены ли в теле больного отдаленные метастазы — вторичные очаги в различных органах:
Классификация TNM применима для большинства видов рака. Она позволяет очень подробно описывать злокачественные опухоли. В пределах основных групп выделяют подгруппы, их обозначают с помощью букв, например: T1a, T1b, T1c.
Однако, зачастую система TNM оказывается слишком громоздкой и не совсем удобной. Существует ее упрощенный вариант, когда возможные сочетания значений T, N и M сводят к пяти стадиям.
Стадии злокачественной опухоли
Часто онкологи обозначают стадию рака римской цифрой от I до IV. Эта классификация основана на TNM, но она проще и зачастую удобнее:
Это очень приблизительное описание стадий. Деление зависит от типа рака, от того, в каком органе он находится. Для того чтобы обозначить подстадию, к букве приписывают цифру. Например, стадия I может делиться на подстадии IA и IB.
Сторожевой лимфатический узел
Когда хирург оперирует онкологического пациента, зачастую ему приходится решать сложную задачу: стоит ли удалять регионарные лимфатические узлы? Если в них есть раковые клетки, и они будут оставлены в организме больного, произойдет рецидив. Если же удалить «чистые» лимфоузлы, это чревато осложнением в виде лимфедемы — отека на руке или ноге из-за нарушения оттока лимфы.
Раньше врачи нередко предпочитали меньшее из зол и удаляли лимфатические узлы «на всякий случай». Современные хирурги уже не действуют вслепую и могут более точно определить показания к лимфодиссекции. Это стало возможно благодаря появлению сентинель-биопсии или биопсии сторожевого лимфатического узла.
Сторожевым называется лимфатический узел (или группа лимфатических узлов), который первым принимает лимфу, оттекающую от злокачественной опухоли. Его можно обнаружить во время операции: для этого нужно ввести в опухоль флуоресцентный краситель или препарат с радиоактивной меткой. Препарат проникает в лимфатические сосуды, затем в сигнальный лимфоузел и «прокрашивает» его. Лимфатический узел удаляют и проверяют, нет ли в нем раковых клеток.
Для обозначения состояния сигнального лимфоузла используют специальную классификацию:
Если в сигнальном лимфоузле обнаружена опухолевая ткань — это показание к удалению регионарных лимфоузлов.
Степень злокачественности
Злокачественность и степень дифференцировки — два показателя, которые тесно взаимосвязаны. Они описывают внешний вид раковых клеток под микроскопом. Степень дифференцировки показывает, насколько раковая клетка отличается от здоровой. Если она высокая — опухолевая ткань похожа на здоровую. Низкодифференцированные раковые клетки полностью теряют сходство с нормальными.
Чем ниже степень дифференцировки и выше злокачественность, тем агрессивнее ведет себя рак и быстрее распространяется в организме. Для оценки используют гистологическую классификацию:
Шкала Глисона при раке простаты
Для того чтобы оценить степень злокачественности и агрессивности рака предстательной железы, используют шкалу Глисона, разработанную в 1960-х годах. В зависимости от того, как опухолевая ткань выглядит под микроскопом, ей присваивают оценку от 1 до 5. Чем ниже оценка, тем более высокодифференцированными и менее злокачественными являются клетки. Патологоанатом должен выявить два преобладающих типа ткани и выставить две оценки. Итоговая сумма баллов может колебаться от 2 до 10. Чем она больше, тем агрессивнее ведет себя опухоль, и выше риски.
Классификации рака печени
Классификация TNM не очень хорошо отражает течение злокачественных опухолей печени, поэтому в разных странах были созданы специальные классификации печеночно-клеточного рака. Например, многие врачи используют Барселонскую клиническую классификацию. В ее рамках выделяют следующие стадии рака печени:
В некоторых странах практикуется классификация итальянской программы по изучению рака печени (CLIP). В ней учитывается четыре фактора: состояние функции печени, распространение опухолевых очагов (больше или меньше половины печени), уровень альфа-фетопротеина (опухолевый маркер) и наличие тромбоза портальной вены. По каждому показателю врач выставляет оценку 0, 1 или 2 балла. Выживаемость пациентов зависит от суммы баллов:
В соответствии с системой CLIP, всех больных печеночно-клеточным раком можно поделить на две группы: 0–2 балла — значительно более благоприятный прогноз; более 2 баллов — значительно менее благоприятный прогноз.
В 1985 году была предложена классификация Okuda, в которой учитываются: степень поражения печени, наличие асцита (скопления жидкости в брюшной полости), изменение уровня альбумина и билирубина в крови. В соответствии с классификацией Okuda, выделяют три стадии рака печени:
Почему важно установить стадию злокачественной опухоли?
Знание стадии рака по TNM и другим системам помогает онкологу решать важные задачи:
Единые классификации помогают врачам из разных клиник и стран «разговаривать на одном языке». Видя стадию опухоли, диагностированную в другой клинике, онколог четко понимает, что это значит, и как дальше работать с пациентом.
Tumor budding bd1 что означает
ФГБОУВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
ГУНУ «Факультет фундаментальной медицины МГУ им. М.В. Ломоносова»; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
Новое в классификации злокачественных эпителиальных опухолей толстой кишки. (ВОЗ, 2019, 5-е издание)
Журнал: Архив патологии. 2020;82(3): 38-46
Олейникова Н. А., Мальков П. Г., Данилова Н. В. Новое в классификации злокачественных эпителиальных опухолей толстой кишки. (ВОЗ, 2019, 5-е издание). Архив патологии. 2020;82(3):38-46.
Oleynikova N А, Mal’kov P G, Danilova N V. Changes in the classification of malignant colon epithelial neoplasms. (WHO, 2019, 5th edition). Arkhiv Patologii. 2020;82(3):38-46.
https://doi.org/10.17116/patol20208203138
ФГБОУВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
В настоящее время классификация аденокарцином по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома (код МКБ-О: 8201/3), веретеноклеточная карцинома (8032/3), плоскоклеточная карцинома (8070/3), добавлены карцинома с саркоматозным компонентом (8033/3), дискогезивная (poorly cohesive) карцинома (8490/3) и аденомоподобная карцинома (8262/3). В качестве важных гистологических характеристик в Заключении необходимо указывать наличие лимфатической инвазии, интра- и экстрамуральной сосудистой инвазии, периневральной инвазии, степени злокачественности, «опухолевого почкования» (tumor budding) и характер иммунного окружения. В 5-м издании классификации добавлен большой раздел, посвященный молекулярной диагностике и молекулярным прогностическим факторам колоректального рака. Найдены соответствия между двумя различными классификациями, основанными на двух различных подходах: геномном (по ДНК) и транскриптомном (по РНК). В соответствии с геномной классификацией выделены две большие группы колоректального рака: гипермутационные и негипермутационные, которые соответствуют молекулярным путям с развитием микросателлитной и хромосомной нестабильности соответственно. Раздел нейроэндокринных опухолей существенных изменений не претерпел. Не рекомендовано использовать термин «карциноид» для обозначения нейроэндокринной опухоли G1, т.е. термин «карциноид» исключен.
ФГБОУВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
ГУНУ «Факультет фундаментальной медицины МГУ им. М.В. Ломоносова»; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ; ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
Новая классификация опухолей толстой и прямой кишки WHO 2019, 5-е издание [1] выглядит довольно стройной, чрезвычайно краткой и включает только эпителиальные новообразования, разделенные на две группы: доброкачественные и злокачественные новообразования. Наша публикация посвящена классификации злокачественных новообразований (табл. 1). Ранее входившие в классификацию мезенхимальные опухоли и лимфомы из классификации исключены и вынесены в отдельный раздел.

Примечание. *NOS — not otherwise specified (без дополнительных уточнений).
Частота возникновения колоректального рака стремительно растет и регистрируется преимущественно в странах с высоким доходом, причем отмечается тенденция к развитию заболевания в молодом возрасте. В 2018 г. заболеваемость колоректальным раком занимала 2 место в мире у женщин и 3 место у мужчин [1].
Аденокарциномы
Морфологическая классификация аденокарцином по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома (8201/3), веретеноклеточная карцинома (8032/3), плоскоклеточная карцинома (8070/3), добавлены карцинома с саркоматозным компонентом (8033/3), дискогезивная (poorly cohesive) карцинома (8490/3) и аденомоподобная карцинома (8262/3).
Карцинома с саркоматозным компонентом. Характеризуется недифференцированными фокусами с наличием саркомоподобных признаков, таких как веретеноклеточный компонент или рабдоидные фигуры. Прогноз крайне неблагоприятный. Как правило, опухоли имеют большой размер, рабдоидные клетки с яркими внутрицитоплазматическими рабдоидными тельцами. Опухолевые клетки часто разрознены и заключены в миксоидный матрикс. Могут встречаться плеоморфные гигантские или веретеновидные клетки наряду с фокусами железистой дифференцировки. Характерно отсутствие ядерного окрашивания при иммуногистохимическом определении SMARCB1 (INI1).
Аденомоподобная карцинома. Ранее называлась «ворсинчатая», или «инвазивная папиллярная аденокарцинома», представляет собой инвазивную аденокарциному, в которой более 50% «инвазивных зон» (дословный перевод) похожи на ворсинчатые структуры аденомы с дисплазией low-grade. Характеризуется высокой частотой мутаций в гене KRAS и благоприятным прогнозом. Диагноз с помощью биопсии труден.
Зубчатая аденокарцинома. Критерии постановки диагноза не изменились. Частота встречаемости 10—15% от всех колоректальных раков. Морфология опухоли должна быть похожа на зубчатые образования с наличием зубчатого просвета, возможен муцинозный компонент. Опухолевые клетки имеют низкое ядерно-цитоплазматическое соотношение. Критерии этого подтипа весьма условны, поскольку при различных степенях дифференцировки и выраженности клеточной атипии оценить наличие зубчатого просвета и его «истинность» крайне затруднительно. Однако по сравнению с предыдущим изданием принципиально новых диагностических критериев или маркеров не добавлено.
Дискогезивная (poorly cohesive) аденокарцинома. Описание и критерии постановки не приведены, несмотря на ее наличие в классификации. Учитывая общий с перстневидно-клеточной аденокарциномой код МКБ-О (8490/3), отсутствие критериев нельзя считать критичным, однако с практической точки зрения неясно, в каких случаях пользоваться данной рубрикой. Такие опухоли ранее описаны при раке желудка, для колоректального рака этот подтип введен впервые. Смеем предположить, что критерии для толстой кишки те же, что и для желудка: изолированные или сгруппированные в мелкие кластеры опухолевые клетки, которые могут быть не только перстневидными, но и напоминать гистиоциты, лимфоциты, плеоморфные с резко атипичным ядром или ярко выраженной эозинофильной цитоплазмой и выраженной стромальной реакцией.
Аденоплоскоклеточная карцинома по-прежнему осталась в классификации и описана как редкий (частота менее 0,1%) тип, сочетающий в себе признаки аденокарциномы и плоскоклеточной карциномы (рис. 1).

Окраска гематоксилином и эозином, об. ×20.
Авторы по-прежнему настоятельно рекомендуют оценивать степень злокачественности по двухступенчатой шкале — low- и high grade по самому злокачественному компоненту, а не по степени дифференцировки опухоли (G1, G2, G3). Основные востребованные критерии колоректального рака [1]:
‒ степень дифференцировки: Low/High;
‒ глубина инвазии (по TNM);
‒ наличие (лимфо)васкулярной инвазии: интрамуральная сосудистая, экстрамуральная сосудистая инвазия, лимфатическая инвазия;
‒ периневральный рост: есть / нет;
‒ край резекции (проксимальный, дистальный, хирургический): позитивный, негативный, расстояние в сантиметрах;
‒ качество образцов краев резекции;
‒ количество выявленных лимфатических узлов;
‒ количество лимфатических узлов с метастазами;
‒ наличие ответа на терапию: есть (частичный или полный) / нет;
‒ микросателлитный статус/наличие белков системы репарации ДНК (MLH1, MSH2, MSH6,м PMS2): микросателлитно-стабильная, микросателлитно-нестабильная; окрашивание с белками системы репарации ДНК отсутствует или присутствует;
‒ статус опухолевого почкования;
‒ наличие/отсутствие соответствующих мутаций.
В качестве важных гистологических характеристик в Заключении необходимо указывать наличие лимфатической инвазии, интра- и экстрамуральной сосудистой инвазии, периневральной инвазии, степени злокачественности, опухолевого почкования (tumor budding) и характер иммунного окружения [2]. Все эти параметры, за исключением последнего, ассоциированы с плохим прогнозом, а иммунное окружение — с благоприятным (табл. 2). Также важно отмечать наличие позитивных/негативных краев резекции (проксимального, дистального и края резекции клетчатки) — считается положительным, если расстояние между опухолью и краем резекции менее 1 мм. В стадировании колоректального рака принципиальных изменений не выявлено, кроме введения новой подрубрики M1c — наличие метастазов на брюшине независимо от поражения соседних органов (ранее эти случаи кодировались M1b).

Примечание. *HR — hazard ratio — соотношение рисков,**CI — confidence interval — доверительный интервал.
В новую классификацию введены дополнительные характеристики опухоли: опухолевое почкование (tumor budding) и иммунное микроокружение. В тексте 5-го издания подробных инструкций к определению данных параметров не приводится, однако указаны ссылки на релевантные источники, которые рекомендуется использовать.
Консенсус «International Tumor Budding Consensus Conference» в марте 2015 г. в Бостоне [3] определил опухолевое почкование (tumor budding) как единичные клетки или как кластеры не более чем из 4 клеток (5 клеток и более именуются плохо дифференцированными кластерами), которые находятся в инвазивном крае опухоли и расцениваются как независимый прогностический фактор колоректального рака. Отмечено, что опухолевое почкование должно быть оценено на препаратах, окрашенных гематоксилином и эозином, при всех возможных вариантах, за исключением случаев с выраженным перитуморальным воспалением и фрагментацией желез; в некоторых случаях следует проводить иммуногистохимическое типирование. В дооперационных биопсиях следует использовать метод горячей точки (hotspot 1 ). В операционном материале может быть использован как метод hotspot, так и подсчет на 10 полях зрения. Инвазивный край с формированием опухолевых почек (budding) и плохо дифференцированных кластеров в общую оценку степени злокачественности опухоли не включаются, так как являются отдельным прогностическим фактором.

Метод определения количества опухолевых почек «hotspot» включает в себя следующие этапы (рис. 2):
1) выбор микропрепарата с наибольшей глубиной инвазии;
2) обзорный просмотр препарата при об. ×10 для определения горячей точки, hotspot — на 10 полях зрения вдоль инвазивного края в операционном материале (см. рис. 2, а) и на всех полях зрения вдоль инвазивного края при pT1-эндоскопическом материале (см. рис. 2, б);

Описание рисунков приводится в тексте.
3) подсчет опухолевых почек в выбранной области (hotspot) при об. ×20 (рис. 3);
4) нормализация опухолевых почек по формуле с учетом коэффициента пересчета из табл. 3.

Окраска гематоксилином и эозином, об. ×20.
Формула подсчета опухолевых почек:
где Bd — budding, опухолевые почки на площадь 0,785 мм 2 ; N — количество почек, подсчитанное при об. ×20; F — коэффициент пересчета (см. табл. 3).
Полученное значение Bd стандартизовано:
Bd1 2 2 (Low grade) — 0—4 почки;
Bd2 (Intermediate) — 5—9 почек;
Bd3 (High grade) — 10 почек и более.
В некоторых гистологических подтипах колоректального рака (муцинозном, перстневидно-клеточном, медуллярном и микропапиллярном) оценку опухолевых почек следует проводить с осторожностью:
— в муцинозных и перстневидно-клеточных карциномах опухолевые почки, расположенные в озерах слизи, считать не следует;
— в медуллярной карциноме в зоне выраженного воспалительного инфильтрата разрозненные опухолевые клетки не отличаются от истинных опухолевых почек, поэтому считать их следует с большой осторожностью;
— в микропапиллярной карциноме не следует в подсчет опухолевых почек включать плохо дифференцированные кластеры (5 клеток и более);
— во всех типах аденокарцином фрагментация желез в зоне выраженного (часто нейтрофильного) воспалительного инфильтрата также может быть с трудом отличима от опухолевых почек.
В случаях, когда точное количество опухолевых почек не может быть посчитано, в Заключении следует писать: «опухолевые почки не могут быть оценены», с последующим пояснением. В материале резекций прямой кишки по поводу рака после неоадъювантной терапии опухолевые почки не следует считать, поскольку в этих случаях их прогностическое значение не доказано.
Опухолевое почкование имеет доказанное прогностическое значение в трех ситуациях:
1) в случаях эндоскопических резекций pT1-раков, когда опухолевое почкование ассоциировано с метастазами в лимфатические узлы, показана хирургическая резекция;
2) у пациентов со II стадией, когда опухолевое почкование ассоциировано с короткой безрецидивной выживаемостью, целесообразна адъювантная терапия;
3) при оценке статуса опухолевого почкования в пред- операционной биопсии, что может помочь пациенту в выборе неоадъювантной терапии и потенциально предсказать регрессию опухоли.
Наличие иммунного микроокружения ассоциировано с лучшим прогнозом и микросателлитной нестабильностью (как независимым от прогноза фактором). Иммунное окружение следует оценивать по опухольинфильтрирующим лимфоцитам и тканевой реакции, подобной болезни Крона (Crohn) [2]:
— тканевая реакция, подобная болезни Крона, — более 3 лимфоидных фолликулов в фокусе выраженной воспалительной реакции;
— опухольинфильтрирующие лимфоциты (TILs) — наличие лимфоцитов (но не гранулоцитов) строго между опухолевыми клетками, считается на 5 полях зрения при об. ×40, среднее значение TILs вычисляется как общее количество лимфоцитов, деленное на 5.
Показано, что среднее число более 2 TILs в поле зрения и выраженная тканевая реакция, подобная болезни Крона, являются независимыми благоприятными прогностическими факторами. Другая известная схема подсчета TILs, основанная на рекомендациях International TILs Working Group, была предложена Y. Iseki и соавт. [6], однако в официальной классификации она не упоминается.
Для оценки опухолевого ответа на терапию предлагается использовать любую из нижеприведенных шкал оценки (табл. 4).

Примечание. AJCC — American Joint Committee on Cancer; MSKCC — Memorial Sloan Kettering Cancer Center; * — в оригинальной работе — пищеводная стенка.
Диагностическая молекулярная патология
В 5-м издании классификации добавлен большой раздел, посвященный молекулярной диагностике и молекулярным прогностическим факторам колоректального рака. Найдены соответствия между двумя различными классификациями, основанными на двух различных подходах: геномном (по ДНК) и транскриптомном (по РНК).
В соответствии с геномной классификацией выделены две большие группы колоректального рака: гипермутационные и негипермутационные, которые соответствуют молекулярным путям с развитием микросателлитной и хромосомной нестабильности соответственно.
Гипермутационные раки (около 15%) имеют высокую частоту мутаций и часто ассоциированы с MSI из-за гиперметилирования промотера гена MLH1 или инактивации ДНК через механизм MMR (13%). Почти все опухоли имеют CpG-фенотип и множество неактивных (silenced) генов из-за гиперметилирования промотера. Малое число опухолей является наследственными и относится к синдрому Линча (Lynch) или соматическим мутациям в MMR. Около 2—3% раков относят к ультрамутационным с чрезвычайно высоким уровнем мутаций, характерной заменой нуклеотидов (C→А), приводящей к наличию мутации, инактивирующей корректирующую функцию экзонуклеазного домена ДНК-реплицирущего фермента POLE (или реже POLD1), что, в свою очередь, приводит к ошибкам при спаривании оснований во время репликации ДНК. Ультрамутационные и гипермутационные часто объединяют в единую группу, поскольку показана достоверно более высокая частота мутаций по сравнению с негипермутационными раками.
Негипермутационные раки (85%) микросателлитно-стабильны и имеют низкую частоту мутаций, однако в них наблюдается высокая частота изменений (увеличение/уменьшение) числа копий соматических генов (SCNA, somatic copy-number alteration) на уровне плеча хромосомы. Гены, которые часто мутированы в негипермутированных раках, — APC (80%), TP53 (60%), KRAS (45%), а также другие (табл. 5).

Чаще всего данные изменения (табл. 6) находят отражения в WNT-, MAPK- и PI3K-сигнальных путях и в инактивации TGF-β- и p53-ингибиторных путей, что может служить основой для таргетной терапии. WNT-сигнальный путь активируется в 97% гипермутационных раков и в 93% негипермутационных.
Впервые достигнут консенсус по молекулярным подтипам колоректального рака (рис. 4). На основании транскриптомного профиля выделены четыре подтипа (consensus molecular subtype, CMS). Почти все гипермутационные (по генетической классификации) раки относятся к первой категории (CMS1, MSI-immune, 14%). Эти раки характеризуются частыми мутациями гена BRAF, метиляторным фенотипом, низкими SCNA, выраженным иммунным ответом — инфильтрацией CD8+ лимфоцитами, что обусловливает потенциальный ответ на ингибиторы контрольных точек иммунного ответа. Остальные микросателлитно-стабильные раки делятся на три подтипа: CMS2 (канонические, 37%), CMS3 (метаболические, 13%) и CMS4 (мезенхимальные, 23%). Тем не менее около 13% всех колоректальных раков не укладываются в достигнутый консенсунс, представляют собой раки с переходным фенотипом или внутриопухолевой гетерогенностью и отнесены к неклассифицируемому подтипу (см. рис. 4).

Выделены биомаркеры с установленным предикторным значением и биомаркеры с частично установленным предикторным значением или находящиеся в стадии разработки (см. табл. 6).

Биомаркеры с установленным предикторным значением
RAS-гены, к которым относятся KRAS и NRAS, имеющие терапевтическое значение. По международным рекомендациям подлежат анализу 12, 13, 59, 61, 117 и 146-й кодоны генов KRAS и NRAS, поскольку они коррелируют с устойчивостью к моноклональным антителам к внеклеточному домену EGFR (HER1). Эти антитела (цетуксимаб и панитумумаб) предотвращают димеризацию EGFR и последующее развитие онкогенных сигнальных путей. Почти 50% колоректальных раков имеют мутации гена KRAS и устойчивы к анти-EGFR-терапии, однако оставшиеся 40—60% опухолей с геном KRAS дикого типа хорошо отвечают на данную терапию.
BRAF. Мутации гена BRAF (чаще в районе 600-й аминокислоты, V600E) сопряжены с неблагоприятным прогнозом, используются для исключения синдрома Линча. Есть данные об отсутствии эффекта от анти-EGFR-терапии у пациентов с мутацией V600E.
Микросателлитная нестабильность. Наличие микросателлитной нестабильности — ключевой момент при синдроме Линча. Микросателлитная нестабильность, ассоциированная с геном BRAF дикого типа, является предиктором хорошего прогноза. С терапевтических позиций микросателлитная нестабильность снижает эффект от химиотерапии фторурацилом и является основанием для назначения иммунотерапии опухоли, в том числе блокаторов PD-L1, особенно в тех случаях, когда традиционная терапия не оказала эффекта.
Биомаркеры с частично установленным предикторным значением или находящиеся в стадии разработки
Успех PD-1/PD-L1-ингибиторов в лечении микросателлитно-нестабильных раков является обнадеживающим, однако имеет много ограничений в биологии и стадии опухоли.
Ген PIK3CA кодирует каталитическую субъединицу PI3K и подвержен мутациям в 10—20% случаев колоректального рака, которые затрагивают преимущественно экзоны 9 и 20. В колоректальных раках с геном RAS дикого типа мутации гена PIK3CA ассоциированы с неблагоприятным прогнозом и плохим ответом на терапию моноклональными антителами к EGFR. С другой стороны, мутация PIK3CA сопряжена с успешной адъювантной терапией ацетилсалициловой кислотой.
c-Met, рецепторная тирозинкиназа часто гиперэкспрессируется в гастроинтестинальных опухолях; аберрантная экспрессия, активация, амплификация и мутация гена MET наблюдаются в некоторых группах колоректального рака и могут являться потенциальными предиктивными маркерами к терапии ингибиторами c-Met.
«Жидкостная биопсия» — анализ периферической крови пациента. Может быть использована в диагностике метастатического колоректального рака и для определения предиктивных маркеров противоопухолевой терапии. Среди всех потенциальных тестов (обнаружение циркулирующих опухолевых клеток, экзосом, внеклеточной ДНК) выявление мутаций в генах (K)RAS и BRAF-мутаций сейчас доступно в некоторых центрах и с большой вероятностью станет широко распространено в ближайшем будущем.
Любопытно отсутствие упоминания о маркерах стволовых клеток и опухолевого микроокружения, которые являются активно развивающимися областями в онкологии и которым посвящено большое количество публикаций.
Нейроэндокринные опухоли. Раздел нейроэндокринных опухолей существенных изменений не претерпел и включает:
‒ нейроэндокринную опухоль (NET);
‒ нейроэндокринную карциному (NEC);
‒ смешанную нейроэндокринную/ненейроэндокринную карциному (8154/3), которая ранее именовалась как смешанная аденонейроэндокринная карцинома (8244/3).
Нейроэндокринные опухоли чаще развиваются в прямой кишке, отмечается незначительное увеличение заболеваемости в 1,5 раза за последние 20 лет. Не рекомендовано использовать термин карциноид для обозначения нейроэндокринной опухоли G1, т.е. термин карциноид исключен. Добавлена новая подрубрика — нейроэндокринная опухоль G3 с кодом, идентичным нейроэндокринной опухоли G2 (8249/3), однако критерии еще не определены.
Заключение
Классификация аденокарцином толстой кишки по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома, веретеноклеточная карцинома, плоскоклеточная карцинома, добавлены карцинома с саркоматозным компонентом, дискогезивная (poorly cohesive) карцинома и аденомоподобная карцинома. Введены дополнительные характеристики опухоли — опухолевое почкование (tumor budding) и иммунное микроокружение, имеющие прогностическое значение. На основании секвенирования генома выделены гипермутационные и негипермутационные раки и на основании транскриптомного профиля CMS1 (раки с MSI, 14%), CMS2 (канонические, 37%), CMS3 (метаболические, 13%), CMS4 (мезенхимальные, 23%), а также неклассифицируемый подтип (около 13%).
Работа выполнена в рамках госзадания ФГБОУ ВО МГУ им. М.В. Ломоносова с использованием оборудования, приобретенного по Программе развития ФГБОУ ВО МГУ им. М.В. Ломоносова до 2020 г.
1 Зона с максимально выраженным процессом, опухолевым почкованием.