Susp neo что это означает
Рак молочной железы: симптомы, диагностика и лечение
Рак молочной железы — опасная болезнь, которая ежегодно уносит тысячи жизней. В России смертность от него остается крайне высокой. Каждый год более 55 000 женщин узнают об этом страшном диагнозе, и лишь половине удается побороть рак. Данная патология в большинстве случаев поражает железистые клетки протоков или долек молочной железы.
Появление первых признаков рака груди не всегда удается уловить, так как в большинстве случаев на начальном этапе это заболевание протекает бессимптомно. Иногда может наблюдаться болезненность молочных желез и боли во время менструального цикла. Нередко новообразование обнаруживается при осмотре или скрининговой маммографии. Лечение обычно включает хирургическое иссечение, часто с лучевой терапией, с адъювантной химиотерапией или гормональной терапией.
Клиника онкологии Юсуповской больницы является одним из крупнейших центров по лечению заболеваний молочной железы. Использование высокотехнологичного современного оборудования позволяет специалистам онкологического центра максимально быстро верифицировать диагноз и расписать дальнейшую тактику лечения. За время существования больницы нашим специалистам удалось помочь тысячам пациенток успешно побороть рак.
Причины и факторы риска
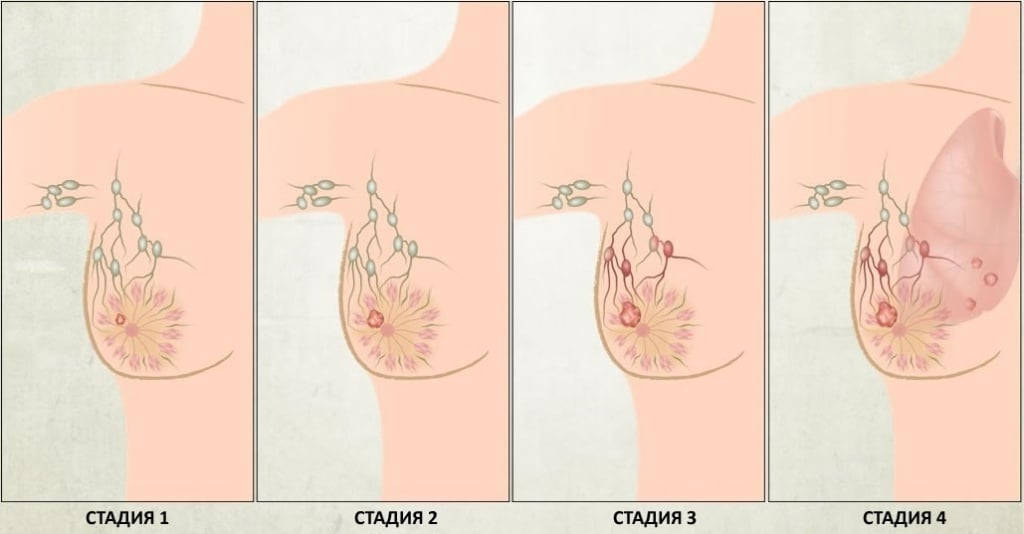
Стадии
Стадия рака молочной железы определяется, исходя из характеристик конкретной болезни. Определение стадии помогает выбрать лучшие варианты лечения.
Обычно стадия рака молочной железы обозначается цифрой по шкале от 0 до IV, при этом стадия 0 описывает неинвазивный рак (рак in situ), а стадия IV — инвазивную болезнь, распространившуюся в другие части тела.
Стадии TNM
Во всем мире принята классификация рака молочной железы по ТНМ, которая включает размер опухоли, состояние лимфатических узлов, наличие или отсутствие метастазов. Система определения стадий TNM дает полную информацию о развитии опухоли:
буква T – обозначает размер злокачественного образования;
буква N – описание распространения рака на лимфатическую систему;
буква M – описание распространения новообразования на другие ткани и органы.
Рак прямой кишки
Рак прямой кишки – что это такое?
Это злокачественное онкологическое заболевание происходит из эпителия прямой кишки. Этой опухоли присущи характерные черты любого злокачественного образования – быстрый рост, прорастание в соседние ткани, метастазирование.
Подвержены болезни мужчины и женщины в равной степени. Рост числа заболевших отмечается с 45 лет, а пик заболеваемости приходится на 75-летних.
О заболевании
Слизистая оболочки конечного участка толстой кишки покрыта цилиндрическим эпителием с большим количеством желез. Их клетки продуцируют слизь. Под влиянием факторов риска появляются патологические клетки с бесконтрольным делением и утратой механизма апоптоза – запрограммированной гибели. Постепенно из них формируется опухоль прямой кишки.
Предположительно установлены причины рака прямой кишки:
Виды рака прямой кишки
Тип опухоли определяется ее локализацией:
Характер роста опухоли может быть:
По гистологической картине новообразование бывает:
Симптомы рака прямой кишки, первые признаки
Обсуждение проблем прямой кишки для многих людей является чем-то постыдным. Поэтому первые признаки патологии часто остаются без должного внимания. Начальные симптомы рака прямой кишки – изменения характера стула. Появляется частая смена запора и диареи, меняется форма кала. Он становится значительно тоньше, чем раньше. Беспокоят чувство неполной дефекации, неприятные ощущения, повышенное образование газов.
Развитие опухолевого процесса вызывает отдаленные признаки рака прямой кишки:
На начальных стадиях проявления болезни может не быть. При выявлении анемии неизвестного происхождения стоит искать причину скрытого кровотечения. Возможно, это рак.
Поздние стадии характеризуются поражением других органов:
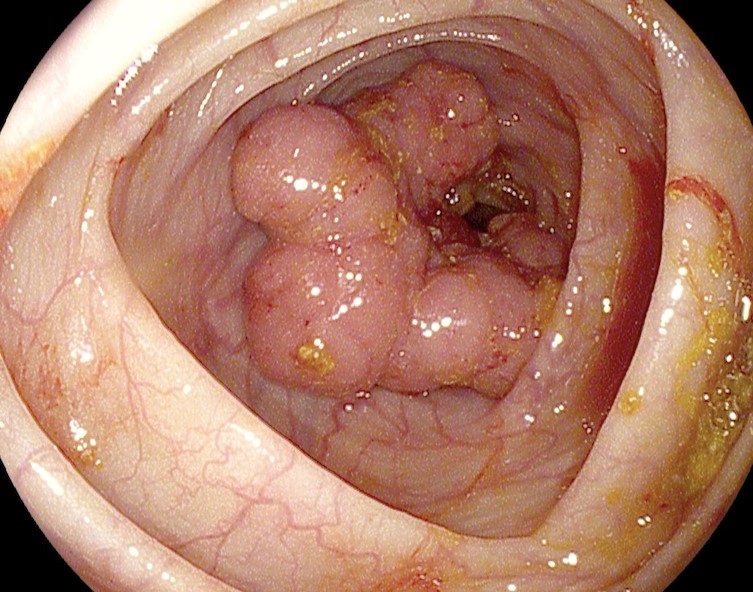
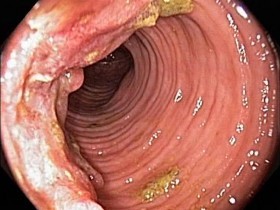
Как выглядит рак прямой кишки – фото
На фото рака прямой кишки можно заметить, что он значительно сужает просвет кишечника. Это является причиной запоров, переполненного живота, метеоризма.
На этом фото карцинома растет инфильтративно, охватывая стенку.
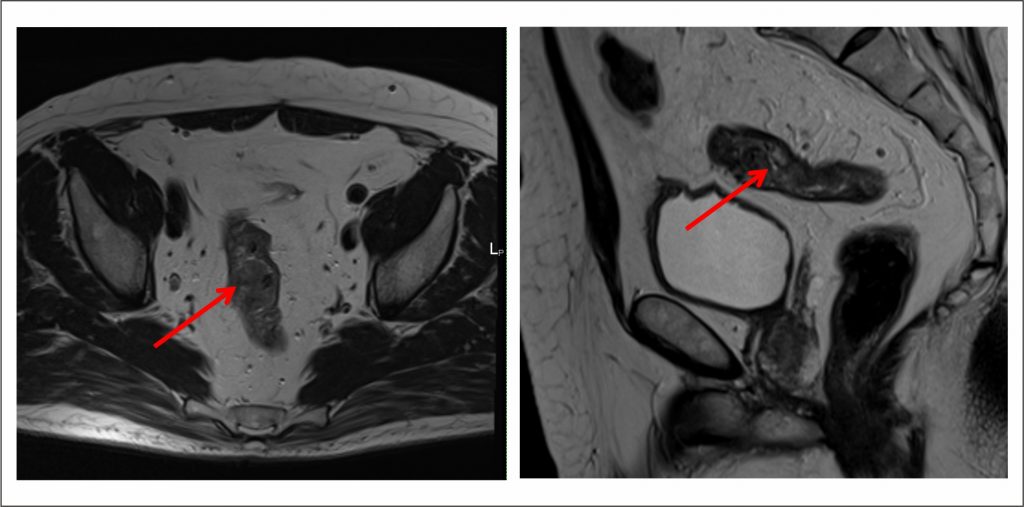
Диагностика
После обращения к врачу, определяют симптомы, которые беспокоят пациента и позволяют предположить болезнь ректального отдела.
Стадии рака прямой кишки
Течение ракового процесса при отсутствии должного лечения прогрессирует. Стадия определяется по степени поражения самого кишечника, прорастанием ее через стенку, наличием метастазов в лимфоузлах, отдаленных поражениях других органов.
В связи с этим опухоли делят на 4 стадии. Такое распределение универсально для любых злокачественных опухолей.
1 стадия – опухоль небольших размеров, растет на слизистом слое, не поражает соседние органы и лимфоузлы.
2 стадия делится на А и Б. 2А – это поражение от трети до половины окружности кишечной трубки, но растет строго в стенке или просвете, метастазов нет. 2Б – размер очага такой же, но есть метастазы в околокишечных лимфоузлах.
3А – опухоль занимает более половины окружности кишки, прорастает через все слои и околокишечную клетчатку. Могут быть единичные метастазы в ближайших лимфоузлах.
3Б – любой размер опухоли, метастазы в отдаленных лимфоузлах, принимающих лимфу от ректальной области.
4 стадия – метастазы распространяются по внутренним органам и отдаленным лимфатическим узлам. Размер первичной опухоли может быть любой.
Методы лечения рака прямой кишки
Небольшой размер опухоли и ее прорастание только через слизистый и подслизистый слой прямой кишки, не затрагивая мышечный и серозный, позволяет выполнить хирургическое удаление самой опухоли. Иногда возможно проведение операции через кишку с помощью колоноскопа.
Если она проросла в мышечный слой, то показана резекция прямой кишки или экстирпация (полное удаление органа). Также удаляется параректальная клетчатка и лимфоузлы, в которых в 20% случаев уже обнаруживаются метастазы. Для проведения операции используют два доступа – лапаротомия (рассечение брюшной стенки) и лапароскопия (операция с помощью видеооборудования через несколько проколов на животе).
Тип операции выбирается исходя из локализации опухоли. Высокое расположение позволяет провести удаление новообразования и временно вывести конец кишки на брюшную стенку – сформировать колостому для дефекации. Такая манипуляция нужна, если пока сшить между собой концы кишки невозможно. Вторым этапом через некоторое время восстанавливают целостность кишечника.
При низком расположении опухолевого процесса, если ниже ее не осталось здоровых тканей, проводят удаление пораженного участка и анального отверстия, накладывают колостому на брюшную стенку.
Прогноз выживаемости
После проведения радикальной операции выживаемость в течение 5 лет колеблется в пределах 34-68%. На исход лечения влияет стадия, на которой была диагностировна опухоль, состояние самого пациента, его возраст, сопутствующие заболевания.
В зависимости от стадии опухолевого процесса, пятилетняя выживаемость определена следующими цифрами:
4 стадия не рассматривается в данной статистике. Радикальные операции зачастую провести невозможно, т.к. метастазы опухоли диссеминрованы по всему организму. Летальный исход зависит от общего состояния больного.
Противопоказания
Операция противопоказана при следующих условиях:
При распространенном процессе с метастазированием во многие органы применяют паллиативные резекции, направленные на облегчение состояния больного. Симптоматические операции – наложение обходных анастомозов, чтобы разгрузить кишечник и избежать осложнений на последних стадиях рака.
Лечение до и после операции
Химиотерапия и лучевая терапия показаны для больных с опухолями 2 и выше стадиями.
Если до операции были выявлены метастазы в нескольких лимфоузлах, а опухоль проросла мышечный слой, то на этапе подготовки к операции проводят лучевую терапию коротким курсом в течение 5 дней. Это позволяет уничтожить ранние метастазы, уменьшить размер самого образования.
Лечение рака прямой кишки после хирургического вмешательства проводится после получения патоморфологических данных об удаленных тканях. Решается вопрос о проведении облучения или его сочетании с химиотерапией. Лучевая терапия после операции уничтожает оставшиеся клетки в зоне первичной опухоли и предупреждает ее рецидив. У неоперабельных больных она облегчает состояние.
Чувствительность к химиотерапии выявляется у 30% больных. Ее назначают с лечебной целью для уничтожения метастазов.
Также химиотерапию проводят адьювантно – для предупреждения распространения карциномы, если выявлялось поражение нескольких лимфоузлов. Этот способ терапии улучшает качество и продолжительность жизни пациентов с метастазами. Применяют препараты платины, 5-фторурацил, лейковарин, фолинат кальция. Лекарства вводятся внутривенно капельно, курсами по несколько дней. Также применяют химиотерапию в сочетании с лучевой до проведения операции при местнораспространенной форме рака. Такое комбинированное лечение проводят в течение 1-1,5 месяца, а после окончания облучения через 6 месяцев выполняют операцию.
Нейроэндокринные опухоли
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Что такое нейроэндокринные опухоли (НЭО)?
Основные локализации нейроэндокринных клеток:
щитовидная и паращитовидные железы, надпочечники.
Нейроэндокринные опухоли встречаются сравнительно редко и могут быть как злокачественными, так и доброкачественными. Чаще всего НЭО (устаревшее название – карциноиды) встречаются в следующих органах:
тонкая кишка, прямая кишка и аппендикс,
Нейроэндокринные опухоли делятся по следующим признакам:
Факторы риска появления НЭО
Чаще всего эти опухоли возникают спорадически – то есть случайно. Но есть и наследственные мутации, при наличии которых риск возникновения НЭО возрастает. Описаны несколько наследственных опухолевых синдромов, при которых повышен риск появления НЭО:
MEN 1 типа (multiple endocrine neoplasia – синдром множественных эндокринных неоплазий первого типа),
болезнь фон Гиппеля-Линдау,
Симптомы НЭО
Не всегда у пациентов с НЭО есть какие-либо симптомы. Кроме того, симптомы часто не специфичны – то есть встречаются и при других заболеваниях. На основе наличия или отсутствия симптомов НЭО принято разделять на функциональные (симптомные) и нефункциональные (бессимптомные). Функциональные опухоли усиленно вырабатывают гормоны, которые и становятся причиной появления симптомов.
Наиболее распространенные симптомы НЭО:
покраснение кожи лица и шеи,
повышенное артериальное давление,
Стадирование опухолевого процесса
Определение стадии играет ключевое значение, так как полностью определяет дальнейшее лечение. Как и при большинстве других опухолей, при НЭО принято выделять 4 стадии – от I до IV. При этом, кроме стадии, диагноз включает специальную кодировку – TNM, где:
T (tumor, опухоль) – описывает первичную опухоль,
N (nodes, лимфоузлы) – описывает распространение опухоли в лимфоузлы,
M (metastasis, метастазы) – описывает наличие или отсутствие метастазов.
Еще один параметр, описывающий нейроэндокринную опухоль – Grade. Он используется для описания способности опухоли к быстрому росту и распространению по организму и бывает 3 степеней:
G1 (low grade) – низкий темп роста и распространения,
G2 (intermediate grade) – промежуточный,
G3 (high grade) – высокий темп роста и распространения.
Обследование при подозрении НЭО
Сбор жалоб и анамнеза (истории болезни),
Анализ крови и мочи для выявления биохимических маркеров нейроэндокринной опухоли,
ПЭТ-КТ с галием (68Ga-DOTATATE и 68Ga-DOTANOC),
ПЭТ-КТ с глюкозой (ФДГ)
Сцинтиграфия с 111 In-Octreotide,
Особое место в диагностике занимает биопсия – забор фрагмента опухоли для точного определения ее типа. Биопсию возможно выполнить различными методами, например, при ФКС или ФГС. После биопсии фрагмент опухоли отправляется на гистологическое и иммуногистохимическое исследование (под микроскопом) для определения типа и агрессивности опухоли.
Какие из обследований будут использованы в Вашей ситуации будет определяться Вашим лечащим врачом. Часто при обследовании и планировании лечения необходимо получить консультацию у смежного специалиста, например, у кардиолога.
Лечение нейроэндокринных опухолей
Учитывая редкость НЭО и сложность постановки диагноза, перед началом лечения каждый пациент обсуждается мультидисциплинарной командой. В ее состав входят:
специалист лучевой диагностики,
при необходимости – дополнительные специалисты: кардиолог, анестезиолог и т.д.
В ходе разбора клинической ситуации каждого конкретного пациента вырабатывается коллегиальный индивидуальный план лечения, а при необходимости – дополнительного обследования.
Возможности лечения при НЭО:
терапия аналогами Соматостатина,
эмболизация при наличии метастазов в печени.
Часто лечение складывается из комбинации нескольких методов для достижения наиболее хорошего результата. Кроме того, бывают ситуации, когда одному пациенту подходят два варианта лечения с одинаковой эффективностью. Наилучший для Вас вариант лечения Вам расскажет лечащий врач по итогам работы мультидисциплинарной команды.
Особенности диагностики нейроэндокринных опухолей
Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
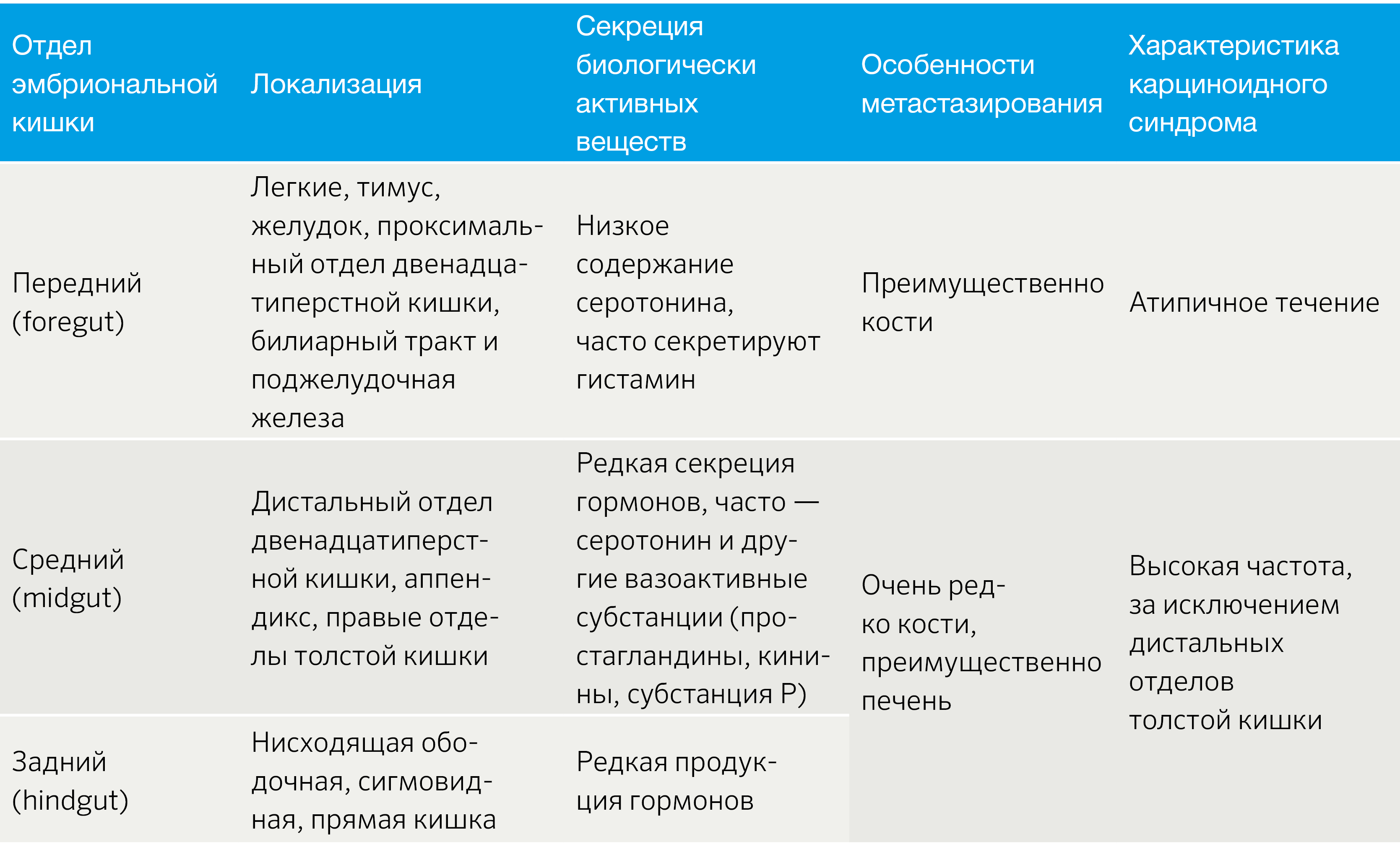
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
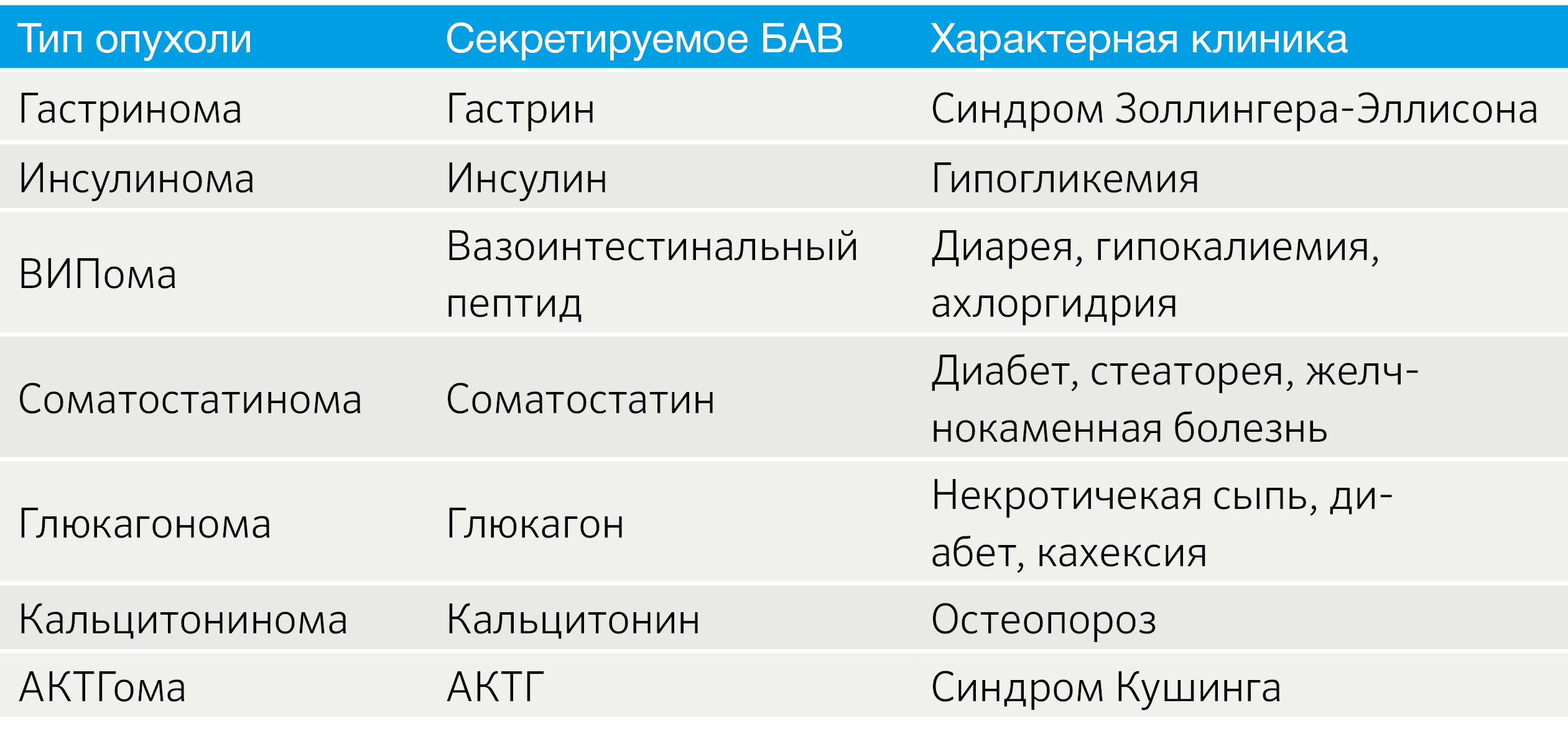
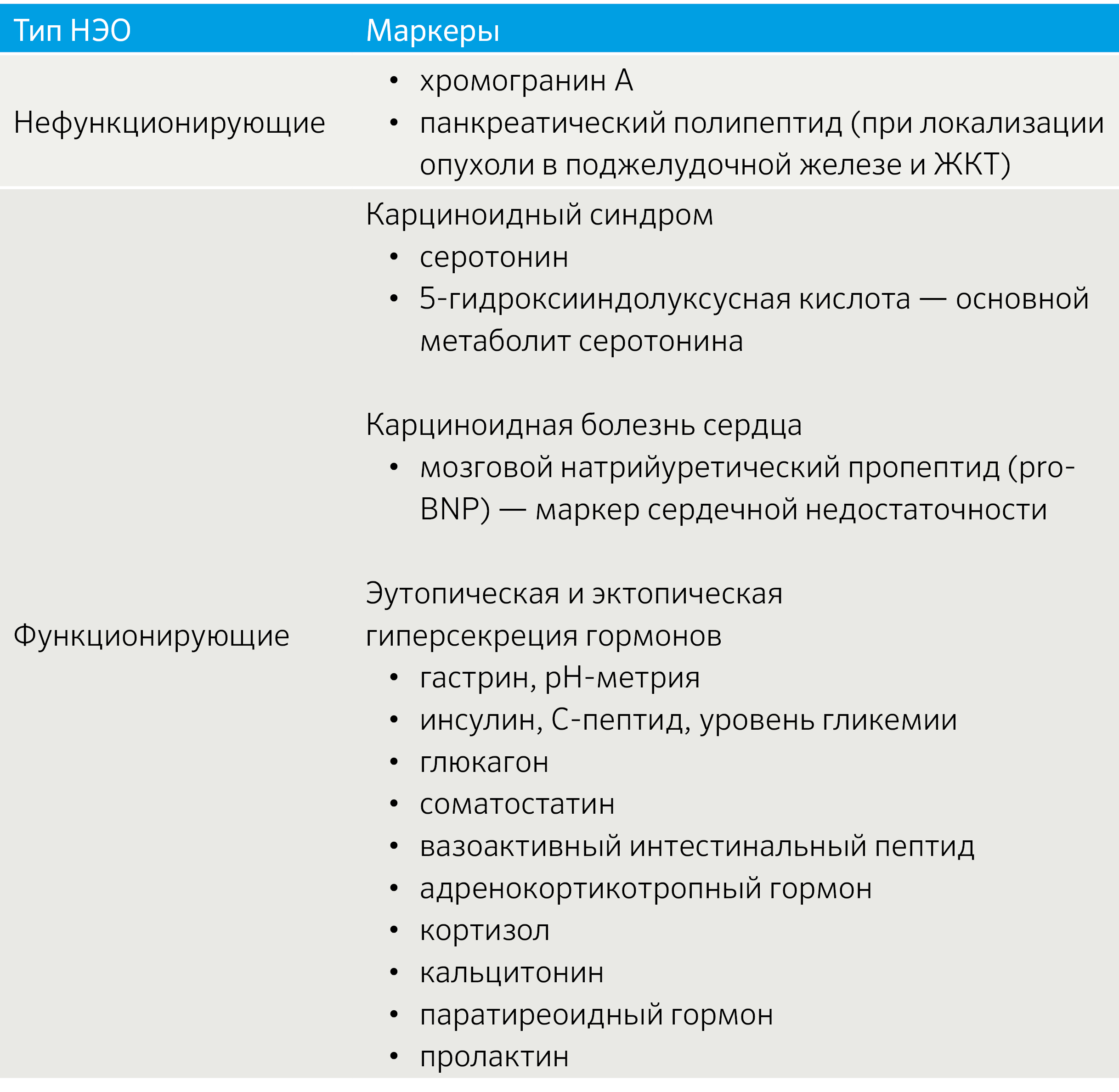
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
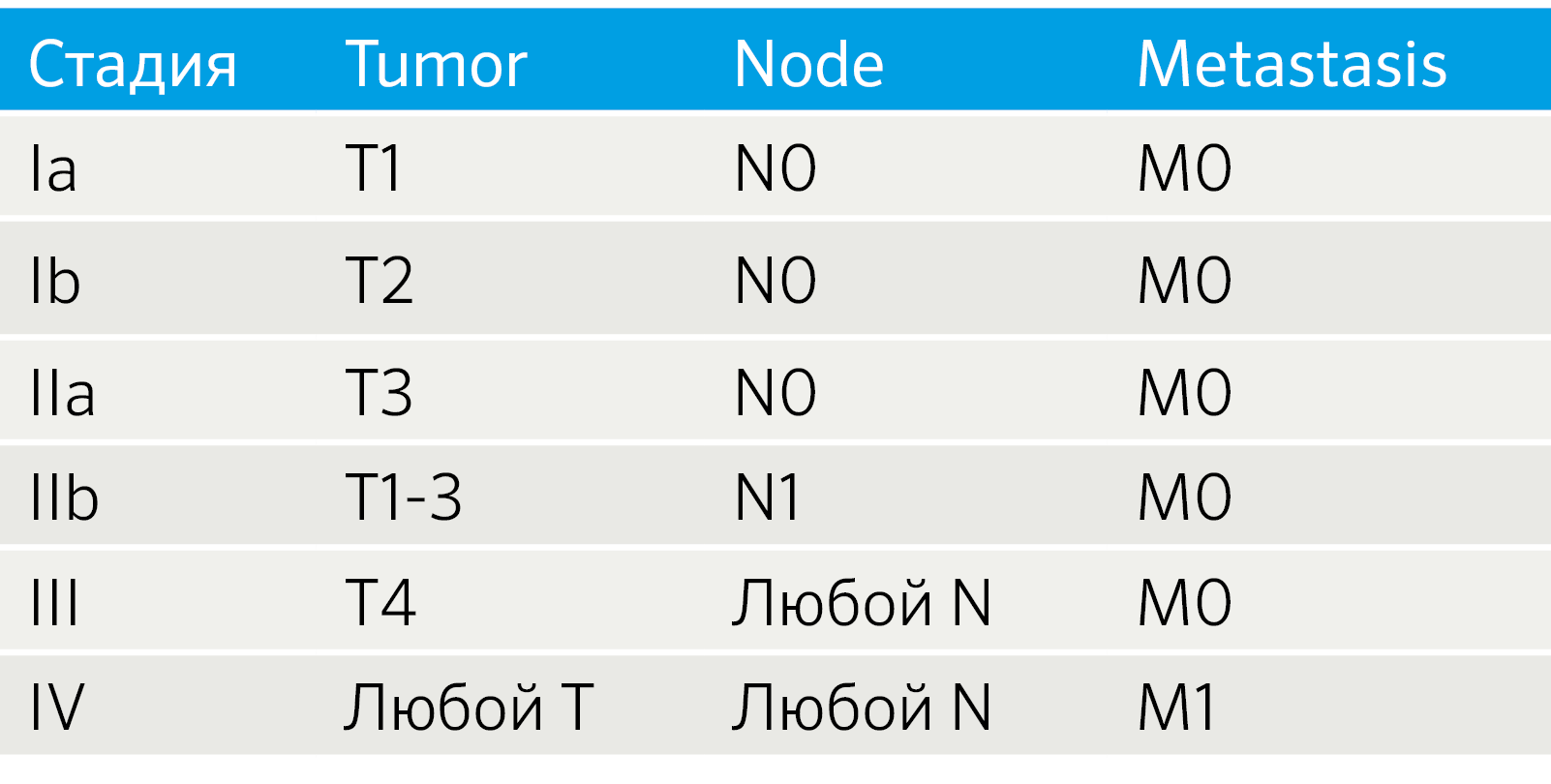
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
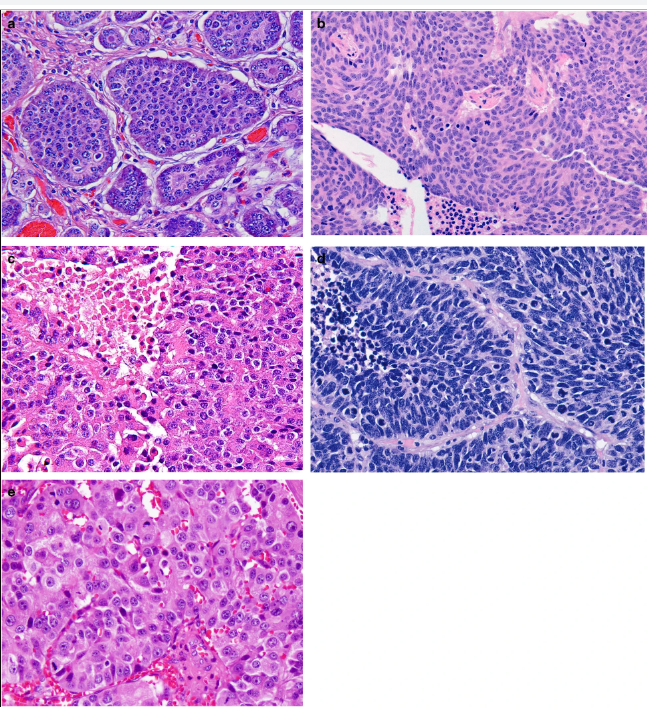
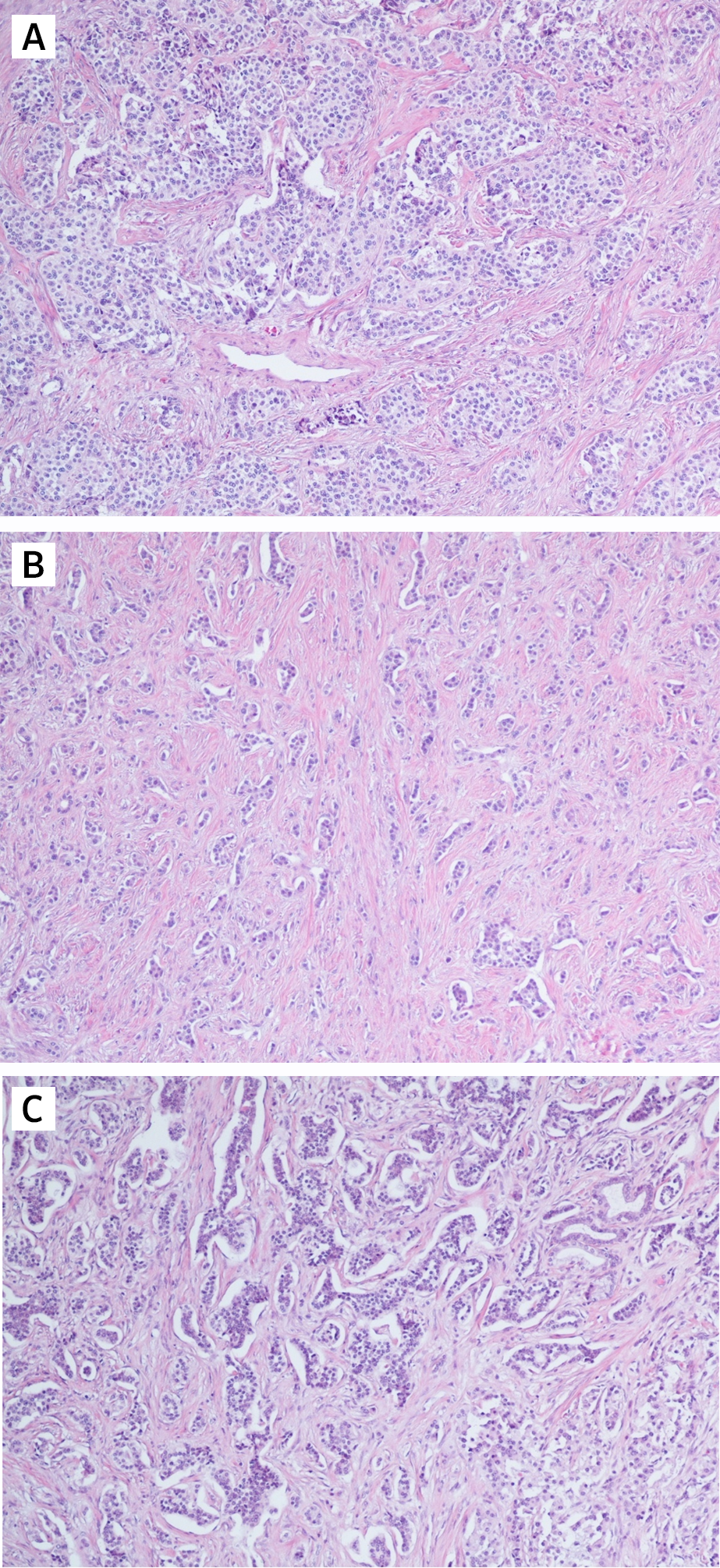
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
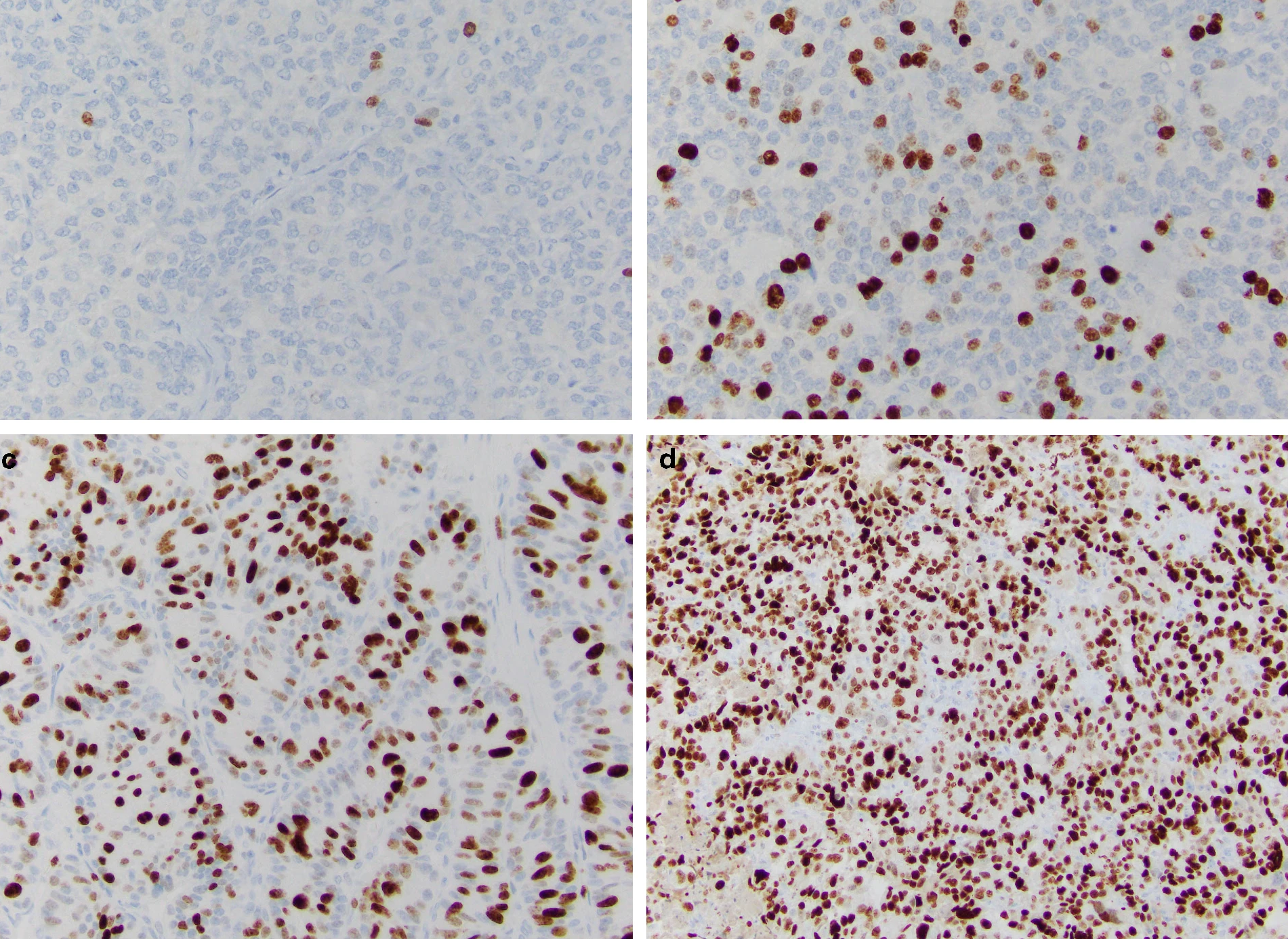
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.