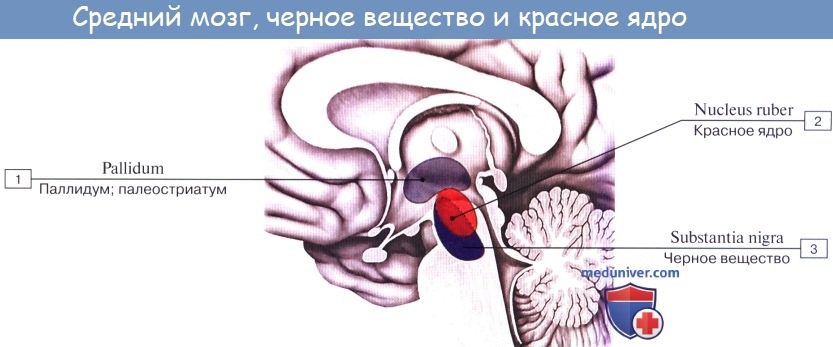
среднего мозга черная субстанция и водопровод
Среднего мозга черная субстанция и водопровод
Средний мозг, mesencephalon, развивается в процессе филогенеза под преимущественным влиянием зрительного рецептора, поэтому важнейшие его образования имеют отношение к иннервации глаза. Здесь же образовались центры слуха, которые вместе с центрами зрения в дальнейшем разрослись в виде четырех холмиков крыши среднего мозга.
С появлением у высших животных и человека коркового конца слухового и зрительного анализаторов в коре переднего мозга слуховые и зрительные центры среднего мозга сами попали в подчиненное положение и стали промежуточными, подкорковыми. С развитием у высших млекопитающих и человека переднего мозга через средний мозг стали проходить проводящие пути, связывающие кору конечного мозга со спинным (ножки мозга).
В результате в среднем мозге человека имеются:
1) подкорковые центры зрения и ядра нервов, иннервирующих мышцы глаза;
2) подкорковые слуховые центры;
3) все восходящие и нисходящие проводящие пути, связывающие кору головного мозга со спинным и идущие транзитно через средний мозг;
4) пучки белого вещества, связывающие средний мозг с другими отделами центральной нервной системы.
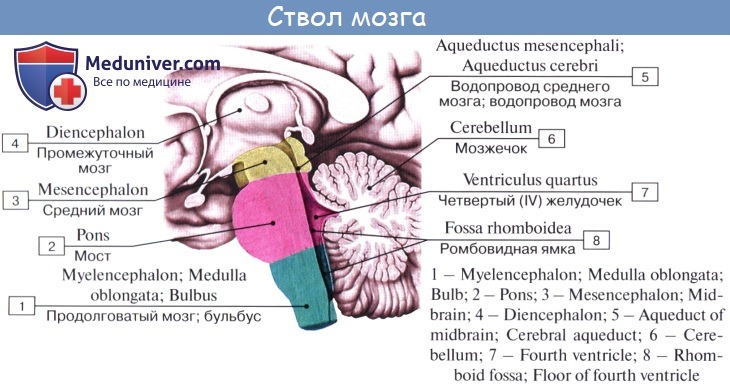
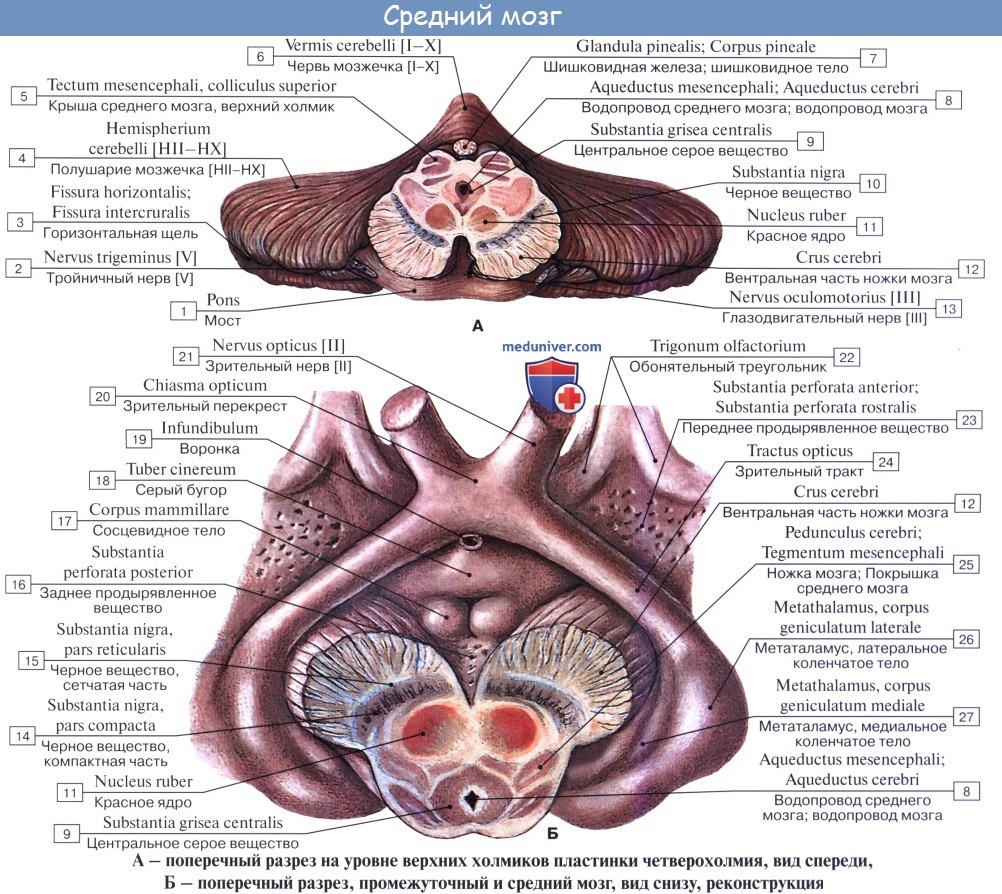
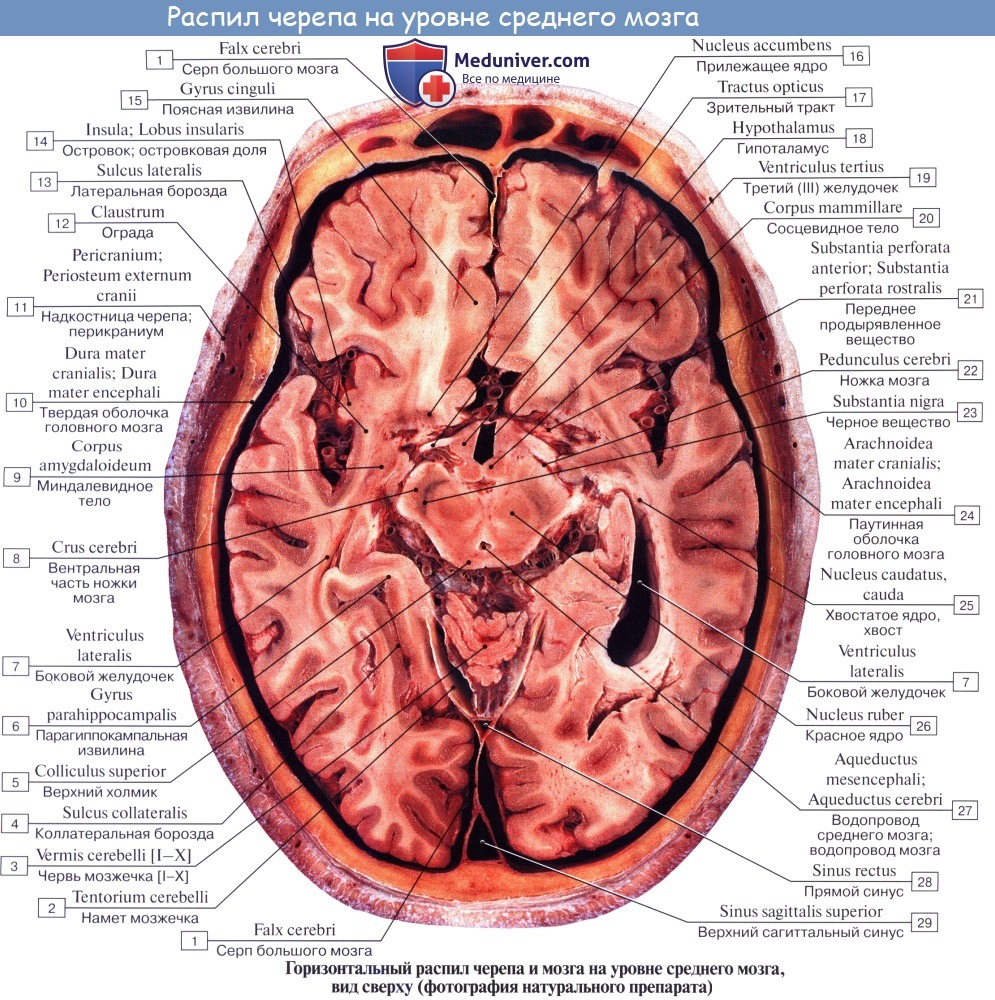
Соответственно этому средний мозг, являющийся у человека наименьшим и наиболее просто устроенным отделом головного мозга, имеет две основные части: крышу, где располагаются подкорковые центры слуха и зрения, и ножки мозга, где преимущественно проходят проводящие пути.
Дорсальная часть, крыша среднего мозга, tectum mesencephali.
Она скрыта под задним концом мозолистого тела и подразделяется посредством двух идущих крест-накрест канавок — продольной и поперечной — на четыре холмика, располагающихся попарно.
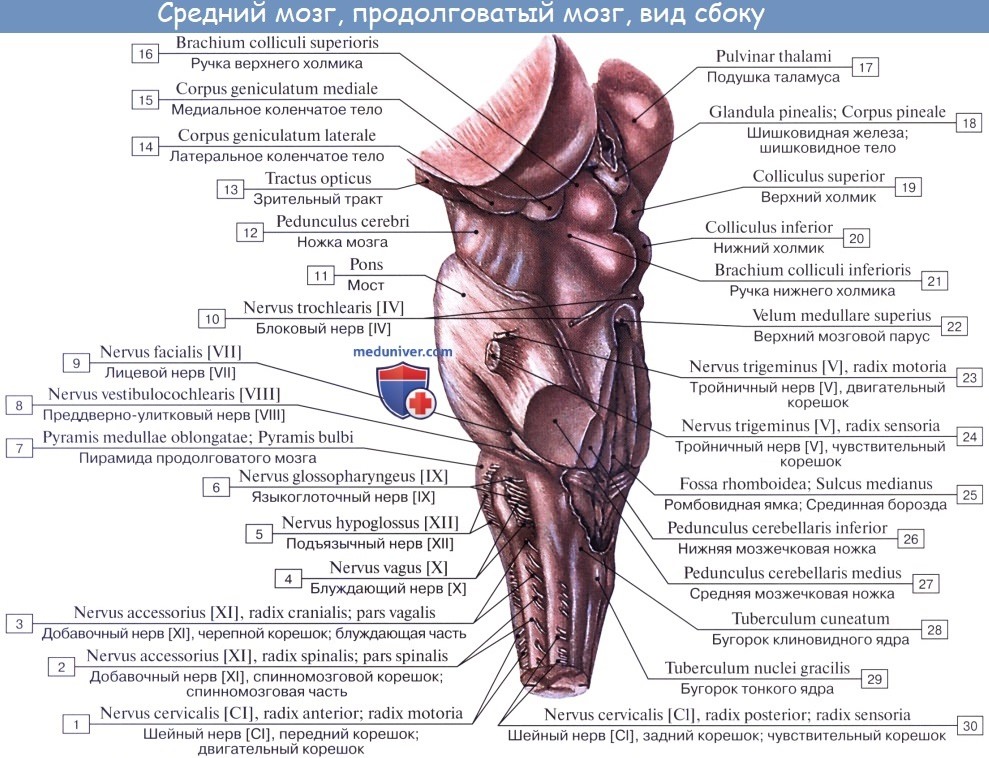
Верхние два холмика, colliculi superiores, являются подкорковыми центрами зрения, оба нижних, colliculi inferiores,— подкорковыми центрами слуха. В плоской канавке между верхними бугорками лежит шишковидное тело. Каждый холмик переходит в так называемую ручку холмика, brachium colliculi, направляющуюся латерально, кпереди и кверху, к промежуточному мозгу. Ручка верхнего холмика, brachium colliculi superioris, идет под подушкой, pulvinar, таламуса к латеральному коленчатому телу, corpus geniculatum laterale.
Ручка нижнего холмика, brachium colliculi inferioris, проходя вдоль верхнего края trigonum lemnisci до sulcus lateralis mesencephali, исчезает под медиальным коленчатым телом, corpus geniculatum mediale. Названные коленчатые тела относятся уже к промежуточному мозгу.
Вентральная часть, ножки мозга, pedunculi cerebri, содержит все проводящие пути к переднему мозгу.
Ножки мозга имеют вид двух толстых полуцилиндрических белых тяжей, которые расходятся от края моста под углом и погружаются в толщу полушарий большого мозга.
Полость среднего мозга, являющаяся остатком первичной полости среднего мозгового пузыря, имеет вид узкого канала и называется водопроводом мозга, aqueductus cerebri. Он представляет узкий, выстланный эпендимой канал 1,5 — 2,0 см длиной, соединяющий IV желудочек с III. Дорсально водопровод ограничивается крышей среднего мозга, вентрально — покрышкой ножек мозга.
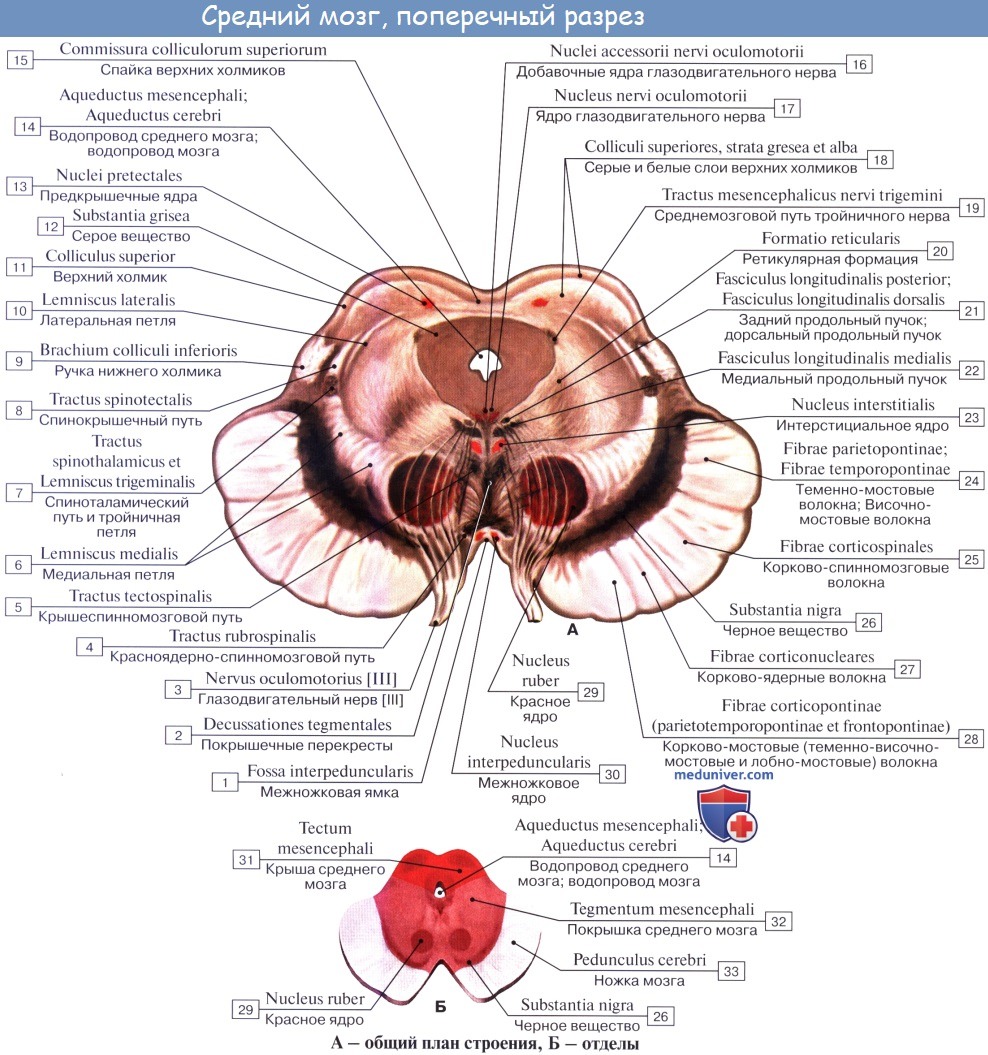
На поперечном разрезе среднего мозга различают три основные части:
1) пластинку крыши, lamina tecti;
2) покрышку, tegmentum, представляющую верхний отдел pedunculi cerebri;
3) вентральный отдел pedunculi cerebri, или основание ножки мозга, basis pedunculi cerebralis.
Соответственно развитию среднего мозга под влиянием зрительного рецептора в нем заложены различные ядра, имеющие отношение к иннервации глаза.
У низших позвоночных верхнее двухолмие служит главным местом окончания зрительного нерва и является главным зрительным центром. У млекопитающих и у человека с переносом зрительных центров в передний мозг остающаяся связь зрительного нерва с верхним холмиком имеет значение только для рефлексов. В ядре нижнего холмика, а также в медиальном коленчатом теле оканчиваются волокна слуховой петли (lemniscus lateralis). Крыша среднего мозга имеет двустороннюю связь со спинным мозгом — tractus spinotectalis и tractus tectobulbaris et tectospinalis. Последние после перекреста в покрышке идут к мышечным ядрам в продолговатом и спинном мозге. Это так называемый зрительно-звуковой рефлекторный путь, о котором говорилось при описании спинного мозга. Таким образом, пластинку крыши среднего мозга можно рассматривать как рефлекторный центр для различного рода движений, возникающих главным образом под влиянием зрительных и слуховых раздражений.
Водопровод мозга окружен центральным серым веществом, имеющим по своей функции отношение к вегетативной системе. В нем, под вентральной стенкой водопровода, в покрышке ножки мозга заложены ядра двух двигательных черепных нервов — n. oculomotorius (III пара) на уровне верхнего двухолмия и n. trochlearis (IV пара) на уровне нижнего двухолмия. Ядро глазодвигательного нерва состоит из нескольких отделов соответственно иннервации нескольких мышц глазного яблока.
Медиально и кзади от него помещается еще небольшое, тоже парное, вегетативное добавочное ядро, nucleus accessories, и непарное срединное ядро. Добавочное ядро и непарное срединное ядро иннервируют непроизвольные мышцы глаза, m. ciliaris и m. sphincter pupillae. Эта часть глазодвигательного нерва относится к парасимпатической системе. Выше (ростральнее) ядра глазодвигательного нерва в покрышке ножки мозга располагается ядро медиального продольного пучка.
Латерально от водопровода мозга находится ядро среднемозгового тракта тройничного нерва, nucleus mesencephalicus n. trigemini.
Ножки мозга делятся, как уже отмечалось, на вентральную часть, или основание ножки мозга, basis pedunculi cerebralis, и покрышку, tegmentum. Границей между ними служит черное вещество, substantia nigra, обязанное своим цветом содержащемуся в составляющих его нервных клетках черному пигменту — меланину.
Покрышка среднего мозга, tegmentum mesencephali, — часть среднего мозга, расположенная между его крышей и черным веществом (substantia nigra) ножек мозга.
От нее отходит tractus tegmentalis centralis — центральный покрышечный путь — проекционный нисходящий нервный путь, расположенный в центральной части покрышки среднего мозга. Он содержит волокна, идущие от таламуса, бледного шара, красного ядра и ретикулярной формации среднего мозга к ретикулярной формации и оливе продолговатого мозга; относится к экстрапирамидной системе.
Substantia nigra простирается на всем протяжении ножки мозга от моста до промежуточного мозга; по своей функции относится к экстрапирамидной системе.
Расположенное вентрально от substantia nigra основание ножки мозга содержит продольные нервные волокна, спускающиеся от коры полушария большого мозга ко всем нижележащим отделам центральной нервной системы (tractus corticopontmus, corticonuclearis, corticospinalis и lдр.).
Tegmentum, находящаяся дорсально от substantia nigra, содержит преимущественно восходящие волокна, в том числе медиальную и латеральную петли. В составе этих петель восходят к большому мозгу все чувствительные пути, за исключением зрительного и обонятельного.
Среди ядер серого вещества самое значительное — красное ядро, nucleus ruber. Это удлиненное колбасовидное образование простирается в покрышке ножки мозга от гипоталамуса промежуточного мозга до нижнего двухолмия, где от него начинается важный нисходящий тракт, tractus rubrospinal, соединяющий красное ядро с передними рогами спинного мозга. Пучок этот после выхода из красного ядра перекрещивается с аналогичным пучком противоположной стороны в вентральной части срединного шва — вентральный перекрест покрышки.
Nucleus ruber является весьма важным координационным центром экстрапирамидной системы, связанным с остальными ее частями. К нему проходят волокна от мозжечка в составе верхних ножек последнего после их перекреста под крышей среднего мозга, вентрально от aqueductus cerebri, а также от pallidum — самого нижнего и самого древнего из подкорковых узлов головного мозга, входящих в состав экстрапирамидной системы. Благодаря этим связям мозжечок и экстрапирамидная система через посредство красного ядра и отходящего от него tractus rubrospinal оказывают влияние на всю скелетную мускулатуру в смысле регуляции бессознательных автоматических движений.
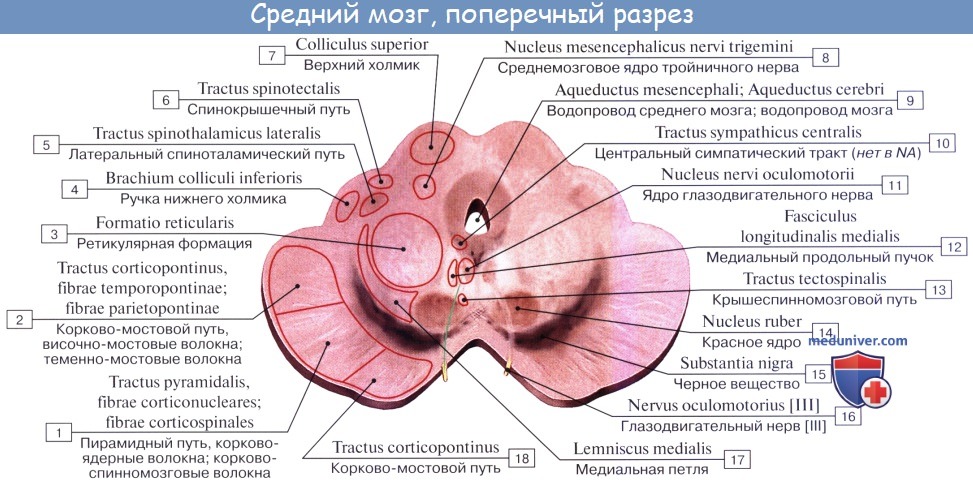
В покрышку среднего мозга продолжаются также ретикулярная формация, formatio reticularis, и fasciculus longitudindlis medialis. Последний берет начало в различных местах. Одна из его частей начинается из вестибулярных ядер, проходит на той и другой стороне по бокам средней линии, непосредственно под серым веществом дна водопровода и IV желудочка, и состоит из восходящих и нисходящих волокон, идущих к ядрам III, IV, VI и XI черепных нервов.
Медиальный продольный пучок является важным ассоциативным путем, связующим различные ядра нервов глазных мышц между собой, чем обусловливаются сочетанные движения глаз при отклонении их в ту или другую сторону. Функция его связана также с движениями глаз и головы, возникающими при раздражении аппарата равновесия.
Видео анатомия среднего мозга от А.А. Стрелкова
— Вернуться в оглавление раздела «Анатомия нервной системы.»
Транскраниальное ультразвуковое сканирование мозга при болезни Паркинсона
Опубликовано в журнале:
Визуализация в клинике »» N17, Декабрь 2000 TRANSCRANIAL ULTRASOUND SCANNING OF THE BRAIN IN PARKINSON’S DISEASE
А.О. Чечеткин
Chechetkin A.О.
Научно-исследовательский институт неврологии РАМН, Москва
Research Institute of Neurology, Russian Academy of Medical Sciences, Moscow
В обзоре дана оценка возможностей транскраниального ультразвукового сканирования (ТКУС) в выявлении структурных изменений головного мозга при болезни Паркинсона (БП). Показано, что у большинства больных БП выявляют повышение эхогенности ткани мозга в области черной субстанции (ЧС), а также расширение третьего желудочка. Однако наличие гиперэхогенного ультразвукового сигнала от области ЧС и размер его площади не являются специфическими признаками заболевания, так как схожие изменения выявлены и у лиц без клинических признаков БП. Роль ТКУС в диагностике БП остается неясной. Проведение дальнейших исследований с верификацией полученных ультразвуковых данных с помощью позитронно-эмиссионной томографии, возможно, поможет решить эту задачу.
The potentialities of transcranial ultrasound scanning (TCUS) in identification of structural changes of the brain in patients presenting with Parkinson’s disease (PD) are reviewed. It is demonstrated that the majority of PD patients show an increase of brain tissue echogenicity in the area of substantia nigra (SN) and an enlargement of the third ventricle. However, the presence of the hyperechogenic ultrasound signal from the SN region and the size of its area are not specific signs of the disease because the similar changes were also revealed in persons without the clinical evidence of PD. The role of TCUS in the diagnosis of PD remains unclear. Further studies including verification of the ultrasound data by positron emission tomography are likely to be of help in solving this problem. («Визуализация в клинике». 2000, 17. 45-48)
Ключевые слова: болезнь Паркинсона, транскраниальное ультразвуковое сканирование, черная субстанция.
Key words: Parkinson’s disease, transcranial ultrasound scanning, substantia nigra.
Диагностика болезни Паркинсона (БП) может представлять определенные трудности, особенно в дебюте заболевания. Для ее распознавания из визуализирующих методов исследования используют магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ). МРТ головного мозга позволяет выявлять только неспецифические и едва уловимые изменения [4, 11, 18, 24]. Более точные сведения о нигростриарной системе позволяет получать ПЭТ, которая способствует ранней диагностике БП даже в доклинической стадии [9, 13, 15, 17, 19, 21]. Однако понятно, что такой дорогостоящий вид исследования не может быть использован как рутинный диагностический метод.
В последние годы возросла роль транскраниального ультразвукового дуплексного сканирования в диагностике церебральных заболеваний, которое позволяет визуализировать сосудистую систему и вещество головного мозга. Данные об использовании транскраниального ультразвукового сканирования (ТКУС) вещества мозга у больных БП немногочисленны и неоднозначны.
В 1995 г. Becker G. et аl. [5] впервые выполнили ТКУС мозга у больных БП. Поскольку этот метод позволяет визуализировать ткани головного мозга в зависимости от их эхогенности, авторы поставили перед собой задачу выяснить, можно ли с его помощью выявлять структурные изменения мозга при БП. Для этого они оценивали состояние области предполагаемого анатомического расположения черной субстанции (ЧС) на уровне ножек среднего мозга, проводя исследование через височное ультразвуковое окно. Авторы считали, что в норме ультразвуковой сигнал от ЧС идентичен эхогенности прилежащей ткани мозга.
При исследовании 30 больных БП и 30 лиц без клинических проявлений этого заболевания они получили следующие данные: у 17 больных и у 2 лиц контрольной группы было выявлено гомогенное повышение эхогенности ткани мозга в области ЧС. Следует отметить, что у 5 больных и двух лиц контрольной группы эти изменения определялись с трудом. Анализ полученных данных показал, что у больных с четкой гиперэхогенной зоной в области ЧС (12 пациентов, т.е. 40% от числа всех больных) клиническая симптоматика была более выражена, а доза антипаркинсонических препаратов оказалась выше, чем у больных с изоэхогенной ЧС (18 больных). Авторы предположили, что повышение эхогенности в области ЧС, по-видимому, обусловлено относительным увеличением глиальных клеток в сочетании с микроструктурными изменениями клеточной архитектоники, о чем сообщали Bogerts В. et аl. [8].
Сопоставление длительности заболевания с наличием выявленной зоны повышенной эхогенности в области ЧС дало противоречивые результаты. Becker G. et аl. [5] обнаружили гиперэхогенную зону в области ЧС примерно у половины больных БП и только при длительном течении заболевания (в среднем 14,6+/-4,5 лет), когда клинический диагноз уже не вызывал сомнения; в то же время у больных с изоэхогенной ЧС продолжительность заболевания составляла в среднем 6,5+/-4,2 года. В. Лелюк с соавт. [1, 16] наблюдали такие изменения абсолютно у всех больных независимо от длительности заболевания с момента появления первых симптомов.
Результаты измерения третьего желудочка свидетельствуют о его расширении у больных БП по сравнению с соответствующими данными в контрольных группах. Так, в работе Becker G. et аl. [5] и В. Лелюка с соавт. [1] размеры третьего желудочка у больных БП составляли в среднем 8,6+/-2,3 мм и 6,3+/-1,2 мм против 7,4+/-2,2 мм и 2,6+/-1,2 мм в контрольных группах соответственно. Авторы объясняют это атрофическими изменениями головного мозга у больных БП, описанными Schneider Е. et аl. [20].
Как указывалось выше, Becker G. et аl. [5] обнаружили гиперэхогенный сигнал у 2 лиц контрольной группы. Эти находки навели Berg D. et аl. [6] на мысль о проведении скринингового исследования эхогенности в области предполагаемого анатомического расположения ЧС у лиц без клинических проявлений БП. Они исследовали 301 человека (146 мужчин и 155 женщин) в возрасте до 79 лет (средний возраст около 30 лет). В число исследованных вошли здоровые добровольцы (студенты и сотрудники госпиталя), а также пациенты, страдающие грыжами межпозвоночного диска и невоспалительной миопатией. Поскольку сигнал эхогенности (яркости) в В-режиме не является количественным параметром, котур видимых гиперэхогенных изменений в области ЧС обводили, а затем определяли полученную площадь. Исследования выполнялись двумя независимыми специалистами. Полученные ими данные о зоне повышенной эхогенности в области ЧС суммировали, определяли средние значения и использовали их для дальнейшего анализа. В среднем площадь гиперэхогенного сигнала с одной или с обеих сторон у исследованных лиц составляла 0,11 см2 при этом наблюдалась четкая закономерность повышения полученных значений с возрастом. Была выделена группа из 26 человек (16 мужчин и 10 женщин) с более широкой зоной гиперэхогенного сигнала, площадь которой с одной или с обеих сторон превышала 0,25 см2. Численность этой группы составила 8,6% от числа включенных в исследование лиц. Площадь гиперэхогеиного сигнала справа и слева была равна у них в среднем 0,32 см2. Для более детального исследования отобрали по 10 человек, сопоставимых по полу и возрасту, из обследованных с площадью гиперэхогенного сигнала менее 0,2 см2 (первая группа) и из пациентов с площадью, превышающей 0,25 см2 (вторая группа). У них было проведено исследование двигательных функций (использование доски со штифтами и серия тестов с применением печатной машинки), когнитивных функций (стандартизированный психометрический тест) и МРТ. ПЭТ выполнили только у лиц второй группы, и для сравнения полученных данных отобрали 10 человек из числа ранее обследованных в клинике больных без БП, которым вводили [18F]-dopa. Были получены следующие результаты: 1) тесты по оценке двигательных функций не показали статистически значимых различий между двумя группами; 2) при оценке когнитивных функций выявлены значительные различия только в плавности речи, которая была хуже во второй группе; 3) относительные интенсивности сигналов от ЧС при МРТ были повышены у лиц второй группы; 4) обнаруженные при ПЭТ соотношения активности внутривенно введенной [18F]-dopa в базальных ганглиях во второй группе были значительно ниже, чем в группе лиц, взятых для сравнения. Несмотря на полученную корреляцию данных ультразвукового исследования, МРТ и ПЭТ, природа гиперэхогенного сигнала от области ЧС осталась для авторов неясной. Ими высказано предположение, что у лиц второй группы нигростриарная система более уязвима по отношению к различным патогенетическим факторам (экзо- и эндотоксинам), под воздействием которых может произойти нейрональная дегенерация ЧС, о чем сообщали другие авторы [14, 23]. На наш взгляд, это высказывание является гипотетическим, так как подтвердить происходящие изменения в области ЧС могут только патоморфологические, гистохимические и электронно-микроскопические исследования.
Любопытные результаты получены при сопоставлении площади гиперэхогенной зоны в области ЧС у больных БП и у лиц без клинических симптомов этого заболевания. Так, в работе В. Лелюка с соавт. [1] у больных БП она была практически равна площади гиперэхогенной зоны той же области у лиц без клинических признаков БП, найденной Berg D. et аl. [6], и составляла примерно 0,32 см2. Эти находки позволяют считать, что получение сигнала повышенной эхогенности и размер его площади не являются специфическими признаками БП.
В работе Berg D. et аl. [6] показано, что гиперэхогенный сигнал площадью более 0,25 см2 в области ЧС встречался у 8,6% от общего числа исследованных. Однако эти результаты существенно превышают данные о частоте встречаемости БП в популяции, которая, по данным Golbe L. [12], составляет 0,1%, а по данным других авторов [2], колеблется от 60 до 140 случаев на 100000 населения, что составляет соответственно 0,06 и 0,14%.
Исходя из изложенного выше, можно отметить, что у больных БП методом ТКУС в большинстве случаев выявляются повышение эхогенности ткани мозга в области предполагаемого анатомического расположения ЧС и расширение третьего желудочка по сравнению с контрольной группой. Однако данные о частоте обнаруженных изменений в области ЧС у больных БП, а также о связи между длительностью заболевания и их наличием противоречивы. Кроме того, в работах, где больным БП было проведено ТКУС, для верификации полученных данных не была произведена ПЭТ, которая, в отличие от МРТ, в настоящий момент является наиболее информативной методикой в диагностике этого заболевания.
Наличие зоны повышенной эхогенности в области ЧС при ТКУС не является специфическим признаком для БП, поскольку она обнаруживается не у всех больных БП и такие же изменения находят и у лиц без клинических проявлений этого заболевания. Размер площади гиперэхогенного ультразвукового сигнала также не может служить диагностическим критерием, так как у больных БП, как показано выше, он был практически идентичен размеру исследуемой зоны у лиц без БП.
Следует отметить, что визуализация структур головного мозга при ультразвуковом исследовании в В-режиме в значительной степени зависит от ультразвукового окна, а оценка видимых изменений весьма субъективна (особенно в отношении измеряемой площади), так как сигнал эхогенности (яркости) не является количественным параметром.
Таким образом, роль ТКУС в диагностике БП остается неясной. Проведение дальнейших исследований с верификацией полученных ультразвуковых данных с помощью ПЭТ, возможно, поможет решить эту задачу.
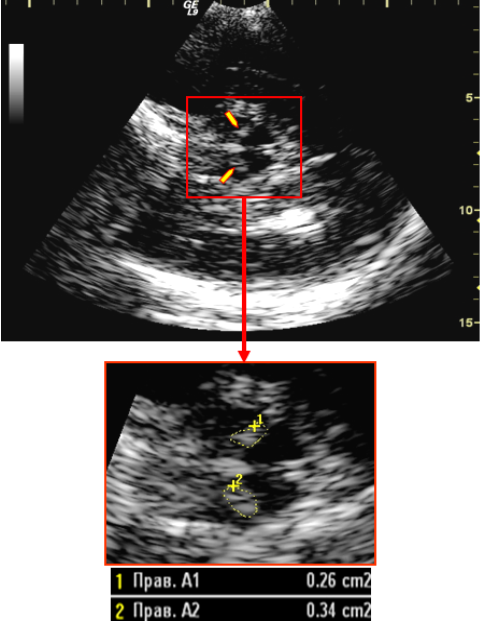
Транскраниальная сонография черной субстанции (уникальная методика)
Черной субстанцией называется область среднего мозга, отвечающая за регуляцию движений. Наш центр одним из первых в РФ внедрил методику оценки изменения эхогенности ультразвукового сигнала от чёрной субстанции у пациентов с экстрапирамидными заболеваниями и, в частности, при болезни Паркинсона. Выявляемый феномен «гиперэхогенности» ножек среднего мозга является общепризнанным в мире биомаркером, характерным для болезни Паркинсона, который помогает неврологу поставить диагноз. Необходимо понимать, что данный признак не является 100% для болезни Паркинсона, поэтому окончательное заключение делает врач на основании всей информации о пациенте. Накопленный многолетний опыт (около 20 лет) изложен в уникальной монографии «Транскраниальная сонография при экстрапирамидных заболеваниях» и учебном пособии «Ультразвуковое исследование структур головного мозга при экстрапирамидной патологии».
*Показания к проведению исследования определяются неврологом!
Что исследуется?
Оценивается эхогенность сигнала от черной субстанции, размеры третьего и боковых желудочков головного мозга.
Подготовка
Специальной подготовки не требуется.
Обращаем внимание, что у 10-20% людей, особенно у лиц пожилого возраста, исследование провести невозможно из-за отсутствия ультразвуковых окон, поэтому сначала проводится исследование, а затем осуществляется оплата.
Среднего мозга черная субстанция и водопровод
Ствол мозга — отдел центральной нервной системы, состоящий из продолговатого мозга, моста, среднего мозга, промежуточного мозга и мозжечка. В стволе мозга сосредоточены ядра и проводящие пути, обеспечивающие жизнедеятельность организма, в частности дыхательный и сосудодвигательный центры, а также ретикулярная формация. Серое и белое вещество ствола мозга обладает комплексной структурой, анатомически тесно переплетенной, что делает его топографию сложной для интерпретации при нейровизуализации.
Специалисты НИИДИ ФМБА России и ФГБУ ФНКЦ ФМБА России опубликовали обзор, целью которого стало раскрытие современных представлений об МРТ головного мозга как инструменте дифференциальной диагностики при поражении ствола мозга.
Поражение ствола мозга при острых нарушениях мозгового кровообращения у детей
Дисметаболические нарушения у детей с поражением ствола мозга
Митохондриальные заболевания включают широкий спектр клинических синдромов, связанных с дефицитом окислительного фосфорилирования, вызываемым частичным или полным дефицитом одного или более ферментов дыхательной цепи. Наследование может быть аутосомно-рецессивным, аутосомно-доминантным, Х-сцепленным. Дефект митохондриальной дыхательной цепи может быть вызван генетическими мутациями ядерной или митохондриальной ДНК. Метаболическая уязвимость является важной составляющей поражения ствола мозга при этих заболеваниях. Клинически данные заболевания проявляются мультисистемным поражением, постановка диагноза затруднена вследствие широкой генетической и фенотипической гетерогенности.
При МРТ ствола мозга регистрируются симметричные, иногда билатеральные очаги. Наиболее часто поражаются черная субстанция, в особенности ее ретикулярная часть, покрышка моста и среднего мозга, нижние бугры четверохолмия. Билатеральная гипертрофическая дегенерация ядер олив была описана в 40% случаев у пациентов с заболеваниями обмена веществ, что заставляет предположить, что нижние ядра олив поражаются при синдроме Лея как из-за первичной метаболической уязвимости, так и от вторичной транссинаптической нейрональной дегенерации. При синдроме Лея поражение ствола может также сопровождаться билатеральными и симметричными очагами в базальных ядрах и диффузной супратенториальной лейкоэнцефалопатией. При синдроме Лея описывается также поражение мозжечка с формированием отека с петехиальным компонентом, что позволяет предполагать наличие микроангиопатии. Гибель клеток Пуркинье и мозжечковая атрофия при синдроме Лея возникает, как предполагается, вследствие эксайтотоксичности.
Описано мультисистемное митохондриальное заболевание, специфически поражающее проводящие пути белого вещества, которое называется лейкоэнцефалопатией с поражением ствола головного мозга, спинного мозга и повышенным накоплением лактата (LBSL). Данное состояние ассоциировано с различными генетическими отклонениями, в частности с мутациями гена DARS2. При этом синдроме описано билатеральное симметричное поражение белого вещества медиальной петли, тригеминальной петли, пирамидных трактов, задних канатиков спинного мозга, верхних и нижних ножек мозжечка, белого вещества мозжечка; при МР-спектроскопии выявляется увеличение уровня лактата.
У 20–30% младенцев с эпилепсией, получавших вигабатрин, описаны преходящие билатеральные симметричные Т2-гиперинтенсивные очаги в области покрышки, бледного шара и таламуса. Причины развития данного поражения неясны, однако известно, что наиболее выраженные МРТ-изменения регистрируются через 3–6 мес. от начала лечения.
Стволовой энцефалит у детей
Наиболее часто стволовой энцефалит вызывается энтеровирусами 71-го типа, листериями, вирусом простого герпеса. МРТ-находки при этой патологии неспецифичны. Очаги обычно множественные, асимметричные, Т2-гиперинтенсивные и не всегда накапливающие контрастное вещество в режиме Т1.
При некоторых вирусных энцефалитах регистрируется селективная уязвимость черной субстанции. Формирование абсцесса с кольцевым усилением сигнала после введения контрастного вещества наблюдается при поражении всех уровней ствола мозга, при инфекции. При туберкулезе регистрируется милиарный паттерн. Для обеих этих форм стволового энцефалита характерно формирование абсцессов, которые обычно расположены в мосту и выглядят как очаги с легкой Т2-гиперинтенсивностью сигнала вследствие формирования вазогенного отека. Центральная часть этих очагов может выглядеть изо- или гиперинтенсивной в Т2-режиме. В случае формирования туберкуломы сигнал от центральной части очага — Т2-гипоинтенсивный. Поражение ствола при энцефалите может быть ассоциированным с супратенториальными нарушениями, в некоторых случаях со специфическими симметричными билатеральными очагами в области базальных ядер.
Существует «только стволовой энцефалит», известный также как энцефалит Бикерстаффа, который имеет воспалительную неинфекционную природу и в большинстве случаев аутоиммунную этиологию. После того как была продемонстрирована патогенетическая роль антиганглиозидных антител, пациенты, у которых клинически наблюдался широкий спектр симптомов — от офтальмоплегии и атаксии до нарушения сознания и арефлексии, и которые ранее описывались как случаи симптома Миллера–Фишера, синдрома Гийена–Барре или энцефалита Бикерстаффа, стали расцениваться как больные синдромом анти-GQ1B антител.
Острый диссеминированный энцефаломиелит в большинстве случаев — монофазное и мультифокальное воспалительное заболевание. Стволовые очаги по данным МРТ невозможно дифференцировать от таковых при рассеянном склерозе, однако у таких пациентов чаще выявляются повреждения на уровне среднего мозга, кроме того, они более симметричны, билатеральны, чем при рассеянном склерозе. Билатеральное симметричное вовлечение мозжечка, базальных ядер, таламуса и относительная сохранность мозолистого тела подтверждают диагноз острого диссеминированного энцефаломиелита.
Кроме того, при повторных МРТ в периоде реконвалесценции очаги при остром диссеминированном энцефаломиелите уменьшаются в количестве, размерах, а также наблюдается ослабление интенсивности в режиме Т2. При рассеянном склерозе часто происходит вовлечение ствола мозга. Очаги чаще расположены на дне 4-го желудочка, в периферических частях ствола, в особенности в мосту. Субтенториальное расположение очагов считается специфичным для рассеянного склероза. Рассеянный склероз у детей наблюдается редко, тем не менее в дебюте заболевания вовлечение ствола и мозжечка, особенно у мальчиков, встречается чаще, чем у пациентов с дебютом в молодом возрасте.
Нейродегенеративные заболевания у детей
Дефицит кофактора молибдена является редким аутосомно-рецессивным нейродегенеративным заболеванием. Возможно, данная патология является не столько редкой, сколько трудно диагностируемой. При данном поражении развивается энцефалопатия с ранним дебютом или с поздним дебютом в атипичных случаях в виде общей задержки развития. Структурная МРТ и диффузионно-взвешенная МР-картина напоминает таковую при диффузном гипоксически-ишемическом поражении.
Гипертрофическая дегенерация ядер оливы считается специфической формой транссинаптической гипертрофической дегенерации и развивается вследствие неспецифического повреждения денто-рубро-оливарного пути. Хотя это состояние у детей считается редким, сообщается о его превалировании у пациентов с метаболическими заболеваниями, а также после операции по поводу опухолей задней черепной ямки. На МРТ выявляются Т2-гиперинтенсивные очаги, часто с билатеральным и симметричным увеличением оливарных ядер. Они начинают появляться в течение месяца после острого события и в течение 3–4 лет имеют тенденцию к разрешению.
Опухоли ствола мозга у детей МРТ
признаками глиомы ствола мозга являются Т2-гиперинтенсивные очаги с масс-эффектом, окружающие цистерны, 4-й желудочек, сильвиев водопровод и/или мозжечок. Чаще всего у детей развиваются отличающиеся по анатомии и клиническому течению 3 группы глиом ствола — это диффузная внутренняя понтинная глиома, экзофитическая среднемозговая глиома и тектальная глиома. Первый вариант имеет наихудший прогноз выживаемости. На МРТ отличительными особенностями являются перифокальный отек, отсутствие накопления контраста и масс-эффекта. Чаще всего возникает в возрасте 5–10 лет с развитием клинической триады — атаксии, поражения черепно-мозговых нервов и длинных трактов. В типичном случае поражение тотальное или субтотальное, чаще всего в мосту.
Опухоли ствола у детей также могут развиваться при неврофиброматозе 1-го типа. Чаще всего возникает астроцитома, которая растет менее агрессивно, чем у детей без неврофиброматоза. У таких пациентов выявляются яркие Т2-гиперинтенсивные очаги, которые остаются стабильными и иногда исчезают у пациентов старше 12 лет. Интракраниальное поражение ствола мозга может развиваться при гистиоцитозе клеток Лангерганса. Это редкое гранулематозное заболевание системы моноцит-макрофаг. Типичные клинические проявления при этом — литические очаги краниофациального скелета, вовлечение гипоталамически-питуитарной области, несахарный диабет. Интракраниально выявляются симметричные Т2-гиперинтенсивные очаги нейродегенерации и реже регистрируются массивные туморозные очаги.
Таким образом, поражение ствола мозга, изолированное или связанное с супратенториальными изменениями, возникает при широком спектре патологических состояний. Для целей дифференциальной диагностики основополагающее значение играют клинические, эпидемиологические и лабораторные исследования.
Н.В. Марченко, В.Б. Войтенков, Н.В. Скрипченко, М.А. Бедова, О.О. Курзанцева Выпуск №1/2020