сколько можно прожить с метастазами в мозге
Выявление и лечение метастатических новообразований головного мозга
Метастазы в головном мозге образуются при распространении атипичных клеток из других органов: молочных желез, яичников, лёгких, кожи. Они возникают в четвёртой стадии опухолевого процесса. Метастазы в головном мозге выявляют у каждого четвёртого онкологического больного. В частности, при раке лёгких метастатические опухоли выявляют в 70% случаев, молочной железы – 30%, кишечника –3%, меланоме – 7%. Симптоматическую терапию при наличии метастазов рака в головной мозг проводят врачи клиники онкологии Юсуповской больницы. Паллиативную помощь больным оказывают медицинские работники хосписа.
Рентгенологи, врачи функциональной диагностики проводят обследование пациентов с помощью новейших аппаратов с высокой разрешающей способностью. Они позволяют выявить мельчайшие метастазы злокачественной опухоли в головном мозге. Лаборанты используют качественные реагенты, благодаря которым врачи получают точные результаты анализов. Сложные обследования пациенты клиники онкологии имеют пройти в клиниках-партнёрах Юсуповской больницы.
Причины
Гистологическое строение метастатического очага схоже со структурой первичного новообразования. В группу повышенного риска образования метастазов головного мозга входят онкологические больные старше 50 лет, женщины, страдающие раком молочных желез, мужчины с диагнозом «рак лёгких».
Симптомы и диагностика метастазов головного мозга
Также в арсенал методов, позволяющих врачам Юсуповской больницы выявить метастазы в рака в головной мозг, входит ангиография, позитронно-эмиссионная томография, стереотаксическая биопсия. Полученные результаты данных диагностических исследований позволяют врачам Юсуповской больницы подобрать максимально эффективную тактику лечения, которая поможет облегчить состояние больного и продлить срок его жизни.
Лечение метастазов головного мозга
Пациентам, у которых выявлены метастазы раковой опухоли в головном мозге, онкологи предлагают паллиативную терапию. Она направлена на продление и улучшение качества жизни пациента. Медикаментозное лечение глюкокортикоидами ослабляет выраженность симптомов метастазов в головном мозге. При проведении терапии кортикостероидными гормонами общее самочувствие пациента значительно улучшается в течение суток с момента начала приёма препарата и сохраняется стабильным до окончания лечения.
При возникновении приступов эпилепсии пациентам проводят противосудорожную терапию. Головную боль уменьшают неопиоидными и опиоидными анальгетиками, нестероидными противовоспалительными препаратами. При повышении внутричерепного давления вследствие нарушения тока спинномозговой жидкости назначают мочегонные препараты.
Основной метод лечения метастазов головного мозга – лучевая терапии. Курс облучения состоит из 10-15 сеансов. Стандартная доза облучения – 30 Гр. В отдельных случаях проводят химиотерапию противоопухолевыми препаратами. Благодаря сотрудничеству Юсуповской больницы с ведущими научно-исследовательскими институтами онкологии пациенты клиники имеют уникальную возможность получать терапию эффективнейшими химиотерапевтическими препаратами, которые находятся на конечном этапе клинических исследований.
Нейрохирургическое вмешательство выполняют пациентам, у которых выявлены резектабельные единичные новообразования в головном мозге. Эту сложную операцию проводят с использованием инновационной системы нейронавигации. При наличии показаний используют флуоресцентную навигацию – метод, который позволяет отличить область, поражённую опухолью, от здоровых структур головного мозга.
При обнаружении единичных метастазов рака в головной мозг выполняют операцию с помощью кибер ножа. Это малотравматичный метод. Он эффективен, если размер опухоли не превышает шести сантиметров, а количество метастатических очагов не более шести.
Прогноз и профилактика
При отсутствии адекватной терапии продолжительность жизни больных с метастазами раковой опухоли в головной мозг не превышает одного месяца. Кортикостероидная терапия продлевает жизнь на два-три месяца. С помощью лучевой терапии срок жизни больных увеличивается до шести месяцев. Онкологи Юсуповской больницы применяют инновационные методики лечения онкологических больных с помощью ультрасовременного медицинского оборудования. Это позволяет продлить жизнь пациентов на несколько лет.
Единственный действенный метод профилактики метастазов рака в головной мозг – своевременная диагностик и адекватная терапия первичных опухолей. Чтобы сохранить жизнь, при появлении ранних признаков опухолевого процесса обращайтесь в клинику онкологии Юсуповской больницы. Записывайтесь на приём к онкологу онлайн или звоните по телефону контакт-центра в любое время дня и ночи независимо от дня недели.
Сколько живут с раком 4 стадии?
UPD 10.02.2021
Вопрос о том, сколько живут с раком 4 стадии с метастазами или еще более конкретный: «Маме (тете, бабушке…) поставили IV стадию, сколько ей осталось?», регулярно задают врачам-онкологам родственники пациентов. Не услышав однозначного ответа, вопрошающие, как правило, начинают сетовать на врачей.
Почему на вопрос о том сколько живут больные раком IV стадии нет и не может быть четкого ответа? От чего зависит продолжительность жизни пациента с этой самой поздней стадией онкологического заболевания? Этот вопрос мы задали врачу высшей категории, заведующей научным отделом инновационных методов терапевтической онкологии и реабилитации НИИ онкологии им. Н.Н. Петрова, доктору медицинских наук Семиглазовой Татьяне Юрьевне.
Клетки рака – это собственные клетки человека над ростом и размножением которых организм потерял контроль.
Эволюция рака насчитывает 4 этапа – 4 стадии, каждую из которых принято обозначать римскими цифрами от I до IV. Обнаружение опухоли на этапе, когда уже появились метастазы в отдаленные лимфоузлы и/или ткани и органы, автоматически определяет стадию процесса как четвертую.
Что влияет на продолжительность жизни пациента с 4 стадией рака?
Прогноз жизни больных злокачественной опухолью IV стадии определяется скоростью распространения опухоли в окружающие ткани и отдаленные органы.
Период удвоения опухоли может занимать от 30 дней до нескольких лет и десятилетий. Есть опухоли, о существовании которых в своем организме человек может никогда и не узнать. Они характеризуются очень медленным ростом и длительно себя клинически никак не проявляют. Это так называемые, латентные, вялотекущие или «добрые» опухоли.
Есть «злые опухоли», для которых характерен агрессивный потенциал метастазирования. При, казалось бы, маленьких размерах первичного очага отмечается бурная диссеминация процесса — быстрое появление и рост отдаленных метастазов в различных органах, чаще всего в печени, легких, костях, головном мозге… Однако, в большинстве случаев, с помощью современного и своевременного противоопухолевого лечения все же удается взять под контроль симптомы заболевания и замедлить, а то и приостановить, «бег» самой болезни.
В ряде случаев резко усугубляют прогноз жизни больного сопутствующие заболевания (тяжелая форма сахарного диабета, хроническая декомпенсированная сердечная недостаточность, дыхательная или почечная недостаточность, цереброваскулярные и тромбоэмболические заболевания, хронические инфекции и т.д.), которые не дают провести лечение в полном объеме.
Парадоксы возраста
Существует мнение, что пожилым людям сложнее бороться с недугом под названием рак. Ведь большое количество сопутствующих заболеваний ограничивает применение тех или иных видов лечения, в связи с риском развития различных осложнений. С другой стороны — у пожилых людей обменные процессы замедлены, и течение самого заболевания не активное, вялотекущее. При этом важно помнить, что на сегодняшний день пожилой и старческий возраст не является сам по себе противопоказанием к назначению противоопухолевой лекарственной терапии. Большее значение имеет биологический возраст больного, а не тот, что указан в паспорте.
У молодых пациентов напротив — количество сопутствующих заболеваний в разы меньше, а серьезных и вовсе может не быть. Но активные обменные процессы могут отчасти способствовать агрессивному течению опухоли. Так что возраст становится и союзником, и врагом.
Большое значение имеет длительность анамнеза (истории) болезни, а также резервы противоопухолевого лечения.
Противоопухолевое лечение при IV стадии рака на сегодняшний день может включать:
Химиотерапия
Поэтому по чувствительности к химиотерапии опухоли подразделяются на 3 основные группы:
Иммунотерапия
На территории Российской Федерации для лечения злокачественных новообразований зарегистрированы ингибиторы точек иммунного контроля: ипилимумаб, пембролизумаб, ниволумаб, пролголимаб, атезолизумаб и дурвалумаб. Онкоиммунологические препараты (антитела к CTLA-4, PD-1, PD-L1) заново «обучают» иммунную систему организма бороться со злокачественной опухолью, лишая опухолевые клетки возможности «ускользать» от иммунного надзора. Противоопухолевый эффект таких препаратов сохраняется даже спустя годы после завершения лечения.
Важно помнить, что иммунотерапия – это не панацея от всех болезней. На данный вид терапии отвечает только 20-30% больных иммунокомпетентными опухолями. Вероятность ответа к иммунотерапии при соблюдении определенных показаний в соответствии с регистрационным удостоверением иммуноонкологических препаратов присутствует у больных следующими метастатическими опухолями:
Реакция организма пациента на иммунотерапию особая. Поэтому для всех препаратов, относящихся к новому классу ингибиторов точек иммунного ответа, лечение следует начинать под контролем опытных и квалифицированных онкологов.
Лаборатория молекулярной онкологии
Участие в клинических исследованиях
Для онкологических больных IV стадией участие в клинических исследованиях крайне важно. Лечение инновационными лекарственными препаратами в рамках клинических испытаний позволяет в ряде случаев эффективно контролировать болезнь долгие годы. По российскому законодательству регистрация любого нового противоопухолевого препарата в России возможна после проведения исследований с участием российских пациентов. На включение нового препарата в действующие клинические рекомендации уходят годы, поскольку важно подтвердить безопасность и эффективность лекарственного средства. Пациент, желающий принять участие в клиническом исследовании после беседы с лечащим врачом-онкологом подписывает информированное согласие в нескольких экземплярах. В рамках клинического испытания больного информируют обо всех диагностических исследованиях и лечебных процедурах, включая введение исследовательского препарата, а также о том, что исследуемый препарат может оказаться неэффективным для пациента, как, впрочем, и препарат, назначенный в соответствии с клиническими рекомендациями. При этом участники клинического исследования обязаны четко соблюдать условия протокола, неукоснительно следуя графику процедур и визитов в исследовательский Центр. Контроль за соблюдением прав пациента осуществляется Министерством Здравоохранения России и этическим комитетом.
Почему опухоль сразу не отвечает на лечение или возобновляется рост метастазов после длительной ремиссии?
Ответ на этот вопрос кроется в биологии самой опухолевой клетки, которая, как все живое на планете, старается как можно быстрее адаптироваться к агрессивной окружающей среде. Например, многократный прием пенициллиновых антибиотиков способствует возникновению резистентности (потере чувствительности) у бактерий, поэтому требуется смена антибиотиков при очередном обострении воспалительного процесса.
Опухолевые клетки – это те же клетки организма, над которыми сам организм по ряду причин потерял контроль. Вместо запрограммированной гибели клетки опухоли приобрели способность бесконтрольного деления, роста и метастазирования. Поэтому после длительного и стойкого регресса (уменьшения) опухоли возобновляется рост опухоли или возникают новые метастазы. Опухоль со временем «умнеет»: с каждой линией нового лечения период до обострения болезни будет все короче и короче. Больные часто не понимают этого и просят вернуться к лечению, которое когда-то было столь эффективно.
Важно относиться с пониманием, когда врачи просят выполнить биопсию новых метастазов, например, в печени или легких. Поскольку новые опухолевые очаги могут отличаться по рецепторному и мутационному статусу, а может возникнуть и новая опухоль. Поэтому больному потребуется назначение нового лечения в зависимости от биологического подтипа или вновь обнаруженных мутаций.
Важно, чтобы проведение, по сути, токсичного лечения было возможно с учетом исчерпанных в ряде случаев резервов организма пациента или сопутствующей патологии. Например, при возникновении вирусных инфекций, в том числе гриппа или новой инфекции COVID-19, противоопухолевое лечение, как правило, приостанавливается, и все силы врачей, и все силы организма будут направлены на борьбу с заболеванием. Сроки возобновления противоопухолевого лечения обсуждаются с лечащим терапевтом и врачом-онкологом индивидуально.
Среди пациентов с 4 стадией онкологического заболевания нужно особо выделить паллиативных пациентов.
Паллиативные пациенты — это те онкологические больные, которые исчерпали все возможности лечения, их организм не может больше бороться с болезнью. Физическое состояние таких пациентов, обусловлено в ряде случаев полиорганной недостаточностью. Исчерпанные возможности противоопухолевого лечения не позволяют продолжать лечение. По картине клинического анализа крови можно увидеть, что резко угнетено кроветворение (к примеру, низкие показатели гемоглобина, тромбоцитов, лейкоцитов). В биохимическом анализе крови, наоборот, могут «зашкаливать», например, показатели креатинина, билирубина и/или трансаминаз и т.д.
Этап, когда паллиативный пациент испытывает сильную слабость, не встает с постели и самостоятельно не передвигается, не ест, у него наблюдается спутанность сознания — называют термальным. Все возможные виды лечения уже испробованы и перестали работать, возможна лишь симптоматическая помощь (например, купирование болевого синдрома). Причиной гибели онкологических пациентов зачастую является полиорганная недостаточность. Опухоль угнетает функции важных органов и систем организма, опухолевая масса растет и становится несовместимой с жизнью. Тем не менее, пациенты с 4 стадией рака, получающие грамотную паллиативную медицинскую помощь, которая в настоящее время оказывается в полном объеме квалифицированным и специально подготовленным персоналом ХОСПИСов, могут жить достаточно долго и с хорошим качеством жизни. У каждого больного всегда есть шанс дождаться новых видов лечения, к которым рак будет чувствителен. Наука двигается вперед семимильными шагами!
Нельзя забывать также о психологической, социальной и духовной составляющих. Найти свои «духовные якоря» онкологическим пациентам часто помогают медицинские психологи.
Что дает онкологическому больному психологическая помощь?
Важно помнить, что IV стадия злокачественного процесса сегодня – это хорошо управляемый процесс, который с помощью противоопухолевого лечения успешно переводится в хронический и вялотекущий процесс. Это в свою очередь дает возможность больным доживать до нового и более эффективного лечения. Двадцатилетний опыт работы химиотерапевтом в НИИ онкологии им. Н.Н. Петрова на вопрос: «Cколько живут больные раком 4 стадии?» позволяет ответить: «Долго», но при условии своевременного и современного лечения.
Авторская публикация:
Татьяна Юрьевна Семиглазова
врач высшей категории
доктор медицинских наук
заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации НИИ онкологии им. Н.Н. Петрова
Метастазы рака в головном мозге
Оглавление
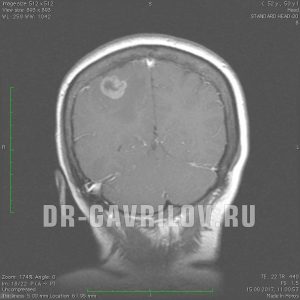
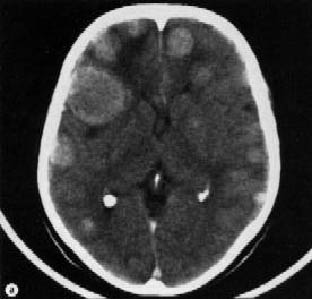
Метастазами называется миграция канцерогенных клеток от первичной опухоли в другие органы, что характерно для большинства онкологических новообразований. Это приводит к формированию вторичных очагов в других тканях. Для различных видов рака характерна разная интенсивность метастатического процесса, что зависит от степени злокачественности и особенностей первичной опухоли. Чем интенсивнее распространение, тем агрессивнее рак. К примеру, при меланоме кожи метастазы в головной мозг случаются часто, в отличие от базальноклеточного рака. Метастатический процесс начинается, как правило, на третьей стадии канцерогенеза, а на четверной стадии он проявляется уже достаточно сильно. Есть два пути миграции раковых клеток: через кровь и лимфу. Вид метастатических новообразований будет идентичен виду клеток первичной опухоли. При обнаружении неоплазий головном мозге важно убедиться в том, что это вторичные опухоли. С этой целью проводят полное обследование организма. При наличии метастаз в головном мозге прогноз ухудшается, продолжительность жизни оценивается месяцами, в некоторых случаях неделями.
Образование метастаз
Метастазы формируются после развития первичного злокачественного новообразования в других органах. Последние образуются в результате мутагенеза или ошибок в генетическом материале соматических клеток. На начальных стадиях метастатический процесс отсутствует, но по мере его прогрессирования, ткани первичной опухоли прорастают в близко расположенные органы. В дальнейшем болезнь усугубляется, раковые клетки начинают отрываться от первичного очага и мигрировать по кровяному или лимфатическому руслу (повреждается целостность сосудов). Метастатическая клетка закрепляется в каком-либо органе, прорастает и дает начало новому очагу – вторичной опухоли.
Важно. У разных лиц характер, сроки и интенсивность формирования вторичных метастатических очагов различны, что объясняется уровнем противоопухолевого иммунитета.
Особенности метастазирования
На интенсивность метастатического процесса, степень злокачественности, особенности формирования рецидивов, лечение метастаз в головном мозге и агрессивность рака влияют следующие обстоятельства:
Метастазы в головной мозг
Приводят к формированию вторичных опухолей в различных участках головного мозга. Почти всегда это становится причиной летального исхода. В общем, к этому может привести любой вид рака, однако есть опухоли, которые дают метастазы чаще остальных видов рака:
Кроме этих видов рака, метастатические поражения мозга могут формироваться и при других злокачественных новообразованиях, например, на терминальных стадиях рака гортани или щитовидной железы, при прорастании опухоли в крупные магистральные артерии.
Симптомы и признаки
При прогрессировании рака он переходит на поздние (3 и 4) стадии. В этом случае метастазы образуются в головном мозге, поэтому начинают проявляться характерные клинические признаки. Проявления будут зависеть от зоны поражения головного мозга. Во многих случаях свойственна зеркальность признаков, т. е. если опухоль в правом полушарии, то клиника будет проявляться с левой стороны и наоборот.
Основные признаки:
Диагностика
Поскольку образование вторичных опухолей в головном мозге становится причиной смерти больного, важно как можно раньше выявить наличие патологического образования. При наличии рака диагностика пациента должна проводится постоянно для мониторинга ситуации и своевременного выявления вторичных новообразований в головном мозге. Если опухоль в голове будет небольшого размера, она уже, как правило, имеет выраженную клинику, однако, ее можно диагностировать на самых ранних этапах при помощи компьютерной (КТ) или магнитно-резонансной томографии (МРТ). Важное значение имеет биопсия для установления метастатического процесса и выяснения всех нюансов патогенеза. Наличие метастаз можно заподозрить даже при биохимическом анализе крови.
Лечение
Что делать при метастазах в головном мозге решает консилиум врачей на основании диагностики и истории болезни пациента. Лечение метастаз в голове проходит весьма сложно, что связано с труднодоступностью локации вторичных очагов в головном мозге, наличием множественных опухолей в других органах, состоянием больного на поздних стадиях, возраста и еще целого ряда факторов. Сегодня при наличии вторичных опухолей в голове применяют стереотаксические радиохирургические методики, которые останавливают или замедляют рост патологической ткани. Самый лучший результат достигается при удалении опухолей оперативным путем, но на данных стадиях лечение всегда проходит трудно. Способ лечения будет зависеть от локации опухоли, интенсивности поражения других органов и общего состояния больного.
Основные виды лечения
Прогноз жизни
При наличии метастаз в головном мозге прогноз неблагоприятный. Ситуация осложняется трудностью в лечении в основном из-за обширного распространения патогенных клеток, образованием множественных вторичных очагов и слабостью пациента. Продолжительность жизни на терминальной стадии с наличием вторичных опухолей в головном мозге, как правило, от нескольких месяцев до одного года, в редких случаях больные проживают более года.
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ЛУЧЕВАЯ ТЕРАПИЯ В КОМБИНИРОВАННОМ И КОМПЛЕКСНОМ ЛЕЧЕНИИ МЕТАСТАЗОВ
В ГОЛОВНОЙ МОЗГ: ОСНОВНЫЕ ЭТАПЫ, ПЕРСПЕКТИВЫ
З.П. Михина, С.И. Ткачев, О.П. Трофимова, В.С. Данилова, О.П. Извекова,
В.А. Горбунова, М.Б Бычков, Р.Б. Карахан, В.Б. Крат
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Метастатическое поражение головного мозга – серьезное осложнение течения опухолевого процесса, которое отмечается примерно у 50% онкологических больных и чаще всего встречается при раке легкого (34–66%), молочной железы (10–33%), почки, колоректальном раке, меланоме. Пик метастазов приходится на возрастную группу 55-65 лет. В детском возрасте метастазы в мозг возникают чаще при саркоме Юинга, рабдомиосаркоме, нейробластоме и остеогенной саркоме (1, 2).
При подозрении или выявлении метастазов в головной мозг должно проводиться полное общее обследование, и оно особенно показано пациентам с поражением мозга без выявленной первичной опухоли и больным с известным первичным диагнозом рака, у которых была некоторое время ремиссия. Начальная оценка состояния больного с поражением ЦНС должна проводиться с использованием шкалы Карновского или системы ВОЗ. Обе системы позволяют количественно определить функциональное состояние больного, прогнозировать качество и время жизни, определять объем обследования.
Клинический осмотр больного должен включать тщательную пальпацию всех периферических лимфатических узлов, щитовидной железы, молочных желез, выслушивание легких, обследование брюшной и тазовой области, включая яички, ректальное исследование, осмотр всей кожи для выявления меланомы. Следует выяснить жалобы на боли в костях, потому что метастазы в кости и мозг нередко встречаются вместе.
Тщательная неврологическая оценка часто показывает дефициты, которые пациент не сознавал, особенно локальную слабость и умственные изменения. Следует исследовать зрение, которое отражает кортикальную функцию и внутричерепное давление. До 25% больных с метастазами в мозг имеют отек диска зрительного нерва, изолированный паралич VI (отводящего) нерва может быть неправильно истолкован как локальный симптом, хотя он отражает внутричерепную гипертензию.
При подозрении или установления диагноза метастаза в мозг у онкологического больного следует начать терапию с учетом степени тяжести неврологических симптомов. При выраженном внутричерепном давлении с признаками, предполагающими наличие вклинения мозга, или при эпилептическом состоянии показан маннитол 1 г/кг внутривенно и дексаметазон от 32 до 64 мг внутривенно струйно. Поддерживающие дозы маннитола (0.5-2 г/кг) и дексаметазона (4-10 мг в/в) вводятся, разделенные на 4 дозы. При эпилептическом статусе последовательно вводятся противосудорожные препараты: лоразепам от 1 до 4 мг в/в, далее фосфенитоин 20 мг/кг, в/в, фенобарбитал, пропофол, вплоть до общей анестезии, если нет стойкого эффекта.
Дексаметазон – глюкокортикоид, наиболее часто используемый для уменьшения отека мозга. Уменьшение отека с последующим клиническим улучшением обычно наблюдается в пределах 1-2 дней. Стандартный подход у больных с симптомами заключается в подведении высокой начальной дозы, от 16 до 32 мг в/в или в/м с последующим снижением дозы до 4-8 мг в/в или per os. При наступлении устойчивого клинического улучшения следует начать медленное снижение доза дексаметазона до самой низкой эффективной, например, по 2 мг каждые 5-7 дней. Следует не забывать, что длительное использование кортикостероидов связано с высокой частотой побочных эффектов, таких как кандидоз полости рта, повышение кислотности желудка, язвенная болезнь, условно-патогенные инфекционные процессы, отсутствие толерантности к глюкозе или свершившийся диабет, артериальная гипертензия, кушингоидные изменения, нарушения сна, личности, остеопороз, аваскулярный некроз, риск тромбоза глубоких вен. Не рекомендуется использовать кортикостероиды у пациентов с отсутствием или минимальными симптомами (1, 2).
Облучение всего головного мозга в самостоятельном варианте используется у больных с милиарной диссеминацией метастазов, с множественным или ограниченным числом очагов (2-4), но при неблагоприятном прогнозе. Весь мозг облучается при метастазах лимфосарком, мелкоклеточного рака легкого (МРЛ), герминогенных опухолей, при которых хирургическое лечение проводить нецелесообразно, но лучевая терапия обязательно дополняется химиотерапией, к которой опухоли данных локализаций высоко чувствительны.
WBRT проводится с профилактической целью после хирургического удаления одиночных метастазов или при МРЛ, аденокарциноме легкого, лейкозах, учитывая высокий потенциал интракраниального метастазирования при указанных формах первичной опухоли.
Параллельно с лучевой терапией у больных с одиночными метастазами использовался хирургический метод в самостоятельном варианте. При числе метастазов 2-3 хирургическое лечение считалось противопоказанным (3).
После представленных итогов возникли вопросы относительно роли лучевой терапии: необходима ли вообще лучевая терапия после «полной» резекции одиночного метастаза, должна ли послеоперационная лучевая терапия быть локальной или ее следует проводить в виде WBRT.
Ретроспективные исследования, которые изучали роль послеоперационной лучевой терапии при одном метастазе, не сумели ответить на этот вопрос из-за противоречивых результатов. Четко отмечалась меньшая частота рецидива в зоне операции и в других отделах мозга при использовании WBRT, не было единого мнения о пользе для выживаемости, оставалась высокая вероятность развития поздних лучевых повреждений мозга, снижающих качество жизни больных.
Patchell и соавт. опубликовали результаты рандомизированного исследования, определяющего важность включения WBRT. Больные в общем состоянии >70 баллов по шкале Карновского были рандомизированы после полного удаления единичного метастаза в головном мозге. Для увеличения эффекта и снижения возможного нейрокогнитивного ухудшения использовалась классическая лучевая терапия (СОД 50,4 Гр; РОД 1,8 Гр). Анализа данных показал достоверное уменьшение частоты рецидивов (18% против 70%) и причин смерти от неврологической болезни (14% против 44%) у больных с WBRT после хирургического удаления по сравнению с хирургией в самостоятельном варианте. Однако пользы для выживаемости или функциональной независимости больных отмечено не было. Авторы рекомендовали применять WBRT для уменьшения частоты локальных или новых метастазов в головном мозге и снижения вероятности смерти по неврологическим причинам.
WBRT обычно назначается всем пациентам после резекции 2-3 метастазов, даже, когда послеоперационные исследования (КТ и МРТ) не показывают наличие болезни. Высокая вероятность появления новых метастазов в мозге оправдывает применение WBRT после операции, не смотря на потенциальный риск постлучевых изменений. В настоящее время окончательное решение принимается с учетом полноты резекции очагов, чувствительности опухоли к облучению, наличия экстракраниальных метастазов и прогнозирования длительности выживания.
Оценка больших клинических материалов показала, что приблизительно 50% пациентов с метастазами в мозг умирают от неврологических причин (4). Было высказано предположение, что если подводить к метастазам бoльшие дозы, выживаемость может быть увеличена. Были проверены стратегии по увеличению доз облучения с использованием ускоренной гиперфракционной радиотерапии, брахитерапии, фракционированной стереотаксической радиохирургии и стереотаксической радиохирургии (SRS) в виде одной дозы. В последнем десятилетии наиболее активно использовалась SRS с подведением к опухоли всей дозы за один сеанс с минимальной дозой в нормальной ткани мозга.
SRS радиохирургия использует множество мелких, хорошо коллимированых пучков ионизирующего излучения линейного ускорителя или «гамма-ножа» для уничтожения внутричерепных очагов. Анализ 40 нерандомизированных исследований, включавших 2,697 пациентов и 3,922 метастатических очагов, выявил среднюю частоту непосредственного эффекта в 81% случае при использовании SRS.
Активное внедрение в ряде стран SRS для лечения интракраниальных метастазов позволило высказать сомнения в целесообразности использовании WBRT у пациентов с несколькими метастазами.
В настоящее время продолжаются или уже опубликованы предварительные результаты ряда рандомизированных исследований, касающихся более детальной и ясной оценки роли WBRT в сочетании с радиохирургией. Исследование Aoyama и соавт. (5) было проведено в Японии с участием больных с 1-4 метастазами, состоянием ≥70 баллов по шкале Карновского, размерами метастазов по МРТ ≤3 см, получивших радиохирургию в сочетании или без WBRT. Проведено сравнение в группах в зависимости от числа метастазов (1 против 2-4), вида первичной опухоли (легкое против других опухолей), состояния экстракраниальной болезни (есть – нет). WBRT проводилась по схеме 30 Гр за 10 фракций, дозы SRS уменьшались на 30-40% на краях метастазов в группе WBRT+SRS. Первично изучалась выживаемость, вторично – сохранение системных функций (KRS ≥70%), сохранение неврологического статуса (RTOG, стадия ≤2), время, свободное от новых интракраниальных метастазов, поздние неблагоприятные последствия, причины смерти по определению Patchell, частота локального контроля в области поражения.
Начиная с 80 гг., с внедрением новых диагностических методов (КТ, МРТ), основное внимание уделялось совершенствованию методов диагностики внутримозговых метастазов, определению прогностических групп, разработке методов лечения с учетом прогноза. На основе изучения прогностических факторов 1176 больных исследователи RTOG, используя статистический метод, названный рекурсивным парциальным анализом (RPA), выделили три подгруппы (классы). Рекурсивный класс I включал пациентов до 65 лет, в общем состоянии по шкале Карновского ≥70%, излеченной или контролируемой основной опухолью и отсутствием внечерепных метастазов. Эта группа составляла меньше 20% от общей численности пациентов с метастазами в мозг. Класс III включал пациентов в общем состоянии по шкале Карновского 90% пациентов с метастазами в мозг до лучевой терапии всего черепа имелиcь нарушения познавательной функции, которые в значительной степени зависели от объема опухоли, но не от числа метастазов, и исходный уровень этой функции был значительным прогностическим признаком выживаемости, помимо обычных используемых показателей прогноза.
Поздние изменения мозга после WBRT имеют особый интерес, поскольку они включают возможность появления деменции. Важно, что деменции, частота которой с течение первого года после WBRT составляла 11%, была выявлена только у пациентов, леченных большими ежедневными фракциями (больше 3 Гр). В то же время приведены веские доводы в пользу того, что лечение крупными фракциями позволяет быстрее получить эффект с улучшением неврологических симптомов и уменьшить время приема поддерживающих лекарств. Кроме того, больные с неблагоприятным прогнозом имеют небольшую выживаемость, и у них не успевает развиться такое серьезное осложнение как деменция. Однако выживаемость у части больных растет, и при хорошем прогнозе больные могут дожить до поздних повреждений, что заставляет изучать факторы, определяющие позднюю нейротоксичность.
Таблица 2.
Лучевые осложнения после облучения черепа.
| Фаза | Признаки | Время появления | Вероятная причина | Лечение |
|---|---|---|---|---|
| Острая | Усталость, головная боль, тошнота, алопеция, эритема кожи черепа, обострение локального неврологического дефицита | Первые 2 недели лучевой терапии | Отек | Кортикостероиды |
| Ранняя отсроченная | Усталость, сонливость, головная боль → познавательная дисфункция → замедленная обработка информации → снижение внимания → неспособность обучения; нарушение памяти → исполнительная дисфункция → нарушение моторной ловкости | 1-6 мес. после лучевой терапии | Демиелинизация | Кортикостероиды, возможно спонтанное улучшение |
| Поздние нарушения | Деменция, изменение личности, лейкоэнцефалопатия, судороги, повышение черепно-мозгового давления, атаксия, дизартрия, несдержанность, оптическая невропатия, индуцированные опухоли | От 6 мес. до нескольких лет после лучевой терапии | Ангиопатия, демиелинизация, некроз | Кортикостероиды, антикоагулянты, вит. Е |
В заключение следует отметить, что решение клинической проблемы должно основываться на оценке прогностических показателей. Это позволяет разделить больных на благоприятные, промежуточные, и неблагоприятные категории и предложить методы лечения (резекцию, облучение, радиохирургию, химиотерапию), которые разработаны в конкретном учреждении и доступны больным.
В странах с большим опытом применения стереотаксической радиохирургии до конца не определено место метода в лечении метастазов: должна ли радиохирургия использоваться в сочетании с WBRT для предупреждения рецидивов и новых метастазов или во время рецидива после WBRT, или использоваться самостоятельно, резервируя WBRT для облучения обширных мозговых рецидивов. В России только набирается опыт лечения с использованием гамма-ножа, нет пока исследований по обоснованному сочетанию радиохирургии с различными методами лечения. В связи с этим общее облучение мозга проводится практически всем больным (после операции, самостоятельно), и при показаниях добавляется локальное облучение отдельных очагов на линейных ускорителях. Дальнейшие исследования должны обязательно включать оценку реакций на облучение всего мозга с изучением познавательной функции путем анкетирования больных с различными первичными новообразованиями, имеющими шанс прожить более 3 мес.
1. Evaluation and management of brain metastases. /Mehta M., Tremont-Lukats I.W Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P.375—82.
2. Treatment of brain metastases. / Patchell R.A. Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P. 383—91.
3. Management of cerebral metastases: the role of surgery/ Lang F.F., Wildrick D.M., Sawaya R. — Cancer Control. — 1998, Mar. — Vol. 5. — No. 2. — P.124—9.
4. Focal management of single or multiple brain metastasis without whole-brain radiotherapy. / Kleinberg L.R Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P. 93—9.
5. Interim report of the JROSG99-1 multi-institutional randomized trial, comparing radiosurgery alone vs. radiosurgery plus whole brain irradiation for 1-4 brain metastases. /Aoyama H, Shirato H, Nakagawa K, et al. J Clin Oncol.—2004—22 (suppl; abstr 1506)14s.
6. Phase II trial of radiosurgery for one to three newly diagnosed brain metastases from renal cell carcinoma, melanoma, and sarcoma. / Manon R, O’Neill A, Knisely J, et al. An Eastern Cooperative Oncology Group study (E 6397). J Clin Oncol.— 2005. —23. — P. 8870-8876.
7. Clinical practice guideline on the optimal radiotherapeutic management of brain metastases/ Tsao M.N., Lloyd N.S., Wong R.K.S. and the Supportive Care Guidelines Group of Cancer Care Ontario’s Program in Evidence-based Care. — BMC Cancer. — 2005. — Vol. 5 — P.34.
8. Neurocognitive sequelae оf whole-brain radiotherapy in patients with brain metastase. /Jeffrey S. Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P.100—4.