реактивный трабекулярный отек костного мозга
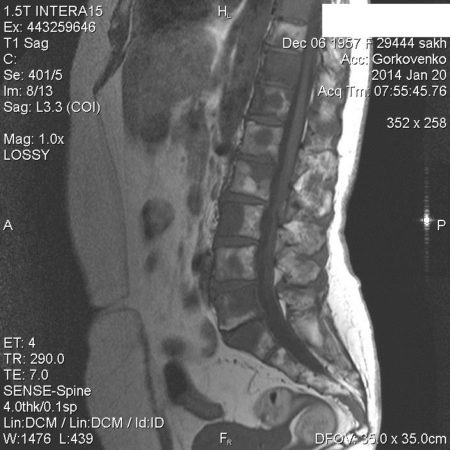
Отек костного мозга на МРТ позвоночника
Боли в спине – одна из самых распространенных причин обращения людей к врачу. Благодаря современным высокотехнологическим исследованиям врач может определить характер патологии, локализацию, размеры, выработать план лечения.
МРТ регистрирует отклик атомов водорода в тканях человека на сильное магнитное поле, на снимках ткани визуализируются по-разному в зависимости от содержания в них воды. Поэтому можно обнаружить изменения структуры костного мозга и его отек на МРТ позвоночника.
Причины отека костного мозга
Костный мозг расположен внутри тела каждого позвонка. Между трабекулами кости располагаются стволовые клетки, рыхлая соединительная ткань, жировая ткань. Здесь образуются все клетки крови – эритроциты, лейкоциты, тромбоциты. Поэтому изменения в костном мозге сопровождаются анемией, снижением иммунитета, обострением аутоиммунных заболеваний, склонностью к кровотечениям. С возрастом жировые клетки замещают большую часть костного мозга.
Причину отека помогает выявить опрос пациента. Большое значение имеет предшествующая травма, характер и длительность боли, нарушения чувствительности кожи, сопутствующие заболевания.
Травматический отек
Наиболее частой причиной его возникновения является травма спины: человек упал или ударился, боль со временем не проходит. Характерная особенность боли – она локализована выше, чем травмированное место. Это связано с тем, что отекший позвонок сдавливает спинномозговые корешки, сами нервы выходят из спинного мозга выше и какое-то время следуют внутри позвоночного канала, затем покидают его через межпозвоночные отверстия.
Трабекулярный отек сопровождает травмы в 100 % случаев. Встречается в любом отделе позвоночника – от шейного до копчика, локализация зависит от механизма травмы. Под действием механического фактора увеличивается давление на костную ткань, может произойти перелом позвонка, растяжение и разрывы связок. Кровеносные сосуды повреждаются, жидкая часть крови и клетки выходят из сосудов и заполняют место между костными балками. Симптоматическое лечение временно облегчает состояние, но без прицельного воздействия на причину отека костного мозга вылечиться невозможно.
Вторичный отек кости
Вторичные отеки не связаны с травмой, они осложняют течение других патологических процессов:
Отек спинного мозга часто сопровождает воспалительные процессы в позвоночнике (остеомиелит, туберкулез). Микробы могут попадать в тела позвонков с кровью из любого очага хронической инфекции (кариес, тонзиллит, эндокардит).
Дегенеративные явления (остеохондроз, межпозвоночные грыжи, артрозы фасеточных суставов – соединений между двумя соседними позвонками) нарушают питание кости, приводят к отеку. При первичном очаге в хряще отек сначала субхондральный, то есть под хрящом, далее распространяется на остальную костную ткань.
Опухоли сдавливают окружающие ткани, приводят к нарушению кровоснабжения кости, что проявляется в виде перифокального отека костного мозга позвоночника, то есть вокруг новообразования.
Нарушения обмена, эндокринные заболевания, хроническая патология почек, расстройства пищеварения ведут к дисбалансу электролитов, накоплению ионов натрия, могут стать причиной развития метаболического отека кости.
Ятрогенные причины: после операций на позвоночнике (реактивный отек), в результате приема некоторых лекарств (стероидных гормонов), на фоне лучевой терапии.
Отек костного мозга, что покажет МРТ позвоночника?
Из-за скопления жидкости в костной ткани тела позвонков увеличивается в размерах, приобретают раздутую форму. Если они увеличиваются настолько, что начинают сдавливать спинной мозг, проходящий в канале позвоночного столба, появляются неврологические симптомы, на снимках видны структурные изменения спинномозговых корешков и спинного мозга. Это уже очень опасно, развиваются:
Двигательные и чувствительные нарушения в нижних конечностях, если поражен поясничный отдел позвоночника, появляются нарушения работы тазовых органов (нарушение мочеиспускания, дефекации, половые расстройства).
При поражении шейного отдела позвоночника страдает иннервация рук (изменяется чувствительность, ограничение движений). При сильном отеке спинной мозг сдавливается не только на уровне шеи, нарушение кровообращения распространяется в вышележащие отделы. Могут присоединиться нарушения зрения, головные боли, менингеальные симптомы, рвота, повышение внутричерепного давления из-за отечности и сдавления нервов, мозговых оболочек. В продолговатом мозге расположены жизненно важные центры – дыхания и сердечной деятельности. Вовлечение их в патологический процесс может привести к летальному исходу.
Отек спинного мозга, нервов, оболочек мозга характеризуется повышением интенсивности сигнала по сравнению со здоровыми тканями. При гидроцефалии расширяются желудочки мозга.
Как выглядит отек костного мозга на МРТ?
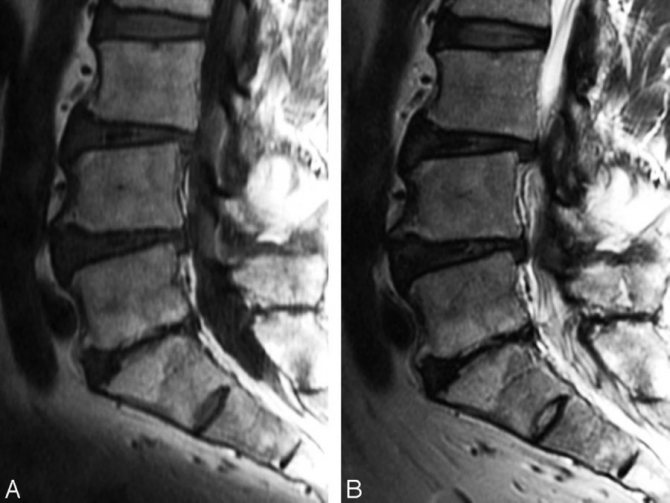
На снимках МРТ отек костного мозга выглядит как очаг внутри кости большей интенсивности с размытыми однородными контурами. Само тело позвонка увеличено, несколько размыты границы. В норме содержание жидкости в кости до 10 %. При отеке эта цифра увеличивается до 20 %. Под действием магнитного поля можно определить концентрацию атомов водорода в тканях, границы отека, какие структуры кроме костного мозга вовлечены. Это особенно ценно, так как другие методы – рентген, КТ не выявляют отек костного вещества, микротрещины. На них визуализируются более значительные повреждения – перелом, остеопороз, трещина, смещение, некроз.
На МРТ, когда отекает костная ткань, выявляют гиперинтенсивность костного мозга. Впервые явление было зафиксировано Уилсоном в 1988 году, получило название отек костного мозга. Некоторые рассматривают его как первую, обратимую стадию развития остеонекроза. Обычно эту формулировку используют как клинико-радиологический синдром для уточнения основного заболевания. И только при исключении всех возможных других патологий ставят диагноз отек костного мозга. Для дифференциальной диагностики назначают МСКТ с контрастом, МРТ с контрастом, рентген, определение онкомаркеров в крови, ревматоидного фактора, пункцию с последующей биопсией костного мозга.
После определения с диагнозом выбирают лечение.
МРТ – единственное исследование, которое выявляет отек костного мозга позвоночника. Кроме того, на снимках видно состояние всех мягких тканей по соседству – нервов, связок, мышц, кровеносных сосудов, визуализируются грыжи на начальных стадиях. Это очень ценная информация, позволяющая выбрать правильное лечение: кому-то необходима срочная операция, кому-то – антибиотики, гормональное лечение, сосудистые средства, мочегонные, бисфосфонаты, препараты кальция, ингибиторы простагландина, витамин Д, ношение корсета. Клинически многие болезни проявляются болью в спине, а лечение требуется всем разное. Выбрать правильное направление помогает именно МРТ.
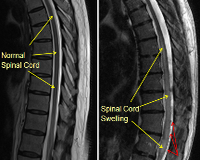
Отек спинного мозга
Отек спинного мозга — это неспецифический патологический процесс, при котором происходит избыточное накопление жидкости в межклеточных пространствах. Заболевание возникает как осложнение позвоночно-спинномозговой травмы, опухолевого процесса, демиелинизирующих или сосудистых патологий. Состояние проявляется восходящими параличами, потерей всех видов чувствительности, отсутствием рефлексов, другими симптомами с учетом первопричины. Диагностика отека требует проведения КТ или МР-сканирования спинного мозга, рентгенографии позвоночника. Лечение включает массивную дегидратацию, нейрометаболическую поддержку, нейрохирургические операции (по показаниям).
МКБ-10
Общие сведения
Истинная распространенность состояния не установлена, поскольку отек спинного мозга служит универсальной реакцией на травматическое повреждение. Он встречается у всех больных с осложненной травмой позвоночника. После оперативного удаления новообразований вероятность отека составляет около 0,6%, Патология широко распространена в практической неврологии, является опасной для жизни и здоровья пациента, поэтому не теряет актуальности разработка новых способов диагностики и эффективного лечения отека спинного мозга.
Причины
Основной причиной развития отека является позвоночно-спинномозговая травма (ПСМТ) — повреждение, которое сопровождается контузией, нарушением анатомической целостности спинного мозга. Патология возникает в начальном остром периоде (первые 2-3 суток), значительно отягощает состояние пациента после травмы. Кроме ПСМТ, причинами отека могут выступать следующие заболевания:
Патогенез
В механизме развития отека участвует несколько факторов: травматический, циркуляторный, сосудистый, тканевой. Наблюдается повреждение тканевых элементов, накопление провоспалительных медиаторов, нарушение проницаемости сосудов, что сопровождается избыточной фильтрацией жидкости в интерстициальное пространство. При этом спинной мозг увеличивается в объеме, а поскольку он ограничен пространством спинномозгового канала, возникают явления компрессии.
Посттравматический отек вызывает ишемию спинного мозга, которая становится причиной поражения миелиновых оболочек нервов. В последующем формируется специфический глиоз — замещение погибших нейронов клетками нейроглии, что сопровождается нарушением спинномозговых функций. Эти изменения видны на МРТ в виде миомаляции: в первые полгода состояние может быть частично обратимо, затем закрепляется стойкий неврологический дефицит.
Симптомы
Клиническая картина обусловлена основным заболеванием. При перенесенной ПСМТ ведущим симптомом является боль в спине, которая сосредоточена в месте приложения механической силы, распространяется на другие отделы позвоночника. Соответственно уровню повреждения развиваются вялые параличи дистальных отделов ног или всех нижних конечностей, дополняемые парезами мышц брюшного пресса, спины, грудной клетки.
При локализации поражения на уровне верхнешейного отдела спинного мозга наблюдается тетраплегия по центральному типу с утратой чувствительности, которая дополняется вялым параличом шейных мышц. Если травма произошла в нижнешейном отделе, определяются признаки поражения плечевого сплетения, одно- или двусторонний синдром Горнера, различное положение рук (опущены, сложены на груди, запрокинуты).
Отек спинного мозга неуклонно нарастает, уже спустя несколько часов патологический процесс захватывает значительное число сегментов. Постепенно усугубляется неврологическая симптоматика: появляются восходящие параличи, которые распространяются от нижних к верхним конечностям, туловищу, мышцам шеи и головы. Может возникать судорожный синдром.
Осложнения
Отек спинного мозга — грозное состояние, которое без лечения может быстро распространиться на вышележащие сегменты, достигая церебрального уровня. При вовлечении в процесс продолговатого мозга у пациента нарушаются витальные функции: дыхательная (дыхание Биота), сердечно-сосудистая деятельность (замедление пульса, гипотония). Наблюдается отсутствие сухожильных и периостальных рефлексов, расширение зрачков, неподвижность глазных яблок.
При ПСМТ спинальный отек нередко осложняется спинальным шоком, который характеризуется перераздражением органа или лишением супраспинальных влияний со стороны церебральных структур. У больных выявляются атонический паралич, отсутствие всех типов рефлексов и чувствительности ниже уровня травмы. Также отмечаются расстройства функций тазовых органов, быстро нарастающие трофические нарушения.
Вероятность смертельного исхода составляет до 25%. При успешном купировании неотложного осложнения могут появляться на этапе восстановления неврологических функций. Из-за необратимых повреждений нейронов в резидуальном периоде сохраняется дефицит моторных функций ниже поврежденного уровня, полное или диссоциативное расстройство чувствительности. Часть больных после перенесенного заболевания получают инвалидность.
Диагностика
Обследование начинается со стандартного осмотра врачом-неврологом. У пациента выявляются парезы и параличи, разнообразные нарушения чувствительности, арефлексия и другие симптомы цереброспинального поражения. На травму указывает локальная болезненность, признаки перелома позвонков, характерный анамнез. Для подтверждения диагноза применяются инструментальные и лабораторные методы:
Лечение отека спинного мозга
Консервативная терапия
Медикаментозное лечение проводится по общим принципам неотложной помощи в неврологии. Терапия направлена на снижение количества жидкости в интерстиции, за счет чего удается уменьшить компрессию органа, предупредить необратимые органические изменения. В лечении отека используется несколько групп препаратов:
При тяжелом состоянии, поражении мышц диафрагмы и шеи, угрозе развития дыхательной недостаточности необходим экстренный перевод пациента на ИВЛ. В качестве симптоматического лечения при отдельных состояниях, сопровождающихся отеком спинного мозга, назначаются антиконвульсанты, обезболивающие средства, противовоспалительные препараты. При проникающих травмах для предупреждения инфекционных осложнений показана антибиотикотерапия.
Хирургическое лечение
При травматическом или опухолевом генезе отека больному необходима квалифицированная помощь нейрохирургов. Тип и объем операции подбирается индивидуально: фиксация переломов позвонков пластинами или винтами, установка люмбального дренажа, иссечение новообразования и т. д. При сдавлении спинного мозга хирургическое вмешательство проводится в максимально ранние сроки, чтобы не допустить необратимых изменений.
Прогноз и профилактика
Отек спинного мозга имеет неблагоприятное течение, риск летального исхода в первые часы заболевания, а также высокую вероятность развития инвалидности в восстановительном периоде. Своевременное начало лечения значительно повышает шансы на восстановление неврологического дефицита. Профилактика состояния заключается в предупреждении травматизма, раннем выявлении и лечении опухолевых, нейродегенеративных, сосудистых заболеваний.
Отек костного мозга позвоночника
Специалисты ЦМРТ более 15 лет специализируются на диагностике и лечении заболеваний суставов. Читайте подробнее на странице Лечение суставов.
Ребра, грудина, тазовые кости, череп, позвонки, эпифизы длинных трубчатых костей являются вместилищем красного костного мозга. Избыточное депонирование жидкости (отек) в тканях последнего в сегментах позвоночника на уровне L1-5 может быть следствием травматизации или ряда заболеваний. Клинические проявления представлены симптомами основной патологии. Отек костного мозга поясничного отдела позвоночника обнаруживают с помощью магнитно-резонансного сканирования. Лечение преимущественно консервативное.
Рассказывает специалист ЦМРТ
Дата публикации: 16 Июля 2021 года
Дата проверки: 0 года
Содержание статьи
Причины отека костного мозга
Накопление жидкости происходит на фоне:
Если причину отека установить не представляется возможным, говорят об идиопатической форме. К факторам риска относят заболевания почек и сердца, связанные с задержкой жидкости в организме.
Симптомы отека костного мозга
Клиника обусловлена основной причиной и локализацией очага. Начальная стадия не имеет выраженной симптоматики, а отек костной ткани позвоночника можно диагностировать исключительно на МРТ. Без медицинской помощи нарушается кроветворение, что выражается снижением выработки форменных элементов. При длительном течении развивается анемия, появляются носовые кровотечения, “беспричинные” синяки на теле, слабость. Гипергидратация способствует увеличению объема губчатого вещества и разбуханию тела позвонка, что вызывает стеноз канала с компрессией спинного мозга и нервных волокон. Изменения могут сопровождать:
Классификация
Первичный отек костного мозга развивается после травмы на фоне проникновения из поврежденных кровеносных и лимфатических сосудов жидкости, вторичный — является следствием специфического заболевания вертебрального столба.
Как диагностировать
Жалобы неспецифичны и могут встречаться при других заболеваниях опорно-двигательного аппарата. Наиболее подходящим инструментом визуализации рассматривают магнитно-резонансную томографию. Отек костного мозга на МРТ позвоночника виден на доклинической стадии, когда симптомы отсутствуют. Сканирование показывает:
Отек костного мозга в шейном отделе позвоночника нередко сопровождается гидроцефалией. О трабекулярном отеке на фото МРТ свидетельствует деформация, деструкция позвонка. В отдельных случаях может потребоваться биопсия пораженной структуры.
К какому врачу обратиться
Пациентов с подобной проблемой могут вести несколько специалистов — невролог, ортопед-травматолог, вертебролог, онколог. После купирования острых явлений показана консультация реабилитолога.
Костно-мышечные нарушения в практике интерниста — диагностика, подходы к лечению
В статье представлены основные подходы к диагностике и лечению таких заболеваний костно-мышечной системы, как остеоартроз, боль в спине, периартикулярная патология. Отражены принципы нелекарственной и медикаментозной терапии.
The article presents main approaches to the diagnosis and treatment of diseases of the musculoskeletal system like osteoarthritis, back pain, periarticular pathology. The principles of non-pharmacological and pharmacological therapy were reflected.
Костно-мышечные нарушения широко распространены и встречаются во всех возрастных группах населения. Подавляющее большинство пациентов составляют лица среднего и пожилого возраста. Ведущей жалобой являются боли в суставах и спине, связанные с физической нагрузкой, появляющиеся и/или усиливающиеся во второй половине дня/первой половине ночи, уменьшающиеся в покое, при этом локальные и системные признаки воспаления выражены незначительно.
Типичными представителями группы костно-мышечных заболеваний являются остеоартроз (ОА), периартикулярная патология (энтезиты, бурситы, тендиниты и др.), неспецифическая боль в нижней части спины (БНС).
ОА — мультифакториальное заболевание, развитию которого способствуют генетические факторы, ожирение, гиподинамия, микротравматизация суставов, избыточные физические усилия, а также «большие» травмы суставов [1]. Согласно определению Международного общества по изучению остеоартрита (The Osteoarthritis Research Society International, OARSI) 2005 г., ОА — это расстройство с вовлечением подвижных суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, инициируемых микро- и макроповреждением, которые активируют неадекватные восстановительные ответы, включая провоспалительные пути иммунной системы [2].
В настоящее время описаны несколько фенотипов ОА [3].
ОА представляет гетерогенную группу заболеваний различной этиологии, при которых в процесс вовлекается не только суставной хрящ, но и субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы.
Прогрессирование ОА — следствие взаимодействия механических, биологических, биохимических и молекулярных факторов, нарушающих нормальный цикл синтеза и деградации хондроцитов суставного хряща, компонентов внеклеточного матрикса (ВМ) и субхондральной кости. В нормальном хряще существует баланс между синтезом и деградацией составляющих ВМ, тогда как при ОА динамическое равновесие нарушается в результате потери коллагена II типа. Помимо нарушений метаболизма хряща, изменений субхондральной кости в патогенезе ОА большая роль отводится воспалению. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита [4].
Взаимодействия цитокинов, ферментов, продуктов распада матрикса приводят к уменьшению содержания протеогликанов в хряще, нарушению архитектоники матрикса, появлению микротрещин и надрывов хряща. Эти процессы могут усиливаться при прорастании в хрящ сосудов микроциркуляторного русла. В воспалительный процесс вовлекаются синовиальная оболочка и субхондральная кость. На этом этапе возможно появление боли. Поскольку хрящ не иннервируется, боль является признаком вовлечения в патологический процесс периартикулярных тканей. Кроме того, источниками боли при ОА могут быть также синовит, трабекулярные микропереломы, давление на обнаженную субхондральную кость, формирование остеофитов, повышение внутрикостного давления в связи с венозным застоем, спазм близлежащих мышц, дегенеративные изменения связок [4].
Одной из наиболее значимых и инвалидизирующих форм ОА является гонартроз. Его основным симптомом является боль механического типа, возникающая при ходьбе и особенно при спуске или подъеме по лестнице. Боли локализуются в передней или внутренней частях сустава и могут иррадиировать в голень. Основное место отводится оценке болевого синдрома при ОА, клиническая палитра которого обусловлена различными его патогенетическими вариантами:
В качестве диагностических критериев ОА коленного сустава, в наибольшей мере отражающих клинические представления об этом заболевании, используются критерии M. Lequene:
Диагноз устанавливается при наличии всех трех признаков и исключении таких заболеваний, как ишемический некроз кости, костная болезнь Педжета, хондрокальциноз (пирофосфатная артропатия), гемохроматоз, охроноз, гемофилия, артриты, инфекции сустава (в т. ч. туберкулез), сустав Шарко (нейроартропатия), пигментный виллезонодулярный синовит, хондроматоз [4].
На современном этапе описаны факторы прогрессирования ОА:
У 85% больных ОА, согласно морфологическим данным, определяются воспалительные изменения в области «синовиоэнтезиального комплекса», что свидетельствует о тесной связи между синовией и периартикулярными структурами [5]. При описании периартикулярной патологии обычно используют следующие термины:
Бурсит — воспаление синовиальных сумок преимущественно в области суставов (субакромиальный, локтевого отростка, вертельный, препателлярный, сумки гусиной лапки (анзериновый)).
Тендинит — воспаление сухожилия (тендинит) и его влагалища (теносиновит) (двуглавой, надостной мышц, пяточного (ахиллового) сухожилия, инфрапателлярный).
Энтезопатия/энтезит — воспаление в местах прикрепления сухожилий, фасций, связок к костям, чаще всего в местах апофизов, бугристостей, мыщелков, отростков (латеральный и медиальный эпикондилиты).
Основные причины периартикулярной патологии (тендинитов и энтезитов):
Характерными клиническими особенностями периартикулярного поражения являются боль при определенных движениях и ее локальный характер (пациент указывает точку максимальной боли), уменьшение объема активных при сохранении объема пассивных движений, асимметрия сустава, связь отечности с конкретной бурсой, сухожильным влагалищем.
Анзериновый тендинит/бурсит (pes anserinus — место прикрепления к большеберцовой кости сухожилий портняжной (m. sartorius), тонкой (m. gracilis) и полусухожильной (m. semitendinosus) мышц. Анатомически находится на 3–4 см ниже проекции щели коленного сустава по медиальной его поверхности). Факторами риска развития тендинита являются спортивные нагрузки (бег), остеоартрит, разрыв мениска, ожирение, длительная ходьба, внезапное увеличение нагрузок на ноги, плоскостопие, сахарный диабет.
Для анзеринового тендинита характерны боль при подъеме по лестнице (при гонартрозе — усиление боли при спуске), лежа на боку, при укладывании одного колена на другое. Больной указывает на болезненную точку, соответствующую расположению анзериновой сумки, при пальпации отмечается выраженная болезненность и припухание (реже) в «заинтересованной» зоне.
Тендинит/бурсит большого вертела (трохантерит) — развивается чаще у женщин в возрасте 40–60 лет, страдающих ОА тазобедренного сустава. Для трохантерита характерна глубокая, жгучая боль по латеральной поверхности сустава и бедра, возрастающая при ходьбе по ровной поверхности и подъеме по лестнице, сидении на корточках, которая сочетается с хромотой у части больных. Постоянный характер боли указывает на вертельный бурсит. Снижение интенсивности боли отмечается в покое, усиливается по ночам, лежа на больной стороне. При осмотре отсутствуют ограничения пассивных и активных движений в тазобедренном суставе, отмечается локальная болезненность в зоне большого вертела при пальпации, при сопротивлении активному отведению бедра возникает боль.
Неспецифическая БНС является универсальной моделью костно-мышечных нарушений у пациентов всех возрастных групп, включающей поражение мышц, связок, суставного аппарата позвоночника. В появлении острой БС важную роль играет локальное повреждение связочного аппарата позвоночного столба, прежде всего коротких связок (желтых, межпоперечных и межостистых), стабилизирующих позвоночник на сегментарном уровне на фоне нефизиологических движений и чрезмерной нагрузки. Развитие мышечной дисфункции, энтезопатий, тендопатий вовлеченных мышц, сочетающихся с ОА дугоотростчатых суставов, спондилезом, лежит в основе развития хронической БС, при этом поддержание болевого синдрома у части больных обусловлено развитием феноменов периферической и центральной сенситизации (рис.) [5].
Миофасциальная дисфункция (миофасциальный синдром, МФС), ассоциированная с физической или позной нагрузкой, характеризуется формированием плотных болезненных тяжей и участков повышенной чувствительности (триггерных точек, ТТ) в пределах пораженной мышцы с воспроизведением паттерна отраженной боли или чувствительных расстройств (парестезий) при пальпации, а также ограничением объема движений.
МФС квадратной мышцы поясницы сопровождается болью в поясничной области глубинного характера с иррадиацией в крестцово-подвздошное сочленение и ягодичную область, при глубоком расположении ТТ — в бедро, область гребня подвздошной кости и паховую область. Формирование ТТ в квадратной мышце поясницы происходит при форсированных движениях, сопровождающихся наклоном и поворотом туловища, подъемом груза, а также при позном напряжении, связанном с садовыми работами. Болевые ощущения в поясничной области возникают и усиливаются при ходьбе, наклонах туловища, поворотах в постели, вставании со стула, кашле, чихании. Наиболее интенсивный характер боль приобретает в горизонтальном положении. Для выявления ТТ необходима глубокая пальпация в положении пациента лежа на здоровом боку. При выполнении наклона туловища в сторону, противоположную локализации спазмированной мышцы, болевой синдром усиливается [6].
МФС грушевидной мышцы характеризуется ноющими, тянущими, мозжащими болями в ягодичной области, в области крестцово-подвздошного сочленения, тазобедренного сустава и по задней поверхности больной ноги. Болевые феномены усиливаются после длительного сидения, в начале ходьбы, в положении стоя, полуприседании на корточках, при попытке приведения бедра. Уменьшение болей происходит в положении лежа, сидя с разведенными ногами, в процессе непродолжительной ходьбы. Объем движений в поясничном отделе позвоночника не изменен, поднимание прямой ноги часто ограничено. ТТ в грушевидной мышце наиболее часто активируются при движениях, связанных с форсированной ротацией на одной ноге, падениях, при длительном отведении ног в тазобедренных и сгибании в коленных суставах во время акушерских и урологических манипуляций.
Боль при спондилоартрозе локализуется в паравертебральной области, носит односторонний или двусторонний характер, может иррадиировать в ногу до уровня колена. Болевой синдром возникает после эпизодов длительной неподвижности, усиливается при разгибании, уменьшается при сгибании и движении, неврологические нарушения не характерны. Переразгибание позвоночника или сочетание разгибания с ротацией провоцирует боль (положительный тест Кемпа) [7].
Скрининговую оценку состояния опорно-двигательного аппарата (GALS — Gait — походка, Arm — рука, Leg — нога, Spine — позвоночник) рекомендуется проводить, учитывая следующие анамнестические сведения [8]:
В диагностике заболеваний суставного аппарата важное значение имеет оценка признаков непосредственного поражения сустава и периартикулярной патологии. В первом случае боль носит постоянный характер, присутствует в покое, усиливается при движении, сопровождается уменьшением объема как активных, так и пассивных движений, при объективном осмотре определяется выпот в суставе (реактивный синовит при ОА), утолщение синовиальной оболочки, интраартикулярный хруст.
Лечебная тактика при ОА, периартикулярной патологии, неспецифической БНС сводится к купированию болевого синдрома в максимально короткий срок с использованием нестероидных противовоспалительных препаратов (НПВП), оценка эффективности которых проводится через 7–14 дней от начала приема полной терапевтической дозы, предпочтителен пероральный способ применения. Для кратковременного лечения очень интенсивной острой боли и/или при невозможности перорального приема рекомендуется использование инъекционных форм НПВП продолжительностью не более трех дней. При слабой или умеренно выраженной боли, высоком риске осложнений при системном приеме НПВП применяются локальные формы НПВП (мази, гели, спреи) [5].
Алгоритм ведения пациентов с ОА включает соблюдение рекомендаций по снижению веса, сбалансированному питанию, лечебной физкультуре. При наличии реактивного синовита показан охранительный режим до купирования воспаления. Для сдерживания прогрессирования ОА показано курсовое применение базисной терапии (симптом-модифицирующие препараты замедленного действия). В качестве физиотерапевтического лечения используются бальнеотерапия, ультразвуковая терапия, магнитотерапия, электрофорез с глюкокортикостероидами (ГКС).
При наличии периартикулярного поражения рекомендуется ограничить активные движения с участием вовлеченных структур в течение 2–3 недель. Проводится периартикулярное введение ГКС при неэффективности НПВП, физиотерапевтические процедуры (фонофорез, электрофорез, криотерапия, магнитные токи, бальнеотерапия), лечебная физкультура. Локальные инъекции ГКС проводятся при наличии локального воспаления в области четко определенной анатомической структуры и отсутствии эффекта при использовании НПВП в течение как минимум 7–14 дней. Интервал между введениями ГКС должен составлять 2–3 недели, показано не более трех инъекций в одну область в течение 12 месяцев [5].
При неспецифической БНС постельный режим должен быть ограничен 72 часами. Медикаментозная терапия в остром периоде может носить многокомпонентный характер (НПВП, миорелаксанты коротким курсом до 10 дней, анальгетики). При наличии МФС предпочтение отдается назначению миорелаксантов, применению мануальных миорелаксирующих методик. Рекомендуется еженедельная оценка состояния при острой БНС или обострении хронической БНС. Коррекция тактики ведения (в т. ч. консультация невролога) при ее неэффективности проводится через 4–6 недель (при хроническом варианте течения — ежемесячный осмотр) [9].
Приоритет в терапии ОА отдается лекарственным средствам замедленного симптоматического действия (SYSADOA — Symptomatic Slow-Acting Drugs for Osteoarthritis). Последние характеризуются природным происхождением, наличием достоверных данных о клинической эффективности и низкой частотой нежелательных эффектов. В лечении ОА используют хондроитин сульфат, глюкозамин, неомыляемые соединения сои и авокадо, диацереин, гиалуроновую кислоту.
В клинической практике на протяжении нескольких десятилетий широко используется многокомпонентный препарат замедленного симптоматического действия, демонстрирующий высокую клиническую эффективность и безопасность, — Алфлутоп — стандартизированный раствор для инъекций на основе биоактивного концентрата из мелкой морской рыбы. В состав препарата входят сульфатированные глюкозаминогликаны, аналогичные матриксу гиалинового хряща: хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, глюкуроновая кислота, свободные аминокислоты, макро- и микроэлементы (натрий, калий, кальций, магний, железо, медь, цинк) (табл.).
Согласно новым экспериментальным данным, полученным in vitro, Алфлутоп демонстрирует патогенетический механизм действия при ОА.
Механизм действия препарата Алфлутоп:
Кроме того, в экспериментальных исследованиях на стандартизированной клеточной линии нормальных костных хондроцитов человека (CHON-001) доказано хондрорепаративное действие препарата Алфлутоп. Изучались пролиферативный статус (показателен для динамической клеточной регенерации) и внеклеточное высвобождение трансформирующего фактора роста бета (ТФР-β) — ключевого белка в гомеостазе внеклеточного матрикса. В ходе исследования Алфлутоп продемонстрировал активацию ТФР-β и улучшение клеточного пролиферативного индекса более чем на 50% по сравнению с контрольными клетками; препарат стимулирует синтез дезоксирибонуклеиновой кислоты и митоз хондроцитов, этот эффект носит дозозависимый характер [10].
Препарат Алфлутоп имеет широкий спектр клинической доказательной базы. С участием сотрудников кафедры факультетской терапии им. акад. А. И. Нестерова РНИМУ им. Н. И. Пирогова проведено двухлетнее многоцентровое слепое рандомизированное плацебо-контролируемое клиническое исследование по изучению симптом- и структурно-модифицирующего действия препарата Алфлутоп при гонартрозе [11]. В исследование были включены 90 больных ОА коленного сустава второй и третьей стадий по классификации Kellgren–Lawrence. Пациентов рандомизировали на две группы по 45 человек в каждой: первая получала внутримышечные инъекции Алфлутопа по 1 мл курсами по 20 дней с интервалом шесть месяцев в течение двух лет (всего четыре курса), вторая — инъекции плацебо (изотонический раствор натрия хлорида) по аналогичной схеме. В качестве сопутствующей терапии назначался ибупрофен в дозе 600–1200 мг/сут. Различия в абсолютной величине снижения интенсивности боли по индексу выраженности остеоартрита университетов Западного Онтарио и МакМастера (Western Ontario McMaster Universities OA Index — WOMAC) между группами оказались достоверными. Достоверное снижение скованности в группе Алфлутопа наблюдалось к третьему визиту (p
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
* Курс лечения целесообразно повторить через шесть месяцев.
Костно-мышечные нарушения в практике интерниста – диагностика, подходы к лечению/ Н. А. Шостак, Н. Г. Правдюк
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 68-73
Теги: болевой синдром, суставы, позвоночник, миофасциальный синдром

.gif)
.gif)