расслоение сосудов головного мозга
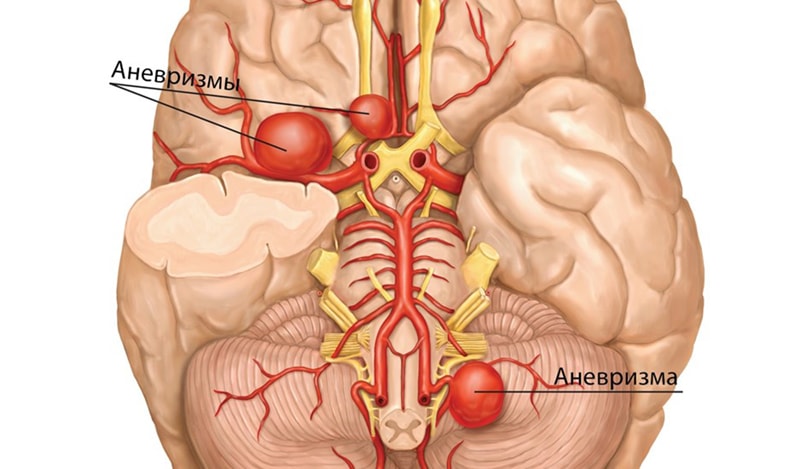
Аневризма сосудов головного мозга
Что такое аневризма?
Ещё совсем недавно аневризму головного мозга трудно было даже вовремя диагностировать, а уж тем более успешно лечить страдающих этим опасным заболеванием. Иногда промедление стоило пациентам жизни. Сегодня подобные проблемы уже позади, а врачи научились ставить диагноз ещё на стадии появления первых признаков заболевания.
Как же возникает аневризма и что из себя представляет?
Дело в том, что в результате нарушений различной этиологии стенки сосудов могут истончаться, а их структура претерпевать необратимые изменения. Следствием этого является расширение сосуда, его своеобразное выпячивание. Степень тяжести недуга может быть различной. Например, сосуд сильно выпирающий и наполненный кровью, может не только сдавливать ткани головного мозга, препятствуя его нормальной жизнедеятельности, но и рискует в любой момент попросту лопнуть, что может привести даже к летальному исходу. Локализация аневризмы может быть любой, но чаще всего образуется она в месте, где сосуды имеют разветвления.
На ширину сосуда и её патологическое изменение могут повлиять:
Существует несколько способов классифицировать заболевание. Например, по степени выпячивания стенки сосуда можно выделить боковую, веретенообразную и ягодную (мешотчатую) аневризму. А по размерам — гигантские (от 25 мм), средние (11-25 мм) и малые (до 11 мм). Кроме того, аневризма головного мозга может быть много- или однокамерной. Следует сказать, что женщины страдают от этого недуга наиболее часто, а первые симптомы они начинают чувствовать где-то после тридцати лет.
Без соответствующего лечения аневризма рано или поздно всё-таки разрывается, что в зависимости от её размера на этот момент неизбежно приводит к одному из следующих последствий:
Разрыв даже маленькой аневризмы является практически стопроцентной гарантией того, что подобное будет происходить и в будущем. Более того, повышается риск развития новых аневризм.
Частые симптомы аневризмы
Симптоматика этого заболевания неодинакова у пациентов с различной локализацией аневризмы. Большое значение имеют и её размеры. Чаще всего больной вообще не подозревает о проблеме до тех пор, пока выпирание сосуда не достигнет определённой степени. Тогда частыми становятся жалобы на:
О скором разрыве аневризмы могут предупреждать такие симптомы, как очень сильная, просто невыносимая головная боль, двоение предметов в глазах, тошнота и даже рвота, напряжение в затылочных мышцах. Когда кровоизлияние уже произошло, в особо тяжёлых случаях могут появиться судороги. Часты потери сознания, а иногда и кома.
Диагностика аневризмы мозгового сосуда
Сегодня в арсенале медиков много средств, которые могут диагностировать развитие аневризмы ещё на ранней стадии. Главное — не упустить момент и вовремя обратиться за помощью при появлении первых симптомов. Не менее важное значение имеет и профилактический осмотр. При подозрении на аневризму используют следующие методы точной диагностики:
Первые три исследования проводятся с помощью контрастного вещества.
Записаться на приём
Запишитесь на приём и получите качественное обследование головы в нашем центре
Лечение аневризмы и прогнозы относительно выздоровления
Насколько эффективным будет лечение в каждом конкретном случае появления аневризмы головного мозга, можно сказать только после того, как будут установлены основные характеристики заболевания:
Если аневризма на момент обращения имеет небольшие размеры, то первое время врач просто ставит пациента на учёт, а далее ведёт постоянное наблюдение за динамикой развития заболевания. При увеличении симптоматики лечение начинает проводиться такими методами, как клиппирование и окклюзия.
Опасность заболевания объясняется ещё и тем, что на сегодняшний день не существует профилактических мер, которые бы снизили вероятность появления аневризмы. Прогнозы относительно последствий разрыва полностью зависят от своевременности оказания первой помощи и тяжести кровоизлияния. Кроме того, немалое значение имеют расположение аневризмы и возраст больного.
Где проверить мозг на аневризмы в Москве
В нашем центре мы выполняем данное исселедование, позвонив нам по телефону 8(495) 407-01-40 или написав на почту mrttushino@mail.ru Вы сможете узнать сколько стоит МРТ головы. Мы удобно расположены по адресу: Москва, Волоколамское шоссе, дом 95.
Записаться на приём
Запишитесь на приём и получите качественное обследование мозга в нашем центре
Диссекция (расслоение) церебральных артерий и ишемический инсульт
Опубликовано в журнале:
«Атмосфера. Нервные болезни», 2011, № 2, с. 2-5
Диссекция церебральных артерий (ДЦА) является частой причиной ишемического инсульта в молодом возрасте. Ее доля среди прочих причин составляет 25% или более, что выше частоты кардиогенной эмболии и антифосфолипидного синдрома [1]. Интенсивное изучение ДЦА, показавшее ее высокую распространенность, началось в конце прошлого века, когда в клинике стала широко применяться неинвазивная ангиография (магнитно-резонансная и компьютерно-томографическая), обеспечившая прижизненную верификацию этого вида сосудистой патологии головного мозга. Ранее диссекция считалась раритетом, поскольку ее диагноз подтверждался, как правило, только патоморфологическим исследованием; последнее, однако, не отражало распространенность диссекции, так как обусловленный ею ишемический инсульт чаще всего имеет благоприятный для жизни исход [16, 21, 28]. В России целенаправленное изучение этой проблемы впервые началось в Научном центре неврологии РАМН также в конце прошлого века 5.
Основным клиническим проявлением ДЦА служат ишемические нарушения мозгового кровообращения (94%) (инсульты, преходящие нарушения мозгового кровообращения). Значительно реже, в 5% случаев по нашим данным и в 2,2–8% – по данным литературы [10, 11], диссекция проявляется изолированной головной или шейной болью. Это наблюдается при диссекции ВСА или ПА, когда ИМГ преимущественно распространяется в сторону адвентиции и не вызывает гемодинамически значимого сужения просвета артерии. Еще более редким клиническим проявлением диссекции (1% случаев) служит изолированное поражение черепных нервов, чаще всего каудальной группы [3, 22]. Причиной этого является нарушение кровообращения в питающих нерв артериях, которые отходят от артерии, подвергнувшейся диссекции. Иногда единственным проявлением диссекции ВСА может служить симптом Горнера, обусловленный повреждением периартериального симпатического сплетения [12, 17].
Нарушения мозгового кровообращения при диссекции представлены ишемическими инсультами и преходящими нарушениями мозгового кровообращения. Как правило, они развиваются у лиц, считавших себя практически здоровыми, за исключением того, что часть из них ранее страдали головными болями, обычно мигренеподобными. Развитие диссекции нередко провоцируется различными факторами, такими как ушиб, сотрясение головы, физическое напряжение, повороты, наклоны, запрокидывание головы, ее вынужденное неудобное положение, мануальная терапия на шейном отделе позвоночника, прием алкоголя, банальная инфекция, прием контрацептивов [2, 27].
Характерной особенностью ДЦА различной локализации является сочетание симптомов очаговой ишемии головного мозга с головной или шейной болью. Боль, как правило, регистрируется на стороне диссекции и при поражении экстракраниального отдела ВСА и ПА предшествует очаговым неврологическим симптомам инсульта на 3–4 нед, а при диссекции интракраниальных артерий обычно возникает почти одновременно с ними. Патофизиологической основой боли является раздражение рецепторов артериальной стенки развивающейся в ней гематомой. Очаговая неврологическая симптоматика определяется бассейном, в котором произошло нарушение мозгового кровообращения.
Прогноз для жизни в большинстве случаев благоприятный, летальный исход наблюдается, по нашим данным, в 4% случаев. На такую же частоту указывают и данные литературы [28]. Обычно летальный исход наступает при обширных инфарктах мозга вследствие диссекции интракраниальных артерий. У большинства больных наблюдается хорошее восстановление нарушенных функций. Диссекция церебральных артерий может рецидивировать. Частота рецидивов среди наших больных составила 6%, W.I. Schievink et al. [30] отмечают, что в течение 1-го месяца диссекция рецидивирует у 2% больных, в дальнейшем частота рецидивов составляет 1% в год. При этом риск повторных диссекций выше у больных с наследственной отягощенностью [24, 29].
Механизм развития нарушений мозгового кровообращения чаще всего связан с сосудисто-мозговой недостаточностью в условиях стенозирующе-окклюзирующего процесса, обусловленного диссекцией кровоснабжающих головной мозг артерий. Значительно реже он представлен артерио-артериальной эмболией из псевдоаневризмы, сформировавшейся вследствие диссекции. Некоторые авторы основное значение придают артериальной эмболии из места надрыва интимы [13, 20].
Важная роль в диагностике диссекций принадлежит ангиографии, особенно неинвазивной – магнитно-резонансной и компьютерной рентгеновской [2, 19, 26]. Патогномоничными симптомами диссекции магистральных артерий являются “симптом пламени свечи”, который обнаруживается при окклюзии или субтотальном стенозе ВСА вследствие “косого” отслоения интимы на 1–2 см выше ее устья, “симптом струны” – пролонгированное, достаточно равномерное сужение просвета артерии, “симптом четок, или нитки бус”, обусловленный неравномерным сужением просвета артерии на разных уровнях, наличие псевдоаневризмы. Частым признаком служит и постепенное, в течение 2–3 мес, полное или частичное восстановление проходимости по артерии, обусловленное рассасыванием ИМГ. Признаки атеросклеротического поражения артерий отсутствуют, иногда выявляются гемодинамически незначимые атеросклеротические бляшки. Нередкой находкой служат извитость и гипоплазия артерий. Большое диагностическое значение принадлежит магнитно-резонансной томографии шеи в режиме Т1 с подавлением сигнала от жировой ткани (T1 fs), позволяющей обнаружить ИМГ.
Морфологическое исследование артерий мозга при ДЦА позволяет выявить расслоение, истончение, а местами и отсутствие внутренней эластической мембраны, участки фиброза в интиме, неправильную ориентировку миоцитов в медии. Эти изменения обусловливают слабость сосудистой стенки, которая предрасполагает к надрыву интимы и диссекции [3, 4]. Предполагается, что причиной изменений сосудистой стенки служит генетически детерминированная слабость соединительной ткани, однако генетические исследования не дали положительных результатов [14]. Впервые в мире нами было предположено, что причиной слабости артериальной стенки служит митохондриальная цитопатия. Исследование биоптатов мышц и кожи подтвердило это предположение. При гистологическом и гистохимическом исследовании мышц обнаружены красные рваные волокна, снижение реакции на сукцинатдегидрогеназу и цитохромоксидазу, субсарколеммальный тип окрашивания в волокнах с сохранной реакцией. При электронно-микроскопическом исследовании артерий кожи выявлены изменения митохондрий, вакуолизацию, отложение жира, липофусцина и гликогена в клетках с измененными митохондриями, отложения кальция в экстраклеточном матриксе. Комплекс выявленных изменений, характерных для митохондриальную цитопатии, позволил предложить термин митохондриальная артериопатия – для обозначения патологии артерий, предрасполагающих к диссекции [8, 9].
Лечение ишемического инсульта, обусловленного диссекцией, окончательно не определено, так как отсутствуют рандомизированные плацебоконтролируемые исследования, выполненные на большом числе больных [18, 19, 23, 25]. Чаще всего рекомендуется введение прямых антикоагулянтов (АК) с последующим переходом на непрямые АК, которые применяются в течение 3–6 мес. Основой для такой рекомендации служит представление о том, что основным механизмом развития инсульта при диссекции служит артерио-артериальная эмболия. Согласно нашим данным, основным механизмом ДЦА является не эмболия, а сосудисто-мозговая недостаточность вследствие окклюзирующего процесса в артериях мозга, обусловленного диссекцией, в связи с чем строгие показания к назначению АК отсутствуют. Исход инсульта, по нашим данным, не зависит от того, применялись АК или нет. Более того, введение гепарина может привести к увеличению ИМГ и нарастанию окклюзирующего процесса в артериях головного мозга. Вместе с тем введение небольших доз гепарина теоретически может быть полезно, так как препятствует сворачиванию крови в области ИМГ и способствует ее разрешению. Абсолютные показания к назначению АК, по нашему мнению, существуют в случаях, когда инсульт развивается по механизму артерио-артериальной эмболии из псевдоаневризмы магистральных артерий головы, сформировавшейся вследствие диссекции.
В качестве альтернативы антикоагулянтам в остром периоде инсульта рекомендуется применение антиагрегантов, причем какие-либо различия в исходах инсульта, по предварительным данным, отсутствуют [25]. S.T. Engelter et al. [18] полагают, что при тяжелом ишемическом инсульте, обусловленном интракраниальной диссекцией, анамнестических указаниях на склонность к кровоточивости более оправданно применение антиагрегантов. С другой стороны, при окклюзии экстракраниальных артерий, вызванной диссекцией, при множественных эпизодах ишемии в одном и том же бассейне или при выявлении флотирующего тромба в месте разрыва интимы предпочтение следует отдавать антикоагулянтам [18].
Целесообразно подчеркнуть, что применение АК и антиагрегантов ограничивается периодом 2–3 мес, в течение которых происходит организация ИМГ. Дальнейший профилактический прием АК и антикоагулянтов нецелесообразен, так как причиной инсульта при диссекции служит не гиперкоагуляция, а слабость артериальной стенки.
Имеются описания тромболитической терапии при ДЦА с хорошим восстановлением нарушенных функций головного мозга. Однако отнести улучшение только на счет тромболизиса нельзя, так как для инсульта, обусловленного диссекцией, характерен хороший регресс очаговых неврологических симптомов вне зависимости от проведения тромболизиса [26].
В связи с тем, что основной причиной, предрасполагающей к развитию диссекции, является “слабость” артериальной стенки, лечебные мероприятия как в остром, так и в отдаленном периоде инсульта должны быть направлены и на ее “укрепление”. Учитывая наши данные о митохондриальной цитопатии, приводящей к энергетической недостаточности клеток артериальной стенки и ее дисплазии [8, 9], показано применение препаратов с трофическим и энерготропным действием. Одним из широко применяемых нами препаратов, как в остром, так и в отдаленном периоде инсульта при диссекции, служит Актовегин. Он представляет собой биологически активное вещество естественного происхождения – гемо-диализат крови телят. Основное действие Актовегина заключается в активации клеточного метаболизма, которое опосредуется его активными компонентами – инозитолфосфат-олигосахаридами. Они облегчают поступление кислорода и глюкозы в клетку, обеспечивая тем самым дополнительный приток энергетических субстратов и увеличивая в 18 раз продукцию аденозинтрифосфата – универсального донатора энергии, необходимой для жизнедеятельности клетки и ее функционирования. Универсальностью действия Актовегина объясняется широкий спектр его клинического применения. Клинические и экспериментальные исследования показали эффективность Актовегина при трофических повреждениях кожи, нарушениях кровообращения, гипоксическом повреждении миокарда, ишемии мозга [16]. Следует особо подчеркнуть, что применение Актовегина при ишемическом инсульте, обусловленном ДЦА, показано не только с целью “укрепления” сосудистой стенки, но и для улучшения метаболизма мозга после перенесенной ишемии. Актовегин назначается внутривенно капельно (250 мл – 2000 мг) в течение 10 дней с последующим переходом на прием препарата внутрь (1–2 драже 3 раза в день перед едой) в течение 1–1,5 мес. Используются и другие препараты с нейротрофическим действием для улучшения восстановления нарушенных вследствие инсульта функций: церебролизин, пирацетам, глиатилин (церепро), цераксон.
Наряду с медикаментозным лечением в остром периоде диссекции большое значение имеет соблюдение режима: следует избегать резких движений головой, травм, физического напряжения, натуживания, которые могут привести к нарастанию диссекции.
В заключение еще раз следует отметить, что диссекция артерий головного мозга является частой причиной ишемического инсульта в молодом возрасте и у детей, реже она служит причиной ишемического инсульта в старших возрастных категориях. Знание клинических и ангиографических особенностей данного вида сосудистой патологии головного мозга является основой для выбора лечения и проведения вторичной профилактики.
Лечение неразорвавшихся аневризм головного мозга
Общая информация
Краткое описание
Ассоциация нейрохирургов России
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ НЕРАЗОРВАВШИХСЯ АНЕВРИЗМ ГОЛОВНОГО МОЗГА (Москва, 2015)
Клинические рекомендации утверждены на Пленуме Правления Ассоциации нейрохирургов России 14.10.2015 г. Красноярск
Введение
В последние годы число обращений пациентов с неразорвавшимися аневризмами (НА) в нейрохирургические учреждения неуклонно возрастает. Опубликованные в зарубежной литературе серии по анализу этой патологии содержат до нескольких сотен, а кооперативные исследования – до нескольких тысяч больных.
Учитывая, что неразорвавшиеся аневризмы потенциально могут стать источником внутричерепного кровоизлияния, возникла необходимость определения тактики ведения и лечения этих больных. Единой точки зрения по этому вопросу не существует, хотя в последние годы рекомендации различных клиник все более совпадают по различным позициям и становятся более конкретными. Основной проблемой при выявлении неразорвавшейся аневризмы является оценка вероятного риска ее разрыва. Несмотря на опубликованные незначительные показатели первичных кровоизлияний из ранее неразорвавшихся аневризм [28, 75, 90], существуют группы больных с высоким риском разрыва аневризм. К таким факторам риска относят как морфологические особенности выявленной аневризмы (несколько куполов, неровность тела аневризмы, соотношение размера аневризмы к диаметру несущего сосуда, расположение, большой и гигантский размеры, увеличение размеров аневризмы с течением времени и т.д.), так и семейный анамнез кровоизлияния из аневризмы, наличие ряда вредных привычек, таких как курение, присутствие сопутствующих заболеваний (артериальная гипертензия). Существенное увеличение пациентов с диагностированными неразорвавшимися аневризмами в РФ и накопление значительного опыта хирургического лечения этой патологии явилось обоснованием для создания российского рекомендательного протокола по ведению и лечению больных с НА.
Этиология и патогенез
В настоящее время этиология и патогенез НА рассматриваются в рамках этиологии и патогенеза аневризм в целом. Факторы, лежащие в основе заболевания, принято делить на немодифицируемые и модифицируемые. К первым относят: генетические факторы [12, 26, 100]; ряд наследственных заболеваний [4, 9, 13, 19, 21, 84, 85, 99, 106, 120]; возраст и пол [6, 30, 31, 35, 40, 41, 62, 66, 71, 97, 103, 114, 115]. Во вторую группу входят: артериальная гипертония, курение, алкоголь, лекарства и вещества с симптомиметическим действием, пероральные контрацептивы [31, 32, 36, 45, 52, 53, 114]. Доказательность степени влияния этих факторов на формирование аневризм, в том числе, неразорвавшихся, различна.
Эпидемиология
Факторы и группы риска
Группы повышенного риска выявления НА
Пол и возраст
Частота выявления НА увеличивается с возрастом, достигая максимума в возрастной группе от 50 до 60 лет. Чаще аневризмы выявляются у женщин, в независимости от возрастной категории [6, 30, 31, 35, 40, 41, 62, 66, 71, 97, 103, 114, 115].
Сопутствующие заболевания
Пациенты с перечисленными ниже заболеваниями входят в группу повышенного риска обнаружения неразорвавшихся аневризм [4, 9, 13, 19, 21, 84, 85, 99, 106, 120]:
— аутосомно-доминантный поликистоз почек (частота обнаружения аневризм в 3-14 раз выше по сравнению с основной популяцией)
— синдром Элерса-Данло IV типа
— синдром Марфана
— коарктация аорты
— двустворчатый аортальный клапан
— эластическая псевдоксантома
— наследственная геморрагическая телеангиэктазия
— нейрофиброматоз 1 типа
— недостаточность α1-антитрипсина
— фиброзномышечная дисплазия
— феохромацитома
— сидром Кляйнфельтера
— туберозный склероз
— Синдром Нунан (наследственное сочетание стеноза клапанов лёгочной артерии, гипертелоризма, оттопыренных ушных раковин и др. нарушений)
— недостаточность α-глюкозидазы
— первичная карликовость с микроцефалией и остеодисплазией
— внутричерепные артериовенозные мальформации
«Семейные аневризмы»
По данным различных исследований [9, 55, 56, 76-78, 83, 86, 94] частота встречаемости «семейных аневризм» составляет от 7 до 20% в зависимости от различных методов оценки семейного анамнеза и анализа полученных данных. Чаще выявляют неразорвавшиеся аневризмы среди родственников первого поколения пациента с разрывом аневризмы – около 4% [74, 94], с некоторой большей встречаемостью среди сибсов пациента, чем среди его детей.
К факторам, повышающим вероятность обнаружения аневризмы среди родственников больного, перенесшего САК, относят следующие: старший возраст, женский пол, курение, наличие в анамнезе гипертонической болезни, гиперхолестеринемия, семейный анамнез поликистозной болезни почек, семейный анамнез наличия САК или аневризмы у 2 и более родственников [74]. Частота выявления неразорвавшихся аневризм у родственников первой степени родства при наличии в анамнезе аневризм и/или САК у 2 и более членов их семей составляет от 8,7% [76] до 19,1% (старше 30 лет, наличие таких отягощающих факторов, как курение и гипертоническая болезнь) [9].
Риск разрыва аневризмы
Таблица 1. Риск разрыва НА в зависимости от ее размера и локализации (по данным ISUIA [114]).
| Пятилетний кумулятивный риск разрыва в соответствии с размером и расположением аневризмы | |||||
| 7-12 мм | 13-24 мм | 25 мм | |||
| Группа 1 | Группа 2 | ||||
| Кавернозный отдел ВСА (n=210) | 0 | 0 | 0 | 3.0% | 6.4% |
| ПСА и ПМА/СМА/ВСА | |||||
(n=1037)
средняя мозговая артерия, ВСА – внутренняя сонная артерия, ВББ – вертебробазилярный бассейн, ЗМА – задняя мозговая артерия, ЗСА – задняя соединительная артерия
Группа 1 – пациентов без САК
Группа 2 – пациенты с САК в анамнезе при разрыве другой аневризмы
Предрасполагающие факторы риска разрыва аневризмы
Рост аневризмы
К факторам, ответственным за рост аневризм с течением времени, относят повышенное АД, гемодинамический стресс в зависимости от формы аневризмы и ее расположения, изначальный размер аневризмы, воспаление в стенке аневризмы, женский пол, курение, молодой возраст, избыточное употребление алкоголя. Отмечается повышенный риск роста аневризм у пациентов с наличием инсульта или транзиторной ишемической атакой в анамнезе, и при выявлении множественных аневризм [39, 58, 89].
Проспективное исследование, проведенное в США и включавшее пациентов с аневризмами диаметром менее 7 мм и без наличия САК в анамнезе (всего 319 аневризм) не зафиксировало ни одного разрыва аневризмы за период наблюдения в течение 2,4 лет. Однако за период наблюдения был отмечен рост аневризмы как минимум на 0,75 мм у 5,4% пациентов в течение года [10].
Отмечено, что ежегодный риск разрыва «растущей» аневризмы может превышать данный показатель у аневризмы без роста в 12 раз [58, 71, 104].
Морфологические параметры и локализация
Наибольшая частота кровоизлияний характерна для аневризм в вертебробазилярном бассейне, в области ПСА и перикаллезной артерии [111,121]. Аневризмы в области СМА менее подвержены риску разрыва.
Больший риск разрыва аневризмы отмечают при выявлении следующих морфологических параметров: больший размер, неправильная форма и/или наличие дивертикулов, узкая шейка аневризмы, соотношение максимального размера аневризмы к диаметру несущей артерии более 2,05, соотношение высоты аневризмы к диаметру шейки более 1,6 [47, 80, 111, 121].
Другие факторы
Факторами риска разрыва НА являются молодой возраст, курение, артериальная гипертензия, женский пол, наличие в анамнезе САК из другой аневризмы, семейный анамнез САК [10, 61].
Клиническая картина
Cимптомы, течение
НА наиболее часто определяются в ходе обследования больных после кровоизлияния из другой аневризмы, а также при наличии у больного неврологической симптоматики или возникновения внезапной головной боли или изменения ее характера. В исследовании ISUIA неразорвавшаяся аневризма была выявлена у пациентов в ходе обследования по поводу кровоизлияния из другой аневризмы (30.4%), головной боли (23.7%), ТИА или ОНМК по ишемическому типу (10.5% и 10.6% соответственно), поражения черепных нервов (8.0%), судорожных припадков (2.9%), появления симптомов объемного образования головного мозга (2.7%), субдуральной или внутримозговой гематомы (1.2%), опухоли головного мозга (0.8%), демиелинизирующих заболеваний головного мозга (0.4%) и неопределенных “приступов” (7.1%) [114].
Характер проявления НА влияет на естественное течение заболевания и на выбор тактики лечения. Отмечено, что среди неразорвавшихся симптомных аневризм риск кровоизлияния в 4 раза выше по сравнению с асимптомными, случайно выявленными, аневризмами [111].
Диагностика
Диагностика
Возможности методов нейровизуализации аневризм резко расширились в последнее десятилетие, включая применение дигитальной субтракционной ангиографии в 2D и 3D режимах, МР-ангиографии и КТ-ангиографии.
После выявления неразорвавшейся аневризмы необходимо оценить ее анатомические особенности (и, что возможно будет доступно в широкой практике в будущем, гемодинамические параметры) как при первичном исследовании, так и при обследовании в динамике для определения дальнейшей тактики лечения [22, 63, 122].
Методы обследования
Компьютерная томография в ангиографическом режиме (КТ-ангиография)
Чувствительность, специфичность и точность КТ-ангиографии в диагностике аневризм составляет 96.3%, 100% и 94.6% соответственно. При милиарных аневризмах размером менее 3 мм эти показатели составляют 81.8%, 100% и 93.3% соответственно [108].
При проведенном в 2003 мета-анализе 21 исследования, включавших 1251 пациентов, выявлено, что чувствительность и специфичность КТ-ангиографии составляет 93.3% и 87.8% соответственно в сравнении с цифровой церебральной ангиографией [14]. Выполнение КТ-ангиографии позволяет оценить наличие кальцификатов в стенке аневризмы и тромбов в ее полости [70]. Однако 3D-реконструкция может не совсем точно отражать истинную анатомию и размеры шейки/купола/несущего сосуда, особенно при аневризмах малых размеров (менее 5 мм) [29].
Дигитальная субтракционная ангиография (ДСА)
ДСА остается «золотым стандартом» в диагностике аневризм, особенно с введением в рутинную практику 3D-ротационной ангиографии, для выявления аневризм менее 3 мм и сосудов малого диаметра (в том числе, перфорирующих артерий) [20, 29, 46, 60, 91, 95, 101, 102, 116]. ДСА не может быть использована как скриннинговое исследование в связи с необходимостью госпитализации пациентов и наличием вероятных осложнений при проведении манипуляции, таких как аллергическая реакция на контраст, ОНМК по ишемическому типу, разрыв аневризмы, повреждение артерии, гематома в области пункции артерии и другие [34, 82]. Количество осложнения при проведении ДСА, включая постоянный неврологический дефицит у пациентов с аневризмами, САК и АВМ, не превышает 0.07% [17].
Проведение ДСА нецелесообразно [рекомендация] у пациентов с аутосомно-доминатным поликистозом почек, почечной недостаточностью, синдромом Элерса-Данло.
Анализ изображений [рекомендации]
При выявлении аневризмы, независимо от того, какой метод использовался, необходимо определить ряд параметров для уточнения тактики лечения и проведения динамического наблюдения. Необходимо оценить размеры шейки аневризмы, соотношение диаметра купола к диаметру шейки, угол расположения аневризмы относительно несущего сосуда (для латеральных аневризм), соотношение максимального размера купола к диаметру несущего сосуда, размеры аневризмы в 3 плоскостях [63].
Скриннинг
Определенные группы в популяции, имеющие повышенный риск обнаружения аневризм головного мозга, подлежат проведению скрининга. Пациент перед проведением обследования должен быть информирован о возможных последствиях как проведения самого исследования, так и различных видов лечения или консервативного лечения, включая такие психологические факторы, как стресс и тревогу, если аневризма будет обнаружена. Учитывая данные эпидемиологических исследований, можно рекомендовать проводить неинвазивные методы скрининга каждому человеку в общей популяции после 30 лет в независимости от наличия или отсутствия факторов риска обнаружения аневризмы. Если при первом обследовании данных за аневризму не обнаружено, повторное обследование можно рекомендовать по достижении 50 лет.
Лечение
Хирургическое лечение пациентов с неразорвавшимися аневризмами
Отбор пациентов с неразорвавшимися аневризмами на операцию [рекомендации]
Проведение операции по поводу НА сосудов головного мозга показано при наличии одного и/или нескольких следующих факторов риска разрыва аневризмы:
• размер аневризмы 7 и более мм
• несферическая форма и наличие дивертикулов
• латеральное расположение аневризмы
• коэффициент соотношения высоты купола аневризмы к диаметру шейки аневризмы более 1,6
• коэффициент соотношения максимального размера аневризмы к диаметру несущего сосуда более 2,05
• угол отклонения латеральной аневризмы от несущей артерии более 1120
• рост размера аневризмы на 0,75 мм и более в течение 6 месяцев
• появление новых клинических проявлений (симптомы поражения черепных нервов, появление и/или изменение характера головных болей, ишемические нарушения в бассейне несущей аневризму артерии)
• незамкнутость артериального круга большого мозга
• «перианевризматическое» окружение – контакт аневризмы с ТМО, костями черепа, черепными нервами, артериями и венами
• множественные аневризмы
• наличие в анамнезе кровоизлияния из другой аневризмы
• курение
• артериальная гипертензия
При выявлении у больного НА размерами 3 мм и менее хирургическое лечение не показано, больному необходимо проведение динамического наблюдения с повторными обследованиями через 6, 12 месяцев и затем каждые 2 года [стандарт]. Подобному же наблюдению подлежат пациенты, отказавшиеся от хирургического лечения [стандарт].
При выявлении аневризм размерами от 3 до 7 мм необходимо измерение морфологических параметров аневризмы, вопрос о проведении хирургического лечения принимается индивидуально с учетом факторов риска (возраст, пол, наличие в анамнезе курения, гипертонической болезни, наличие «семейного» анамнеза, наличие генетических заболеваний) [рекомендации].
Больной с НА должен быть информирован о характере болезни, возможных вариантах течения, возможных осложнениях хирургического вмешательства [стандарт].
Обследование в нейрохирургическом стационаре [рекомендации]
После поступления больного в специализированный нейрохирургический стационар, помимо общих клинических исследований, необходимо провести:
— подробный неврологический осмотр;
— КТ-АГ или МР-АГ головного мозга при поступлении в том случае, если: с момента предыдущего исследования прошло более 6 месяцев; отмечено изменение в неврологическом статусе больного за время с момента выявления аневризмы до госпитализации; качество ранее выполненных КТ и/или МРТ низкое.
— проведение ДСА (в 2D и 3D режимах) показано пациентам со «сложными» аневризмами для оценки их морфологических особенностей и выбором тактики хирургического лечения; также больным с аневризмами размерами менее 7 мм для оценки их морфологических параметров и уточнения рисков разрыва.
Хирургические вмешательства у пациентов с неразорвавшимися церебральными аневризмами [рекомендации]
1) Микрохирургическое лечение:
— пациенты в возрасте до 60 лет
— аневризмы доступной локализации
— аневризмы большого и гигантского размера, оказывающие объемное воздействие на окружающие структуры
— частично тромбированные аневризмы
— при необходимости выполнения комбинированных (микрохирургическое выключение аневризмы из кровотока и реваскуляризирующие вмешательства) операций.
2) Эндоваскулярное лечение:
— пациенты в возрасте старше 60 лет
— локализация аневризм в вертебробазилярном бассейне, в области кавернозного отдела или офтальмического сегмента ВСА
— наличие декомпенсированных соматических заболеваний
Интраоперационный контроль эффективности прямого хирургического вмешательства [рекомендации]
Для подтверждения радикальности клипирования аневризмы и состоятельности кровотока по несущей артерии и функционально значимым ветвям выполняют следующее:
— пункция аневризмы и/или вскрытие просвета аневризмы
— визуальная оценка области клипирования (через микроскоп и/или эндоскоп)
— контактная интраоперационной допплерографии/флуометрия
— интраоперационная ангиография с использованием индоцианина зеленого
Оценка результатов операции и исходов лечения больных, динамическое наблюдение за пациентами после выключения аневризмы из кровотока
Окончательную оценку исходов проводят в сроки не ранее 6 месяцев после операции. Более раннюю оценку (при выписке больного) выполняют как промежуточный этап. Оценку исходов лечения проводят по шкале исходов Глазго.
Пациентам с оперированными церебральными аневризмами, вне зависимости от типа хирургического вмешательства, необходимо проведение контрольных обследований для исключения повторного заполнения аневризмы, оценки остаточной заполняющейся части аневризмы, а также для выявления аневризм de novo [63] [стандарт].
Для проведения динамического наблюдения за пациентами после операции возможно выполнение МР-ангиографии, КТ-ангиографии или ДСА.
Несмотря на то, что применение МР-ангиографии и КТ-ангиографии ограничивается наличием возможных артефактов от металлических имплантов, таких как клипсы, стенты и спирали, эти методы остаются достаточно эффективными для послеоперационного контроля [1, 2, 48, 88, 92]. Напряженность поля при выполнении контрольной МР-ангиографии должна быть 1,5 Тесла [опция].
Применение КТ-ангиографии для динамического наблюдения может быть ограничено в связи с нежелательностью рентгеновского облучения у ряда пациентов [70, 79, 98, 107].
Использование ДСА в качестве контрольного обследования у пациентов с оперированными аневризмами ограничено в связи с инвазивностью обследования и наличием радиационной нагрузки [24, 76].
После проведенного хирургического лечения контрольную ДСА в ранние сроки (до 2 недель после операции) выполняют в том случае, если аневризма не была полностью выключена, при сомнении хирурга в радикальности проведенной операции, или при подозрении на миграцию наложенного клипса. Повторное исследование после микрохирургической операции необходимо провести в течение 6-12 месяцев после вмешательства [рекомендация].
После выполнения эндоваскулярного вмешательства необходимо выполнение контрольного обследования (ДСА) в период от 6 до 12 месяцев после операции [1, 2, 3, 48, 72, 87, 92] [рекомендации]. Время последующих контрольных обследований зависит от характера окклюзии аневризмы при вмешательстве и первом контрольном обследовании, а также от состояния пациента. При наличии резидуальной аневризмы после эмболизации или стентирования обязательно проведение обследований в отдаленном периоде, так как возможны кровоизлияния и рост остаточной части аневризмы. Показано проведение серии контрольных обследований при аневризмах с широкой шейкой, больших и гигантских аневризмах, так как у них имеется высокий риск повторного заполнения [10, 93].
Всем пациентам, входящим в популяционные группы риска по формированию аневризм, независимо от вида оперативного вмешательства, после завершения периода наблюдения можно рекомендовать выполнение неинвазивных методов обследования (МР- или КТ-ангиографии) 1 раз в 5 лет для исключения формирования аневризм de novo [рекомендация].
Динамическое наблюдение за пациентами с неразорвавшимися церебральными аневризмами, не получавшими хирургического лечения [рекомендации]
Пациентам с неразорвавшимися аневризмами сосудов головного мозга, которые не получали хирургического лечения, необходимо проведение нейровизуализационного обследования в динамике для исключения роста аневризмы, изменения ее формы и появление других факторов риска ее разрыва [4, 11, 24, 25, 37, 42, 59, 64].
1) При отсутствии противопоказаний основной методикой для проведения динамического наблюдения является TOF MRA (времяпролётная магнитно-резонансная ангиография), а также у пациентов с почечной недостаточностью и тем, у кого имеет значение доза полученного рентгеновского облучения.
2) КТ-ангиография головного мозга является методом выбора у пациентов с противопоказаниями к проведению МРТ или при наличии аневризм, которые не могут быть правильно оценены с помощью МРТ (милиарные аневризмы менее 3 мм, «сложные» аневризмы).
3) Первое динамическое обследование после выявления неразорвавшейся аневризмы необходимо проводить в период от 6 до 12 месяцев [8, 33, 56, 112, 113]. Затем рекомендуется проводить обследование 1 раз в год или каждые 2 года при отсутствии признаков роста аневризмы и/или изменения ее других морфологических параметров (формы, расположение относительно несущего сосуда и т.д.) [113].
Госпитализация
Больного с неразорвавшейся аневризмой сосудов головного мозга, при наличии показаний к хирургическому лечению, необходимо госпитализировать в плановом порядке в стационары, где имеются:
— нейрохирургическое отделение;
— специалисты, владеющие опытом прямых микрохирургических операций по поводу церебральных аневризм;
— специалисты, владеющие опытом эндоваскулярного выключения аневризм;
— отделение лучевой диагностики, оснащенное аппаратурой для проведения КТ или МРТ, спиральной КТ-ангиографии, МР-ангиографии, ангиографическая операционная для проведения ДСА и выполнения эндовазальных операций;
— операционная, оснащенная оборудованием для микрохирургии церебральных аневризм (операционный микроскоп, микрохирургический инструментарий, съемные и постоянные немагнитные клипсы);
— отделение нейрореанимации.
Информация
Источники и литература
Информация
| Крылов Владимир Викторович | академик РАН, профессор, доктор медицинских наук, заведующий научным отделением неотложной нейрохирургии НИИ скорой помощи им. Н.В. Склифосовского, заведующий кафедрой нейрохирургии и нейрореанимации Московского государственного медико-стоматологического университета им. А.И. Евдокимова, главный внештатный специалист нейрохирург Министерства Здравоохранения Российской Федерации |
| Элиава Шалва Шалвович | Доктор медицинских наук, профессор, заведующий отделением сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко |
| Яковлев Сергей Борисович | Доктор медицинских наук, заведующий отделением эндоваскулярной нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко |
| Хейреддин Али Садек | Доктор медицинских наук, врач отделения сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко |
| Белоусова Ольга Бенуановна | Доктор медицинских наук, ведущий научный сотрудник отделения сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко |
| Полунина Наталья Алексеевна | Кандидат медицинских наук, научный сотрудник отделения неотложной нейрохирургии НИИ СП им. Н.В. Склифосовского |
Определение понятий
Стандарт
Общепринятые принципы диагностики и лечения, которые могут рассматриваться в качестве обязательной лечебной тактики (эффективность подтверждена несколькими рандомизированными исследованиями, мета-анализами или когортными клиническими исследованиями).
Рекомендация
Лечебные и диагностические мероприятия, рекомендованные к использованию большинством экспертов по данным вопросам. Могут рассматриваться как варианты выбора лечения в конкретных клинических ситуациях (эффективность подтверждена отдельными рандомизированными исследованиями или когортными клиническими исследованиями).
Опция
Лечебные и диагностические мероприятия, которые могут быть полезны (эффективность подтверждена мнением отдельных экспертов, в отдельных клинических случаях).
Не рекомендуется
Лечебные и диагностические мероприятия, не имеющие положительного эффекта или могущие принести вред (любой уровень подтверждения).