нер 2 негативный что означает
HER2- статус рака молочной железы
Рак молочной железы является основной причиной онкологической смертности среди женщин в мире. Он составляет почти 11% от числа всех онкологических заболеваний и занимает первое место в мире по распространенности. К счастью, во многих развитых странах смертность от рака молочной железы значительно снизилась за последние 20 лет, что обусловлено как появлением новых лекарственных средств (химиотерапии и биологических веществ), так и улучшением скрининга и раннего выявления опухолей.
Рецептор человеческого эпидермального фактора роста 2 типа (HER2)
HER2 представляет собой трансмембранный белок, играющий ключевую роль в передаче сигналов факторов роста. HER2 входит в семейство HER-белков, включающих рецепторы факторов роста четырех типов: HER1 (также известный как рецептор эпидермального фактора роста EGFR), HER2, HER3, HER4.
В здоровой ткани HER2 передает сигналы, регулирующие пролиферацию и выживаемость клеток, но гиперэкспрессия HER2 может обусловить злокачественную трансформацию клеток. Связь гиперэкспрессии HER2 и канцерогенеза лучше изучена на модели рака молочной железы, однако HER2 также является важным маркером рака желудка и пищеводно-желудочного перехода (16% рака желудка или пищеводно-желудочного перехода являются HER2-позитивными, то есть в них регистрируется гиперэкспрессия белка (ИГХ 2+/FISH-положительный или ИГХ 3+)).
Актуальные подходы к лечению рака молочной железы сегодня включают комбинацию химиотерапии, гормонального лечения, применения биологически препаратов и хирургического лечения и/или радиотерапии. Для пациентов с HER2-позитивными опухолями ранних стадий или метастатическим раком молочной железы таргетная анти-HER2-терапия в сочетании с химиотерапией является современным стандартом лечения.
Несмотря на то, что HER2-положительный статус является показателем более агрессивного течения опухоли, добавление анти-HER2 препаратов к химиотерапии улучшает течение заболевания у многих пациентов.
Методы определения HER2-статуса
ИГХ представляет собой метод микроскопии в светлом поле и позволяет одновременно с определением HER2-статуса оценить морфологию ткани, также является относительно простым, быстрым и недорогим методом и используется в большинстве патологоанатомических лабораторий
Однако нецелесообразно использовать ИГХ как единственный метод при неопределенном результате тестирования. Критерии оценки ИГХ являются субъективными и полуколичественными, что приводит к появлению ложно-положительных и ложно-отрицательных результатов.
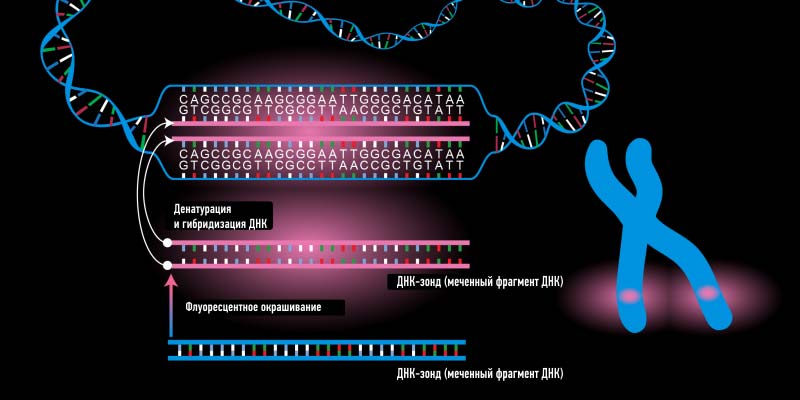
Образцы, оцененные как ИГХ2+, должны быть повторно протестированы с помощью гибридизации in situ для получения точного результата.
При этом зонд HER2 связывается с локусом гена HER2 на 17 хромосоме, а зонд CEP17 связывается с центромерным участком 17 хромосомы. Результат оценивается как соотношение числа копий гена HER2 к числу копий 17 хромосомы. FISH-положительным считается образец, в котором соотношение HER2:CEP17 больше или равно 2,0.
Гибридизация in situ часто используется для подтверждения неопределенных результатов ИГХ, но также может быть использована как начальный метод определения HER2 статуса опухоли молочной железы. Пациентки, чьи образцы оценены как положительные при гибридизации in situ при первичном ISH тестировании, направляются на анти-HER2-терапию. Когда ИГХ используется в качестве исходной методологии тестирования, гибридизация in situ должна выполняться при всех ИГХ 2 + результатах для подтверждения HER2 статуса и определения количественной оценки амплификации гена HER2.
Метод FISH менее чувствителен к вариациям предварительной обработки на преаналитическом этапе и этапе сбора материала; его интерпретация более объективная и количественная, чем при ИГХ. Метод FISH позволяет определить HER2- положительные случаи внутри неопределенной категории (ИГХ 2+). Однако иногда явление полисомии обуславливает появление ложно-отрицательных результатов гибридизации in situ при ИГХ 3+.
Таргетная терапия наиболее эффективна у пациенток с гиперэкспрессией HER2 (ИГХ 3 + или ИГХ 2 + / ISH-положительные). Считается, что пациентки, образцы которых были оценены как ИГХ 3 + имеют положительный HER2 статус, а ИГХ 0/1 + имеют отрицательный. ИГХ 2 + образцы считаются неопределенными и должны быть повторно протестированы с помощью гибридизации in situ. Образцы ИГХ 2 + / ISH-положительные, классифицируются как HER2-позитивные.
При наличии сомнений относительно результата, оцененного как ИГХ 3+ проводят повторное определение HER2 статуса с использованием другого метода.
Стоимость и срок исследования
| Наименование | Срок | Стоимость, руб. |
|---|---|---|
| Иммуногистохимическое исследование (1 ИГХ реакция HER2) | от 3 дней | 5500* |
| Определение амплификации HER2/neu методом FISH | от 10 дней | 20125 |
*Цена указана без учета услуг по доставке материала в лабораторию.
По всем возникшим вопросам Вы можете проконсультироваться у нашего медицинского администратора по телефону: 8-800-555-92-67 или написать нам в WhatsApp: +7 925 740 05 87
Рак груди и HER 2
Прежде чем приступить к лекарственному лечению рака молочной железы, необходимо составить так называемый «биологический портрет опухоли». В этот комплекс входит определение рецепторного статуса опухоли, индекса пролиферативной активности ki-67 и статус HER 2.
Определение HER 2 статуса опухоли и FISH-тест
Дальше следует анализ опухоли на амплификацию гена. Он называется методом внутриклеточной флуоресцентной гибридизации или аббревиатурой FISH от английского fluorescence in situ hybridization. При FISH-тесте «рассматривают» в ядре опухолевой клетки саму ДНК, в которой флуоресцентные метки соединились с геном HER2. Светящиеся метки контактируют со всеми копиями гена, во флуоресцентный микроскоп видно, что копий гена больше, чем необходимо. Тест FISH выдаёт такие варианты ответа:
Механизм работы трастузумаба понятен не до конца. Предполагают, что он активирует Т-лимфоциты, поэтому при большом количестве Т-лимфоцитов в опухоли, трастузумаб не работает. Большое число Т-лимфоцитов, собравшихся вокруг клеток опухоли, как бы сигнализируют ему: «Место уже занято, борьба с опухолью идёт, больше тут делать нечего». А вот когда Т-лимфоциты не населяют опухоль, трастузумаб оказывается полезным.
В конечном итоге трастузумаб каким-то образом пресекает взаимодействие рецептора с фактором роста, поэтому опухолевая клетка не получает сигнала о делении, а чувствительность к гормональным препаратам и цитостатикам повышается.
Трастузумаб сопровождает цитостатическую и гормональную терапию, эффект от использования его в качестве единственного лекарства против рака молочной железы очень скромен.
Рекомендации обязывают использовать трастузумаб при наличии гена HER2 при любом противоопухолевом лечении пока только на протяжении года, но изучение результатов 6-месячной терапии продолжается. Препарат значимо удорожает лечение – 17 введений в течение года обходятся очень недёшево, поэтому исследователи стараются найти оптимальное соотношение длительности лечения и его эффективности.
Кардиотоксичность герцептина
Препарат герцептин обладает токсическим действием на миокард сердца, вызывая хроническую сердечную недостаточность и патологическое расширение желудочков сердца больше чем у трети больных. Женщинам с исходной сердечной патологией лечение проводят под контролем ЭХО-ЭКГ и в сокращённом режиме.
По большому счёту, каждая женщина, получающая химиотерапию с трастузумабом, должна иметь не только личного врача-химиотерапевта, но и личного врача-кардиолога, ориентированного в превратностях влияния противоопухолевых лекарств на сердечно-сосудистую систему.
Парадоксально, но в штатах государственных онкологических учреждений нет кардиологов, обычные кардиологи поликлиник и кардиологических диспансеров прекрасно разбираются в болезнях сердца, но не знают, какой противоопухолевый препарат какую патологию сердечно-сосудистой системы вызывает.
Кардиологи Юсуповской больницы не просто ориентированы, они специализируются на проблемах токсических повреждений миокарда, возникающих в процессе химиотерапии. Они всегда готовы оказать высококвалифицированную помощь и нацелены на профилактику патологии сердца.
Анти-HER2 терапия в лечении рака молочной железы
Анти-HER2 терапия в лечении рака молочной железы
Процессы роста и размножения всех клеток в организме находятся под жестким регулирующим контролем генов, которые способных запускать или останавливать их. В норме в организме поддерживается баланс между появлением новых клеток и гибелью старых. В опухолевых клетках процессы размножения клеток выходят из под контроля. Зачастую это происходит по причине возникновения «сбоев» в работе определенных генов, играющих наиболее важную роль в контроле над делением клеток.
HER2 (аббревиатура от английского human epidermal growth factor receptor 2 – рецептор фактора роста эпидермиса) является одним из таких генов. Этот ген может также обозначаться как «HER2-neu» или «ERBB2», эти названия являются синонимами. Его неправильная работа обнаруживается во многих случаях развития рака молочной железы и приводит к активной выработке в клетках одноименного белка (HER2), что заставляет клетки быстро делиться. Когда в клетке образуется избыточное количество белка HER2, говорят об амплификации этого гена. Амплификация HER2 обнаруживается примерно у 25% пациенток с диагнозом рака молочной железы. Её наличие приводит к повышению агрессивности опухолевых клеток. Вследствие высокой важности знания HER2-статуса опухоли, определение наличия амплификации HER2 является или избыточной выработки белка HER2 является одним из стандартных методов обследования, и проводится у всех пациенток с диагнозом рака молочной железы. Кроме того, в ряде исследований была продемонстрирована клиническая значимость выработки HER2 при раке желудка, по этой причине препараты, подавляющие активность этого белка также применяются для лечения рака желудка.
В чем особенности HER2-положительного рака молочной железы?
Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, который характеризовался очень быстрым темпом роста опухоли, высоким риском развития рецидива болезни и появления отдаленных метастазов. Тем не менее, в настоящее время разработано множество препаратов, подавляющих активность этого белка (см. ниже). Они продемонстрировали высокую эффективность в лечении HER2-положительного рака молочной железы, превратив этот подтип рака в один из относительно благоприятных вариантов заболевания. Проведение целенаправленной («таргетной») терапии, блокирующей активность HER2, позволяет значительно повысить эффективность лечения и резко снизить риск развития рецидива рака молочной железы или добиться длительного контроля над болезнью в случае лечения её поздних стадий.
Кому назначаются препараты, блокирующие активность HER2?
Необходимо отметить, что применение препаратов, блокирующих активность HER2, целесообразно только в том случае, если в опухоли есть повышенная выработка этого белка вследствие наличия амплификации гена HER2. Если она отсутствует, раковые клетки не вырабатывают этот белок, следовательно, назначение препаратов, блокирующих активность этого белка не приведет к желаемому результату. По этой причине перед началом лечения всем пациенткам с диагнозом рака молочной железы перед началом лечения проводится специальное обследование, направленное на определение повышенной выработки HER2. Эта информация критически важна для правильного лечения рака молочной железы.
Как определяется HER2 статус опухоли?
В процессе диагностики рака молочной железы небольшой кусочек опухолевой ткани путем биопсии забирается для проведения иммуногистохимического исследования. Как правило, одновременно проводится определение наличия экспрессии (выработки) опухолевыми клетками рецепторов женских половых гормонов, HER2-статуса опухолевых клеток, а также темпов её роста (индекс Ki-67). При проведении этого исследования на опухолевые клетки наносятся специальные «красители», которые окрашивают HER2 в случаях, когда он содержится в клетках в большом количестве. Иммуногистохимическое исследование оценивает наличие гиперпродукции белка HER2 опухолевыми клетками.
По результатам иммуногистохимического определения HER2 статуса опухоли может быть получен один из следующих результатов:
0 баллов – в опухоли не отмечено признаков экспрессии HER2 (результат исследования отрицательный, назначение анти-HER2 препаратов нецелесообразно);
Если по результатам иммуногистохимического исследования была выявлена выраженная экспрессия HER2 (3+), пациентке показано назначение препаратов, блокирующих активность этого белка, так как опухолевые клетки активно вырабатывают этот белок и процессы их роста зависят от его функционирования. Если результат исследования отрицательный (0 или 1+) назначение такого лечения не приведет к желаемому результату.
Получение сомнительного результата (2+) означает, что по результатам иммуногистохимического исследования достоверно определить наличие экспрессии HER2 не удалось и необходимо проведение дополнительных методов исследования, например, т.н. «флюоресцентной гибридизации in situ» (FISH) или схожего с ней метода CISH. Эти методы позволяют напрямую оценить наличие амплификации HER2. По результатам проведения этих тестов может быть получен положительный или отрицательный ответ. Положительный ответ означает, что была выявлена амплификации HER2 и целесообразно назначение анти-HER2 терапии.
Какие существуют лекарственные препараты для лечения HER2-позитивного рака молочной железы?
На данный момент разработано и внедрено в клиническую практику 4 препарата, подавляющих активность HER2. Они несколько различаются по структуре и механизму действия, а также по показаниям к применению, эти лекарства могут назначаться как в комбинации с другими препаратами, например химиотерапевтическими агентами, так и самостоятельно (в монотерапии). В этом разделе представлено краткое описание этих препаратов.
Трастузумаб – лекарственный препарат, который представляет собой белок (моноклональное антитело), сконструированный таким образом, чтобы избирательно связываться с HER2 и «закрывать» его, не давая ему возможности нормально функционировать и провоцировать процессы роста и деления опухолевых клеток. Трастузумаб является препаратом, который наиболее часто назначается пациенткам с HER2-положительным раком молочной железы. Он применяется в сочетании с химиотерапией в качестве пред- или послеоперационной терапии данного заболевания, а также для первоначального лечения поздних его поздних стадий. Препарат выпускается как в виде раствора для внутривенных капельных введений, так и в виде раствора для подкожных введений. Трастузумаб-эмтанзин (T-DM1) – комбинированный препарат, который содержит молекулы трастузумаба, соединенные с противоопухолевым препаратом эмтанзином, который оказывает губительное действие на клетки. Препарат сконструирован таким образом, что молекулы трастузумаба связываются со своей мишенью на поверхности опухолевых клеток, после чего эмтанзин проникает в них и вызывает гибель раковых клеток. Помимо лечения рака молочной железы трастузумаб также применяется для лечения рака желудка в случае выявления в опухоли гиперэкспрессии HER2. Препарат вводится внутривенно капельно.
Пертузумаб – также как и трастузумаб, пертузумаб представляет собой моноклональное антитело к HER2, однако в отличие от трастузумаба он связывается с другим участком этого белка. Препарат назначается в комбинации с трастузумабом и позволяет повысить эффективность лечения. Препарат вводится внутривенно капельно.
Лапатиниб – препарат, блокирующий сигнальный путь, который проводит сигналы от HER2. Препарат применяется для лечения пациенток, у которых было отмечено прогрессирование на фоне применения режимов лечения с использованием трастузумаба, а также для лечения HER2-положительного гормонозависимого рака молочной железы, в этом случае лапатиниб применяется в комбинации с гормонотерапией. Препарат выпускается в виде таблеток и принимается внутрь.
Указанные препараты назначаются только пациенткам с HER2-положительными опухолями (экспрессия HER2 3+ при проведении иммуногистохимического исследования или выявленная амплификация гена при проведении FISH или схожего метода исследования).
Может ли HER2 статус изменяться в процессе проведения лечения?
Необходимо отметить, что HER2 статус опухоли может меняться в процессе проведения лечения как результат изменений, происходящих в раковых клетках. Клетки опухоли ищут способ выжить на фоне проводимой терапии и постоянно изменяются. Например, в случае, если произошел рецидив исходно HER2-положительной опухоли, во вновь выявленных опухолевых очагах может отмечаться исчезновение выработки этого белка и утрата зависимости опухолевых клеток от влияния этого гена. Возможно и обратное – появление гиперэкспрессии HER2 в опухолях, которые исходно не вырабатывали этот белок. По этой причине в случае развития рецидивов или появления метастазов врач может рекомендовать повторное проведение биопсии и проведение нового тестирования для определения HER2 статуса опухоли.
HER2 положительный рак молочной железы
Один из распространенных видов рака – это рак молочной железы у женщин. Каждые пять минут в мире умирают три женщины от рака груди. HER2 положительный – это молекулярный подтип рака молочной железы. Опухоль HER2 может быть положительной и отрицательной. HER2 положительный подтип характеризуется развитием эстроген-независимой агрессивной опухоли, с выраженным процессом образования дополнительных копий определенных участков хромосомной ДНК. При развитии такого типа рака молочной железы существует повышенный риск негативного исхода заболевания.
В онкологическом отделении Юсуповской больницы проводится обследование женщин с подозрением на рак молочной железы на инновационном оборудовании известных производителей медицинского оборудования в мире. Раннее обнаружение рака молочной железы увеличивает шансы женщины на благополучный исход заболевания. Каждой женщине следует проходить один, два раза в год осмотр у врача-гинеколога, делать маммографию, проводить ежедневный осмотр молочных желез перед зеркалом. При появлении узелков в молочной железе, изменении положения соска, цвета кожи груди следует обратиться к врачу-онкологу.
Молекулярный тип рака груди определяется по наличию рецепторов на поверхности клетки. HER2 определяется по рецептору человеческого эпидермального фактора роста 2, обнаруживается у 20% женщин, болеющих раком молочной железы. HER2 положительный – это более агрессивная форма рака в отличие от HER2 отрицательного. Опухоль HER2 отрицательная встречается у 80 % заболевших раком молочной железы женщин, характеризуется отрицательным статусом рецепторов человеческого эпидермального фактора роста 2.
Рак молочной железы HER2 позитивный: симптомы
Симптомы положительного HER2 зависят от стадии развития опухоли. Опухоль отличается агрессивным ростом, имеет большое количество рецепторов к белку HER2. На ранней стадии развития диагностируется редко, случайно обнаруживается во время обследования или профилактического осмотра. Диагностируется опухоль с помощью маммографии, УЗИ, МРТ. В большинстве случаев рак молочной железы диагностируется после появления первых симптомов. Выраженные симптомы проявляются на поздних стадиях развития опухоли. Появляются уплотнения в подмышечных лимфоузлах, уплотнение в молочной железе, боль, дискомфорт, выделения из соска, изменяется положение соска, цвет кожи груди над местом поражения.
HER2 позитивный рак молочной железы: выживаемость
Выживаемость при раке груди зависит от многих факторов:
Около 60% женщин обращается за помощью на 2 ранней стадии развития рака молочной железы, около 30% обращаются на третьей стадии развития опухоли. Позднее обращение к онкологу повышает риск негативного исхода, шанс на выживание на протяжении 5 лет есть у 15 % поздно обратившихся женщин. HER2 позитивный рак молочной железы, прогноз при котором неблагоприятный, характеризуется более частыми рецидивами, в отличие от трижды негативного рака молочной железы.
HER2 негативный рак молочной железы
Согласно исследованиям, проведенным в США, более чем в 75% случаев поздней диагностики рака молочной железы определяется HER2 негативный рак. При исследованиях рака молочной железы выделены следующие иммуногистохимические подтипы рака:
Трижды негативный рак не характеризуется экспрессией HER2, в группу негативного подтипа рака входят заболевания с благоприятным прогнозом (варианты слизистого, тубулярного, медуллярного рака) и неблагоприятно протекающий рак (протоковый тип злокачественной опухоли).
Лечение HER2 положительного рака молочной железы
Одной из причин гибели женщин при раке молочной железы становятся метастазы опухоли. Для лечения положительного подтипа опухоли HER2 применяют хирургическое лечение с последующим проведением гормонотерапии, химиотерапии или проводят предоперационную неоадъювантную терапию. Адъювантная терапия трастузумабом при данном типе рака позволяет увеличить показатель выживаемости женщин больных позитивным HER2 раком. HER2 положительный подтип имеет высокую чувствительность к антрациклинам, в то же время антрациклины обладают высокой кардиотоксичностью. Совместное применение трастузумаба и антрациклинов усиливает токсическое воздействие на сердце, в случае риска развития осложнений трастузумаб рекомендован как монотерапия после проведения лечения по схеме АС. Для адъювантной химиотерапии при HER2 положительном подтипе, в результате исследований был рекомендован режим АС с последующим применением других препаратов химиотерапии. Исследователи добивались снижения токсического воздействия препаратов на организм женщины.
HER позитивный рак молочной железы: схема АС
Схема АС – это лечение с помощью доксорубицина, циклофосфамида, а также паклитаксела в некоторых странах. Исследователи проводили лечение рака молочной железы различными методами – это могло быть первоначальное лечение химиотерапией, затем проведение операции. Или проведение операции по удалению опухоли груди, затем применение адъювантной терапии. Варианты с применением неоадъювантной терапии:
Высокая эффективность отмечена во втором варианте лечения. После неоадъювантной терапии по второму варианту чаще проводились органосохраняющие операции, часто наблюдался полный регресс злокачественной опухоли. В Юсуповской больнице проводят лечение злокачественных опухолей с помощью адъювантной и неоадъювантной терапии. Больница оснащена современным оборудованием, в штате онкологической клиники опытные, высококвалифицированные врачи.
Практические аспекты терапии люминального HER2-негативного метастатического РМЖ: поиск оптимальных решений
Люминальный HER2-негативный (HR+ HER2-) подтип опухоли имеет место почти у 70% пациенток. Метастатический рак молочной железы (мРМЖ) до настоящего времени остается неизлечимым заболеванием, но успехи лекарственной терапии, в том числе люминального подтипа, уже сегодня позволяют отнести его к разряду хронических заболеваний с длительным течением. Какие подходы к лечению помогают пациенткам жить максимально долго и сохраняют качество их жизни? Это обсуждали участники сателлитного симпозиума компании «Пфайзер», проходившего в Казани в рамках июньского саммита ESMO-RUSSCO.
Вклад ингибиторов CDK4/6 в достижение целей лечения HR+ HER2- мРМЖ

д.м.н., ведущий научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Цели лечения диссеминированного РМЖ отличаются от тех задач, которые онкологи ставят перед собой при лечении ранних стадий заболевания. В случае раннего РМЖ врачи всегда стремятся вылечить пациента. К сожалению, онкологи вынуждены признать, что при метастатической болезни пока этого сделать нельзя. Вместе с тем в настоящее время мРМЖ перестал считаться фатальным заболеванием, и более 20% пациентов с таким диагнозом сегодня переживают пятилетний рубеж. Основными целями терапии в данной ситуации являются обеспечение максимально возможных сроков жизни и поддержание наилучшего качества жизни онкологических больных. Это достигается с помощью разумного баланса между пользой и вредом противоопухолевого лечения. Эффективная терапия, позволяющая продлевать жизнь пациентов, в идеале должна обладать относительно малой токсичностью, чтобы не нарушать существенным образом качество жизни. Известно, что некоторые виды противоопухолевого лечения могут оказывать столь выраженное токсическое влияние, что ухудшают качество жизни даже в большей степени, чем сама болезнь.
В этой связи наиболее обсуждаемым в последнее время терапевтическим подходом к лечению HR+ HER2- мМРЖ является гормонотерапия (ГТ) в комбинации с ингибиторами циклин-зависимых киназ 4/6 (CDK4/6). Вклад ингибиторов CDK4/6 в увеличение медианы времени до прогрессирования заболевания в рамках первой линии терапии HR+ HER2- мРМЖ на сегодняшний день оценен в пяти рандомизированных клинических исследованиях. Кроме того, доступны данные трех исследований, которые посвящены оценке выигрыша при добавлении ингибиторов CDK4/6 к ГТ в рамках второй и последующих линий терапии.
Медиана времени до прогрессирования во всех исследованиях была существенно выше в группе больных, получавших ГТ в комбинации с ингибиторами CDK4/6. Показатели соотношения риска свидетельствуют о высокой статистической значимости полученных различий.
Подгрупповой анализ убедительно показал преимущество комбинированной терапии ингибитором CDK4/6, в том числе и у больных с висцеральными метастазами. Некоторые онкологи в таких ситуациях осторожно относятся к использованию ГТ, опасаясь быстрого прогрессирования, хотя во всех современных клинических рекомендациях сказано, что даже при наличии висцеральных метастазов в отсутствие висцерального криза специалисты могут и должны отдавать предпочтение ГТ. Существенный выигрыш в эффективности при такой ситуации можно получить, сочетая применение ингибитора ароматазы или фулвестранта с ингибитором CDK4/6. В результате подгруппового анализа преимущество в эффективности такой комбинации было убедительно продемонстрировано во всех исследуемых подгруппах, в том числе и у больных с метастазами во внутренних органах, включая печень, которые трудно поддаются лечению вообще и ГТ в частности.
Недавно специалистам стали известны первые результаты оценки общей выживаемости в двух исследованиях, изучавших ингибиторы CDK4/6. В исследовании PALOMA-3 было показано, что увеличение медианы общей продолжительности жизни более чем на шесть месяцев можно получить даже у больных с прогрессированием на фоне предшествующей ГТ, если добавить ингибитор CDK4/6 палбоциклиб к фулвестранту. А в случае подтвержденной чувствительности к ГТ предшествующих линий прирост медианы общей продолжительности жизни на фоне использования комбинации с палбоциклибом достигал десяти месяцев.
Еще один важный аспект, связанный с качеством жизни пациенток, – это возможность отсрочки начала химиотерапии (ХТ). Во всех исследованиях серии PALOMA с палбоциклибом был проведен соответствующий анализ времени до начала ХТ. В исследовании PALOMA-3 было показано, что у пациентов, получавших палбоциклиб с фулвестрантом, медиана времени до начала ХТ была в два раза больше по сравнению с контрольной группой. Это означает, что онколог сегодня может длительно проводить эффективную ГТ с хорошим качеством жизни пациентки, успешно резервируя и откладывая во времени использование более токсичных схем лечения. Например, в исследовании PALOMA-2, в котором изучалась комбинация палбоциклиба с летрозолом в первой линии терапии HR+ HER2- мРМЖ, медиана времени до начала ХТ составила более трех лет.
В исследовании MONALEESA-7 с ингибитором CDK4/6 рибоциклибом принимали участие молодые женщины, у которых состояние менопаузы достигалось с помощью аналога гонадотропин-рилизинг-гормона. В качестве ГТ больные исследуемой группы получали комбинированную терапию ингибитором ароматазы или тамоксифеном в сочетании с рибоциклибом. В исследовании принимали участие женщины, не получавшие ранее эндокринной терапии по поводу метастатического заболевания, но у части из них в анамнезе имелась одна линия ХТ. На момент анализа результатов исследования медиана общей продолжительности жизни больных, получавших комбинированную ГТ с рибоциклибом, не была достигнута, тогда как в группе больных, получавших только ГТ (+ плацебо), этот показатель составил 40,9 месяца. При этом показатель снижения риска смерти достиг критерия статистической значимости. В рамках этого исследования наибольший выигрыш в показателе общей выживаемости был зафиксирован в подгруппе пациенток без предшествующей терапии, доля которых в общей изучаемой популяции составляла от 45 до 86% (в зависимости от анализируемого вида лечения). Как и в исследованиях с палбоциклибом, было отмечено существенное увеличение времени до начала ХТ.
С появлением новых данных об инновационном классе препаратов у специалистов часто возникает вопрос: «Что, если сравнить эффективность добавления к ГТ ингибитора CDK4/6 с ХТ?» Такое исследование, изучавшее комбинированную ГТ с палбоциклибом и ХТ, было проведено в формате исследования II фазы. В исследовании приняли участие молодые больные HR+ HER2- мРМЖ, получавшие медикаментозную овариальную супрессию агонистом рилизинг-гормона; в одной группе пациентки получали монохимиотерапию капецитабином в стандартной дозе, в другой – ГТ в сочетании с палбоциклибом. По результатам анализа медиана времени до прогрессирования в группе палбоциклиба составила 20,1 месяца, в группе капецитабина – 14,4 месяца; снижение риска прогрессирования заболевания в группе комбинированной ГТ достигло 34% в сравнении с ХТ.
Таким образом, цели, которые мы ставим перед собой при лечении больных с HR+ HER2- мРМЖ, сегодня могут быть успешно достигнуты с помощью комбинации ГТ с ингибитором CDK4/6.
В завершение лекции М.Б. Стенина сделала заключение:
Внедрение нового метода всегда влечет за собой и новые вопросы, поскольку, приступая к первой линии терапии, необходимо проанализировать весь спектр имеющихся опций и сделать правильный выбор. Среди них и такие: на каком этапе лучше использовать комбинацию с ингибиторами CDK4/6, какова оптимальная последовательность лечения?
В будущем интересно увидеть результаты исследования SONIA с палбоциклибом, ориентированного на поиск дополнительных доказательств оптимального места ингибиторов CDK4/6 в лечении HR+ HER2- мРМЖ.
Современное мнение экспертов о значимости и месте нового класса препаратов ингибиторов CDK4/6 наглядно проиллюстрировано в международных и российских клинических рекомендациях включением соответствующих схем в алгоритмы первой и второй линий терапии. Выбор зависит от того, какие препараты пациентка получала ранее, каковы были эффективность и переносимость предшествующей терапии.
Баланс эффективности и безопасности палбоциклиба в терапии HR+ HER2- мРМЖ

д.м.н., профессор РАН, заместитель директора по онкологии ГБУЗ «Московский клинический научный центр им. А.С. Логинова»
Еще совсем недавно в большинстве случаев лечение больных с HER2- мРМЖ начиналось с химиотерапии. И этот подход, несмотря на критику, сдавал свои позиции довольно медленно. Однако успех, который показали CDK4/6-ингибиторы в лечении данного подтипа болезни, заставляет онкологов сегодня окончательно пересмотреть свои взгляды и возможности.
В четырех крупных рандомизированных исследованиях III фазы было абсолютно четко показано, что комбинация CDK4/6-ингибиторов с ГТ в качестве первой линии лечения HR+ HER2- мРМЖ обеспечивает беспрецедентное увеличение выживаемости без прогрессирования. Применение новых схем лечения позволило перешагнуть двухлетний порог медианы времени до прогрессии в рамках только одной первой линии терапии. Поскольку целью лечения больных мРМЖ является не только увеличение продолжительности жизни, но и сохранение ее удовлетворительного качества, баланс эффективности и безопасности имеет большое значение.
Попробуем разобраться, кому и как оптимально назначать ингибиторы CDK4/6. Разберем это на примере наиболее широко изученного на сегодняшний день представителя класса – палбоциклиба.
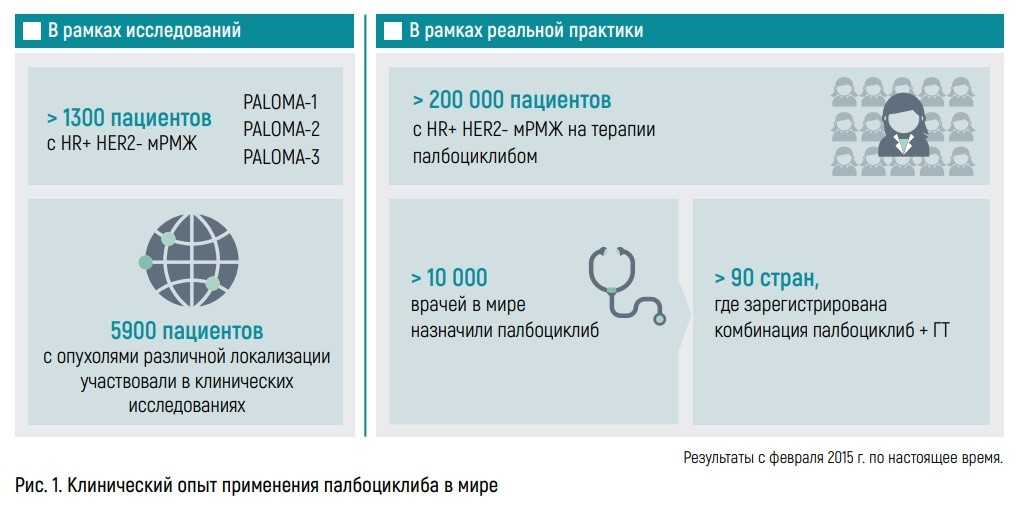
В рандомизированных клинических исследованиях цикла PALOMA приняли участие более 1300 пациентов. Палбоциклиб в комбинации с эндокринной терапией показал благоприятный и управляемый профиль безопасности. Наиболее часто встречающимся нежелательным явлением (НЯ) являлась нейтропения, причем среди НЯ 3–4-й степени нейтропения также занимала лидирующие позиции. Но важно отметить, что такое жизнеугрожающее состояние, как фебрильная нейтропения, с которой мы сталкиваемся при проведении химиотерапии, была зафиксирована лишь в единичных случаях (1,6%).
Связано это с тем, что нейтропения, вызванная применением CDK4/6-ингибиторов, в корне отличается от нейтропении, которую онкологи видят при назначении химиотерапевтического агента. В последнем случае у больного наблюдаются не только низкое число нейтрофилов в крови, но и сопутствующие симптомы, связанные с повреждением слизистых, – мукозиты, тошнота, рвота, нарушение функционального статуса в целом. Объясняется это тем, что механизм действия ХТ вызывает повреждение клеток-предшественников нейтрофилов. Для их восстановления требуется довольно длительное время, и этот период характеризуется серьезным риском развития инфекционных осложнений. В отличие от химиотерапевтических агентов ингибиторы CDK4/6 не вызывают повреждения, а лишь блокируют клеточный цикл и процесс созревания клеток крови, поэтому планового перерыва после трехнедельного приема препарата в каждом цикле, как правило, бывает достаточно для восстановления числа и функций нейтрофилов.
Накопленный клинический опыт позволяет четко прогнозировать изменения показателей крови на фоне лечения. Было установлено, что с началом приема палбоциклиба медиана времени до развития нейтропении любой степени составляет около 15 дней, а до максимального снижения числа нейтрофилов – 29 дней. В среднем период разрешения нейтропении 3–4-й степени (когда требуется особое внимание) длится до семи дней. На основании этих данных были сформированы рекомендации по мониторингу безопасности и управлению токсичностью при терапии палбоциклибом в реальной практике, изложенные в инструкции по медицинскому применению препарата.
Однако, несмотря на относительную простоту управления нейтропенией, вызванной CDK4/6-ингибиторами, специалисты должны относиться к ней с должным вниманием. В течение первых двух циклов необходимо контролировать показатели клинического анализа крови не реже одного раза в две недели и возобновлять терапию, только убедившись в восстановлении показателя числа нейтрофилов до рекомендованного уровня. А если все же на фоне нейтропении возникнет инфекционное осложнение, то онколог должен действовать в соответствии с тем же алгоритмом лечения фебрильной нейтропении, что и при проведении химиотерапии.
Важно, что, своевременно корректируя НЯ с помощью изменения режима и дозы применения палбоциклиба, врач обеспечивает пациенту такой же результат лечения, как и в остальной группе больных. Так, медиана выживаемости без прогрессирования при исследовании палбоциклиба в общей популяции и у пациентов после модификации дозы была абсолютно сопоставима.
Известно также, что больным, у которых в течение первых шести циклов терапии уровень нейтропении не превышал показатели 1–2-й степени, в последующем уже не требуется частый мониторинг общего анализа крови (ОАК). Достаточно осуществлять контроль один раз в три месяца, так как риск развития тяжелой нейтропении является минимальным.
Резюмируя аспект гематологической токсичности, необходимо отметить, что благоприятный и контролируемый профиль безопасности палбоциклиба был установлен в процессе длительного (более 50 месяцев) наблюдения за больными, включенными в исследования. Нейтропения, в том числе 3–4-й степени выраженности, хоть и является самым частым нежелательным явлением, но в отличие от таковой на фоне ХТ редко переходит в фебрильную нейтропению и не требует применения колониестимулирующих факторов.
Клинический опыт применения палбоциклиба основывается не только на рандомизированных исследованиях, но и на реальной клинической практике. Во всем мире сегодня уже более 200 тыс. пациентов получают данную терапию в более чем 90 странах.
На сегодняшний день доступен целый ряд публикаций, в которых коллеги делятся опытом применения палбоциклиба в реальной клинической практике. В частности, приведены наблюдения за переносимостью лечения комбинацией палбоциклиба с ингибиторами ароматазы или фулвестрантом у 411 пациентов, получавших лечение в 2015–2017 гг. в США. Так как начало наблюдения совпадает с датой регистрации препарата, в анализ вошли в том числе пациенты, получавшие палбоциклиб в комбинации с ГТ за пределами первых двух линий лечения, а каждый четвертый пациент имел три и более предшествующих линий лечения. При сравнении результатов в реальной практике с данными рандомизированных клинических исследований частота нейтропении 3–4-й степени оказалась сопоставима, но редукция дозы потребовалась в меньшем проценте случаев. Причины прекращения терапии были те же, что и в рандомизированных исследованиях.
Другое наблюдательное исследование IRIS (США) также продемонстрировало меньшую потребность в модификации дозы палбоциклиба в реальной практике по сравнению с рандомизированными клиническими испытаниями. Снижение дозы палбоциклиба в комбинации с ингибиторами ароматазы в первой линии лечения потребовалось 19,7% больных, а пациенткам, получавшим комбинацию палбоциклиба с фулвестрантом, – в 14,4% случаев.
Что необходимо учесть для безопасного и эффективного использования комбинации ГТ с каждым из трех зарегистрированных сегодня в мире ингибиторов CDK4/6? Рассмотрим ключевые зоны внимания и требования к мониторингу.
Основной вид токсичности и предмет мониторинга на фоне терапии палбоциклибом – это гематологическая токсичность. Данный вид токсичности признан характерным для всего класса ингибиторов CDK4/6. Поэтому регулярный контроль ОАК является обязательным условием мониторинга терапии вне зависимости от того, какой препарат назначен – палбоциклиб, рибоциклиб или абемациклиб.
В отличие от рибоциклиба и абемациклиба палбоциклиб не показал существенной частоты развития печеночной токсичности, поэтому в процессе терапии палбоциклибом специального контроля за печеночными ферментами пациентам не требуется. В то же время на терапии абемациклибом мониторинг печеночных трансаминаз проводится до четвертого цикла включительно и до шестого цикла включительно для больных, получающих рибоциклиб. Если на протяжении нескольких циклов такой токсичности не выявляется, контроль можно ослабить, проводя его далее по индивидуальным показаниям.
Для абемациклиба помимо мониторинга печеночной токсичности важно осуществлять контроль и коррекцию диареи, которая оказалась в числе НЯ, характерных для данного ингибитора CDK4/6.
Еще одно потенциальное НЯ, требующее обязательного мониторинга, – увеличение интервала QT. Данный эффект отмечался на фоне терапии препаратом рибоциклиб в ходе трех исследований III фазы MONALEESA, поэтому при назначении рибоциклиба необходим дополнительный контроль электрокардиограммы (ЭКГ) с оценкой скорригированного интервала QT (QTc), позволяющий своевременно модифицировать режим и дозу приема препарата.
В регистрационных исследованиях палбоциклиба цикла PALOMA, включая дополнительный анализ кардиологической безопасности в исследовании PALOMA-2, не было зафиксировано ни одного случая клинически значимого (> 480 мс) увеличения интервала QTc. Как следствие, на терапии палбоциклибом не требуется мониторинга QTc и контроля электролитов (K, Ca, Mg, Na, Р), которые рекомендованы для безопасного ведения пациентов на рибоциклибе. У палбоциклиба отсутствуют также ограничения к одновременному применению с препаратами, удлиняющими интервал QT.
Следует помнить, что РМЖ, как и любая злокачественная опухоль, потенцирует венозные тромбоэмболические осложнения (ВТЭО). Хорошо известно, что увеличение риска ВТЭО может быть связано и с применением эндокринных препаратов. При использовании их комбинаций с различными CDK4/6-ингибиторами также были зафиксированы случаи НЯ по типу ВТЭО. По имеющимся данным испытаний III фазы ингибиторов CDK4/6, эти осложнения, тем не менее, отмечались редко в исследованиях палбоциклиба и рибоциклиба ( Ситуационная задача по выбору тактики ведения больных HR+ HER2- мРМЖ

д.м.н., профессор кафедры клинической медицины последипломного образования медицинского университета «Реавиз», Самара
Симпозиум продолжился представлением случая из реальной клинической практики.
Пациентке в 2015 г. в возрасте 65 лет был установлен диагноз РМЖ рТ2N2MO и проведено комплексное лечение: радикальная мастэктомия, шесть циклов адъювантной ХТ по схеме CAF, а также лучевая терапия. По данным гистологического заключения, у больной имел место инвазивный РМЖ G2, размер опухоли был 4,5 см, метастазы были выявлены в восьми из десяти подмышечных лимфоузлов. Иммуногистохимическое исследование показало HER2-негативный люминальный B подтип РМЖ.
Пациентка получала адъювантную гормонотерапию – тамоксифен в дозе 20 мг в сутки вплоть до января 2019 г., когда при плановом обследовании обнаружились множественные метастазы в позвоночнике и два небольших очага в левом легком.
Жалоб в момент выявления диссеминации пациентка не предъявляла, статус ECOG 0.
Определяя тактику лечения, согласно клиническим рекомендациям, у пациентки в отсутствие висцерального криза мы должны осуществить все возможные линии ГТ, добиваясь их максимальной продолжительности.
Выбирая конкретный препарат для первой линии, важно помнить, что на старте следует назначать самую эффективную опцию. Этот принцип мы хорошо изучили на примере ХТ, где не стоит оставлять эффективные препараты на поздние линии. Такое же правило применимо к ГТ: если мы хотим максимально длительно проводить ее, то наиболее эффективная схема лечения должна быть назначена первой. И на сегодняшний день комбинация ингибиторов CDK4/6 с ингибиторами ароматазы является оптимальным выбором стартовой ГТ.
К сожалению, пациент в реальной клинической практике значительно отличается от пациента в клиническом исследовании, где задаются определенные критерии отбора пациентов. Реальная популяция, как правило, разнится наличием сопутствующей патологии. Коморбидность – это любой дополнительный диагноз, который существовал до клинического обследования пациента или возник во время него, или же это сочетание у одного больного нескольких хронических заболеваний, связанных единым патогенезом. Ожирение, менопауза являются факторами риска гормонопозитивного РМЖ, но одновременно и факторами риска других заболеваний. Исследования показали, что риск смерти у онкобольных с тяжелой сопутствующей патологией в 2,6 раза выше по сравнению с пациентами, которые в остальных отношениях были относительно здоровы.
Итак, перечень сопутствующих диагнозов у данной пациентки на момент определения тактики лечения мРМЖ: ожирение 2-й степени с индексом массы тела 35 и весом 99 кг; ишемическая болезнь сердца, атеросклеротический кардиосклероз, хроническая сердечная недостаточность II функционального класса по NYHA; гипертоническая болезнь 2-й степени, риск 2; сахарный диабет 2-го типа; варикозная болезнь нижних конечностей и хронический холецистит.
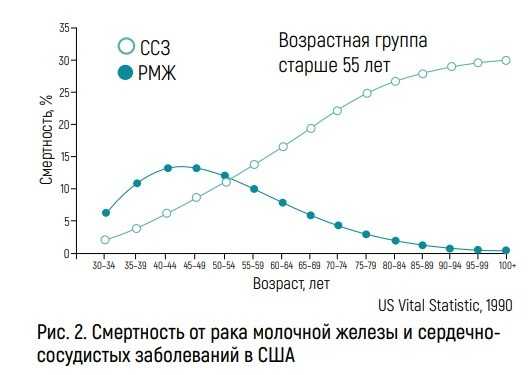
Необходимо отметить, что сегодня активно развивается новая специализация в кардиологии – кардиоонкология. Это происходит потому, что онкологическая помощь становится все более эффективной, пациенты со злокачественными новообразованиями (ЗНО) стали жить значительно дольше и соответственно нуждаться в мультидисциплинарном подходе для успешной коррекции сердечно-сосудистой патологии. Смертность от РМЖ и сердечно-сосудистых заболеваний (ССЗ) конкурируют в структуре причин летальности. И чем старше онкологическая пациентка, тем выше сопутствующий риск летальности от ССЗ.
Противоопухолевая терапия может сопровождаться кардиотоксичностью – кардиомиопатиями, аритмиями, поражением коронарных артерий, перикарда и клапанов сердца. Аритмии, возникающие вследствие удлинения интервала QTс, ассоциируются с желудочковой тахикардией, синкопальными состояниями и риском внезапной сердечной смерти. Женщины чаще подвержены желудочковой аритмии, чем мужчины, особенно после 60 лет. А популярная сопроводительная терапия антиэметиками, антидепрессантами, антигистаминными и противогрибковыми препаратами, вступая в лекарственное взаимодействие с основной терапией, усугубляет данный риск.
65-летняя пациентка в нашем клиническом примере имеет внушительный комплекс сопутствующей патологии. Кроме того, у нее были выявлены дополнительные факторы риска кардиологических осложнений: терапия антрациклинами и лучевая терапия на левую половину грудной клетки в анамнезе.
Длина интервала QTc, по данным ЭКГ, у нее составляла 470 мс (1-я степень удлинения QTc), при том что фракция выброса левого желудочка соответствовала норме. Уровень электролитов (калия, магния и кальция) в анализе крови был без существенных отклонений. После консультации с кардиологом было решено, что с учетом возраста и сопутствующей патологии пациентке необходимо избегать применения препаратов, вызывающих пролонгацию QTc.
В соответствии с клиническими рекомендациями, в качестве оптимальной терапии первой линии пациентке была назначена комбинированная гормонотерапия с ингибитором CDK4/6. Решающим фактором при выборе конкретной схемы лечения была минимизация риска декомпенсации сопутствующей патологии, в том числе влияния на интервал QTc.
В результате эта пациентка на протяжении нескольких месяцев получает лечение ингибитором ароматазы в сочетании с палбоциклибом. По совокупности показаний пациентке раз в месяц проводится контроль ЭКГ с анализом электролитов и каждые три месяца – эхокардиография с консультацией кардиолога. Лечение больная переносит хорошо, при контрольных обследованиях по поводу мРМЖ наблюдается частичный ответ.
К приведенным ранее выводам И.А. Королева добавила следующие на основании клинического примера: