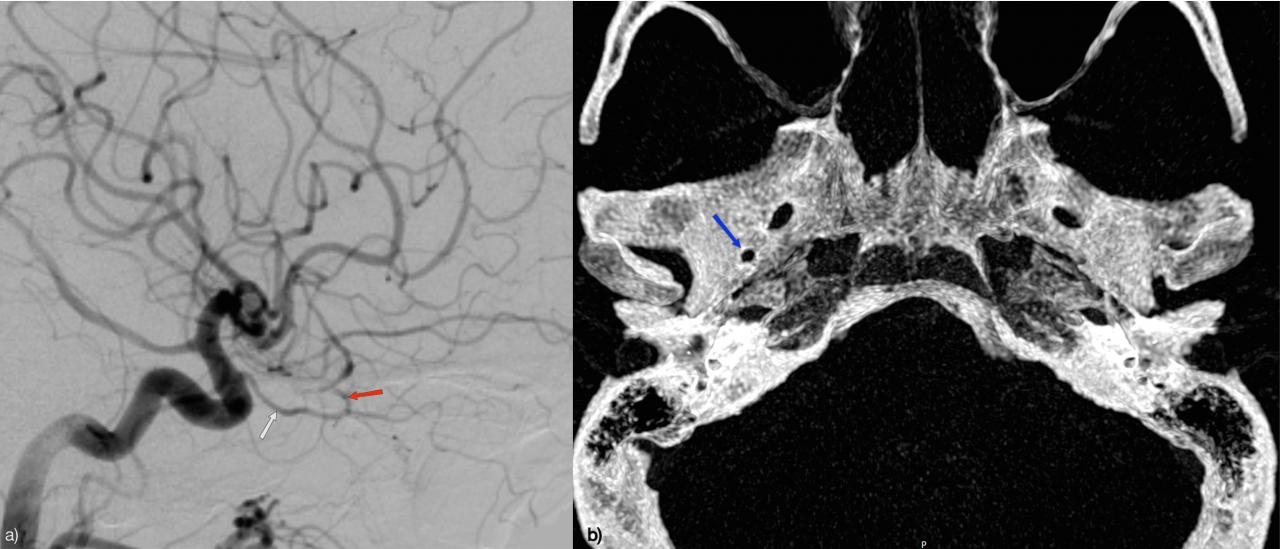
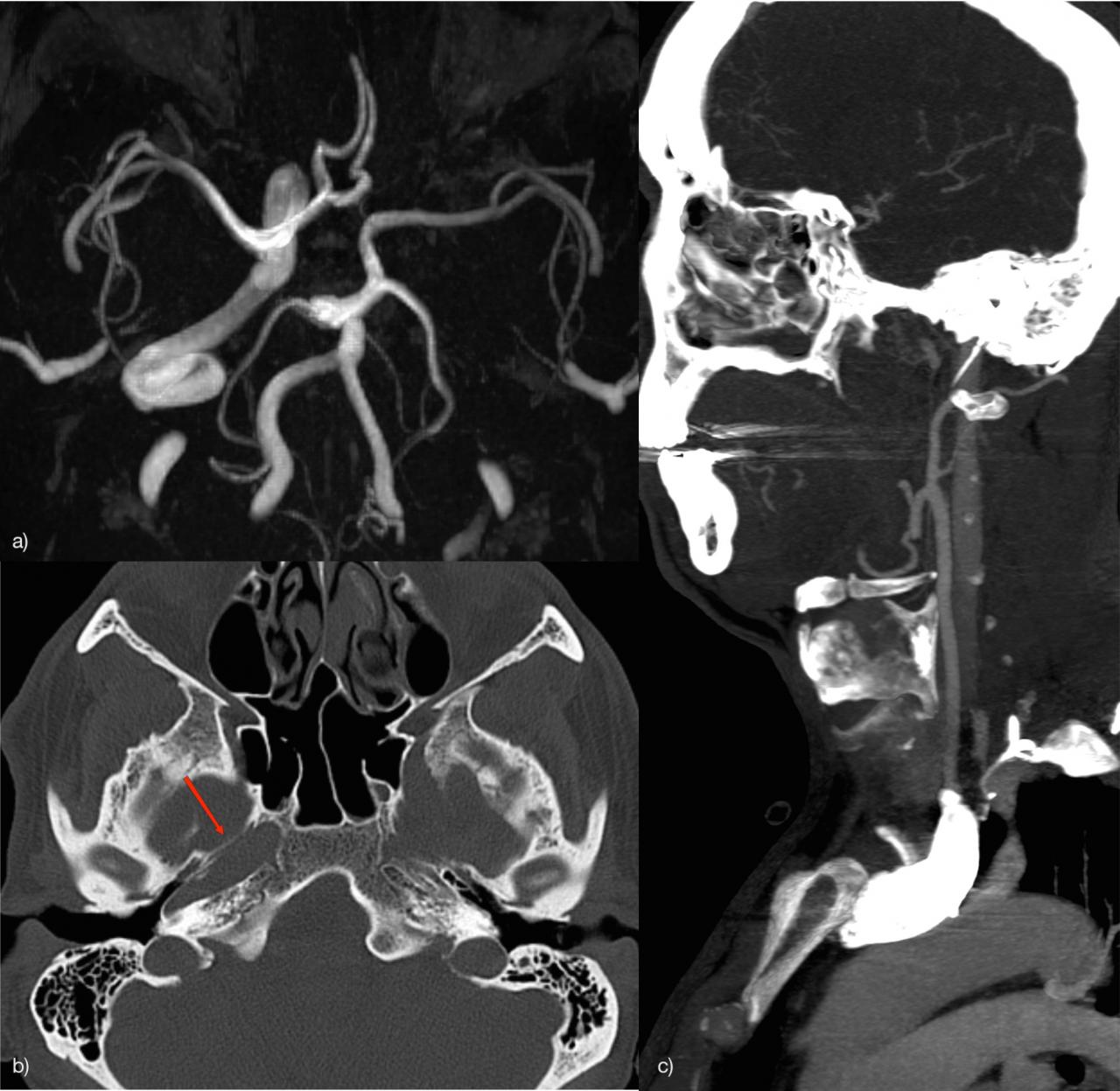
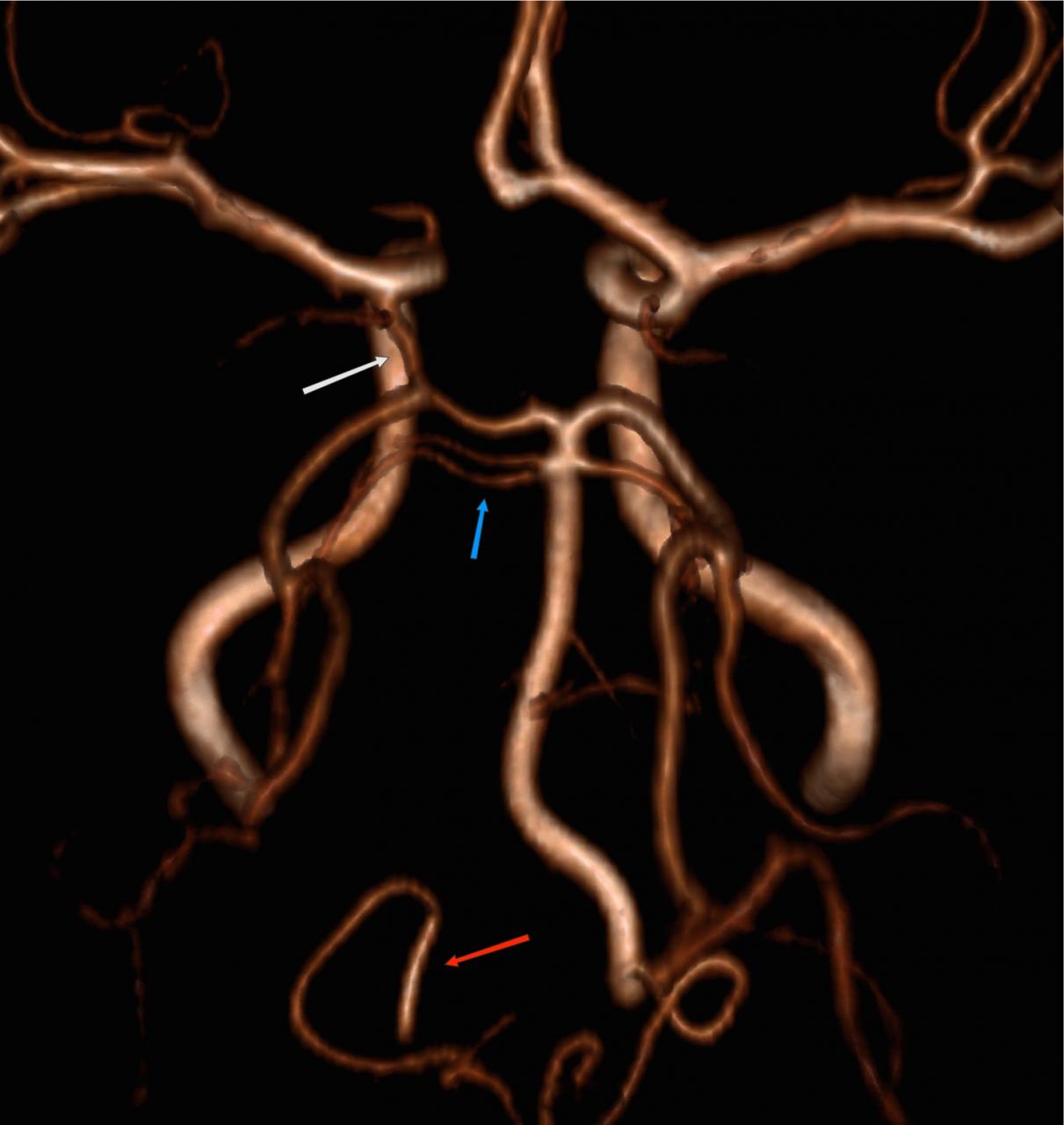
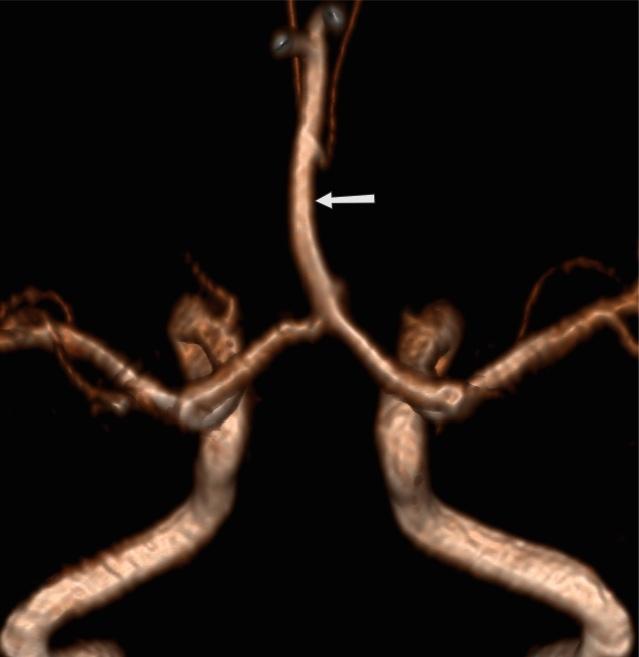
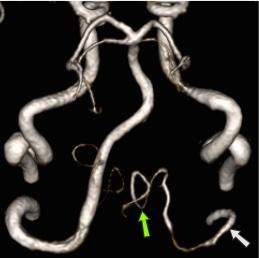
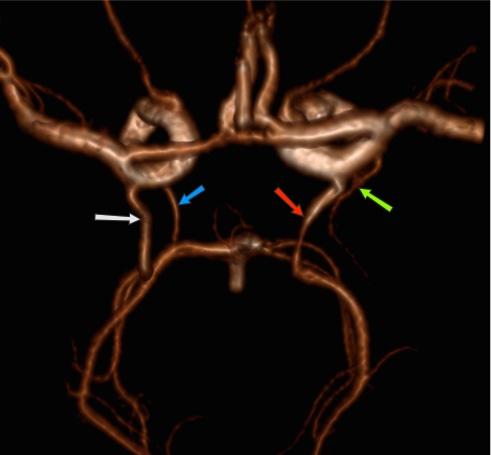
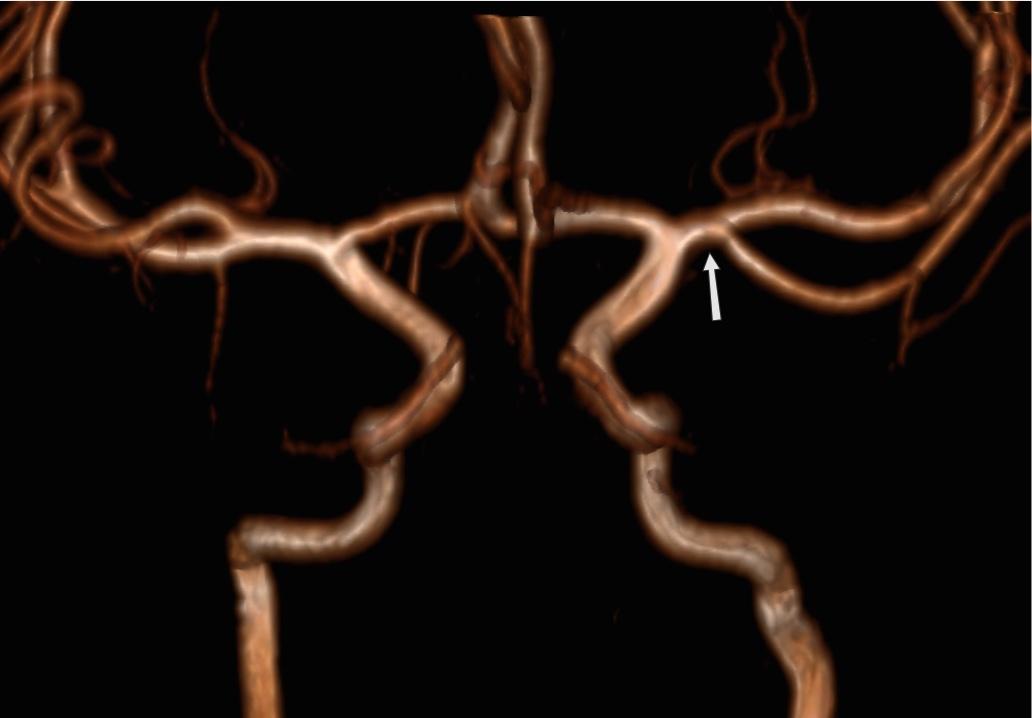
неполное удвоение передней мозговой артерии что это
Гипоплазия артерии – проявления и лечение
Термин «гипоплазия» означает «недоразвитие». Такие дефекты внутриутробного развития встречаются и в артериях головного мозга. В артериях бассейна сонных артерий эти аномалии существуют приблизительно у 4% людей, а в артериях вертебро-базилярного бассейна – у каждого десятого.
Несмотря на то, что головной мозг самый энергоемкий орган и нуждается в массивном кровоснабжении, гипоплазия питающих его артерий может долго оставаться незамеченной. Это связано с особенностями системы кровообращения головного мозга.
За счет передней и задней соединительных артерий образуется сообщение артериальных бассейнов мозга, образующее круг. Он называется виллизиевым, и в его пределах возможен компенсаторный переток крови в участки с пониженным артериальным кровотоком, в том числе по причине гипоплазии какого-либо сегмента артерии. Именно эта особенность кровообращения мозга обеспечивает длительное бессимптомное течение большинства гипоплазий, которые нередко становятся случайной находкой.
Клинические проявления гипоплазии артерий мозга возникают на фоне другой патологии, ухудшающей условия компенсации мозгового кровообращения. Чаще всего это атеросклероз сосудов головного мозга или заболевания шейного отдела позвоночника. В результате могут возникать транзиторные ишемические атаки и ишемические инсульты.
Симптомы
Симптомы хронического нарушения кровообращения мозга зависят от сосудистого бассейна, в котором развивается ишемия ткани мозга. Всех пациентов может беспокоить:
Для гипоплазии артерий каротидного бассейна также характерны слабость и/или онемение в конечностях, нарушения речи. Для ишемии в бассейне позвоночных артерий – нарушения координации, неустойчивость походки.
Для диагностики гипоплазии мозговых артерий и определения лечебной тактики проводятся:
Консервативную терапию препаратами, улучшающими кровоснабжение и метаболизм головного мозга, проводят, если данные выполненного обследования позволяют заключить, что она сможет предотвратить дальнейшее усиление ишемии мозга и ишемический инсульт.
Операции
Однако многие пациенты с декомпенсацией кровоснабжения мозга на фоне гипоплазии артерий нуждаются в хирургическом лечении. В ведущих нейрохирургические центрах мира проводятся сложнейшие микрохирургические операции шунтирования артерий мозга, а также малоинвазивные рентгенхирургические внутрисосудистые вмешательства – баллонная ангиопластика и стентирование артерий.
Операция проходит под общим наркозом и продолжается четыре-пять часов. Сначала выделяется теменная ветвь поверхностной височной артерии (она располагается в покровах черепа). Затем проделывается трепанационное отверстие в височной кости. И далее операция проходит с использованием операционного микроскопа и микрохирургических инструментов. Выделяется крупная корковая ветвь средней мозговой артерии и соединяется с ветвью височной артерии с помощью сосудистого шва, выполненного микронитью.
Для подтверждения прочности анастомоза еще до окончания операции выполняют контактное допплеровское исследование заинтересованных сосудов.
В дальнейшем пациент находится сначала в реанимационном, а затем – в послеоперационном отделении в течение 6-7 дней. За это время неоднократно проводятся контрольные допплерография и МРТ головного мозга.
Для поддержания нормального просвета сосуда баллонную ангиопластику часто комбинируют со стентированием сосуда специальной внутрисосудистой сетчатой конструкцией.
Сегодня в крупных многопрофильных иностранных клиниках используется более 400 моделей стентов. Это саморасправляющиеся конструкции из инертных для организма материалов. Они обладают памятью формы, могут устанавливаться в области извитостей и бифуркаций (раздвоений) сосудов, не деформируются с течением времени. Многие модификации длительно выделяют из своего покрытия препараты, препятствующие тромбообразованию и образованию атеросклеротических бляшек в области стента. Также относительно недавно в зарубежную практику введены стенты четвертого поколения. Это биодеградирующиеся конструкции, которые рассасываются в течение нескольких лет после выполнения функции.
Такой сложный раздел хирургии, как операции на сосудах головного мозга, требует не только особых навыков и многолетнего опыта нейрохирурга, который должен также владеть техникой ангиохирургических и микрохирургических вмешательств.
Необходимо современное оборудование – нейроэндоскопическая и микрохирургическая аппаратура, рентгенхирургические операционные, системы нейронавигации и интраоперационного мониторинга функций нервной системы, а также технически оснащенные реанимационные отделения для послеоперационных пациентов. Все эти условия созданы в крупных специализированных нейрохирургических зарубежных центрах, в которые обращаются самые сложные пациенты со всего мира.
Варианты развития артерий головного мозга и эпилепсия
Слабые анастомозы артерий головного мозга вызывают церебральную ишемию после дискэктомии шейного отдела позвоночника. При болезнях Паркинсона и Альцгеймера нейровизуализационные и патологоанатомические исследования в 20-30 % случаев обнаружили цереброваскулярные поражения, а в основе деменции может быть сосудистое заболевание головного мозга. Структурные изменения сосудов головного мозга, снижение скорости кровотока и наличие в 30 % стеноза в средней мозговой артерии могут стать предпосылками развития инсульта у больных с синдромом апноэ во сне.
При аномалии Киммерле необходимо учитывать наличие врожденных изменений позвоночных артерий. Диспластические нарушения в области краниовертебрального перехода в 2 раза чаще отмечены при патологической извитости позвоночных артерий, в меньшей степени за счет гипоплазии позвоночных артерий. До 51,9 % больных с мальформацией Киари и сирингомиелией имеют особенности строения артериального круга большого мозга. Извитости, асимметрии и гипоплазии позвоночных артерий с признаками нарушения кровотока характерны для вертебробазилярной недостаточности вследствие шейной дорсопатии и отмечены в 76,6 % случаев при центральном вестибулокохлеарном синдроме.
Артериальное русло головного мозга оказывается пораженным и при таких системных заболеваниях организма, как ревматоидный артрит, узелковый полиартериит, болезнь Такаясу, болезнь Шенлейна-Геноха, При проведении стоматологических манипуляций у больных с болезнью Штурге-Вебера или Реклингхаузена как типичных нейрофиброматозов возможно развитие угрожающего кровотечения. Первичное поражение церебральных артерий в виде васкулита и эндартериита лежит в основе развития нейросифилиса и приводит к вторичному страданию нервной ткани и возникновению инфарктов в головном мозге. Церебральный васкулит и герпетический церебральный васкулит могут развиться на фоне герпетической инфекции. При ишемических инсультах в 70 % наблюдений в ткани головного мозга, наряду с изменениями, обусловленными острым нарушением мозгового кровообращения, отмечаются очаговые поражения, сходные с изменениями при менингоэнцефалитах, вызванных опоясывающим и простым герпесом.
Изменения строения артерий головного мозга необходимо учитывать при оценке онкологических метастазов, а также у 40 % больных с тяжелой черепно-мозговой травмой при выявлении травматических субарахноидальных кровоизлияний и сопутствующего ангиографического вазоспазма.
По ходу выполнения изысканий по изучению взаимосвязи вариантов артерий головного мозга человека с цереброваскулярными расстройствами в рамках острых нарушений мозгового кровообращения и хронической ишемии головного мозга у нас сложились наблюдения о взаимосвязи вариантов строения и топографии артерий головного мозга человека с рядом других нозологических единиц. В этой связи мы представляем результаты собственных исследований о вариантах развития артерий головного мозга человека с различными видами эпилепсий.
Нами было проанализировано состояние артериального русла головного мозга 748 амбулаторных и стационарных пациентов от 22 лет до 81 года, находившихся на обследовании и лечении в неврологических и нейрохирургическом отделениях ОКБ № 2 им. профессора И.Н. Аламдарова г. Астрахани в период 1983-1998 гг., неврологических отделениях Городской больнтщы № 3 и Городской больницы № 4 г. Тамбова, нейрохирургическом отделении Тамбовской областной больницы, реабилитационно-оздоровительном комплексе семьи «Б. Липовица», неврологических кабинетах и в дневных стационарах Городской больницы № 4, Узловой поликлинике на ст. Тамбов ОАО «РЖД» и ЦДЛ ООО «Тамбовмедсервис», а также в амбулатории «Домашний доктор» (г. Тамбов) в течении 1998-2009 гг.
Всем пациентам проводилось комплексное клинико-инструментальное исследование, включающее данные клинического обследования невролога, терапевта и офтальмолога, стандартные лабораторные данные, электрокардиографию, флюорографию или обзорную рентгенографию органов грудной клетки. По показаниям были проведены консультации и обследования у нейрохирурга, гинеколога, отоларинголога, кардиолога, эндокринолога и психотерапевта; исследование когнитивной сферы по краткой шкале оценки психического статуса или миниисследование психического статуса, транскраниальная допплерография, электроэнцефалография. Всем пациентам были вьшолнены магнитно—резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА).
Согласно полученным данным, варианты строения и топографии артериального круга большого мозга верифицированы всего в 27 случаях (61,4 % наблюдений) из 44 больных с эпилепсией или энцефалопатиями с ведущими эпилептиформными синдромами. Среди проанализированной группы пациентов с различными видами эпилепсий выявлены следующие варианты строения и топографтии артериального круга большого мозга:
1) изгиб обеих передних мозговых артерий у 1 (3,7 %) пациента;
2) гипоплазия левой позвоночной артерии у 2 (7,4 %) пациентов;
3) задняя трифуркация обеих внутренних сонных артерий и передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 3 (11,1 %) пациентов;
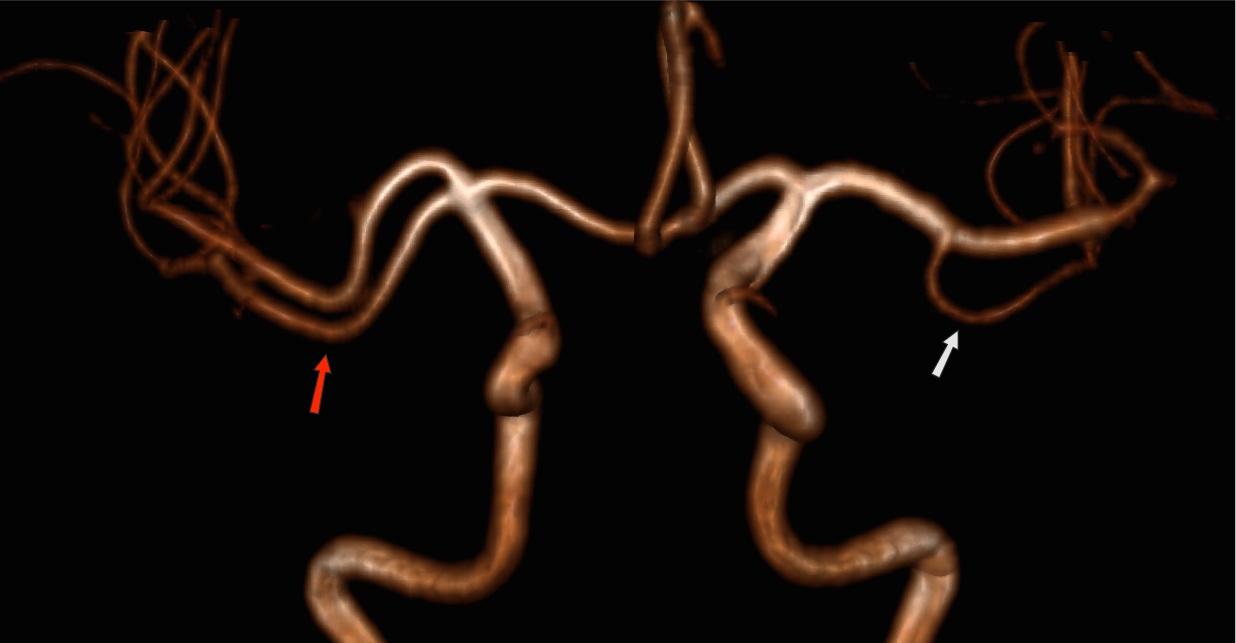
4) передняя трифуркация левой внутренней сонной артерии, гипоплазия базилярной артерии у 6 (22,2 %) пациентов (рис. 1);
5) гипоплазия правой позвоночной артерии, аплазия задней соединительной артерии справа у 4 (14,8 %) пациентов;
6) гипоплазия правой позвоночной артерии, гипоплазия базилярной артерии у 5 (18,5 %) пациентов (рис. 2);
7) передняя трифуркация левой внутренней сонной артерии, гипоплазия задней соединительной артерии` гипоплазия правой задней мозговой артерии у 3 (11,1 %) пациентов;
8) извитость обеих позвоночных артерий у 2 (7,4 %) пациентов;
9) гипоплазия и извитость обеих позвоночных артерий у 1 (3,7 %) пациента,
Ниже приведены достаточно показательные клинические наблюдения из совокупности собственных исследований.
Пример 1. Пациентка Н., 54 лет, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: энцефалопатия как неуточненная (эпилептическая и дисциркуляторная) с полиморфными пароксизмами (по типу паралича Тодда) на фоне аномалий строения артерий головного мозга.
Жалобы на шум в голове, шаткость при ходьбе, приступы слабости в правых конечностях и потери сознания. Неврологически: в сознании менингознаков нет, когнитивные функции снижены, эмоционально лабильна, зрачки d = s, конвергенция ослаблена, легкая слабость мимических мышц справа, парез правой кисти до 4 баллов, чувствительных нарушений нет, сухожильные рефлексы повышены d > s, в позе Ромберга пошатывание, координаторные пробы выполняет с промахиванием DetS, тремор век. Окулист: гипертонический ангиосклероз сосудов сетчаток обоих глаз. Терапевт: гипертоническая болезнь II степени, степень тяжести артериальной гипертонии II, категория риска 3. БАК: холестерин — 4,5 ммоль/л, β-липопротеиды — 3,5 г/л, креатинин — 69 мкмоль/л, мочевина — 7,9 ммоль/л. Протромбин — 88 %, фибриноген — 4.25 г/л. ЭКГ: син, ритм 80 в мин., нормальное положение ЭОС. МРТ и МРА: отображены на рисунке 1. Амбулаторное лечение: пирацетам, глицин, кавинтон, циннаризин, аминалон, энап, престариум, индопамин.
Прошла курс лечения в дневном стационаре: мексидол, магния сульфат, престариум, индопамид, милдронат, эналаприл. Жалобы сохранились прежние. Неврологически — в сознании менингознаков нет, когнитивные функции снижены, черепные нервы без динамики парез правой кисти до 4,5 баллов, в пробе Ромберга пошатывание, координаторные пробы с интенцией с обеих сторон. Консультирована в Тамбовской психиатрической больнице, где поставлен диагноз: последствия органического поражения ЦНС сложного генеза с полиморфными пароксизмами. ЭЭГ: выраженные общемозговые изменения биоритмов с «объединением» биоэлектрической активности, α-активности практически нет. По всем регионам полиритмия «тета-диапазона» менее 5 мкв. Регионарность, реакция активации отсутствуют, усвоения нет. Стойкая дезорганизация деятельности срединных структур. Заинтересованность левой височной области, где выявлен очаг медленноволнового раздражения. Низкое функциональное состояние коры с высокой чувствительностью ее к гипоксии, со снижением порога возбудимости ствола. Одиночные разряды заднестволовых отделов. Сосудистые влияния выражены. Катамнез: на фоне приема депакина-хроно жалобы значительно уменьшились, приступов не отмечено.
Пример 2. Пациент ВН., 21 год, наблюдается в Узловой поликлинике на ст. Тамбов ОАО «РЖД» с диагнозом: эпилепсия с полиморфными церебральными пароксизмами и когнитивными нарушениями. Наблюдается с детства — жалобы на приступы с потерей сознания. После начала лечения с 14 лет в неврологическом отделении Тамбовской областной детской больницы состоял на учете с диагнозом: эпилепсия, парциальные приступы с вторичной генерализацией. ЭЭГ (Психиатрия и наркология, 17.04.02): пароксизмальной активности не выявлено, Неустойчивый α-ритм. Дисфункция диэнцефальной области. Сосудистые влияния с повышенной вегетативной возбудимостью (15.06.04): ОМИ умеренные, но стойкие, с низкоамплитудной дизритмией. Регионарность нечеткая. Реакция активации снижена, усвоения нет. Грубой медленноволновой или пароксизмальной активности не выявлено. Снижена реактивность коры. Высокая вегетативная возбудимость. Сосудистые влияния 22.02.05: по сравнению с 15.06.04, положительная динамика. Общемозговые изменения умеренные, регуляторного характера. Умеренная дисфункция диэнцефальной области с усилением ее активности. Появился неустойчивый α-ритм, фрагментарный. Улучшилась реактивность коры. Несколько повысилась чувствительность коры к РФС, что приводит к снижению порога возбудимости заднестволовых структур. Пароксизмальных тенденций коры нет. Повышена вегетативная возбудимость. МРТ и МРА: отображены на рисунке 2. Неврологически: в сознании менингознаков нет, когнитивные функции несколько снижены, эмоционально лабилен, дистальный гипергидроз, тремор век и вытянутых пальцев рук, зрачки d = s, конвергирует, слабость мимических мышц справа, в позе Ромберга легкое пошатывание, координаторные пробы выполняет, парезов, чувствительных нарушений нет, сухожильные рефлексы d = s, симптом Бабинского слабоположителен с обеих сторон, Эпилептолог: когнитивные расстройства вследствие эпилепсии. Постоянно получает финлепсин (приступы связывает с нерегулярным приемом препарата).
Таким образом, считаем необходимым, сделать следующие выводы.
1. Варианты строения и топографии артериального круга большого мозга могут рассматриваться в качестве предикторов эпилептиформных феноменов структур головного мозга.
2. При различных церебральных пароксизмах, очевидно, есть целесообразность в исследовании артериального круга большого мозга.
3. Варианты строения и топографии артериального круга большого мозга в каждом конкретном случае следует рассматривать с точки зрения малых аномалий развития.
Аномалии и нормальные варианты внутричерепных артерий: подход к классификации и значимость
Перевод презентации «Anomalies and normal variants of the intracranial arteries: proposed workflow for classification and significance».
| Congress: | ECR 2016 |
| Poster No.: | C-0199 |
| Authors: | A. Hakim1, J. Gralla1, C. Rozeik2, P. Mordasini1, F. Pult1, L. Leidolt1, E. Piechowiak1, K. Hsieh1, M. El-Koussy1; 1Bern/CH, 2Loerrach/DE |
| DOI: | 10.1594/ecr2016/C-0199 |
| DOI-Link: | http://dx.doi.org/10.1594/ecr2016/C-0199 |
Перевод на русский: Симанов В.А.
1.Классификация нормальных вариантов
В приведенном ниже списке показана краткая информация о предлагаемой классификации:
1.1. Варианты происхождения (отхождения) сосудов
1.1.1. Общее происхождение: два разных сосуда могут иметь одно и те же происхождение (отхождение)
SCA / PCA: 2-22% Рис.3 :
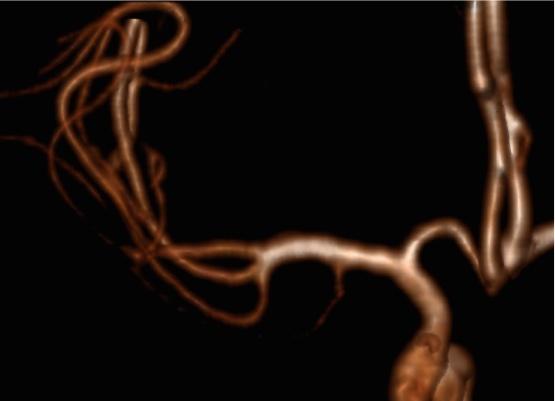
PICA / AICA: распространенный вариант Рис.4:
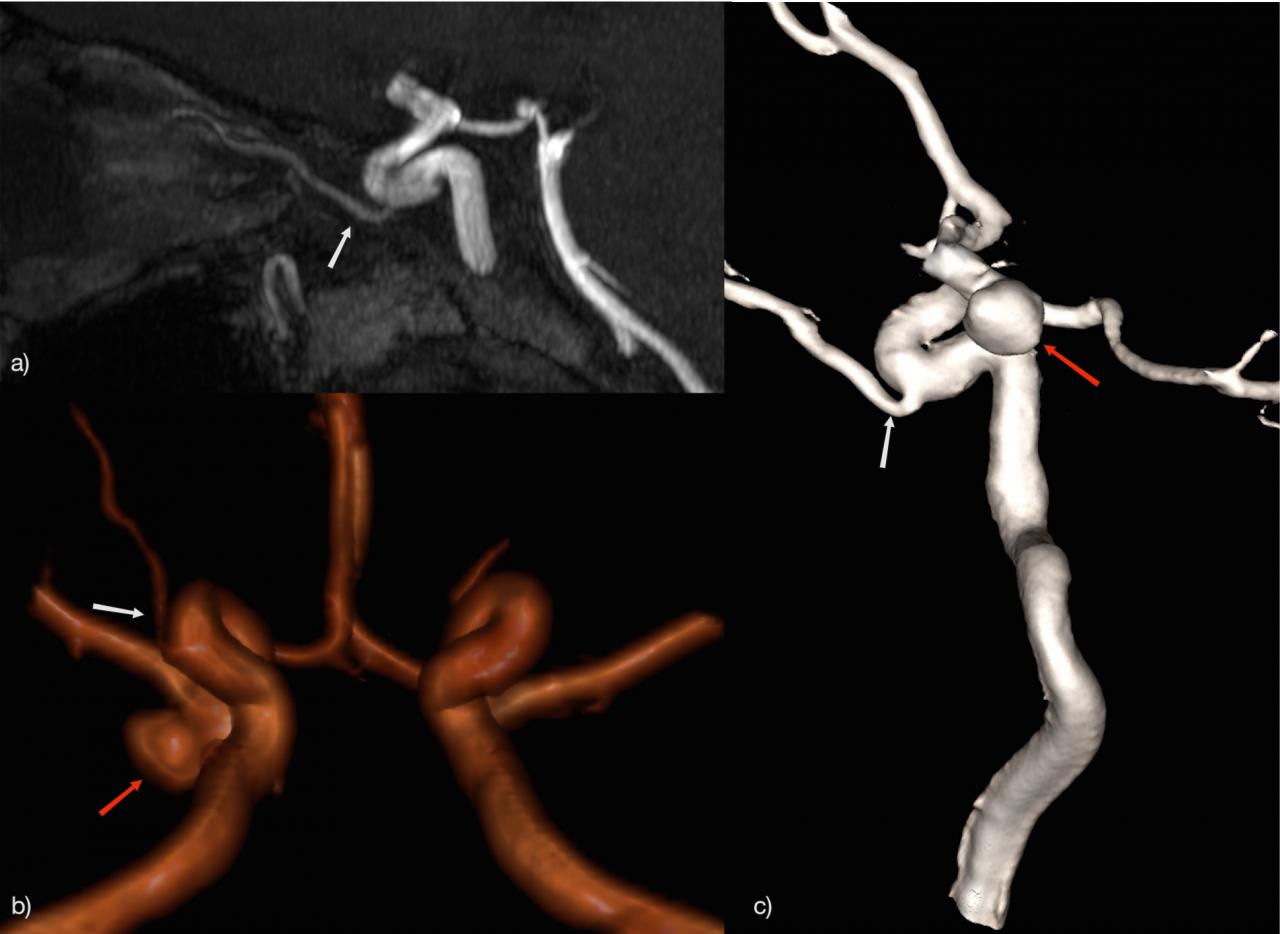
1.1.2. Воронка: 7-15% Рис.5:
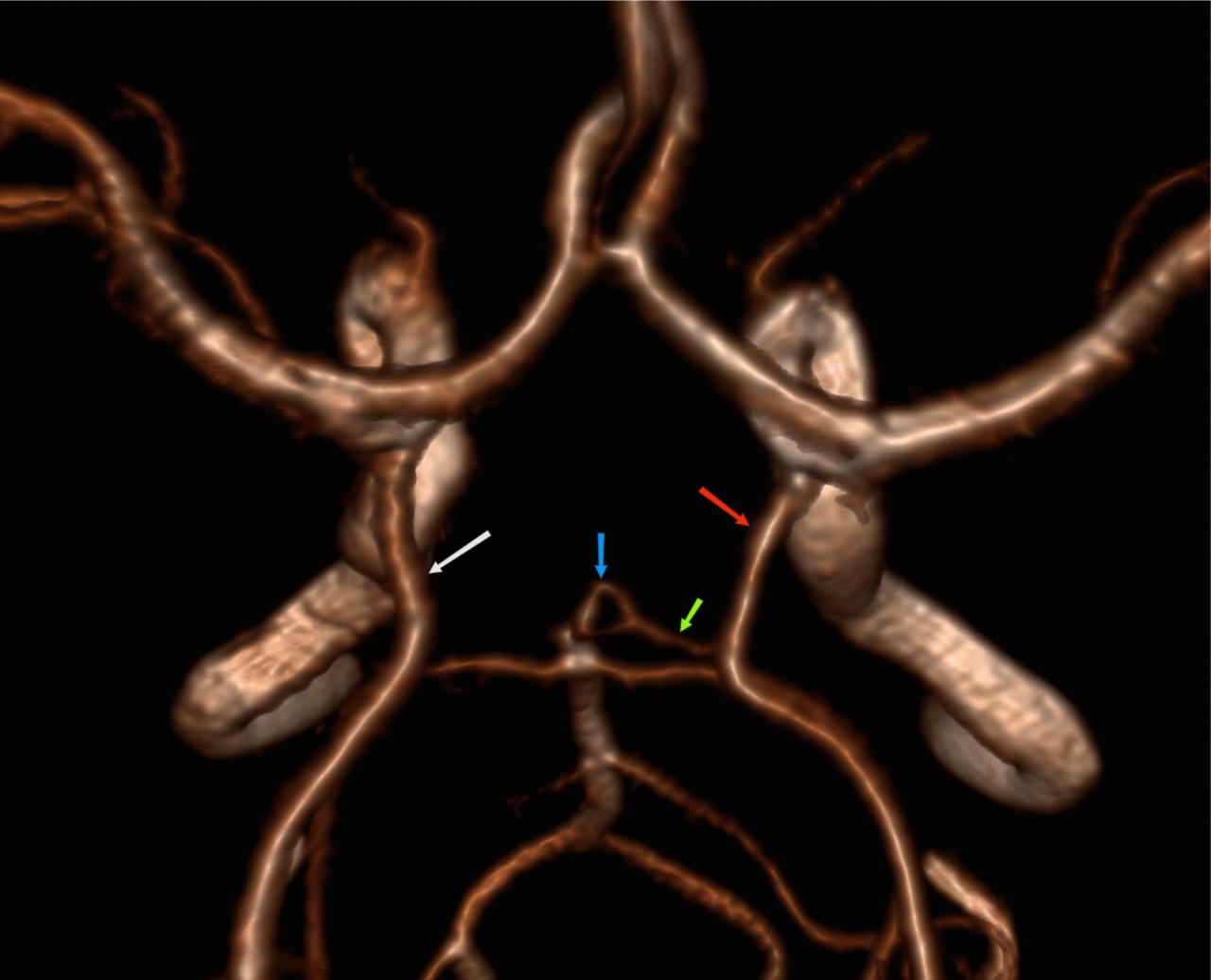
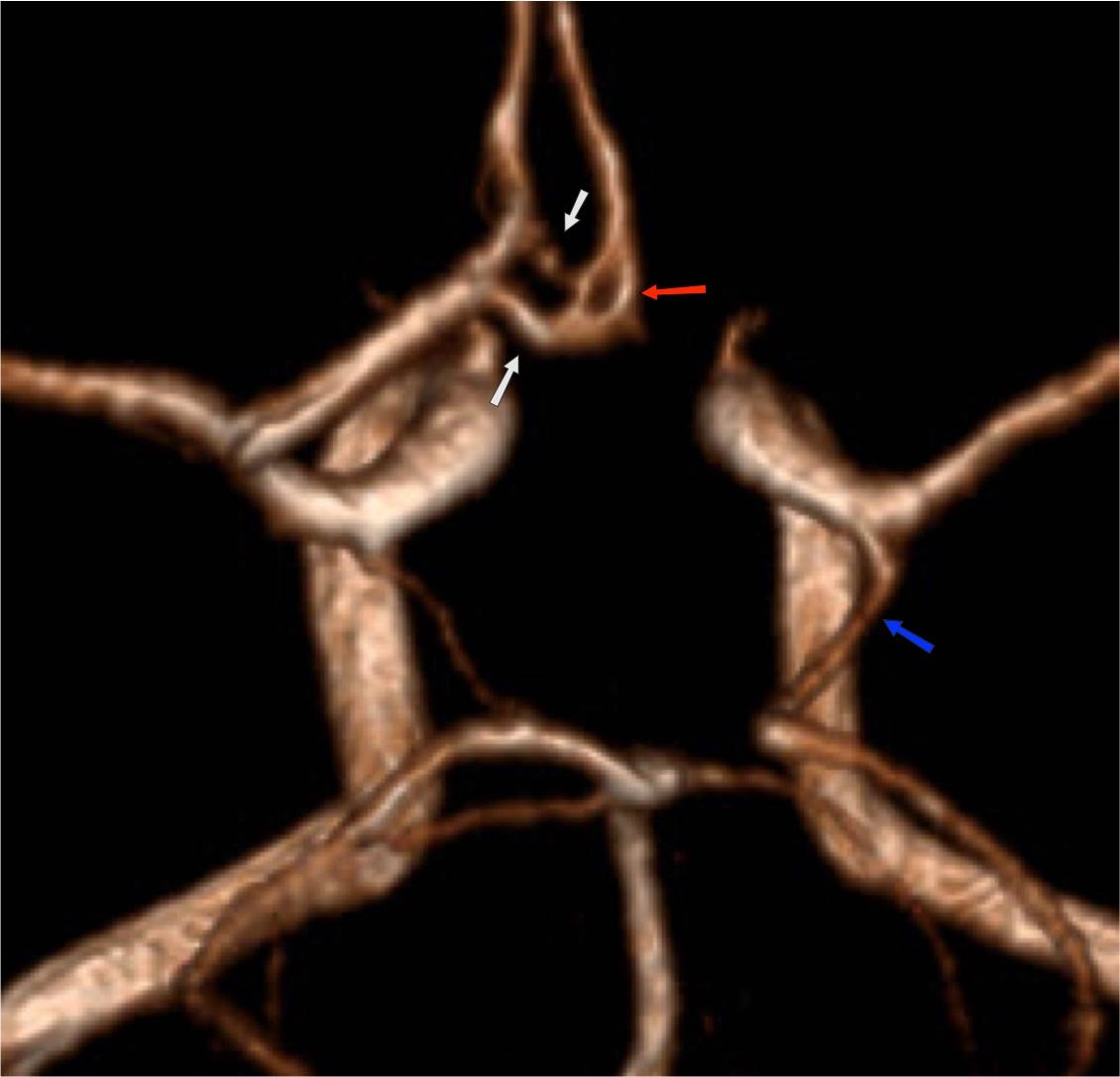
Представляет собой воронкообразную дилатацию сосуда у места отхождения. Её диаметр должен быть не более 3мм. Наиболее часто встречается у места отхождения задней соединительной артерии (Pcom). Также подобный вариант был описан в передней соединительной артерии (Acom), глазной артерии и передней хориоидальной артерии [2].
1.1.3. Аномальное происхождение (отхождение) из-за персистирующего эмбрионального кровообращения:
Задние соединительные артерии являются терминальными ветвями базилярной артерии. В процессе развития РСА берут свое начало от внутренней сонной артерии (ICA). Такой вариант, если он сохраняется в постнатальном периоде, называется «фетальным происхождением». Этот вариант может быть классифицирован на два подтипа: Рис.6
Персистирующая дорзальная глазная артерия (PDOA): 1,1% Рис.8, Рис.46 :
Во время эмбрионального развития, орбита снабжается кровью через переднюю и заднюю ветви, которые берут начало от ICA. Как правило, задняя ветвь облитерируется, а передняя ветвь продолжает кровоснабжать орбиту. Тем не менее, при данном варианте происходит обратное. PDOA входит в орбиту через верхнюю глазничную щель [4].
Глазная артерия также может отходить от других частей ICA, в том числе от кавернозного сегмента, у 8% населения [2] Рис.9.
ММА из глазничной артерии: 16% Рис.10 :
Во время эмбриогенеза средняя менингеальная артерия (ММА) отходит от стременной артерии (stapedial artery). Стременная артерия отдает ветви ECA. Одна из этих ветвей надглазничная артерия, которая образует анастомоз с развивающейся глазной артерией. Вдоль этого анастомоза, провал сегментарной регрессии или персистенция сегментов, которые должны регрессировать, приводят к ряду аномалий, таких как происхождение ММА из глазной артерии [2].В этом случае foramen spinosum будет отсутствовать.
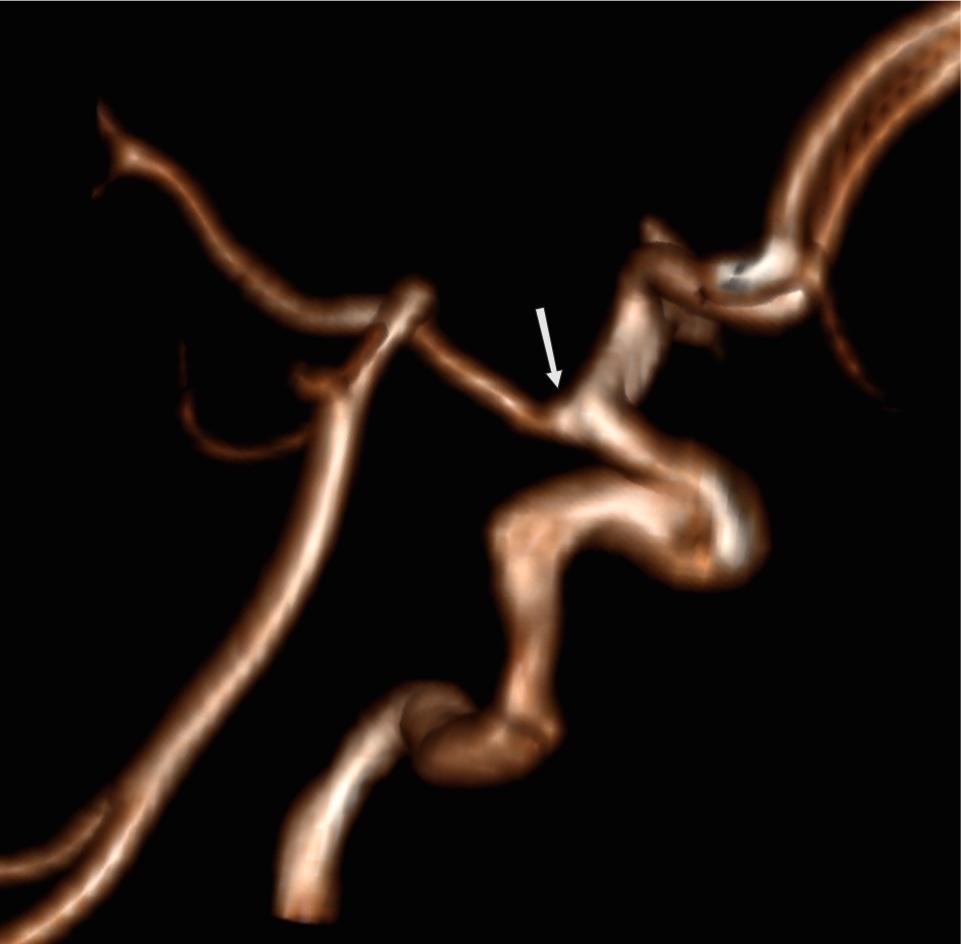
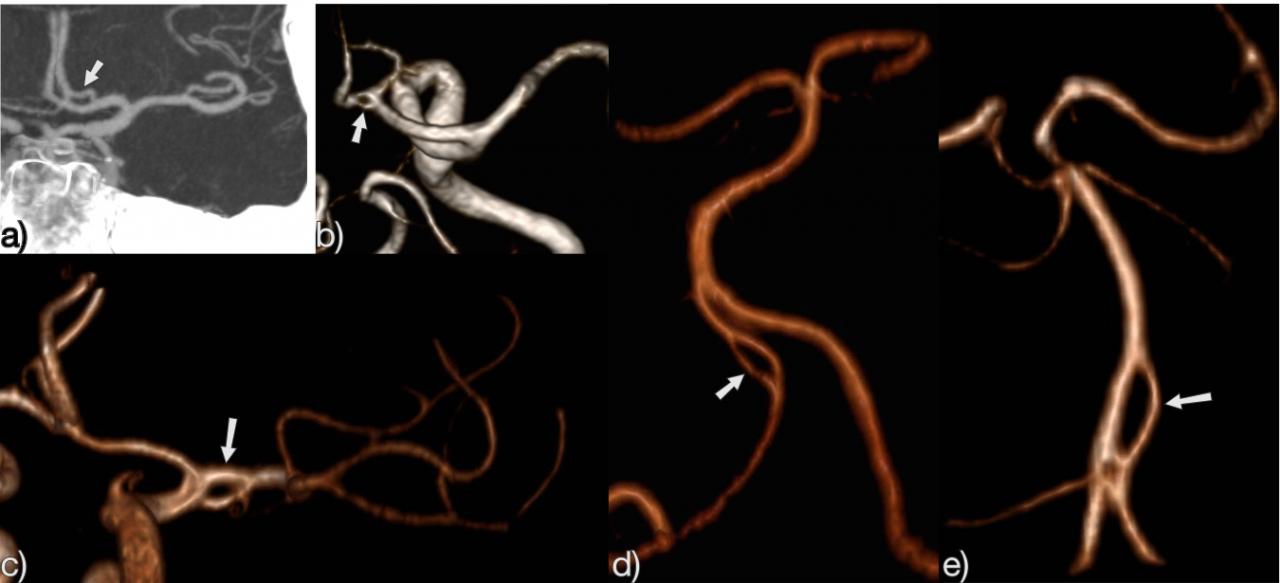
Рис.4 3D TOF MRA AICA (белая стрелка), идущая в каудальном направлении, кровоснабжающая территорию PICA. Обратите внимание на отсутствие PICA ипсилатерально. Контралатеральная PICA присутствует (зеленая стрелка).
Рис.5 3D TOF МРА, воронкообразное расширение (воронка) в месте отхождения Pcom (стрелка).
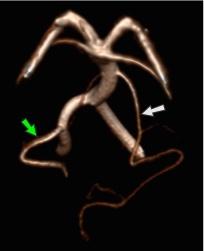
Рис.6 3D TOF MRA, полная фетальная PCA (белая стрелка) с отсутствием P1 сегмента с одной стороны и частичная фетальная PCA (красная стрелка) с гипоплазией P1 сегмента (зеленая стрелка) на другой стороне. Примечание фенестрация проксимальной части P1 сегмента (синяя стрелка).
Рис.7 3D TOF, полные фетальные PCA с обеих сторон и гипоплазированная базилярная артерия
Рис.8 Персистирующая дорсальная глазная артерия: MIP (а) и 3D (б) TOF MRA показывают глазную артерию, отходящую от задней поверхности ICA (стрелка на рисунке а) и отмеченную красным цветом (на рисунке b).
Рис.9 Кавернозное происхождение глазной артерии: вид сбоку MIP TOF (а), вид снизу 3D TOF MRA (b), и вид сбоку 3D rotational DSA (с), показывающие глазную артерию (белая стрелка), отходящую от латеральной поверхности кавернозного сегмента ICA. Обратите внимание на случайно обнаруженную аневризму Pcom (красная стрелка).
Рис.10 DSA (а), показывающая ММА (красная стрелка), отходящую от глазной артерии (белая стрелка). MIP реконструкция в костном окне КТ (b), показывающая отсутствие foramen spinosum с левой стороны. Foramen spinosum c правой стороны отмечено для сравнения (синяя стрелка).
1.2. Изменение количества сосудов
1.2.1. Уменьшение количества сосудов
ICA агенезия : 0,01% Рис.11, Рис.47:
Аплазия А1 сегмента: 1-2%. Рис.12 и Рис.15 :
В этой ситуации оба сегмента А2 кровоснабжаются из существующего A1 сегмента [2].
Azygos ACA: менее 1% Рис.13 :
Оба сегмента А1 образуют общий А2 сегмент, который кровоснабжает оба полушария[2].
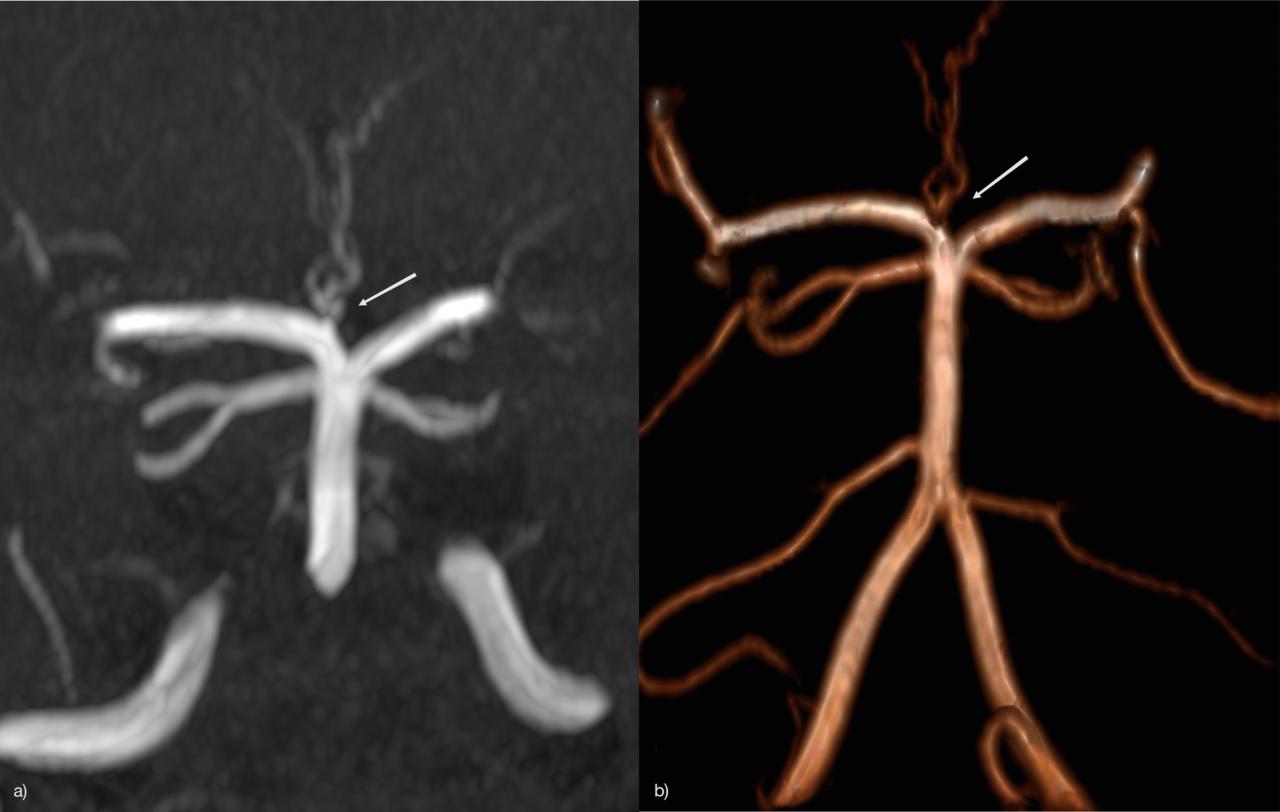
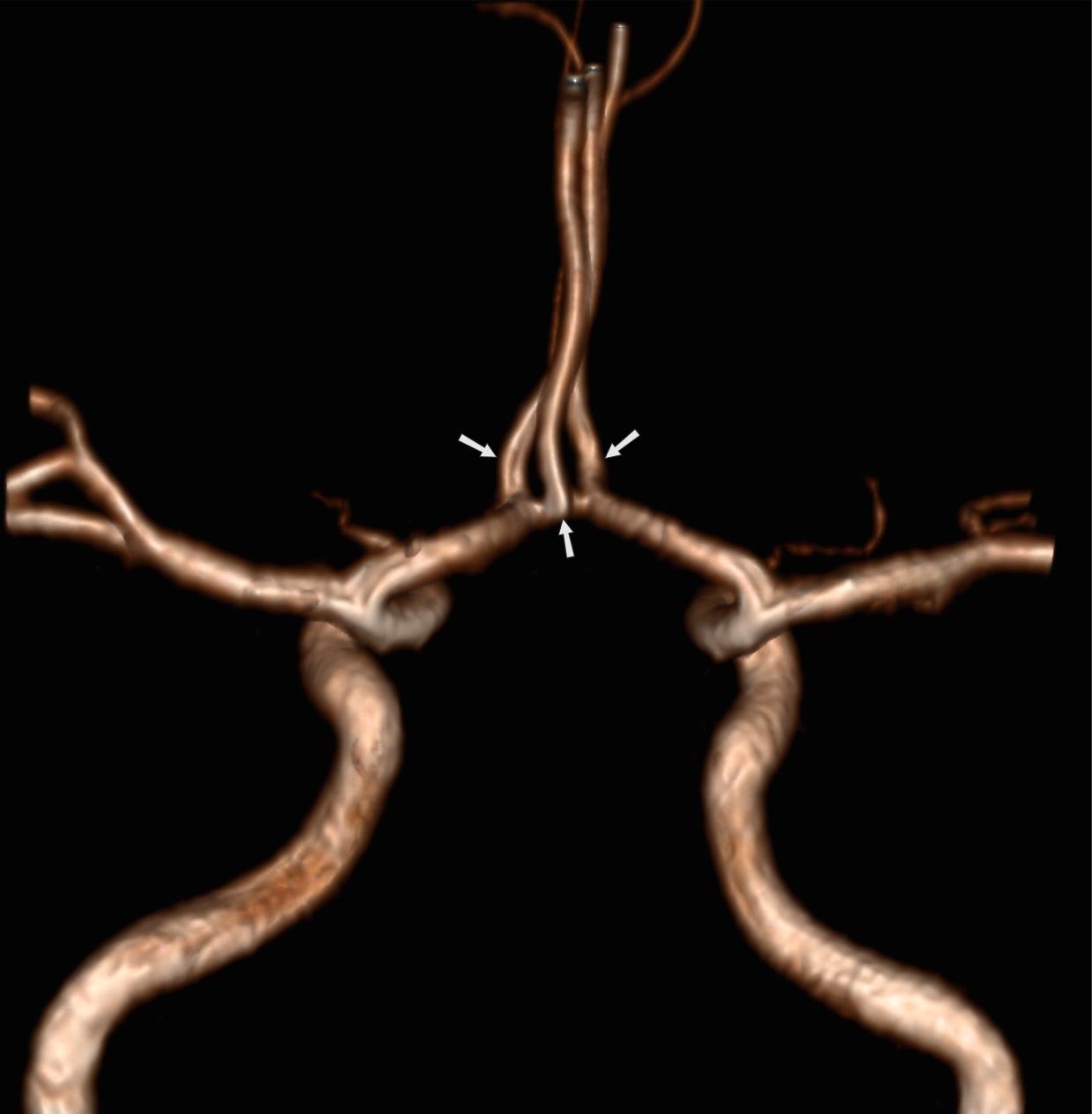
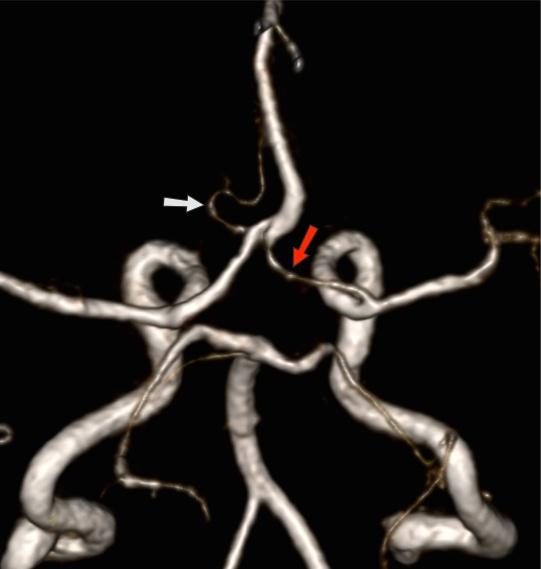
Отсутствие Acom: 5% Рис.14 [2]:
Как правило, отсутствие передней соединительной артерии (Acom) не легко определить на времяпролетной МР-ангиографии, потому что артерия может присутствовать, но сигнал потока слишком слабый, чтобы быть визуализированным.
Отсутствие Pcom: 0,6% Рис.15 :
Задняя соединительная артерия (Pcom), как правило, меньше, чем P1 сегмент. Полное отсутствие редко [2].
Артерия Першерона (Percheron): 4-11.5% Рис.16 :
Таламо-мезенцефальное артериальное кровоснабжение может быть подразделено на 3 типа: тип 1 является наиболее распространенным, перфорантные артерии с обеих сторон отходят от P1 сегментов; тип 2, известный как артерия Першерона, отходящая от одного из P1 сегментов, кровоснабжающая обе стороны; тип 3 представляет собой арку, которая соединяет оба сегмента P1, и из которой берут начало перфорантные артерии [5].
1.2.2. Увеличение числа сосудов
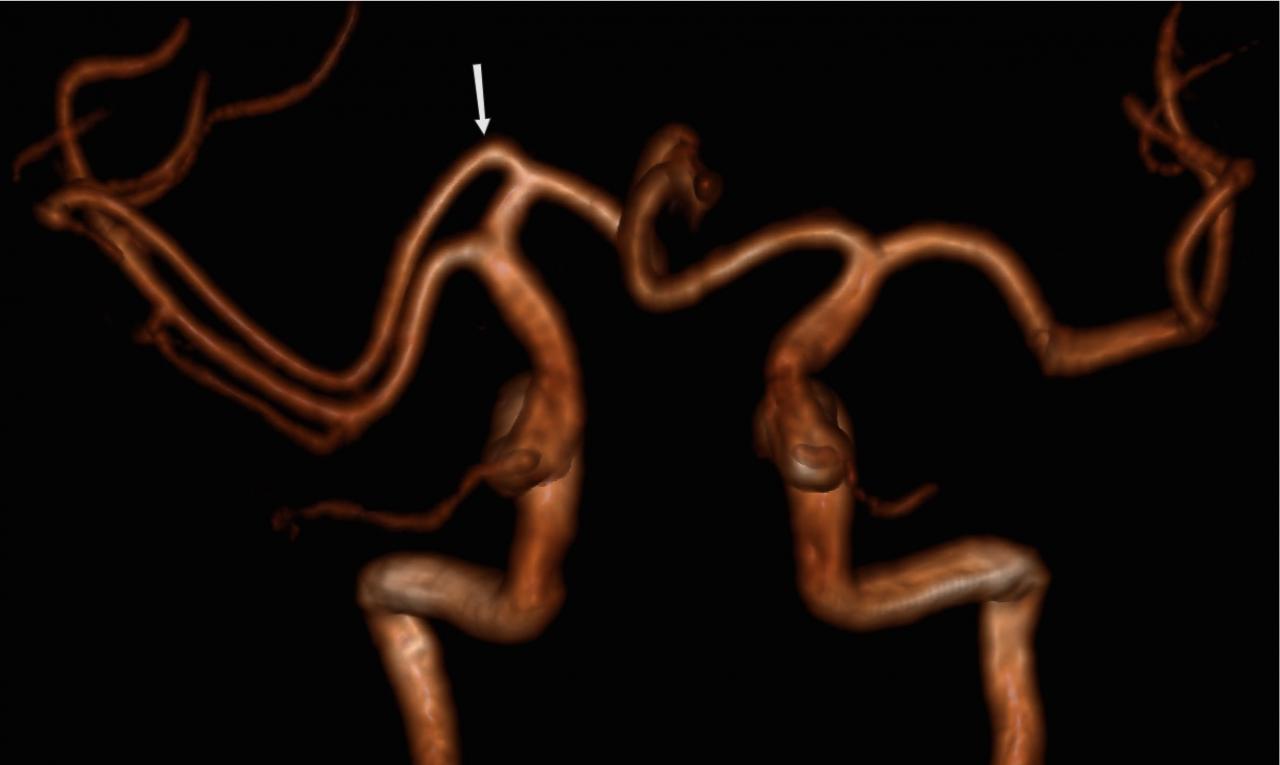
Добавочная MCA: 2,7% Рис.17 :
Литературные определения добавочной средней мозговой артерии (MCA) и удвоения MCA довольно дихотомичны. В данной работе мы используем определение Teal и др., которые ограничили термин «добавочная MCA» ветвью, происходящей из передней мозговой артерии (ACA), а термин «удвоенная MCA» артерией, возникающей из дистального сегмента ICA [6]. Чтобы отличить добавочную MCA от удвоенной, доминирующий сосуд должен быть идентифицирован путем тщательного поиска бифуркации MCA. Сравнение с контралатеральной стороной также полезно, чтобы найти уровень бифуркации ICA [1].
Удвоение: относится к двум отдельным артериям, которые не демонстрируют дистального слияния. Например:
Рис.11 Агенезия левой ICA. TOF MRA (а), отсутствие сигнал от потока в левой ICA. MIP СТА (с), CCA продолжается как ECA с отсутствием ICA. Костное окно КТ (b), отсутствие костного сонного канала на левой стороне. Нормальный сонный канал на правой стороне отмечен красной стрелкой для сравнения.
Рис.12 3D MRA, отсутствие А1 сегмента ACA, оба А2 сегмента, отходят с контралатеральной стороны. Обратите внимание на частичную фетальную PCA (белая стрелка), удвоение верхней мозжечковой артерии (синяя стрелка) и гипоплазию позвоночной артерии (красная стрелка), которая заканчивается, как PICA.
Рис.13 3D MRA, слияние обоих A1 сегментов с формированием единого А2 сегмента (azygos ACA) (стрелка).
Рис.14 3D TOF MRA, отсутствие Acom.
Рис.15 3D TOF, отсутствие Pcom и A1 сегмента на одной стороне. Значение этого варианта: в случае окклюзии ICA на этой стороне не будет возможности коллатерализации через Вилизиев круг. Случайная находка: аневризма терминальной части контралатеральной ICA (стрелка).
Рис.16 MIP (а) и 3D TOF (b), тип 2 таламо-мезенцефального артериального кровоснабжения (артерия Першерона) с одиночным артериальным стволом (стрелка), отходящим от P1 сегмента, ветви которого кровоснабжают обе стороны.
Рис.17 3D TOF, добавочная MCA (стрелка), отходящая от А1 сегмента.
Рис.18 3D TOF, удвоенная MCA (красная стрелка), отходящая от дистальной части ICA. Эту артерию не следует путать с передней височной ветвью (белая стрелка), являющейся частой находкой.
Рис.19 3D TOF, удвоение Acom (белые стрелки), фенестрация проксимальной части A2 сегмента (красная стрелка), аплазия А1 сегмента и полная фетальная PCA (синяя стрелка).
Рис.20 3D TOF, трифуркация АСА с тремя А2 сегментами (стрелки), третья ветвь возникает из Acom
Рис.21 3D TOF, трифуркация MCA с дополнительным средним стволом.
Рис.22 3D TOF, квадрифуркация MCA.
1.3. Изменение морфологии
1.3.1. Гипоплазия
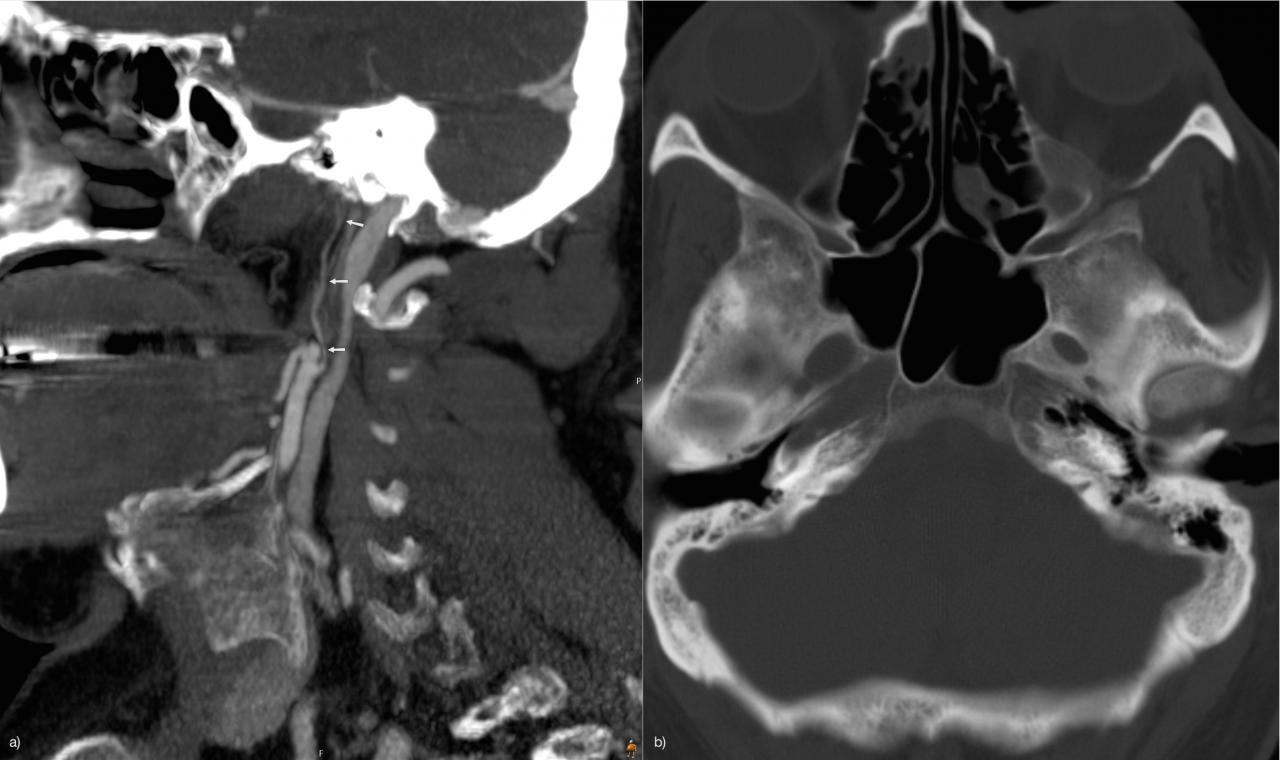
Гипоплазия ICA: 0,079% Рис.23 :
В отличие от агенезии, тонкий сосуд идентифицируется. Опять же, томография основания черепа полезна для визуализации костного сонного канала, который при гипоплазии тоньше, чем обычно [2].
Гипоплазия A1: 10% Рис.24 :
Асимметрия А1 сегментов наблюдается в 80% случаев. Гипоплазия определяется при диаметре сосуда меньше, чем 1,5мм [2].
Гипоплазия A2 (bihemispheric ACA): 7% Рис.24 :
Один из сегментов А2 гипоплазирован. В этом варианте кровоснабжение ипсилатерального полушария происходит в основном из контралатерального (доминирующего) А2 сегмента [2].
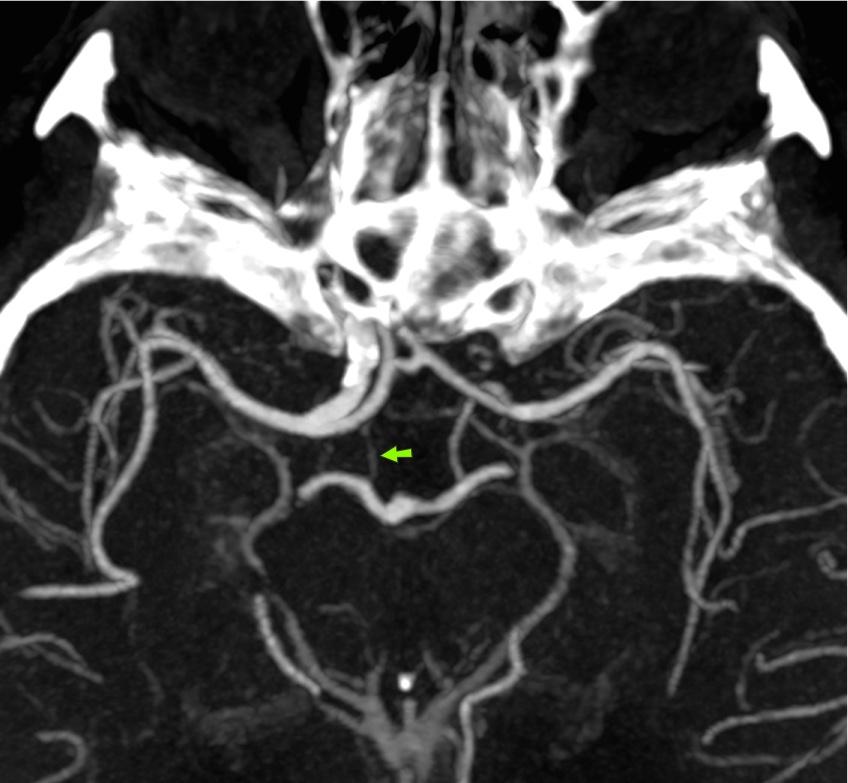
Гипоплазия Pcom: 34% Рис.25 :
но полное отсутствие является редкой находкой [2].
Гипоплазия позвоночной артерии:
50% с правой стороны (левая доминантная), 25% левосторонняя (правая доминантная), 25% кодоминантные. Примерно у 0,2% позвоночная артерия заканчивается в PICA Рис.12 и Рис.26 [7] [2]
1.3.2. Гиперплазия
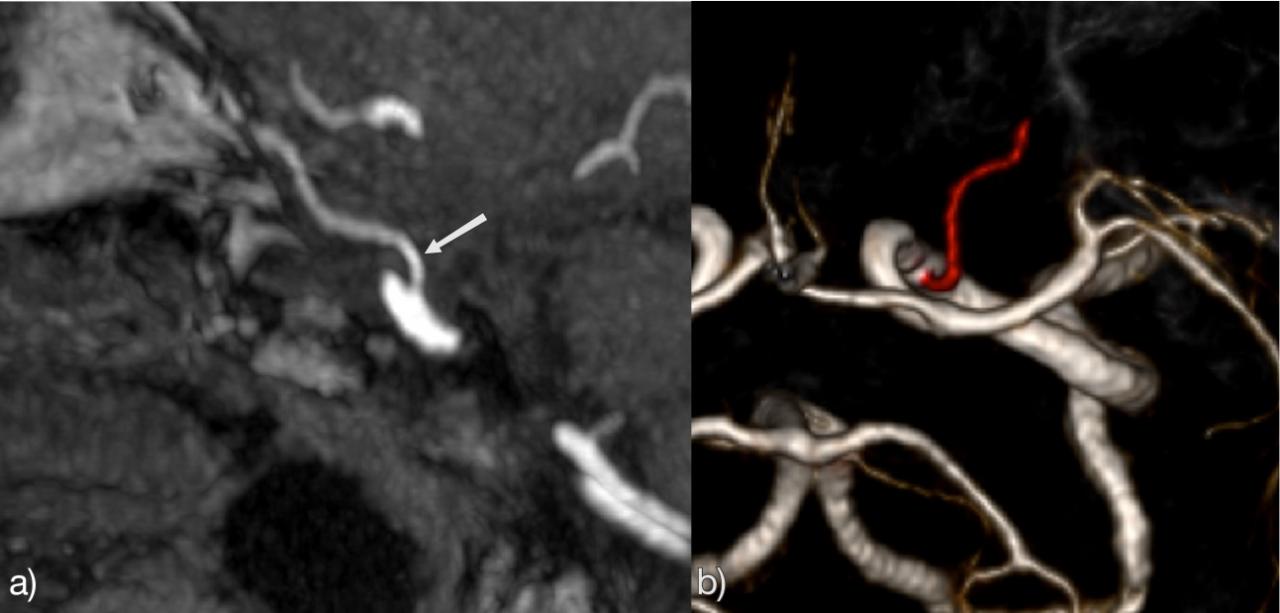
Гиперплазия передней хориоидальной артерии: 2,3% Рис.27 :
Передняя хориодальная артерия отходит от задней поверхности терминального сегмента ICA, дистальнее места отхождения Pcom. Это, как правило, небольшая ветвь. Если она увеличена (гиперплазирована), то кровоснабжает часть территории задней мозговой артерии (затылочно-височной ветви) [1, 2].
1.3.3. Ранняя бифуркация (раннее деление):
Ранняя бифуркация MCA : это частая находка Рис.28 :
Горизонтальный сегмент MCA, как правило, длиной 12 мм, но может быть короче, с ранним разветвлением (би- или трифуркация) [1].
Фенестрация базилярной артерии Рис.29 : 0.12-1.33%: основная артерия образована путем слияния двух продольных невральных артерий. Неполное слияние приводит к сегментарной фенестрации, которая обычно присутствует в проксимальном сегменте базилярной артерии [2].
Рис.23 CTA (а), гипоплазированная ICA (стрелки). Костное окно КТ (b) асимметричный костный сонный канал
Рис.24 3D TOF, гипоплазия А2 сегмента (белая стрелка) и контралатеральный доминантный A2 сегмент «bihemispheric АСА». Обратите внимание на гипоплазию A1 сегмента (красная стрелка).
Рис.25 MIP CTA, гипоплазия правой Pcom (стрелка). Обратите внимание на патологическую окклюзию контрлатеральной ICA.
Рис.26 3D TOF, гипоплазия позвоночной артерии (белая стрелка), которая заканчивается, как PICA (зеленая стрелка).
Рис.27 3D TOF, гиперплазия передней хориоидальной артерии (белая стрелка). Контралатеральная передняя хориоидальная артерия нормального калибра (зеленая стрелка). Красная стрелка указывает на фетальную PCA, синяя стрелка на Pcom.
Рис.28 3D MRA, ранняя бифуркация с коротким пребифуркационным сегментом М1 (стрелка).
Рис.29 Фенестрация А1 сегмента (а), Acom (b), M1 сегмента (с), V4 сегмент (d) и проксимальной части основной артерии (е).
1.4. Изменение хода
1.4.1. Аберрантная латеральная глоточная ICA, извитая ICA и «целующиеся» сонные артерии:
Во время эмбрионального развития, ICA, как полагают, чтобы начать разматываться как дорсальный корень аорты, спускается в грудную клетку, что дает прямой путь для ICA. Сбой в разматывании приводит к извилистости ICA, которая проходит в непосредственной близости от средней линии задней стенки глотки, и называется аберрантной латеральной глоточной артерией [6].
Такая морфология чаще наблюдается у пациентов пожилого возраста или у пациентов с артериальной гипертензией, но её не следует путать с эмбриональным вариантом, хотя оба варианта имеют одинаковое значение (см ниже). Частота аберрантной латеральной глоточной ICA составляет около 5%, но точная распространенность аномалии не известна, так как она не может быть морфологически отдифференцирована от извитости. Исследования, проведенные Ekici и соавт. показали, что наименее вовлеченной возрастной группой с извитостью ICA была младшая возрастная группа [8].
1.4.2. Персистирующая примитивная обонятельная артерия: 0,14%
ACA происходит из примитивной обонятельной артерии, которая регрессирует с образованием возвратной артерии Хюбнера (Heubner). Нарушение регрессии приводит к сохранению примитивной обонятельной артерии. Эта артерия имеет крайний передне-нижний ход в сегменте А1, который перемещается вдоль обонятельного тракта перед задне-верхним переходом к А2 сегменту, образуя конфигурацию в форме шпильки [9].
1.4.3. Персистирующий эмбриологический анастомоз
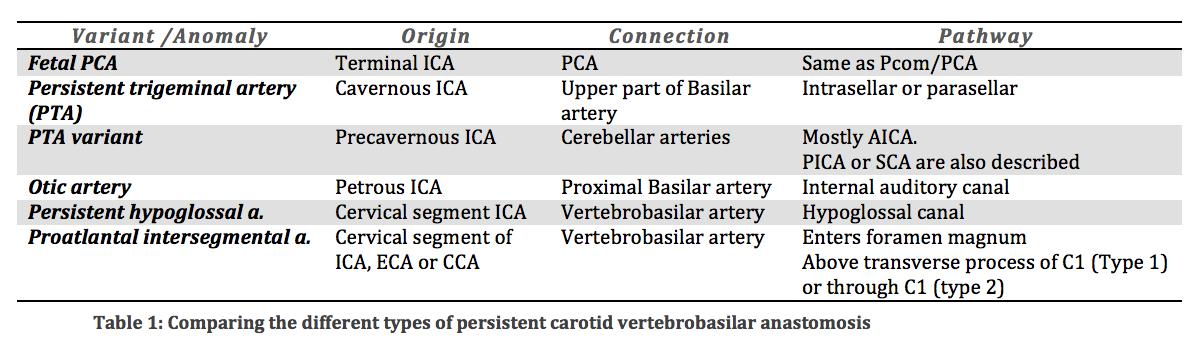
+ персистирующий каротидно-вертебробазиларный анастомоз:
Во время эмбрионального развития, передняя циркуляция питает задний мозг через несколько анастомозов, так как задняя циркуляция пока еще недостаточно развита. После развития позвоночных артерий, эти анастомозы регрессируют. Нарушение регрессии приводит к аномальному сообщению между передней и задней циркуляцией в постнатальном периоде. Наиболее распространенной формой этих анастомозов является фетальный тип PCA (см. варианты происхождения/отхождения сосудов). Распознавание хода этих аномальных сосудов, а также уровень входа в череп, имеют решающее значение для их дифференциации Таблица 1
+ персистирующий внутренний-наружный сонный анастомоз
В таблице 3 приведена частота обсуждаемых вариантов, тем не менее, существуют и другие редкие варианты, которые не могут быть включены в один документ. И, наконец, наличие полностью развитого Виллизиева круга можно считать вариантом, поскольку он присутствует менее чем у 50% популяции [2]
* N.B.: частота варьируется между авторами в зависимости от типа проведенного исследования (КТ, МРТ, хирургическое или посмертное). Частота также может варьироваться в зависимости от географического распределения; опубликованные данные не всегда могут быть применимы к другим группам популяции.
Таблица 1: Типы персистирующих каротидно-вертебробазилярных анастомозов