ндмп у детей что это такое
Нейрогенный мочевой пузырь у детей
Нейрогенный мочевой пузырь у детей – функциональные расстройства наполнения и опорожнения мочевого пузыря, связанные с нарушением механизмов нервной регуляции. Нейрогенный мочевой пузырь у детей может проявляться неконтролируемыми, учащенными или редкими мочеиспусканиями, ургентными позывами, недержанием или задержкой мочи, инфекциями мочевых путей. Диагноз нейрогенного мочевого пузыря у детей ставится по данным лабораторных, ультразвуковых, рентгенологических, эндоскопических, радиоизотопных и уродинамических исследований. Нейрогенный мочевой пузырь у детей требует комплексного лечения, включающего медикаментозную терапию, физиопроцедуры, ЛФК, хирургическую коррекцию.
Общие сведения
Зрелый, полностью контролируемый днем и ночью, режим мочеиспускания формируется у ребенка к 3-4 годам, прогрессируя от безусловного спинального рефлекса до сложного произвольно-рефлекторного акта. В его регуляции принимают участие кортикальные и субкортикальные центры головного мозга, центры спинальной иннервации пояснично-крестцового отдела спинного мозга, периферические нервные сплетения. Нарушение иннервации при нейрогенном мочевом пузыре у детей сопровождается расстройствами его резервуарно-эвакуаторной функции и может стать причиной развития пузырно-мочеточникового рефлюкса, мегауретера, гидронефроза, цистита, пиелонефрита, хронической почечной недостаточности. Нейрогенный мочевой пузырь значительно снижает качество жизни, формирует физический и психологический дискомфорт и социальную дезадаптацию ребенка.
Причины нейрогенного мочевого пузыря у детей
В основе нейрогенного мочевого пузыря у детей лежат неврологические нарушения разного уровня, приводящие к недостаточной координации активности детрузора и/или наружного сфинктера мочевого пузыря при накоплении и выделении мочи.
Нейрогенный мочевой пузырь у детей может развиваться при органическом поражении ЦНС вследствие врожденных пороков (миелодисплазии), травм, опухолевых и воспалительно-дегенеративных заболеваний позвоночника, головного и спинного мозга (родовой травме, ДЦП, спинномозговой грыже, агенезии и дисгенезии крестца и копчика и др.), приводящих к частичному или полному разобщению супраспинальных и спинальных нервных центров с мочевым пузырем.
Нейрогенный мочевой пузырь у детей может быть обусловлен неустойчивостью и функциональной слабостью сформировавшегося рефлекса управляемого мочеиспускания, а также нарушением его нейрогуморальной регуляции, связанным с гипоталамо-гипофизарной недостаточностью, задержкой созревания микционных центров, дисфункцией вегетативной нервной системы, изменением чувствительности рецепторов и растяжимости мышечной стенки мочевого пузыря. Основное значение имеет характер, уровень и степень поражения нервной системы.
Нейрогенный мочевой пузырь чаще встречается у девочек, что связано с более высокой эстрогенной насыщенностью, повышающей чувствительность рецепторов детрузора.
Классификация нейрогенного мочевого пузыря у детей
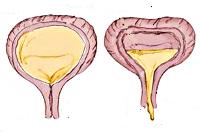
По изменению пузырного рефлекса различают гиперрефлекторный мочевой пузырь (спастическое состояние детрузора в фазу накопления), норморефлекторный и гипорефлекторный (гипотония детрузора в фазу выделения). В случае гипорефлексии детрузора рефлекс на мочеиспускание возникает при функциональном объеме мочевого пузыря, значительно превышающем возрастную норму, в случае гиперрефлексии – задолго до накопления нормального возрастного объема мочи. Наиболее тяжелой является арефлекторная форма нейрогенного мочевого пузыря у детей с невозможностью самостоятельного сокращения полного и переполненного мочевого пузыря и непроизвольным мочеиспусканием.
По приспособленности детрузора к нарастающему объему мочи нейрогенный мочевой пузырь у детей может быть адаптированный и неадаптированный (незаторможенный).
Симптомы нейрогенного мочевого пузыря у детей
Нейрогенный мочевой пузырь у детей характеризуется различными расстройствами акта мочеиспускания, тяжесть и частота проявлений которого определяется уровнем поражения нервной системы.
При нейрогенной гиперактивности мочевого пузыря, преобладающей у детей раннего возраста, отмечаются учащенные (> 8 раз/сутки) мочеиспускания малыми порциями, ургентные (императивные) позывы, недержание мочи, энурез.
Постуральный нейрогенный мочевой пузырь у детей проявляется только при переходе тела из горизонтального положения в вертикальное и характеризуется дневной поллакиурией, ненарушенным ночным накоплением мочи с нормальным объемом ее утренней порции.
Стрессовое недержание мочи у девочек пубертатного возраста может возникать при физической нагрузке в виде упускания небольших порций мочи. Для детрузорно-сфинктерной диссинергии характерны полная задержка мочеиспускания, микции при натуживании, неполное опорожнение мочевого пузыря.
Нейрогенная гипотония мочевого пузыря у детей проявляется отсутствующими или редкими (до 3-х раз) мочеиспусканиями при полном и переполненном (до 1500 мл) мочевом пузыре, вялым мочеиспусканием с напряжением брюшной стенки, ощущением неполного опорожнения из-за большого объема (до 400 мл) остаточной мочи. Возможна парадоксальная ишурия с неконтролируемым выделением мочи вследствие зияния наружного сфинктера, растянутого под давлением переполненного мочевого пузыря. При ленивом мочевом пузыре редкие мочеиспускания сочетаются с недержанием мочи, запорами, инфекциями мочевыводящих путей (ИМП).
Нейрогенная гипотония мочевого пузыря у детей предрасполагает к развитию хронического воспаления мочевых путей, нарушению почечного кровотока, рубцеванию почечной паренхимы и формированию вторичного сморщивания почки, нефросклероза и ХПН.
Диагностика нейрогенного мочевого пузыря у детей
При наличии расстройств мочеиспускания у ребенка необходимо проведение комплексного обследования с участием педиатра, детского уролога, детского нефролога, детского невролога и детского психолога.
Диагностика нейрогенного мочевого пузыря у детей включает сбор анамнеза (семейная отягощенность, травмы, патология нервной системы и др.), оценку результатов лабораторных и инструментальных методов исследования мочевой и нервной системы.
Для выявления ИМП и функциональных нарушений со стороны почек при нейрогенном мочевом пузыре у детей выполняют общий и биохимический анализ мочи и крови, пробу Зимницкого, Нечипоренко, бактериологическое исследование мочи.
Урологическое обследование при нейрогенном мочевом пузыре включают УЗИ почек и мочевого пузыря ребенку (с определением остаточной мочи); рентгенологическое исследование (микционную цистографию, обзорную и экскреторную урографию); КТ и МРТ почек; эндоскопию (уретроскопию, цистоскопию), радиоизотопное сканирование почек (сцинтиграфию).
Для оценки состояния мочевого пузыря у ребенка отслеживают суточный ритм (количество, время) и объем спонтанных мочеиспусканий при нормальном питьевом и температурном режиме. Высокую диагностическую значимость при нейрогенном мочевом пузыре у детей имеют уродинамическое исследование функционального состояния нижних мочевых путей: урофлоуметрия, измерение внутрипузырного давления при естественном заполнении мочевого пузыря, ретроградная цистометрия, профилометрия уретры и электромиография.
Лечение нейрогенного мочевого пузыря у детей
В зависимости от типа, тяжести нарушений и сопутствующих заболеваний при нейрогенном мочевом пузыре у детей используют дифференцированную лечебную тактику, включающую немедикаментозную и медикаментозную терапию, хирургическое вмешательство. Показано соблюдение охранительного режима (дополнительный сон, прогулки на свежем воздухе, исключение психотравмирующих ситуаций), прохождение курсов ЛФК, физиотерапии (лекарственного электрофореза, магнитотерапии, электростимуляции мочевого пузыря, ультразвука) и психотерапии.
При гипотонии мочевого пузыря рекомендованы принудительные мочеиспускания по графику (каждые 2-3 часа), периодические катетеризации, прием холиномиметиков (ацеклидин), антихолинэстеразных средств ( дистигмин), адаптогенов (элеутерококк, лимонник), глицина, лечебные ванны с морской солью.
В целях профилактики ИМП у детей с нейрогенной гипотонией мочевого пузыря назначают уросептики в малых дозах: нитрофураны (фуразидин), оксихинолоны (нитроксолин), фторхинолоны (налидиксовая кислота), иммунокорригирующую терапию (левамизол), фитосборы.
При нейрогенном мочевом пузыре у детей выполняют внутридетрузорные и внутриуретральные инъекции ботулотоксина, эндоскопические хирургические вмешательства (трансуретральную резекцию шейки мочевого пузыря, имплантацию коллагена в устье мочеточника, операции на нервных ганглиях, ответственных за мочеиспускание), проводят увеличение объема мочевого пузыря с помощью кишечной цистопластики.
Прогноз и профилактика нейрогенного мочевого пузыря у детей
При правильной лечебной и поведенческой тактике прогноз нейрогенного мочевого пузыря у детей наиболее благоприятен в случае гиперактивности детрузора. Наличие остаточной мочи при нейрогенном мочевом пузыре у детей увеличивает риск развития ИМП и функциональных нарушений почек, вплоть до ХПН.
Для профилактики осложнений важно раннее выявление и своевременное лечение нейрогенной дисфункции мочевого пузыря у детей. Детям с нейрогенным мочевым пузырем необходимо диспансерное наблюдение и периодическое исследование уродинамики.
Нейрогенный мочевой пузырь
Нейрогенный мочевой пузырь – это дисфункция мочевого пузыря, обусловленная врожденной или приобретенной патологией нервной системы. В зависимости от состояния детрузора дифференцируют гипер- и гипорефлекторный тип патологии. Заболевание может проявляться поллакиурией, недержанием мочи или ее патологической задержкой. Диагностика синдрома заключается в полном невролого-урологическом обследовании (анализы, урография, УЗИ почек и мочевого пузыря, урофлоурометрия, цистография и цистоскопия, сфинктерометрия, рентгенография и МРТ позвоночника, МРТ головного мозга и пр.). Лечение может включать немедикаментозную и лекарственную терапию, катетеризацию мочевого пузыря, оперативное вмешательство.
Общие сведения
Патология часто сопровождается миофасциальным синдромом, синдромом тазовой венозной конгестии (венозного застоя). Более чем в 30% случаев наблюдается развитие вторичных воспалительно-дистрофических изменений со стороны мочевыделительной системы: пузырно-мочеточникового рефлюкса, хронического цистита, пиелонефрита и уретерогидронефроза, приводящих к артериальной гипертензии, нефросклерозу и хронической почечной недостаточности, что может грозить ранней инвалидизацией.
Причины
Нейрогенный мочевой пузырь у детей может иметь место при врожденных дефектах развития ЦНС, позвоночника и мочевыделительных органов, после перенесенной родовой травмы. Недержание мочи может быть вызвано снижением растяжимости и емкости мочевого пузыря вследствие цистита или неврологических заболеваний.
Классификация
Симптомы
Синдром нейрогенного мочевого пузыря может иметь постоянные, периодические или эпизодические проявления, а многообразие его клинических вариантов определяется различием уровня, характера, степени тяжести и стадии поражения нервной системы. Типичными для гиперактивного варианта патологии являются поллакиурия, в т. ч. никтурия, императивные позывы и недержание мочи. Преобладание тонуса детрузора ведет к значительному повышению внутрипузырного давления при малом количестве мочи, что при слабости сфинктеров вызывает императивные позывы и учащенное мочеиспускание.
Гиперактивный тип синдрома характеризуется спастическим состоянием и опорожнением при накоплении менее 250 мл мочи; отсутствием или малым объемом остаточной мочи, затруднением произвольного начала и самого акта мочеиспускания; появлением вегетативных симптомов (потливости, подъема артериального давления, усиления спастики) перед микцией в отсутствии позывов; возможностью спровоцировать мочеиспускание раздражением области бедра и над лобком. При наличии ряда неврологических нарушений может возникать неконтролируемое стремительное выделение большого объема мочи – «церебральный незаторможенный мочевой пузырь».
Относительное преобладание тонуса сфинктеров при детрузорно-сфинктерной диссинергии выражается полной задержкой мочи, мочеиспусканием при натуживании, наличием остаточной мочи. Гипоактивный нейрогенный мочевой пузырь проявляется снижением или отсутствием сократительной активности и опорожнения при полном и даже переполненном пузыре в фазу выделения.
Из-за гипотонии детрузора нет повышения внутрипузырного давления, необходимого для преодоления сопротивления сфинктера, что ведет к полной задержке или вялому мочеиспусканию, натуживанию во время микции, наличию большого (до 400 мл) объема остаточной мочи и сохранению ощущения наполненности пузыря. При гипотоничном растянутом мочевом пузыре возможно недержание мочи (парадоксальная ишурия), когда при переполнении органа происходит механическое растяжение внутреннего сфинктера и неконтролируемое выделение мочи каплями или небольшими порциями наружу.
Осложнения
Денервация вызывает развитие выраженных трофических нарушений и осложнений в виде интерстициального цистита, приводящего к склерозированию и сморщиванию мочевого пузыря. В мочевыводящих путях могут формироваться камни, нарушающие отток мочи, провоцирующие развитие инфекции. В случае спазма сфинктера может возникать пузырно-мочеточниковый рефлюкс (обратный заброс мочи в мочеточники и почки, приводящий к воспалению). Синдром часто сопровождается функциональными невротическими расстройствами, которые в дальнейшем могут стать определяющими.
Диагностика
Основными методами инструментальной диагностики синдрома являются УЗИ почек и мочевого пузыря, цистоскопия, МРТ, рентгенологическое исследование мочевыводящих путей (обычная и микционная уретроцистография, экскреторная урография, восходящая пиелография, радиоизотопная ренография), уродинамические исследования (цистометрия, сфинктерометрия, профилометрия, урофлоуметрия).
При отсутствии заболеваний со стороны мочевыделительной системы проводят неврологическое обследование для выявления патологии головного и спинного мозга с применением электроэнцефалографии, КТ, МРТ, рентгенографии черепа и позвоночника. Осуществляется дифференциальная диагностика с гипертрофией простаты, стрессовым недержанием мочи у пожилых людей. При невозможности установить причину заболевания говорят о нейрогенном мочевом пузыре с неясной этиологией (идиопатическом).
Лечение нейрогенного мочевого пузыря
Терапия проводится совместно врачом-урологом и неврологом; ее план зависит от установленной причины, типа, степени выраженности дисфункции мочевого пузыря, сопутствующей патологии (осложнений), эффективности ранее проведенного лечения. Применяют немедикаментозное, медикаментозное и хирургическое лечение, начиная с менее травматичных и более безопасных лечебных мероприятий.
Гиперактивный вариант лучше поддается лечению. Используют лекарственные средства, снижающие тонус мышц мочевого пузыря, активизирующие органное кровообращение и устраняющие гипоксию: антихолинергические препараты (гиосцин, пропантелин, оксибутинин), трициклические антидепрессанты (имипрамин), антагонисты кальция (нифедипин), альфа-адреноблокаторы (фентоламин, феноксибензамин).
В последнее время довольно перспективным в лечении гиперрефлексии, детрузорно-сфинктерной диссенергии и инфравезикальной обструкции считают применение инъекций ботулотоксина в стенку мочевого пузыря или уретры, внутрипузырное введение капсаицина и резинфератоксина. В дополнение назначают препараты на основе янтарной кислоты, L-карнитин, гопантеновая кислота, N-никотиноил-гамма-аминобутировая кислота, коферментные формы витаминов, обладающие антигипоксическим и антиоксидантным действием.
Параллельно применяют немедикаментозные методы лечения нейрогенного мочевого пузыря: лечебную физкультуру (специальные упражнения для тазовых мышц), физиотерапию (электростимуляцию, лазеротерапию, гипербарическую оксигенацию, диадинамотерапию, тепловые аппликации, ультразвук), тренировку мочевого пузыря, нормализацию режима питья и сна, психотерапию.
Гипоактивный вариант болезни труднее поддается терапии. Имеющиеся застойные явления в мочевом пузыре создают риск присоединения инфекции, развития вторичных поражений мочевой системы. В лечении нейрогенного синдрома с признаками гипотонии важно обеспечение регулярного и полного опорожнения мочевого пузыря (с помощью принудительных мочеиспусканий, наружной компрессии (прием Креде), методами физиотерапии, тренировки мышц мочевого пузыря и тазового дна, периодической или постоянной катетеризацией).
При медикаментозной терапии нейрогенного мочевого пузыря для профилактики мочевых инфекций необходимы контроль количества остаточной мочи и прием антибактериальных препаратов (нитрофуранов, сульфаниламидов), особенно пациентам с пузырно-мочеточниковым рефлюксом.
Также возможно оперативное увеличение мочевого пузыря (с использованием пластики тканей), ликвидация пузырно-мочеточникового рефлюкса, постановка цистостомического дренажа для опорожнения мочевого пузыря. Патогенетическое лечение синдрома нейрогенного мочевого пузыря позволяет уменьшить риск повреждения мочевыделительных органов и необходимость оперативного вмешательства в будущем.
Нейрогенная дисфункция мочевого пузыря
Общая информация
Краткое описание
Нейрогенная дисфункция мочевого пузыря – группа расстройств функций мочевого пузыря, возникающих при заболеваниях головного и спинного мозга, а также периферических нервов и интрамуральных нервных сплетений [1, 2, 3].
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: не проводится.
Общий анализ мочи: бактериурия, лейкоцитурия, эритроцитурия, протеинурия.
Толщина стенки растянутого мочевого пузыря не должна превышать 4 мм. После опорожнения стенка неравномерно утолщается, и ее размер может достигать 8 мм.
Цистография позволяет выявить нейрогенную дисфункцию мочевого пузыря, характерным признаком является «башенный пузырь», контуры мочевого пузыря неровные, нечеткие. Также после того как больной опорожнит мочевой пузырь от контрастной жидкости, следует произвести рентгенографию области мочевого пузыря, где выявляется наличие остаточной мочи с контрастным веществом.
Урофлоуметрия: снижение восходящего и нисходящего сегментов, падение объемной скорости кровотока мочи, увеличение времени мочеиспускания.
Дифференциальный диагноз
Лечение
В/в медленно, в виде раствора с концентрацией 100 мг/мл, максимальная разовая доза для взрослых – 2 г, для детей – 50 мг/кг; максимальная суточная доза для взрослых – 12 г. Для профилактики инфекционных послеоперационных осложнений – в/в по 1–2 г до за 30–60 мин до начала операции и затем каждые 12 часов.Длительность курса 7- 10 дней.
Длительность курса лечения составляет 7–10 дней; тяжелые инфекции могут потребовать более продолжительного лечения.
Больным с нарушением выделительной функции почек и пожилым пациентам, а также при тяжелой ожоговой болезни для адекватного выбора режима дозирования требуется определение концентрации гентамицина в плазме. Доза должна быть подобрана так, чтобы значение Cmax не превышало 12 мкг/мл (снижение риска развития нефро-, ото- и нейротоксичности). При отеках, асците, ожирении дозу определяют по «идеальной» или «сухой» массе тела. При нарушении функции почек и проведении гемодиализа рекомендуемые дозы после сеанса взрослым – 1–1,7 мг/кг (в зависимости от тяжести инфекции), детям – 2–2,5 мг/кг. Длительность курса – 7-10 дней.
Длительность курса- 7-10 дней.
Длительность курса 7-10 дней.
при внутривенном применении 7-10 дней.
Длительность курса до 27 дней.
Длительность курса до 6 месяцев.
Длительность курса 3-5 дней.
Длительность курса 10-15 дней.
• амикацин.Аморфный порошок белого или белого с желтоватым оттенком цвета, 500 мкг.раствор для инъекций.
• кетопрофен 100 мг, раствор для инъекций
Медикаментозное лечение, оказываемое на этапе скорой неотложной помощи: не проводится.
• электромиостимуляция (электрическое раздражение нервных импульсов).
Хирургическое вмешательство: не проводится.
Имплантация сакрального нейростимулятора: (при нейростимуляции происходит прямая стимуляция третьего сакрального сегмента через специальный электрод. Этот электрод вживляется в область третьего крестцового сегмента спинного мозга, и соединяется с генератором слабых электрических импульсов. Генератор имплантируется под кожу. Электростимуляция осуществляется при помощи монофазных электрических импульсов).
Нарушения функции нижних мочевых путей нейрогенной природы у детей и коррекция их методом транскраниальной магнитотерапии
Разработан подход к оптимизации терапии нейрогенной дисфункции мочевого пузыря и энуреза для повышения эффективности лечения путем транскраниальной магнитотерапии бегущим магнитным полем и уменьшения лекарственной нагрузки на ребенка.
The authors developed approach to the therapy of neurogenetic dysfunction of bladder and enuresis to enhance the efficiency of the treatment by transcranial magnetotherapy method by running magnetic field, and reduce drug load on child.
Нарушения мочеиспускания до настоящего времени остаются одной из основных проблем педиатрии и детской урологии.
Наиболее частыми расстройствами мочеиспускания в детском возрасте являются нейрогенные дисфункции мочевого пузыря (НДМП), которые встречаются у 10% детей [1–3]. Среди нефрологических и урологических больных эта цифра достигает 50–60% [4–5].
Самыми частыми и социально значимыми проявлениями НДМП являются гиперактивный мочевой пузырь и дисфункциональное мочеиспускание. Гиперактивный мочевой пузырь (ГМП) — специфическая дисфункция мочевого пузыря, клинически проявляющаяся полным или неполным синдромом императивного мочеиспускания (поллакиурия, императивные позывы, императивное недержание мочи, часто в сочетании с ноктурией, эквивалентом которой в педиатрической практике является энурез) [6]. Одинаковые клинические проявления ГМП у детей — поллакиурия, императивные позывы, императивное недержание мочи, энурез могут быть следствием надсегментарных поражений как с детрузорным компонентом (регистрируемыми подъемами детрузорного давления при наполнении мочевого пузыря), так и без него [7].
Клинический симптомокомплекс ГМП у детей и взрослых отличается. «Классический сценарий» ГМП у детей встречается редко в силу возрастных особенностей темпов созревания симпатического и парасимпатического отделов вегетативной нервной системы, нестабильности метаболизма головного мозга, а также присущей детскому организму склонности к развитию генерализованных реакций в ответ на локальное раздражение. У детей отмечается больший полиморфизм и выраженность синдрома, чем у взрослых. Так, могут иметь место ноктурия и энурез при почти нормальном ритме микций днем. В других случаях резкое снижение функциональной емкости мочевого пузыря в дневные часы с частыми мочеиспусканиями маленькими порциями при отсутствии какой-либо симптоматики ночью [8].
Дисфункциональное мочеиспускание (ДМ) — это любая функциональная аномалия, которая приводит к патологическому мочеиспусканию. Международное общество по удержанию мочи у детей (International Children?s Continence Society, ICCS) определяет дисфункциональное мочеиспускание как «гиперактивность уретрального сфинктера в фазу мочеиспускания у неврологически нормального ребенка». Примерно в 40% случаев причиной визита к детскому урологу является именно дисфункциональное мочеиспускание. ДМ является самой распространенной причиной дневного недержания мочи у детей из-за недостаточной релаксации и/или повышенной активности тазового дна и часто служит причиной возникновения пузырно-мочеточникого рефлюкса (ПМР) и инфекций мочевых путей. У пациентов с ДМ отмечаются снижение скорости потока мочи, многофазное мочеиспускание, а также хронические запоры [9]. В определенных ситуациях недержание мочи у детей, связанное с нейрогенной гиперактивностью детрузора, является дебютом клинических проявлений мальформаций спинного мозга, нейропатий различного генеза. В таких случаях недержание мочи уже не может считаться функциональным нарушением и требует специализированного многопрофильного обследования с участием педиатров, урологов, неврологов [10].
Природа происхождения гиперактивного мочевого пузыря полиэтиологична, сложные патогенетические механизмы до конца не изучены, а некоторые из них — дискуссионны. Основная роль в развитии ГМП принадлежит регулирующему действию гипоталамо-гипофизарной системы, задержке созревания центров регуляции акта мочеиспускания [11–12].
Бесспорным звеном патогенеза детрузорной гиперактивности у детей и взрослых следует считать повышенную чувствительность детрузора к медиатору парасимпатической нервной системы ацетилхолину [13]. Значимую роль в развитии расстройств мочеиспускания играют тканевая гипоксия и полисистемная митохондриальная дисфункция [14–16].
Одним из важных звеньев патогенеза НДМП является нарушение регуляции вегетативной нервной системы на любом ее уровне. Доказательством этого могут служить данные ряда исследований об эффективности использования вегетотропных и ноотропных препаратов для лечения гиперактивного мочевого пузыря [17–19].
Давно известно влияние психических процессов на функции мочевыводящей системы. Под влиянием нервного напряжения, помимо прочего, изменяется тонус сосудов, вследствие чего ухудшается кровоснабжение почек, что, в конечном счете, обусловливает изменение состава крови и мочи и тем самым оказывает воздействие на весь организм. Повышение тонуса означает также повышенную возбудимость сенсоров в стенке мочевого пузыря и вместе с этим сниженный порог возбуждения. Психогенные и другие функциональные нарушения регуляции функций мочевого пузыря составляют особый раздел неврологии и психоневрологии и обычно рассматриваются отдельно [20–22].
Несмотря на это, в последние годы отмечен высокий интерес урологов, нефрологов к изучению психосоциальных аспектов расстройств мочеиспускания, поскольку невозможно рассматривать формирование нездоровья у детей вне роли семьи [23–25].
Многочисленными рекомендациями, принятыми к использованию в России и за рубежом, определена необходимость инструментального исследования нижних мочевых путей (ретроградная цистометрия, цистография) для дифференциации характера нейрогенной дисфункции мочевого пузыря. При этом анамнестические данные, способные пролить свет на природу происхождения расстройств мочеиспускания у детей, недооцениваются или вовсе не учитываются. Ряд авторов показывает, что инвазивные урологические исследования у детей провоцируют выраженный ситуационный стресс, а их назначение при этом не всегда обосновано [26–27].
Несмотря на достигнутые успехи в изучении расстройств мочеиспускания у детей, диагностика зачастую основывается на самом ярком клиническом проявлении ГМП — энурезе и осуществляется уже на этапе осложнений, значительно нарушая качество жизни пациентов, а существующие методы лечения остаются недостаточно эффективными. Формирование стойких условно-рефлекторных взаимосвязей требует времени, и поэтому прием медикаментозных препаратов для лечения гиперактивного мочевого пузыря (оксибутинин) должен быть достаточно длительным (2–3 месяца). В то же время серьезные побочные эффекты препарата (формирование зависимости, сухость слизистых, запоры, сердцебиение, возможное развитие несахарного диабета) требуют сокращения длительности лечения, а зачастую его отмены.
Наличие большого количества побочных эффектов, высокая медикаментозная нагрузка и вероятность последующего рецидивирования симптомов заставляют вести поиск эффективных и безопасных методов лечения, способных на современном уровне решить проблему, воздействуя на все звенья патогенеза. Поэтому в настоящее время наибольшие перспективы связаны с немедикаментозными методами лечения. Целесообразность использования физических факторов состоит в том, что наряду с собственным лечебным воздействием они способны дополнять и потенцировать медикаментозное лечение. Доказана эффективность лазеротерапии [28], метода биологической обратной связи в сочетании с электростимуляцией мышц тазового дна [29] в лечении НДМП. В этом направлении нам представляется перспективным использование транскраниальной магнитотерапии (ТкМТ) особенно бегущим магнитным полем, обладающей ноотропным [30], мнемотропным [31], вазовегетативным [32], адаптогенным [33], а также седативным и антидепрессивным действием [34]. ТкМТ может рассматриваться как частный случай общей магнитотерапии с присущим ей синхронизирующим воздействием по отношению к различным системам организма через регулирующие структуры мозга и в частности гипоталамус [35].
С учетом комплексного воздействия, а также возможного влияния ТкМТ на биоэнергетику детрузора [36] патогенетически обоснованной представляется схема лечения гиперактивного мочевого пузыря путем сочетания ТкМТ с уменьшенной дозой оксибутинина. Рекомендуемая доза в настоящее время составляет 5 мг, 2–3 раза в день. Попытки уменьшения дозы оксибутинина на фоне приема Пикамилона и витаминов группы В дали обнадеживающие результаты при НДМП, но не обеспечили длительного «сухого» периода в случае энуреза [37]. Поэтому поиски в этом направлении продолжают оставаться актуальными, что и предопределило цель нашего исследования.
Целью настоящего исследования была оптимизация лечения НДМП и энуреза для повышения его эффективности путем транскраниальной магнитотерапии бегущим магнитным полем и уменьшения лекарственной нагрузки на ребенка.
Материалы и методы исследования
Под наблюдением находилось 58 детей в возрасте от 6 до 14 лет (20 мальчиков и 38 девочек) с жалобами на учащенное мочеиспускание в дневное время и энурез. Средний возраст составлял 9,2 года. Всем больным проводилось уронефрологическое и неврологическое обследование, ультразвуковое исследование почек и мочевого пузыря. В ряде случаев проводилось психологическое консультирование. Урологическое обследование включало урофлоуметрию (УФ) и ретроградную цистометрию в горизонтальном и вертикальном положении на диагностической установке СУРД-01 «Рельеф-М». Оценку синдрома императивного мочеиспускания у детей проводили по квалиметрическим таблицам Е. Л. Вишневского, отражающим в баллах степень позыва на мочеиспускание, императивного недержания мочи, энуреза, поллакиурии, ноктурии, уменьшение среднего эффективного объема мочевого пузыря, наличие и выраженность лейкоцитурии. Бальная оценка (в диапазоне 0–45 баллов) предусматривает 3 степени тяжести синдрома императивного мочеиспускания — легкую (1–10 баллов), среднюю (11–20 баллов) и тяжелую (более 21 балла). Регистрировали ритм мочеиспускания.
С учетом значимости вегетативной регуляции в патогенезе НДМП исследовалось состояние вегетативной нервной системы (ВНС) по данным кардиоинтервалографии (КИГ). Использовался цифровой электрокардиограф VDC-201. Регистрировали 300 последовательных кардиоциклов в положении лежа и 100 кардиоциклов при ортостатической пробе. Исходный вегетативный тонус (ИВТ) оценивался по индексу напряжения (ИН) в горизонтальном положении, активность подкорковых нервных центров (АПНЦ) — по данным спектрального анализа. Фиксировалась общая мощность спектра (ОМС), доля в спектре высокочастотных (ВЧ), низкочастотных (НЧ) и очень низкочастотных (ОНЧ) колебаний как маркера уровня адаптационных резервов. Снижение ОМС и ОНЧ расценивается как неблагоприятное изменение общих адаптационных возможностей организма [38].
Все исследования проводили до лечения и спустя месяц по окончании курса лечения (с учетом отсроченного действия магнитотерапии). Контрольное обследование проводили через 6–8 мес.
В исследование не включались больные с инфравезикальной обструкцией, неврологическими и иммунными заболеваниями, а также с воспалительными заболеваниями нижних мочевых путей.
По данным раннего анамнеза асфиксия в родах выявлена у 8 (13,8%), родовая травма — у 13 (22,4%), недоношенность — у 10 (17,2%). С диагнозом «перинатальное поражение ЦНС» у невропатолога в течение первого года жизни наблюдалось 29 (50%) детей. По данным неврологического обследования у 14 (24,1%) выявлен синдром гиперактивности с дефицитом внимания, у 18 (31%) — различные формы невроза.
У большинства детей (55,1%) дисфункция мочевого пузыря и энурез отмечались с раннего возраста, у остальных — давностью от полугода и больше. У 9 (15,5%) детей диагностирован пузырно-мочеточниковый рефлюкс II–III степени, различные аномалии строения почек выявлены у 11 (18,9%), обменные нарушения (оксалурия, уратурия) — у 9 (15,5%). В результате уродинамического обследования гиперрефлекторный мочевой пузырь диагностирован у 51 пациента, гипорефлекторный — у 7 детей.
Все пациенты были рандомизированно разделены на две группы. В 1-ю группу (основную) вошли 29 детей, которым кроме медикаментозной терапии назначалась транскраниальная магнитотерапия по битемпоральной методике. Курс состоял из 10–12 ежедневных процедур с экспозицией 10–15 мин. Медикаментозная терапия включала оксибутинин (Дриптан) в уменьшенной дозировке (2,5 мг 2 раза в день — утром и вечером), ноотропы, витамины группы В.
Во 2-ю группу (контрольную) вошли 29 детей, которым назначалась аналогичная 1-й группе медикаментозная терапия и плацебо-процедуры ТкМТ.
Использованная для физиотерапии аппаратура состояла из базового аппарата для магнитотерапии бегущим магнитным полем «АМУС-01-ИНТРАМАГ» (рег. удостоверение № РОСС RU.ИМ04.В06088) и приставки к нему «Оголовье» (производство ООО «ТРИМА», г. Саратов). Приставка представляет собой два терминала бегущего магнитного поля, охватывающие височно-затылочные области головы. В каждом терминале имеется по 3 соленоида с возможностью их последовательного включения с частотой 1–15 Гц (частота движения поля).
Статистическую обработку данных проводили с использованием критерия χ², критерия Фишера, коэффициента ранговой корреляции Спирмена. Различия считали достоверными при p 0,05). При обследовании спустя 6–8 мес число мочеиспусканий у 19% пациентов 1-й группы возросло до первоначального уровня, что требовало назначения повторного курса ТкМТ и оксибутинина.
Ретроградная цистометрия, проведенная до начала лечения, выявила наличие внутрипузырной гипертензии у 14 детей в 1-й группе и у 12 — во 2-й. Средние значения удельного внутрипузырного давления (УВД) у этих детей составили 38 и 45 см водн. ст. соответственно (при норме до 10 см водн. ст.). По окончании лечения при повторной цистометрии отмечалось снижение УВД в 1-й группе до 16,3, во 2-й — до 28 см водн. ст. (р 0,05).
У большинства детей (58,6%) исходно выявлялась асимпатикотоническая вегетативная реактивность. На фоне ТкМТ указанное значение снизилось до 37,9% (р
* ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва


.gif)