на чем основано бактерицидное действие н2о2
На чем основано бактерицидное действие н2о2
Пероксид водорода H2O2 – бесцветная, прозрачная жидкость, является одним из важных побочных продуктов метаболизма и проявляет окислительно-восстановительный дуализм с преобладанием окислительных свойств. В чистом виде H2O2 термодинамически нестабилен, чем обусловлено его экзотермическое разложение с образованием воды и кислорода: 2H2O2 → 2H2O + O2↑; DH0 = –188,55 кДж. Разложение H2O2 ускоряется на свету, а также в присутствии ионов d-элементов с незавершенным d-подуровнем. Более устойчивы водные растворы пероксида водорода, способные сохраняться длительное время в прохладном темном месте.
В митохондриях атомы водорода, отщепленные от субстрата дегидрогеназами, передают свои электроны через цепь переносчиков кислороду, который восстанавливается до воды: 4H++ O2 + 4e- → 2H2O. При этом физиологически важно, чтобы присоединив 4 электрона, молекула O2 восстанавливалась до двух молекул воды, поскольку при неполном восстановлении O2, например, при присоединении 2-х электронов образуется H2O2: 2H+ + O2 + 2e- → H2O2, а при присоединении 1 электрона – гипероксидный (надпероксидный) радикал: O2? + e-→ O2-. Известно, что пероксид водорода и гипероксидный радикал O2- токсичны для клеток, т.к. взаимодействуя с липидами клеточных мембран, повреждают их. Аэробные клетки при помощи фермента каталазы и медьсодержащего фермента супероксиддисмутазы (СОД) могут защитить себя от указанного вредного воздействия, превращая H2O2 и O2- в кислород, который участвует в последующих процессах биологического окисления.
2O2- + 2H+ 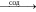
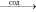
2H2O2 
В качестве фармакопейного препарата применяют 3 %-ный водный раствор пероксида водорода. В медицине препараты пероксида водорода используются наружно как бактерицидное и дезодорирующее средство для обработки ран, полосканий полости рта и горла.
Таким образом, пероксид водорода имеет важную медико-биологическую роль.
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.
На чем основано бактерицидное действие н2о2
Хлорирование воды в России было впервые применено в 1910 г. как принудительная мера, во время эпидемии холеры (в Кронштадте) и брюшного тифа (Нижегородский ярмарочный водопровод). Период с 1910 г. по 1913 г. является началом развития хлорирования питьевых вод в России. Первоначально хлорирование воды производилось раствором хлорной извести. Пер¬вые опыты по применению газообразного хлора были проведе¬ны в 1917 г. на ленинградской водопроводной станции [1, 5].
При выборе дезинфицирующего хлорсодержащего вещества учитывают содержание в нём «активного хлора». Активным хлором – называется количество хлора способное вступить в реакцию взаимодействия с составными частями клеток микроорганизмов и другими примесями воды [4, 7, 8, 14].
Понятие «активный» хлор» определяет не истинное содержание хлора в соединении, а окислительную способность соединения в кислой среде по йодистому калию. Хлорсодержащие дезинфектанты считаются пригодными к употреблению при содержании в них «активного хлора» не менее 15 %.[2, 10, 12]
В растворах хлорсодержащих соединений процессы обеззараживания обусловлены присутствием хлорноватистой кислоты, которая при взаимодействии с восстановителями разлагается с образованием атомарного кислорода (обладающего обеззараживающим действием) и хлорид-ионов по схеме:
В качестве восстановителей могут выступать ионы, содержащиеся в обрабатываемых растворах, такие как: Mn2+, Fe2+, Cl? и др. [8-11, 13]
Для обеззараживания воды хлорированием используются вещества, содержащие «активный хлор»: молекулярный хлор, гипохлориты, хлорная известь, двуокись хлора, хлорамин [3, 8-11].
Молекулярный хлор (Cl2). Хлор представляет собой газ желто-зеленого цвета. Хлор получают путем электролиза растворов хлорида натрия. При прохождении электрического тока через раствор хлорида натрия на аноде выделяется молекулярный хлор, а на катоде происходит разряд ионов водорода. Устанавливая между анодом и катодом диафрагму, обеспечивают разделение продуктов электролиза.
При пропускании газообразного хлора через водный раствор образуется «хлорная вода», обладающая сильными окислительными свойствами. Взаимодействие хлора с водой (гидролиз хлора) протекает по уравнению:
Образующаяся в процессе гидролиза хлора хлорноватистая кислота существует только в растворе. В нейтральной или щелочной среде происходит фотохимическое раз-ложение хлорноватистой кислоты с выделением атомарного кислорода. В кислой среде происходит реакция с соляной кислотой, в результате которой выделяется свободный хлор:
При нагревании хлорноватистая кислота распадается с образованием хлорноватой кислоты:
Хлорноватистая кислота является сильным окислителем, она обесцвечивает такие индикаторы как лакмус и индиго 15.
Гипохлориты. Соли хлорноватистой кислоты – гипохлориты, получаются при реакции между молекулярным хлором и холодным раствором щелочи:
Осуществляется эта реакция либо при пропускании газообразного хлора в раствор щелочи, либо при электролизе растворов хлоридов щелочных металлов в условиях, обеспечивающих перемешивание продуктов электролиза (бездиафрагменный электролиз).
Растворы солей хлорноватистой кислоты гидролизуются с образованием хлорноватистой кислот, разлагающейся с образованием атомарного кислорода:
Разложение их с выделением атомарного кислорода идет лучше при освещении, особенно в области рН = 7. Более энергичное действие гипохлоритов, приготовленных электролитическим путем, по сравнению с соответствующими солями, полученными пропусканием хлора в растворы гидроксидов, объясняется более низким рН раствора и образованием побочных продуктов обладающих сильными окислительными свойствами (СIO2, НСIO, CIO٠, О٠; Н2О2, О3, О2,Сl2, CI٠), которые не могут существовать вне воды в иной агрегатной форме 15. При этом в растворе гарантируется отсутствие диоксинов и каких-либо ксенобиотиков, создающих риск загрязнений внешней среды.
Хлорная известь. Хлорная известь имеет следующий состав: СаО·ЗСl·СаОСl·6Н20. Содержание «активного хлора» в этом препарате (молекулярный вес приведенного выше соединения 361,98; атомный вес Cl = 35,457) составляет около 30%. Практическое же содержание «активного хлора» в технической хлорной извести значительно ниже вследствие того, что часть хлора улетучивается, т.к. хлорная известь разлагается при увлажнении. Поэтому высококачественная хлорная известь максимально содержит 25 – 27 % «активного хлора» [10].
Хлорная известь образуется при взаимодействии хлора с гашеной известью:
= СаОСl2 + СаСl2 + 2Н20
Однако хлорную известь нельзя рассматривать как смесь кальциевых солей соляной и хлорноватистой кислот. При обработке ее спиртом хлористый кальций не извлекается, несмотря на то, что он хорошо растворим в спирту. При действии на хлорную известь углекислотой хлор вытесняется почти полностью, чего нельзя ожидать при наличии хлористого кальция. Окисляющие свойства хлорной извести целиком зависят от имеющегося, и ней аниона хлорноватистой кислоты, содержащего связанный с кислородом «активный хлор».
Хлорная известь в растворе, так как и молекулярный хлор гидролизуется с образованием хлорноватистой кислоты, однако, процесс протекает значительно медленнее, чем гидролиз хлора, благодаря известной стойкости гипохлорита кальция в растворе. При этом техническая хлорная известь содержит много неактивных примесей, снижающих ее ценность как обеззараживающего реагента. Поэтому хлорная известь является менее эффективным окислителем, нежели молекулярный хлор.
Хлорная известь гигроскопична вследствие содержания СаСl2 и малостойкая из-за реакции гидролиза и распада под влиянием света и углекислоты. Разложение хлорной извести может идти с выделением свободного хлора, но в нейтральной или щелочной среде, более характерной для природной воды, реакция протекает в основном с выделением хлорноватистой кислоты. Реакция разложения хлорной извести водой в этом случае отвечает уравнению:
Таким образом, в результате гидролиза хлорной извести непосредственно образуется свободная хлорноватистая кислота, которая затем разлагается с образованием атомарного кислорода и хлоридиона.
Следует отметить, что гидролиз хлорной извести протекает медленнее, чем гидролиз хлора в хлорной воде, благодаря известной стойкости гипохлорита кальция, поэтому образование НСlО в случае применения хлорной извести идет медленнее, чем в водном растворе хлора.
Большое разнообразие химических способов получения хлорной извести сводится к трем основным методам [1, 6].
1. Хлорирование известкового молока:
2Са(ОН)2 + 2Сl2 = = Са(СlО)2 + CaCl2 + 2Н20
2. Хлорирование известкового молока и щелочи:
Са (ОН)2 + 2NaOH + 2Сl2 = 2NaCI + +Са(СlО)2 + 2Н20
3. Хлорирование известкового молока в присутствии солей щелочных металлов (большей частью NaCl).
Двуокись хлора (СlО2). Двуокись хлора, по окислительной активности значительно сильнее молекулярного хлора. Данный реагент эффективен при достаточно широком диапазоне рН раствора.
Двуокись хлора получают действием соляной кислоты на хлорит натрия:
5NaClO2 + 4HCl = = 5NaCl + 4ClO2 + 2H2O
Широкое использование двуокиси хлора в качестве окислителя сдерживается из-за ряда существенных недостатков: он сильно токсичен, взрывоопасен, не может ни сжижаться, ни храниться, ни перевозиться.
Сущность обеззараживающего действия «активного хлора» заключается в окислении веществ, входящих в состав протоплазмы клеток бактерий, что приводит к их гибели. Наиболее чувствительными к «активному хлору» являются бациллы брюшного тифа, дизентерии и холерные вибрионы.
Эффективность действия «активного хлора» на бактерии или бактерицидный эффект хлорирования в значительной степени зависит от начальной дозы хлора и продолжительности сохранения его в воде. Обычно на разрушение бактериальных клеток расходуется лишь незначительная часть вводимого в воду «активного хлора». Большая часть его, величина которой определяется хлороемкостью воды, идет на реакции с разнообразными органическими и минеральными примесями, содержащимися в воде. Эти реакции протекают с различной скоростью и в зависимости от концентрации «активного хлора», рН, температуры воды и других факторов могут останавливаться на той или иной стадии. Поэтому величина хлороемкости воды зависит от начальной дозы «активного хлора», времени контакта и других факторов. При определении дозы «активного хлора» для обеззараживания воды необходимо исходить из хлороемкости обрабатываемой воды и некоторого избыток «активного хлора», обеспечивающего бактерицидный эффект.
Обеззараживающее действие «активного хлора» заключается в окислительно-восстановительных процессах происходящих при взаимодействии хлора и его соединений с органическими веществами микробной клетки.
Эффект обеззараживания воды зависит от сочетания следующих факторов [3, 4, 10, 11]:
1. Биологические особенности микроорганизмов. Например, микроорганизмы характеризуются разной устойчивостью (резистентностью) по отношению к окислителям.
2. Бактерицидное действие реагентов. Данный фактор определяется окислительным потенциалом и способностью взаимодействовать с составными частями клеток микроорганизмов.
3. Состояние водной среды. Обеззараживающее действие зависит от таких свойств обрабатываемой воды как: рН, наличие органических и неорганических веществ, способных к окислению взвешенных и коллоидных примесей. Энергично взаимодействуют с хлором азотсодержащие органические вещества, а присутствие в воде взвешенных частиц ухудшает процесс обеззараживания, т.к. хлор адсорбируется частицами взвеси. Микроорганизмы, которые находятся внутри таких частиц не уничтожаются.
4. Условия, при которых происходит обеззараживание.
Исходя из различных целей хлорирования, существующие методы обработки воды хлором или солями, содержащими «активный хлор», можно объединить в две основные группы: пост-хлорирование и перехлорирование воды.
Постхлорирование представляет собой обеззараживание воды хлором, которое производится после всех других этапов ее обработки и является, таким образом, завершающим этапом очистки воды. Если вода не подвергается другой обработке, кроме обеззараживания, то и в таком случае это будет постхлорирование, т. е. конечное хлорирование.
Постхлорирование может проводиться как небольшими (нормальное хлорирование), так и повышенными дозами (перехлорирование); может оно применяться и совместно с другими обез¬зараживающими веществами (комбинированное хлорирование).
Нормальное хлорирование, применяемое при небольшом загрязнении воды, в технологической схеме очистки и является обычно завершающим этапом. Нередко оно применяется и как самостоятельный процесс, например, когда вода достаточно чистая и обеззараживание ее производится главным образом с профилактической целью.
Дозы «активного хлора» при нормальном хлорировании устанавливаются так, чтобы вкусовые качества воды не были понижены. Количество остаточного хлора после 30-минутного контакта воды с хлором допускается до 0,5 мг/л. Необходимо обеспечивать хорошее смешение хлора с водой. Контакт воды с хлором до поступления ее к потребителю должен быть не менее 30 минут.
Перехлорирование, т. е. хлорирование повышенными дозами хлора, применяется в тех случаях, когда нормальное хлорирование приводит к ухудшению органолептических свойств воды (например, при наличии в воде фенолов) или недостаточно обеззараживает воду. Перехлорирование устраняет многие неприятные привкусы, запахи, уничтожает бактерии, с успехом может применяться в некоторых случаях очистки воды от ОВ. Применение перехлорирования при очистке сточных и питьевых вод, кроме гибели микробов, приводит к уничтожению ряда органических веществ, служащих для бактерий питательным материалом.
Доза остаточного хлора при перехлорировании обычно устанавливается в пределах 1 – 10 мг/дм3. Известны случаи, когда перехлорирование производилось дозами 100 мг/дм3. Периодическое перехлорирование приобрело большое значение для очистки охлаждающей поди на теплоэлектростанциях. Величина доз «активного хлора», применяемых при таком периодическом хлорировании, должна обеспечивать наличие остаточного хлора в количестве от 1,5 до 5 мг/дм3. Продолжительность периодов между двумя моментами введения хлора колеблется от 10 минут (при длительности хлорирования в З минуты) до нескольких часов (при хлорировании в течение 30 минут). В результате такого хлорирования достигается не только прекращение развития слизеобразующих бактерий, забивающих конденсаторы турбин, но и очищаются уже заросшие стенки трубок конденсатора.
Излишек «активного хлора», превышающий допустимую норму, удаляется из воды дехлорированием. При небольшом избытке остаточного хлора он может быть удален аэрацией. При больших избытках остаточного хлора применяется ряд химических методов. Наибольшее распространение в практике дехлорирования воды получили: связывание хлора тиосульфатом (гипосульфитом), сульфитом натрия, бисульфитом натрия, обработка хлорированной воды активированным углем и сернистым ангидридом.
Хлорирование, так же способствует и освобождению воды от ионов железа и марганца. После обработки «активным хлором» вод, содержащих железо, концентрация последнего может быть значительно снижена вследствие разрушения гуматов и других органических соединений железа и перехода их в неорганические соли трехвалентного железа. В результате гидролиза этих солей выпадает осадок гидроокиси железа либо продуктов неполного гидролиза – основных солей железа различного состава 10.
Удаление марганца из вод, содержащих его в количестве выше 0,3 мг/дм3, основано на осаждении нерастворимой двуокиси марганца. Последняя, образуется в результате гидролиза и окисления растворенным кислородом получающихся при хлорировании солей трехвалентного марганца.
При хлорировании воды большими дозами происходит переход части карбонатной жесткости в некарбонатную в результате образующейся при гидролизе хлора соляной кислоты и взаимодействия ее с бикарбонатами воды:
Са (НСО3)2 + 2НСl = = СаСl2 + 2H2О + 2СО2.
Таким образом, хлорирование, кроме его санитарно-профилактического значения, играет большую роль как один из методов очистки воды от коллоидных примесей, а также как эффективный подсобный способ улучшения процессов коагуляции, отстаивания и фильтрования.
