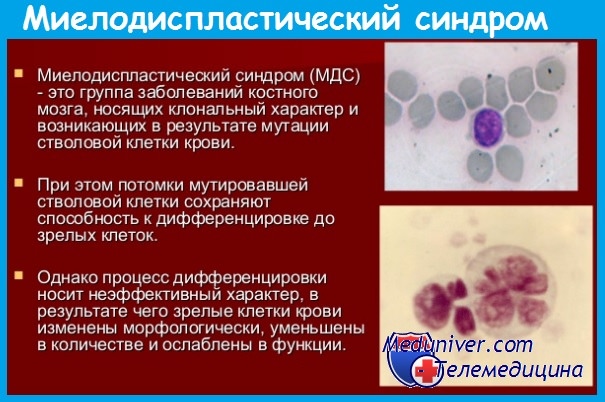
Клональное заболевание что значит
Клональное заболевание что значит
При миелодиспластических синдромах, как и при лейкозах, клоновый характер кроветворения подтверждается обнаружением во всех клетках крови одного типа изофермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) у женщин, гетерозиготных по этому энзиму; в то время как гемопоэтические элементы у них содержат только один тип Г-6Ф-Д, в остальных клетках, в частности в фибробластах, определяются оба типа энзима.
Клоновый характер кроветворения подтверждается и цитогенетическими исследованиями, в том числе методом FISH (флюоресцентной гибридизацией in situ), позволяющим обнаруживать хромосомные аберрации в клетках как в метафазе, так и в интерфазе, методом RFLP (оценкой случайной ингибиции одной из Х-хромосом), а также исследованием онкогенов, включая их точечные мутации и реаранжировки (перестройки и утраты).
Имеются доказательства того, что первично при миелодиспластических синдромах (МДС) поражается стволовая кроветворная клетка. Это положение подтверждается выявлением изофермента А Г-6ФД у женщин, гетерозиготных по этому энзиму, с диагнозом «рефрактерная анемия с кольцевыми сидеробластами», не только в клетках миелоидного, но и лимфоидного ростков кроветворения.
Другим доказательством служит обнаружение одинаковых хромосомных аберраций в клетках миелоидной линии, В-лимфоцитах и стволовых клетках. Например, делеция 5q (5q-) была выявлена методом FISH не только в клетках миелоидной направленности дифференцировки, но и в лимфоидных клетках с про-В-иммунофенотипом (CD34+, CD19+), а также в стволовых клетках (CD34+, CD38).
Молекулярно-биологические методы исследования указывают на наличие мутации гена NRAS в гранулоцитах, моноцитах, Т- и В-лимфоцитах, а также генов, расположенных на хромосоме X лимфоцитов и кодирующих гипоксантинфосфорибозилтрансферазу (HPRT), а также фосфоглицераткиназу (PGK). Исследования полиморфизма гена, расположенного на хромосоме X, кодирующего рецептор андрогена у человека (HUMARA), также подтвердили вовлечение в клоновый процесс лимфоцитов.
Кроме того, о поражении стволовой клетки свидетельствует возможность трансформации заболевания не только в острый миелоидный, но и, крайне редко, — в острый лимфобластный лейкоз, преимущественно В-клеточной направленности дифференцировки. Описано несколько случаев ОЛЛ с характерными иммунологическими (TdT+, CD19+, CD10+) и цитогенетическими маркерами — t(4;11) или Ph’+(p190bcr-abl).
Кроме того, J. F. Leseve и соавт. описали два случая рефрактерной анемии с избытком бластов без трансформации в острый лейкоз с наличием хромосомы Ph’ и белка p190bcr-abl. В обзоре, опубликованном Т. J. Hamblin, указывается на 14 наблюдений билинейного и 7 — бифенотипического острого лейкоза, развившихся из миелодиспластического синдрома.
Однако существуют данные, указывающие на возможность первичного поражения при миелодиспластических синдромах (МДС) не стволовой клетки, а раннего миелоидного предшественника. Это предположение подтверждают исследования клеток крови и костного мозга больных миелодиспластическими синдромами (МДС), имеющих хромосомные аберрации, выявленные методами FISH и ПЦР (полимеразная цепная реакция). Например, по данным некоторых авторов, трисомия хромосомы 8 (+8) и моносомия хромосомы 7 (-7) были выявлены в клетках миелоидного ростка кроветворения, но отсутствовали в лимфоцитах.
Высказывается мнение, что описанные нарушения кариотипа, возможно, появляются на более позднем этапе болезни в результате дополнительных мутаций в миелоидном субклоне. Тем не менее современные методы исследования позволяют более убедительно говорить о происхождения патологического клона из стволовой клетки, что постулируется классификацией ВОЗ в отношении всех вариантов миелодиспластических синдромов (МДС).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клональное заболевание что значит
Хронический миелоидный лейкоз (ХМЛ) — клональное новообразование, развивающееся из стволовых кроветворных клеток. Это первая опухоль человека, при которой был обнаружен характерный хромосомный маркер. Открытие сделано в 1960 г. американскими исследователями Р. С. Nowell и D. A. Hungerford в Филадельфии, поэтому маркер был назван филадельфийской (Ph)-хромосомой. Именно с этой находки началась клиническая цитогенетика в онкологии.
Филадельфийская хромосома — укороченная хромосома из группы так называемых малых акроцентриков. В каждой нормальной женской клетке эта группа включает две пары хромосом — 21-ю и 22-ю, а в мужских клетках таких хромосом не 4, а 5, поскольку в эту группу, кроме 21-й и 22-й хромосомных пар, включена также Y-хромосома.
Ph-хромосома выявляется при обычной окраске (без G-бендинга) практически у всех больных хроническим миелоидным лейкозом (95—98 %). На дифференциально окрашенных (бендинг) хромосомах видно, что укорочена одна из хромосом 22-й пары.
Примерно у 90 % больных Ph-хромосома видна во всех анализируемых метафазах, у остальных пациентов обнаруживают как клетки с Ph-хромосомой, так и нормальные клетки, причем в отдельных случаях Ph-хромосома регистрируется в меньшинстве клеток костного мозга. Транслокация (9;22) наблюдается в миелоидных клетках, эритробластах, В-и Т-лимфоцитах, мегакариоцитах. Этот факт свидетельствует о том, что заболевание начинается с некоммитированной клетки-предшественницы гемопоэза.
В 1973 г. знаменитым американским исследователем J. D. Rowley было установлено, что Ph-хромосома образуется не вследствие делеции хромосомы 22, как предполагали ранее, а в результате сбалансированной транслокации между хромосомами 9 и 22 (участками 9q34 и 22qll), при этом формируются две маркерные хромосомы, обозначаемые как 9q+ и 22q- (Ph). Изредка наблюдаются перестройки, скрывающие укороченную хромосому 22, — так называемая замаскированная Ph-хромосома, т. е. маленький фрагментик, оторвавшийся от любой другой хромосомы, может «прилепиться» к обломанной хромосоме 22 и «замаскировать» поломку. Эта «маскировка» довольно легко раскрывается при дифференциальной окраске.
Примерно в 10 % случаев наблюдаются атипичные транслокации, при которых стандартное цитогенетическое исследование позволяет увидеть перенос фрагмента хромосомы 22 не на 9-ю, а на какую-либо другую хромосому. Кроме того, иногда при хроническом миелоидном лейкозе обнаруживают сложные Ph-транслокации с участием не двух (9-й и 22-й), а трех или более хромосом.
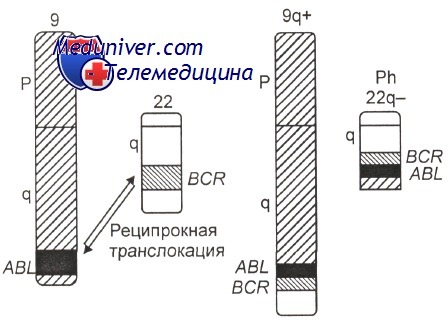
Установлено, что практически при всех Ph-транслокациях участвуют хромосомы 9 и 22, однако это не всегда видно при стандартном цитогенетическом исследовании, но обнаруживается при использовании FISH и ПЦР.
Большинство исследователей считают, что тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Использование молекулярно-генетических методов позволило установить, что в хромосоме 9 разрыв проходит через ген (протоонкоген) ABL, идентифицированный ранее в одном из вирусов лейкоза у мышей. В хромосоме 22 наблюдается разрыв гена ВСЯ. В результате слияния фрагментов названных генов (ABL и BCR) образуется химерный ген BCR-ABL, расположенный, как правило, на делетированной хромосоме 22 (Ph-хромосома) Схематическое изображение молекулярно-генетических событий, приводящих к развитию хронического миелоидного лейкоза, показано на рисунке.
Примерно в 70 % случаев, кроме транскрипта BCR-ABL, обнаруживают продукт (транскрипт) другого химерного гена, образующегося в результате t(9;22) —ABL-BCR на der (9), однако его роль в развитии хронического миелолейкоза неясна.
Установлен еще один важный факт: примерно у 20—25 % больных хроническим миелолейкозом имеется делеция в маркерной хромосоме 9q+. Эта аномалия не видна при «простом хромосомном анализе». Ее можно обнаружить только при использовании FISH со специально разработанными зондами. Размер делеции варьирует от пациента к пациенту: делетированный участок может включать последовательности гена BCR, перенесенные на хромосому 9 с хромосомы 22, последовательности самой хромосомы 9 или последовательности обеих этих хромосом.
Установлено, что делеция возникает одновременно с формированием специфической t(9;22), ее частота одинакова в группах больных, обследованных на разных стадиях хронического миелолейкоза. Независимо от метода лечения (даже при использовании программ, включающих гливек) прогноз у больных с интерстициальной делецией в маркере 9q+ существенно хуже, чем у больных без этой аномалии. Длительность хронической фазы и соответственно выживаемость у больных с делецией значительно меньше. Так, при обследовании большой группы больных (241) обнаружено, что медиана выживаемости была 38 мес для больных с делецией (39 человек) и 88 мес для группы больных без делеции (202 человека). Различия статистически значимы.
Применение этого информативного прогностического метода пока, к сожалению, не вошло в широкую клиническую практику, поскольку он весьма сложен и требует дорогостоящих реактивов и оборудования.
Роль делеции маркера 9q+ в прогрессии хронического миелолейкоза пока до конца не выяснена. Выпадение кодирующих последовательностей генов ABL и/или BCR в результате делеции приводит к тому, что экспрессируется только один химерный ген BCR-ABL, но нет экспрессии гена ABL-BCR. Возможно, и это событие играет роль в профессии лейкоза. Обсуждается также возможность инактивации неизвестных пока генов-супрессоров, локализованных в хромосомном районе, который делетируется.
Химерный ген BCR-ABL кодирует белок с мол. м. 210 000, обладающий более высокой протеинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с высокой протеинкиназной активностью. В эксперименте проводили вырезание гена gag/abl, после этого вирус терял способность вызывать лейкоз у мышей.
Изучение разрывов в генах ABL и BCR при хроническом миелолейкозе показало, что у разных больных их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика —до 200 kb, а в гене BCR разрывы локализуются обычно на маленьком участке — 8,5 kb, т. е. имеется кластер разрывов, отсюда название самого гена BCR (breakpoint cluster region).
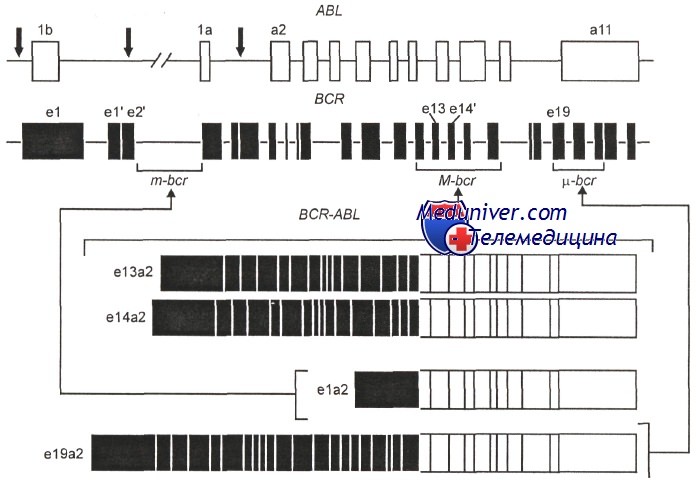
Первый ряд — разрывы в гене ABL; второй ряд — три кластера разрывов в гене BCR: m-BCR, М-BCR и u-BCR. Ниже три типа транскриптов химерных генов BCR-ABL, различающихся по длине вошедших участков гена BCR
В подавляющем большинстве случаев t(9;22) разрывы гена BCR обнаруживают на участке, обозначаемом M-BCR, при этом химерный ген включает длинный фрагмент гена BCR и в результате возникает характерный для хронического миелолейкоза белок P210Bcr/Abl. Кроме того, при t(9;22) разрывы в гене BCR могут локализоваться на одном из двух других типичных участков, называемых m-bcr и u-bcr. Разрывы в области m-bcr приводят к образованию химерного белка Р190Bcr/Abl, т. е. белка меньшей величины, чем Р210Bcr/Abl. При локализации разрывов в u-bcr образуется более крупный белок Р230Bcr/Abl.
Эти молекулярные различия не строго коррелируют с клиническими особенностями лейкозов. Так, Р190Bcr/Abl характерен для двух абсолютно разных лейкозов: с одной стороны, это Ph-позитивный острый лимфобластный лейкоз, а с другой — хронический гранулоцитарный лейкоз с выраженным моноцитозом и миелодиспластическими чертами. При обнаружении Р230Bcr/Abl обычно наблюдается картина так называемого нейтрофильного варианта хронического миелолейкоза, т. е. хронический миелолейкоз, при котором формула крови представлена зрелыми нейтрофилами и единичными метамиелоцитами. Кроме того, название «нейтрофильный гранулоцитарный лейкоз» используется на протяжении многих лет для обозначения Ph(BCR-ABL)-негативного хронического миелолейкоза — относительно доброкачественного варианта, наблюдаемого у пожилых людей, но редко встречающегося и у подростков.
Как отмечалось, коррелятивная связь между типом химерного белка (P190Bcr/Abl, Р210Bcr/Abl или Р230Bcr/Abl) и клинико-гематологичесой картиной лейкоза не является строгой. Любой из этих белков может быть обнаружен при классической картине хронического миелолейкоза. Есть также сообщения о нередком сочетании двух типов белков (Р210Bcr/Abl| и Р190Bcr/Abl) при типичном хроническом миелолейкозе и при остром лимфобластном лейкозе.
Реальная частота «атипичных» белков BCR-ABL при типичном хроническом миелолейкзе неизвестна, поскольку исследования на большом материале не проводились.
Решающая роль гена BCR-ABL и его продукта — белка Р210 в развитии хронического миелолейкоза продемонстрирована на разных модельных системах in vivo и in vitro. Так, трансдукция bcr/abl в стволовые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным животным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелолейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой тирозинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в злокачественной трансформации клеток.
При введении клеток, экспрессирующих р210Bcr/Abl, группе летально облученных мышей в условиях одного и того же эксперимента у одних животных развивался лейкоз, очень похожий на хронический миелолейкоз человека, а у других — самые разнообразные новообразования из гемопоэтических клеток: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные саркомы и эритроидные опухоли. Причина различий не выяснена. Эти опыты, как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины хронического миелолейкоза, пока еще не установлена.
В самом обобщенном виде «молекулярный патогенез» хронический миелолейкоз описывают так: химерный ген BCR-ABL кодирует белок с постоянно активированной тирозинкиназной активностью; это в свою очередь приводит к активации множества сигнальных путей и выраженным изменениям клеточного цикла, адгезии и апоптоза. Считают, что этих событий достаточно для инициации злокачественной трансформации клетки и поддержания опухолевого фенотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хронические миелопролиферативные заболевания
Хронические миелопролиферативные заболевания — это группа патологий, при которых происходит неконтролируемый рост кровяных клеток. Нарушение вызвано генетическими мутациями.
Акции
Запись на консультацию со скидкой 10%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
ХМПЗ (хроническое миелопролиферативное заболевание) — это группа патологических состояний организма, течение которых характеризуется неконтролируемым ростом клеток крови. Данное нарушение возникает в результате генетических мутаций. К ХМПЗ относят эозинофильный и нейтрофильный рак крови, миелолейкоз, эритремию, сублейкемический миелоз и хроническое миелопролиферативное заболевание эссенциальная тромбоцитемия.
Распространенность ХМПЗ невысокая. Обычно заболевает не более 1 человека на 100 000 населения. Точные причины развития данной патологии неизвестны. В ряде случаев имеется связь с наличием в анамнезе пациента других онкологических заболеваний, при лечении которых использовалась лучевая терапия и цитостатики.
Чаще всего заболевание диагностируют у людей среднего (от 40 лет) и пожилого возраста. У всех видов ХМПЗ есть общие характеристики, а именно:
Эффективность терапии хронической миелопролиферативной болезни зависит от вида патологии и ее стадии.
Классификация хронических миелопролиферативных заболеваний
Выделяют следующие виды ХМПЗ:
Все ХМПЗ характеризуется отсутствием диспластических изменений в костном мозге и кровяных клетках на начальных этапах заболевания.
Помимо вышеперечисленных видов в современной онкологии отдельно выделяют группу с миелоидной дисплазией, которая занимает промежуточное положение между ХМПЗ и миелодиспластическим синдромом.
Классификация ХМПЗ с миелодисплазией:
Причины и факторы риска развития ХМПЗ
МПЗ относятся к группе клональных заболеваний. Патологические изменения в организме при таких болезнях начинаются с одного либо нескольких сбоев в ДНК всего лишь одной стволовой клетки костного мозга.
По мере накопления патологически измененных клеток крови состояние пациента начинает ухудшаться. В большинстве случаев причина, по которой произошел запуск патологического процесса в костном мозге, остается неизвестной.
К факторам, которые могут спровоцировать развитие болезни, относят ошибки при делении клеток, факторы внешней среды, вредные привычки и так далее. ХМПЗ не относятся к наследственным заболеваниям, хотя зарегистрированы случаи возникновения истинной полицитемии, эссенциальной тромбоцитемии у членов одной семьи. Причиной развития ХМПЗ являются приобретенные генетические мутации, которые возникают во время жизни пациента.
Одним из основных факторов риска при миелопролиферативных патологиях является возраст больного. После 70 лет увеличивается клональное кроветворение, что повышает риск развития ХМПЗ в 11-13 раз.
Симптомы
Клинические проявления хронических миелопролиферативных заболеваний крови не специфичны, поэтому необходима тщательная дифференциальная диагностика с другими патологиями. На начальном этапе, когда опухолевая масса небольшая, у пациентов наблюдается умеренный лейкоцитоз.
Клинически заболевание может проявляться следующими симптомами:
При истинной полицитемии у пациентов повышается уровень гемоглобина в крови, что проявляется сильным покраснением кожи лица, которое многие ошибочно принимают за проявление алкоголизма. Кроме этого, одним из характерных симптомов данного заболевания ХМПЗ является кожный зуд, возникающий при контакте с водой. Одним из самых опасных состояний при ХМПЗ является тромбоцитоз (склонность к образованию тромбов). Это резко повышает риск закупорки крупных сосудов, что приводит к развитию инсультов, инфарктов и угрожает не только здоровью, но и жизни пациента.
Течение ХМПЗ хроническое. При отсутствии лечения болезнь со временем прогрессирует с возможным развитием острого миелолейкоза, миелодиспластического синдрома. Кроме этого наблюдается прогрессирующее увеличение размеров селезенки.
Диагностика хронической миелопролиферативной болезни
Основными методами диагностики ХМПЗ являются лабораторные методы исследования и биопсия.
Лабораторные методики
Биопсия
Взятие образцов костного мозга и последующее их исследование под микроскопом проводятся в большинстве случаев. При помощи данных методик проводят дифференциальную диагностику ХМПЗ от миелодиспластического синдрома. При проведении гистологии образцов костного мозга обнаруживают повышенное содержание паренхиматозных клеток. Миелофиброз диагностируют путем окрашивания образцов ткани ретикулином.
Пациенты с установленными диагнозами остаются под наблюдением гематолога пожизненно.
Методы лечения ХМПЗ
Для лечения хронических миелопролиферативных заболеваний часто применяют цитостатики. Препараты из этой группы обладают способностью воздействовать на конкретный гематологический росток, что позволяет уменьшить скорость патологического деления клеток крови.
Кроме этого, для лечения ХМПЗ могут использоваться препараты, которые снижают негативные последствия полицитемии (глюкокортикостероиды, средства для разжижения крови, противотромботические соединения и ряд других). С их помощью можно убрать повышенную вязкость крови, которая является следствием усиленного размножения кровяных клеток, снять общее воспаление, предотвратить тромбообразование.
Крайне важно при терапии ХМПЗ остановить аномальное увеличение селезенки. Для этого используют лучевую терапию. Если лечение не дает эффекта, то проводят операцию по удалению селезенки.
Кроме этого, для каждого вида ХМПЗ существуют свои специфические методы терапии. Например, при эозинофильном лейкозе показан прием антигистаминных средств, которые снижают проявления аллергии. При истинной полицитемии одним из вариантов терапии является кровопускание. При тромбоцитемии больным назначают антикоагулянты.
Если ХМПЗ диагностируют у молодых людей (что бывает редко), то возможно проведение радикального лечения, которое включает в себя пересадку стволовых клеток и приводит к полному выздоровлению. К сожалению, большинство пожилых людей в силу возраста не могут перенести эту операцию.
Прогноз при ХМПЗ крови
При хроническом миелопролиферативном лейкозе в течение 3-5 лет идет хроническое развитие заболевания. Затем наступает акселерированная фаза, которая переходит в бластный криз. После этого прогноз выживаемости — от нескольких месяцев до года.
Выживаемость при хронических миелопролиферативных болезнях при грамотной своевременно начатой терапии составляет около 20 лет. Если лечение не проводится, то пациент умирает в течение полутора лет. При этом с каждым месяцем повышается риск развития тромбоэмболий, что еще более ухудшает прогноз. Запущенная стадия заболеваний проявляется снижением уровня эритроцитов, что сопровождается усилением спленомегалии и изменениями в костном мозге.
Профилактика ХМПЗ
Эффективной специфической профилактики не существует. Для снижения вероятности развития ХМПЗ необходимо соблюдать следующие рекомендации:
Информация о клональном гемопоэзе
Эта информация поможет вам узнать, что такое клональный гемопоэз (clonal hematopoiesis, CH). Также здесь описана клиника Memorial Sloan Kettering (MSK), специализирующаяся на клональном гемопоэзе.
Что такое клональный гемопоэз?
При клональном гемопоэзе стволовые клетки (из которых образуются клетки крови) начинают производить клетки крови с одной и той же генетической мутацией (изменением генов). Клетки крови с генетической мутацией отличаются от остальных клеток крови.
Клетки крови производятся в костном мозге (мягкой ткани внутри костей).
Как узнать, есть ли у меня клональный гемопоэз?
Клональный гемопоэз развивается без внешних признаков. У большинства людей с клональным гемопоэзом нет никаких симптомов. Многие узнают о том, что у них клональный гемопоэз, совершенно случайно, когда сдают кровь на генетический анализ.
Каковы причины клонального гемопоэза?
Клональный гемопоэз возникает без определенных причин. Некоторые обстоятельства могут увеличить риск развития клонального гемопоэза. Например, это следующие обстоятельства:
Также с клональным гемопоэзом может быть связана радиотерапия и некоторые виды химиотерапии, но это еще не до конца исследовано.
Клональный гемопоэз может возникнуть даже если вы не подвержены ни одному из этих факторов риска.
Каковы риски для здоровья при клональном гемопоэзе?
Клональный гемопоэз может привести к раку крови, но в большинстве случаев этого не происходит. Рак крови обнаруживают менее чем у 1% (т.е. не более 1 из 100) людей с клональным гемопоэзом.
При клональном гемопоэзе повышается риск сердечно-сосудистых заболеваний, например инфаркта. Люди с клональным гемопоэзом в два раза чаще страдают заболеваниями сердца, чем те, у кого нет этого заболевания.
Нужно ли мне делать анализ на клональный гемопоэз?
Большинству людей не нужно делать анализ на клональный гемопоэз. Это связано со следующими причинами:
Врач сообщит вам, если потребуется сделать анализ на клональный гемопоэз.
Что делать, если у меня клональный гемопоэз?
Лечения клонального гемопоэза не существует, но если у вас этот диагноз, обязательно сообщите о нем врачу. Врач будет следить за рисками, связанными с клональным гемопоэзом. Также вы можете записаться на прием в клинику MSK по клональному гемопоэзу.
Если у вас высокий риск рака крови, например, мало кровяных телец или есть определенные генетические мутации, то нужно будет сдать анализы на рак и другие заболевания крови. Это необходимо меньше 5% (т.е. 5 из 100) людей с клональным гемопоэзом. Если вам это нужно, то врач расскажет подробнее.
Такие исследования могут включать следующее:
Если у вас клональный гемопоэз, важно соблюдать рекомендации по снижению риска заболеваний сердца. Проконсультируйтесь со своим основным лечащим врачом или кардиологом (врачом по лечению болезней сердца) о том, как это делать. В частности, вы должны:
Некоторым людям могут понадобиться дополнительные исследования для проверки сердца, например исследование грудной клетки методом компьютерной томографии (КТ). Если вам это нужно, то врач расскажет подробнее.
Каковы риски для моих детей, если у меня клональный гемопоэз?
Клональный гемопоэз не передается детям. Они не подвержены более высокому риску развития этого заболевания.
Что такое клиника MSK по клональному гемопоэзу (MSK’s CH clinic)?
Клиника MSK по клональному гемопоэзу — это команда медсестер/медбратьев и специалистов по клональному гемопоэзу, в том числе гематологов (врачей, занимающихся лечением заболеваний крови) и кардиологов. Чтобы узнать больше о клинике MSK по клональному гемопоэзу или записаться на прием, поговорите с членом лечащей команды.
В клинике по клональному гемопоэзу доступны следующие услуги:
Если у вас диагностирован рак крови, врачи из клиники по клональному гемопоэзу помогут специалистам по раку из клиники MSK подобрать план лечения.