Кломид или клостилбегит что лучше
Что лучше: Клостилбегит или Кломид
Клостилбегит
Кломид
Исходя из данных исследований, Клостилбегит лучше, чем Кломид. Поэтому мы советуем выбрать его.
Активные вещества одинаковые. Поэтому выбирайте исходя из цены
Сравнение эффективности Клостилбегита и Кломида
У Клостилбегита эффективность больше Кломида – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Клостилбегита более выраженный, то у Кломида даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Клостилбегита и Кломида тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Клостилбегита и Кломида
Безопасность препарата включает множество факторов.
При этом у Клостилбегита она достаточно схожа с Кломидом. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Клостилбегита, также как и у Кломида мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Клостилбегита нет никаих рисков при применении, также как и у Кломида.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Клостилбегита и Кломида.
Сравнение противопоказаний Клостилбегита и Кломида
Исходя из инструкции. Количество противопоказаний у Клостилбегита достаточно схоже с Кломидом и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Клостилбегита и Кломида может быть нежелательным или недопустимым.
Сравнение привыкания у Клостилбегита и Кломида
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Клостилбегита достаточно схоже со аналогичными значения у Кломида. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Клостилбегита значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Кломида.
Сравнение побочек Клостилбегита и Кломида
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Клостилбегита состояния нежелательных явлений почти такое же, как и у Кломида. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Клостилбегита схоже с Кломидом: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Клостилбегита и Кломида
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Клостилбегита примерно одинаковое с Кломидом. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-13 10:17:06
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
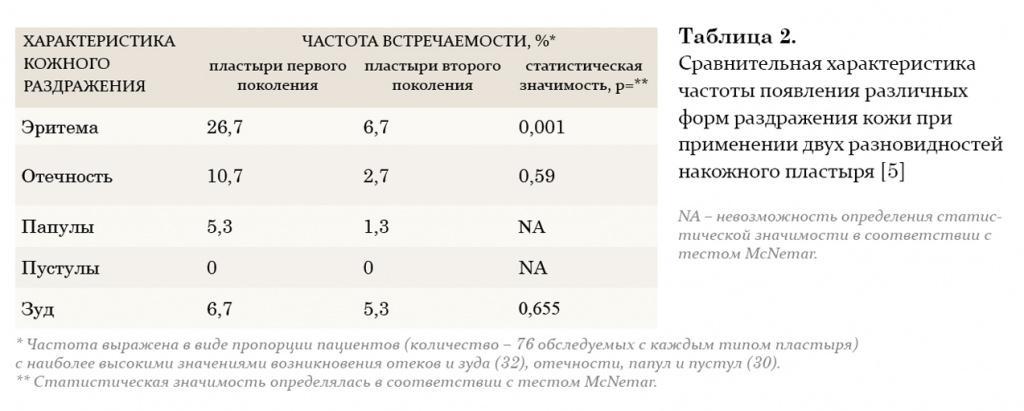
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Клостилбегит – инструкция по применению
Важно! Данная статья размещена исключительно в познавательных целях, информацию нельзя использовать для самодиагностики и самолечения. Для постановки диагноза и правильного назначения лечения следует обращаться к врачу.
Клостилбегит относится к группе антиэстрогенов, стимулирующих созревание и выход яйцеклетки из фолликула (овуляцию). Не воздействует на синтез прогестерона и андрогенов. В высоких дозах ингибирует выработку гонадотропных гормонов.
Состав
| Таблетки | 1 табл. |
| активное вещество: кломифена цитрат | 50 мг |
| вспомогательные вещества: желатин — 2 мг; магния стеарат — 2 мг; стеариновая кислота — 2 мг; тальк — 5 мг; крахмал картофельный — 39 мг; лактозы моногидрат — 100 мг |
Фармакологические свойства
Механизм действия препарата Клостилбегит заключается в его способности взаимодействовать с рецепторами женских половых гормонов гипоталамо-гипофизарной системы и яичников. После приема средство полностью всасывается в пищеварительном тракте. Метаболизм проходит в печеночной ткани. Выводится в основном с желчью, и выделяется с калом. Период полувыведения составляет 5–7 дней.
Показания
Все показания к применению лекарства Клостилбегит делятся на две группы — показания у мужчин и показания у женщин.
Женщинам Клостилбегит назначают в таких случаях:
Мужчинам Клостилбегит рекомендуют при олигоспермии — заболевании, основной симптом которого — низкое количество мужских половых клеток в семенной жидкости. Кроме того, Клостилбегит активно используется для индукции суперовуляции во время экстракорпорального оплодотворения, других вспомогательных репродуктивных технологий.
Противопоказания
Клостилбегит противопоказан к применению если есть такие заболевания и состояния:
При наличии одного или нескольких противопоказаний врач посоветует другой, более безопасный препарат.
Способ применения, дозировка
При терапии бесплодия дозировка, длительность приема рассчитывают в зависимости от чувствительности яичников. Если месячные регулярные терапию начинают на пятый день цикла. Если фолликулярная фаза по результатам лабораторных тестов длится меньше, чем 12 дней, целесообразно назначать прием на третий день. У женщин с аменореей принимать препарат начинают в любой день.
На сегодняшний день применяются две схемы приема Клостилбегита. Согласно первой средство принимают по одной таблетке ежедневно 5 дней. Реакцию на терапию отслеживают при помощи функциональных, лабораторных тестов. Как правило, выход яйцеклетки наблюдается на 12–16-й день цикла. В случае когда терапия не дала результата, переходят ко второй схеме.
Согласно ей, пациентка принимает ежедневно две таблетки лекарственного средства Клостилбегит пять дней подряд. Как и в предыдущем случае, реакция яичников отслеживается с помощью лабораторных и инструментальных тестов. Если лечение не принесло ожидаемого эффекта, прием лекарства по второй схеме повторяют в следующем цикле. При отсутствии овуляции следует сделать перерыв длительностью три месяца и снова повторить терапию начиная с первой схемы. Если после этого овуляция не наступила, дальнейшую стимуляцию Клостилбегитом проводить не целесообразно. Общая доза Клостилбегита, принимаемая за один цикл не должна превышать 750 мг.
Мужчинам рекомендуют по две таблетки в сутки — одну вечером и одну утром. Лечение проходит под контролем спермограммы. Общая длительность курса — до полутора месяцев.
Особенности применения
Прежде чем начинать терапию, нужно детально ознакомиться с инструкцией, проверить функциональные возможности печени (уровень печеночных ферментов в крови), гормональный баланс и уровень гонадотропинов.
Применение Клостилбегита рекомендуется при соблюдении таких условий:
До начала лечения Клостилбегитом, в случае отсутствия овуляции надо исключить и скорректировать другие факторы бесплодия.
Если на фоне приема препарата яичники увеличились, или возникли кистозные изменения, терапию прекращают. Лечение возобновляют только после того, как размер яичников нормализуется, уменьшив дозировку препарата, длительность терапии.
При лечении требуется наблюдение врача-гинеколога и контроль таких параметров:
По завершении курса при наступлении зачатия, с целью поддержки возникшей беременности, назначают препараты прогестерона.
Клостилбегит увеличивает возможность развития многоплодной беременности.
Таблетки содержит 100 мг лактозы, поэтому Клостилбегит противопоказан пациентам с непереносимостью данного вещества, а также при мальабсорбции глюкозы.
Так как средство влияет на зрение, в том числе может вызывать его нарушения, в период лечения нужно соблюдать осторожность при вождении автомобиля и выполнении других работ, связанных с повышенной концентрацией внимания и быстрой психомоторной реакцией.
Побочные эффекты
Во время приема лекарства возможны побочные эффекты со стороны таких органов и систем:
Все побочные эффекты являются дозозависимыми и часто проявляются после применения больших доз или после пролонгированного курса лечения, как было отмечено в исследованиях. При лечении в рекомендованных дозах побочные эффекты отсутствуют.
Дополнительная информация
Клостилбегит : инструкция по применению
Что такое препарат Клостилбегит® и для чего его применяют
Особые указания
Не принимайте препарат в следующих случаях
Меры предосторожности при медицинском применении
Проконсультируйтесь с Вашим лечащим врачом или фармацевтом перед началом применения препарата Клостилбегит® таблетки.
Таблетки Клостилбегит® следует принимать с осторожностью в следующих случаях:
— Если у Вас нарушен менструальный цикл в связи с низкой массой тела.
— Если у Вас рано развилась менопауза.
— Если у Вас ранее были заболевания, сопровождающиеся судорогами.
— Если у Вас миома матки.
— Если у Вас поликистоз яичника.
— Если у Вас увеличены яичники.
— Если Вы или Ваши родственники страдаете гипертриглицеридемией (повышенным содержанием жира в крови).
Врач может назначить тщательное медицинское обследование до назначения Вам препарата Клостилбегит® с целью выявления причины бесплодия. Обязательно выполняйте указания врача.
Дети и подростки в возрасте до 18 лет
Детям и подросткам препарат Клостилбегит® таблетки противопоказан.
Каждая таблетка Клостилбегит® содержит 100 мг лактозы.
Если Ваш врач сообщил Вам, что у Вас имеется непереносимость к некоторым видам сахаров, проконсультируйтесь с Вашим лечащим врачом прежде, чем начать принимать этот препарат.
Другие лекарственные средства и препарат
Сообщите Вашему лечащему врачу или фармацевту о любых лекарственных средствах, которые Вы принимаете, недавно принимали или планируете принимать, включая препараты, отпускаемые без рецепта.
Прием таблеток Клостилбегит® с пищей и напитками
Таблетки следует принимать один раз в день до еды.
Кломид или клостилбегит что лучше
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия
ФГУ Эндокринологический научный центр, Москва
ФГУ Эндокринологический научный центр, Москва
Стимуляция сперматогенеза гонадотропинами и антиэстрогеном при патоспермии и бесплодии мужчин
Журнал: Проблемы эндокринологии. 2016;62(2): 37-41
Кравцова Н. С., Роживанов Р. В., Курбатов Д. Г. Стимуляция сперматогенеза гонадотропинами и антиэстрогеном при патоспермии и бесплодии мужчин. Проблемы эндокринологии. 2016;62(2):37-41.
Kravtsova N S, Rozhivanov R V, Kurbatov D G. Stimulation of a spermatogenesis at men gonadotrophins and an antiestrogen at a pathospermia and infertility. Problemy Endokrinologii. 2016;62(2):37-41.
https://doi.org/10.14341/probl201662237-41
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия
Цель исследования — изучить эффективность подходов к увеличению количества сперматозоидов в эякуляте. Материалы и методы. Использовались хорионический гонадотропин человека (ХГЧ), антиэстрогены (кломифен), рекомбинантный ФСГ (рФСГ) и сочетания указанных препаратов. Результаты. Наименьшая эффективность (10%) отмечалась при монотерапии ХГЧ. Эффективность монотерапии кломифеном составила 20% в отношении зачатия и 63% в отношении олиготератозооспермии. Эффективность сочетания ХГЧ с рФСГ достигала 40% в отношении зачатия и 87% в отношении олиготератозооспермии. Заключение. Наибольшей эффективностью обладает сочетание ХГЧ с рФСГ. Все исследованные виды стимулирующей терапии не приводят к развитию побочных эффектов.
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия
ФГУ Эндокринологический научный центр, Москва
ФГУ Эндокринологический научный центр, Москва
В течение последних 50 лет концентрация сперматозоидов в эякуляте здоровых мужчин, проживающих в технологически развитых странах, постоянно снижалась; мужское бесплодие в большинстве случаев связано со снижением количества и качества сперматозоидов [1]. В связи с этим актуально изучение эффективности методов лечения, направленных на увеличение количества сперматозоидов в эякуляте, в том числе гормональной стимулирующей терапии. Для такой терапии в настоящее время применяют хорионический гонадотропин человека (ХГЧ), антиэстрогены, рекомбинантные препараты фолликулостимулирующего гормона (рФСГ), а также комбинации этих средств [2].
Цель исследования — исследование эффективности и безопасности разных видов стимулирующей терапии у пациентов с патоспермией и бесплодием на фоне нормальной или сниженной секреци гонадотропинов.
Материал и методы
В проспективное когортное исследование были включены 80 бесплодных мужчин с олигоастенотератозооспермией на фоне нормальных или сниженных уровней ЛГ и ФСГ. Все участники добровольно подписали информированное согласие; протокол исследования утвержден локальным этическим комитетом ФГУ ЭНЦ МЗ РФ 22.09.09 (протокол № 19). Критериями исключения являлись травмы или хирургические вмешательства на половых органах в анамнезе, криптозооспермия, азооспермия, любые формы обструктивного бесплодия, гипергонадотропный гипогонадизм, гипотиреоз, гиперпролактинемия, гиперкортицизм, нарушения кариотипа, делеции AZF, опухоли яичек, опухоли гипофиза, варикоцеле, урогенитальные инфекции, воспалительные заболевания половых желез, бактериоспермия, лейкоспермия, носительство антиспермальных антител. Проводилась стратифицированная рандомизация пациентов в группы (табл. 1).

Мы не планировали формирование контрольной группы, так как неэтично было бы отказывать мужчинам в репродуктивной реабилитации. Однако такую группу все же удалось сформировать из 10 пациентов, отказавшихся от предложенных терапевтических рекомендаций.
Пациенты 1-й группы получали кломифена цитрат (клостилбегит, «Эгис», Венгрия) по 50 мг внутрь утром ежедневно. Пациентам 2-й группы внутримышечно вводили ХГЧ (гонадотропин хорионический, «Московский эндокринный завод», РФ) в индивидуально подобранной дозе (от 1000 до 3000 ЕД 1 раз в 3 дня). Эта группа была наиболее малочисленной, поскольку уже предварительная оценка выявила наименьшую эффективность соответствующей терапии и продолжение набора пациентов в данную группу представлялось нецелесообразным. Пациенты 3-й группы получали комбинированную терапию ХГЧ (от 1000 до 3000 ЕД 1 раз в 3 дня) и рФСГ (гонал-Ф, «Мерк Сероно», Швейцария) в дозе 75 ЕД подкожно через день. Дозу ХГЧ подбирали индивидуально, исходя из уровня общего тестостерона в сыворотке крови утром натощак после инъекции препарата (целевым значением являлось 20—33 нмоль/л).
Для оценки объема яичек использовали УЗИ на аппарате Aloka ProSound SSD-α 10 (линейный датчик с частотой 10 МГц). У всех пациентов оценивали уровни ЛГ, ФСГ, общего тестостерона (Т) и ингибина В в трех аликвотах сыворотки. Концентрацию Л.Г. (норма 2,5—11,0 ЕД/л), ФСГ (норма 1,6—9,7 ЕД/л) и Т (норма 12,0—33,3 нмоль/л) определяли на автоматическом анализаторе Vitros ECi («Johnson and Johnson», Великобритания) методом усиленной хемилюминесценции, а уровень ингибина В (норма 25—325 пг/мл) — методом иммуноферментного анализа с использованием тест-системы DSL (США). Кровь для исследования отбирали из локтевой вены в пробирки типа «вакутейнер» в утреннее время натощак.
Эффективность лечения оценивали через 3 мес, понимая под эффективностью возможность зачатия и/или устранение олиготератозооспермии. Мужчины, от которых зачатие на фоне лечения в этот срок не наступило, но устранялась олиготератозооспермия, продолжили получать терапию еще 3 мес с последующей оценкой ее эффективности.
Обработку данных проводили с помощью пакета прикладных программ statistica («StatSoft Inc.», США, версия 8.0). Сравнение количественных признаков осуществляли непараметрическим методом с использованием теста Краскела—Уоллиса для независимых групп, а также теста Вилкоксона для зависимых групп. Сравнение качественных признаков проводили путем анализа таблиц сопряженности с использованием точного критерия Фишера для независимых групп. Статистически значимыми считали различия при p 
Всем пациентам контрольной группы было настоятельно рекомендовано приступить к репродуктивной реабилитации, в том числе с использованием методов вспомогательных репродуктивных технологий (ВРТ).
Проводимая терапия оказывала разный эффект в зависимости от выбранного препарата. Худшая эффективность отмечалась при использовании монотерапии ХГЧ (табл. 3).

Терапия ХГЧ, наряду с повышением уровня Т, увеличивала лишь число сперматозоидов в 1 мл эякулята, не влияя на другие параметры. ХГЧ устранял олигозооспермию у 60% пациентов (n=6), но тератозооспермия купировалась только у одного. До лечения процент морофологически нормальных форм у этого пациента составлял 3%, а через 3 мес — 4% (нижняя граница нормы). От этого мужчины на 3-м месяце лечения наступило зачатие. Беременность окончилась естественными родами здорового ребенка мужского пола. Следует отметить, что у этого пациента в анамнезе имеется здоровый ребенок женского пола от другой партнерши.
Таким образом, эффективность монотерапии ХГЧ в нашем исследовании составила 10% (1 человек). Мы не отмечали побочных эффектов такой терапии, кроме нерезких тянущих болей в области яичек, на которые жаловались 3 пациента. Боли отмечались в начале лечения, купировались самостоятельно, не требовали отмены препарата и были связаны с увеличением объема яичек.
Монотерапия кломифеном оказалась более эффективной (табл. 4).

Наряду с увеличением уровня тестостерона, гонадотропинов и ингибина В такая терапия не только увеличивала число сперматозоидов в 1 мл эякулята, но и улучшала их морфологию. При этом отмечалась тенденция к улучшению подвижности, хотя и не достигшая статистической значимости. Кломифен устранял олиготератозооспермию у 22 (73%) пациентов. От 2 мужчин этой группы на 3-м месяце лечения наступило зачатие. Беременность окончилась естественными родами здоровых детей женского пола. Следует отметить, что у этих пациентов в анамнезе имелись здоровые дети женского и мужского пола от других партнерш. Остальные пациенты (n=20), у которых отмечалось устранение олиготератозооспермии, продолжили терапию кломифеном в прежнем режиме. В табл. 5 приведены результаты их обследования еще через 3 мес.

На фоне продолжающейся терапии кломифена цитратом было выявлено дальнейшее увеличение уровней гонадотропинов и ингибина В и тенденция к повышению уровня Т, что сопровождалось улучшением подвижности сперматозоидов без значимых дальнейших изменений их концентрации или морфологии. Тем не менее на фоне 6-месячного лечения кломифеном зачатие наступило еще от 4 пациентов. Беременности окончилась естественными родами здоровых детей. Следует отметить, что у 3 из этих пациентов в анамнезе имелись здоровые дети от других партнерш.
Из 13 пациентов, у которых была устранена олиготератозооспермия, зачатия достигнуто не было; у 4 из них в анамнезе имелись дети. Таким образом, суммарная эффективность терапии кломифеном составила 20% (6 человек) в отношении зачатия, и 63% (19 человек) в отношении устранения олиготератозооспермии. Пациентам с устраненной олиготератозооспермией, но не достигшим зачатия, было рекомендовано использование ВРТ. При терапии кломифеном нами не было выявлено побочных эффектов, однако у 3 пациентов на фоне продолжающейся терапии отмечалось ухудшение достигнутых ранее показателей. Этим пациентам была рекомендована криоконсервация эякулята и использование методов ВРТ.
Хорошие результаты лечения также отмечались при комбинированной терапии ХГЧ с рФСГ (табл. 5).
Комбинированная терапия гонадотропинами, наряду с увеличением уровня Т и ингибина В, увеличивала как число сперматозоидов в 1 мл эякулята, так и их морфологию. На подвижность сперматозоидов лечение не повлияло. Олиготератозооспермия была устранена у 70% пациентов (n=21). От 3 из них на 3-м месяце лечения наступило зачатие. Беременности окончились естественными родами здоровых детей мужского пола. В анамнезе у одного из пациентов детей не было, а у 2 — здоровые дети женского пола. Пациенты с ненаступившим зачатием продолжили терапию гонадотропинами в прежнем режиме и были повторно обследованы еще через 3 мес (см. табл. 5).
На фоне продолжающейся комбинированной терапии гонадотропинами от 9 мужчин наступило зачатие, закончившееся рождением здоровых детей (5 женского и 4 мужского пола); у 6 из этих мужчин в анамнезе имелись дети. Еще у 5 мужчин было отмечено устранение олиготератозооспермии, но зачатия не наступило (у 3 из них в анамнезе также имелись дети). У 4 пациентов олиготератозооспермия сохранялась. Таким образом, суммарная эффективность комбинированной терапии гонадотропинами составила 40% (12 человек) в отношении зачатия и 87% (26 человек) в отношении олиготератозооспермии. Пациентам, не достигшим зачатия, было рекомендовано использование ВРТ.
При комбинированной терапии гонадотропинами нами не было выявлено побочных эффектов, кроме нерезких тянущих болей в области яичек, на которые жаловались 4 пациента. Боли отмечались в начале лечения, купировались самостоятельно, не требовали отмены препаратов и были связаны с увеличением объема яичек.
Обсуждение
При использовании монотерапии ХГЧ для стимуляции сперматогенеза были получены результаты, сходные с продемонстрированными в данном исследовании. Так, L. Yang и соавт. [3] показали, что, несмотря на возможность наступления спонтанной беременности на фоне монотерапии ХГЧ, для полноценной стимуляции сперматогенеза необходима комбинированная терапия в сочетании с ФСГ [3]. М. Amirzargar и соавт. [4] нашли, что комбинированная терапия ХГЧ с ФСГ приводит к большему числу беременностей (57%), чем монотерапия ХГЧ (32%). К подобному выводу пришли и также А. Sinisi и соавт. [5], показавшие, что у пациентов с гипогонадотропным гипогонадизмом, получающим ХГЧ, добавление рФСГ способствует лучшей индукции сперматогенеза.
Метаанализ результатов использования антиэстрогенов для стимуляции сперматогенеза [6] показал, что эти препараты значимо повышают частоту наступления беременности, увеличивают концентрацию сперматозоидов и их подвижность на фоне возрастания уровней ФСГ и Т в сыворотке при низком риске легких побочных эффектов.
Заключение
Все исследованные виды стимулирующей терапии повышают уровни Т и ингибина В в сыворотке, а также увеличивают концентрацию сперматозоидов в эякуляте. Однако в отношении устранения олиготератозооспермии и достижения спонтанного зачатия эффективны только терапия кломифена цитратом и комбинированная терапия ХГЧ с рФСГ. Длительность лечения должна составлять 3—6 мес. Комбинированная терапия гонадотропинами наиболее эффективна. Все исследованные виды стимулирующей терапии являются безопасными и не приводят к развитию побочных эффектов.
Информация о финансировании и конфликте интересов
Финансирование проведенных лабораторно-инструментальных исследований проведено при поддержке ФГБУ «Эндокринологический научный центр» Минздрава России.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: концепция и дизайн исследования — Н.С. Кравцова, Р.В. Роживанов; сбор и обработка материала, статистическая обработка данных, написание текста — Н.С. Кравцова; редактирование рукописи — Р.В. Роживанов, Д.Г. Курбатов.






