Клеточный апоптоз что это
Клеточный апоптоз что это
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
На молекулярном уровне при апоптозе происходит саморазрушение генома на мельчайшие фрагменты, осуществляемое ферментами самой клетки; в итоге при электрофорезе образующихся клеточных компонентов в полиакриламидном геле выявляется характерная «лестница» из фрагментов ДНК.
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
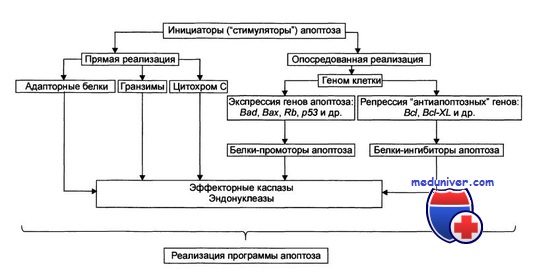
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»
МОЛЕКУЛЯРНАЯ МЕХАНИКА БОЛЕЗНИ
Концепция апоптоза как явления «запрограммированной» гибели клеток приобретает в последнее время все больше фактов и вариантов ее приложения к базовым вопросам современной медицины.
Термин «апоптоз» впервые был предложен в 1972 г. для обозначения генетически обусловленного процесса разрушения клетки и характеризуемого ее сжатием, агрегацией хроматина и деструкцией клеточного ядра. Апоптоз рассматривается как естественный биологический механизм, который способствует ликвидации «ненужных» клеток и тканей. Биологическая «цель» этого явления состоит в удалении нежелательных клеток в процессе индивидуального развития, при защитных реакциях, старении. Физиологическое назначение апоптоза состоит в селекции разновидностей и качества клеток внутри популяции, в том числе удалении клеток с генетическими дефектами, а также поддержании численности клеток тканевой популяции на функционально необходимом уровне.
Однако помимо общебиологического (общефизиологического) значения это явление оказывается значимым в процессах онкообразования, аутоиммунных патологиях, вирусных инфекциях, сердечно-сосудистых заболеваниях. Это представление получает также все большее число иллюстраций при изучении неврологических патологий. За последние пять лет, согласно информации Medline, по проблеме апоптоза опубликовано около 40 тыс. экспериментальных и клинических статей.
Биохимические и морфоцитологические признаки апоптоза выявляются в большом спектре экспериментальных нейродегенеративных расстройств: транзиторной церебральной ишемии, вызванной окклюзией церебральной артерии; интрацеребральной геморрагии; на моделях эпилептогенных судорог, локальном термическом повреждении мозга. Апоптоз включается в патологии любых проявлений ишемических и травматических повреждений нервной ткани, включая нарушения спинного мозга, деменциальные изменения, связанные с развитием болезней Альцгеймера, Паркинсона, сенильной деменцией, врожденными патологиями мозга и др. Таким образом, можно говорить о нейроапоптозе как новом патобиохимическом механизме нейродегенеративных расстройств широкого спектра.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ АПОПТОЗА
1. Нарушение энергетического потенциала митохондрий.
2. Образование активных форм кислорода (АФК).
3. Запуск «специализированных» биохимических систем.
5. Морфологическая гибель клетки, ткани, организма.
Среди факторов запуска апоптоза следует отметить образование активных форм кислорода как «извращенного» пути окислительного метаболизма в клетке. Считается, что повреждения, развивающиеся в результате аноксии или ишемии ткани любого уровня, обязаны в первую очередь образованию АФК. Первичным источником АФК оказываются митохондрии, которые играют ключевую роль в энергетическом обеспечении клетки. Ныне существует обобщенное клиническое понятие «митохондриальная патология»: повреждение мембран митохондрий ведет к образованию супероксидных радикалов, которые, реагируя с NO, образуют пероксинитриты, «повреждающие» молекулы АФК.
Факторы, последовательно включающиеся в апоптоз:
2.Образование АФК, которые стимулируют синтез провоспалительных цитокинов, включающихся в каскад апоптических процессов.
4. Включение каскада протеолитических реакций, приводящих к расщеплению белков ядерного матрикса, дестабилизации структуры хроматина ядер, фрагментации ДНК, нарушению репликационной и метаболической функций клетки. Среди ферментов, причастных к разветвленной цепи апоптоза, ведущее место принадлежит каспазам, относящимся к семейству 1-интерлейкин-конвертирующих протеаз.
Баланс про- и антиапоптических механизмов связан с оксидом азота (NO), различные пути образования которого могут определять как цитотоксическое, так и цитопротекторное его действие. Длительная генерация NO провоцирует развитие апоптоза: усиливается синтез белка р53 и активируются протеазы из семейства каспаз.
Биохимические и цитоморфологические исследования апоптоза выявляют несколько стадий его развития в поврежденной нервной ткани: непосредственную и отсроченную. Как правило, исходное повреждение ткани не ограничивается областью воздействия разрушающей силы, а, продолжаясь во времени, захватывает первично интактные клетки и приводит к расширению очага повреждения.
Поскольку апоптоз рассматривается в качестве патохимического механизма клеточной гибели, представляет собой фазный процесс и, следовательно, имеет обратимые этапы, возможно рассмотрение подходов к фармакологическому вмешательству в его регуляцию. Существенной оказывается оценка условий, благодаря которым, переходя необратимую грань, апоптоз приводит к тотальным последствиям, гибели большого массива функционально значимых клеток и смерти всего организма. К этим условиям относятся характер и величина травмирующего воздействия, степень сбалансированности клеточных биохимических систем, противостоящих необратимому развитию апоптоза, возможность своевременного применения реабилитационных мероприятий защиты структур мозга, кардиоваскулярной системы и организма в целом.
РОЛЬ НЕЙРОПЕПТИДОВ И НЕЙРОТРОФИНОВ
Существует определенная параллель между информацией об участии нейропептидов и нейротрофических факторов роста в патогенезе неврологических расстройств и причастностью этих химических регуляторов к нейроапоптозу. Среди нейротрофических ростовых факторов (см. «МГ» № 30 от 17.04.02) выявляются те, которые играют роль индукторов апоптических процессов или, наоборот, противодействующих развитию нейроапоптоза. Например, в исследованиях последних месяцев подтверждено участие фактора некроза опухоли (TNF-() в апоптозе глиальных и нейрональных клеток как следствии аутоиммунной нейропатологии и патологии мультисклероза. Ассоциируемое с болезнью Гентингтона образование свободнорадикальных продуктов, провоцируемое в эксперименте внесением дофамина, ингибировалось в нейронах стриатума нейротрофическим фактором мозга (BDNF).
АПОПТОЗ В КАРДИОВАСКУЛЯРНЫХ КЛЕТКАХ
Признаки апоптоза выявляются также при различных формах сердечно-сосудистых патологий: дисфункции эндотелия, «чрезмерном» напряжении сосудистой стенки, ишемических и реперфузионных ее нарушениях, атеросклеротических изменениях, инфаркте миокарда, ишемическом инсульте и др. В перикардиальной жидкости пациентов с ишемической патологией миокарда обнаружен митогенактивирующий белок р38, участвующий в запуске апоптических процессов. Известно также, что при кардиоваскулярных расстройствах, сочетающихся с диабетом, в миоцитах и эндотелиоцитах обнаруживаются активированные апоптозные продукты. Недавно были опубликованы клинические результаты, согласно которым определенные белки апоптозного каскада могут быть использованы как маркеры повреждения миокарда при стадийной ИБС.
Как известно, патология «гипертонического сердца» сопровождается гипертрофией левого желудочка, ведущей к ремоделированию миокарда, недостаточной васкуляризации, фиброзу, уменьшению числа функциональных кардиомиоцитов и сократительной способности сердца в целом. За все эти явления ответствены апоптозные процессы, спровоцированные хронической ишемией и перегрузкой больного сердца. Исследования последнего периода показывают, что апоптозная гибель кардиомиоцитов служит решающим фактором в переходе к компенсаторной гипертрофии и нарушению насосной функции сердца при артериальной гипертензии. Условия, провоцирующие экспрессию химических механизмов апоптоза в «перегруженном» сердце, включают чрезмерное механическое напряжение миоцитов, гипоксию и окислительный стресс, активацию нейрогуморальных факторов и цитокинов. Все эти явления сопряжены между собой и составляют звенья единого патогенетического процесса.
Особенно значимы исследования, связанные с ангиотензином II и образующим его ферментом АПФ. Исследования роли ангиотензина II в механизмах окислительного стресса и эндотелиальной дисфункции логично привели к рассмотрению роли этого пептида в индукции апоптоза кардиальных, васкулярных и эндотелиальных клеток. Принципиальным оказывается вывод, что повышенный уровень ангиотензина II сопряжен с активностью некротического и трансформирующего ростовых факторов, а также специфических апоптозных белков (bcl-2, p53), особых ферментов (каспаз), каскадная динамика которых приводит к деградации молекулы ДНК на фрагменты и последующей «запрограммированной» гибели клетки.
Проапоптозный, патогенетический, эффект ангиотензина II может быть заблокирован использованием соответствующих препаратов.
В настоящее время открыт, по сути, базовый биохимический механизм неврологических, кардиоваскулярных, онкологических и других патологий. Очевидно, последующие работы и исследования специфической роли систем химических регуляторов представят новые возможности диагностики и терапии этих заболеваний.
Еще раз об апоптозе
Каждый день в организме погибает большое количество клеток, а на смену им образуется равное количество новых: таково условие для поддержания клеточного гомеостаза. Удалить необходимо ненужные, старые и потенциально опасные. Одним из известных механизмов клеточной гибели является апоптоз, представляющий собой программируемый процесс.
Когда активируется апоптоз?
Физиологические ситуации:
Патологические ситуации:
Внутриклеточный протеолитический каскад
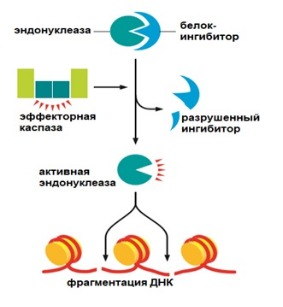
Активируют апоптоз внутриклеточные ферменты — каспазы (caspases). Они относятся к классу протеолитических ферментов (протеазы), так как расщепляют пептидные связи в белках. Буква «с» в «caspases» указывает на то, что в активном центре протеаз находится аминокислота цистеин, «asp» — на то, что расщепление последовательности аминокислот происходит после остатка аспарагиновой кислоты. Каспазы в клетке находятся в неактивной форме (в виде проферментов) и активируются только в процессе апоптоза.
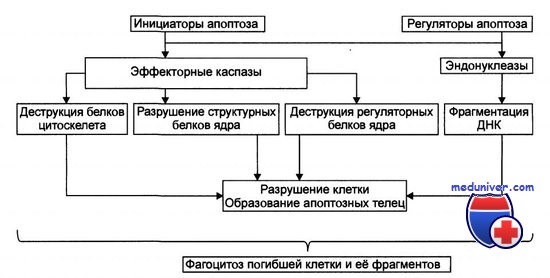
Каспазами разрушается множество белков, среди которых белки ядерной пластинки и белок-ингибитор активности эндонуклеазы. Расщепление последнего ведет к тому, что эндонуклеаза начинает разрезать ДНК. Разрушаются белки цитоскелета и клеточной адгезии, которые соединяют клетки друг с другом. Такой каспазный каскад необратим.
Рисунок 1 | Разрушение каспазой ингибитора эндонуклеазы и последствия. Апоптоз может протекать по двум различным путям — по внешнему и внутреннему (митохондриальному)
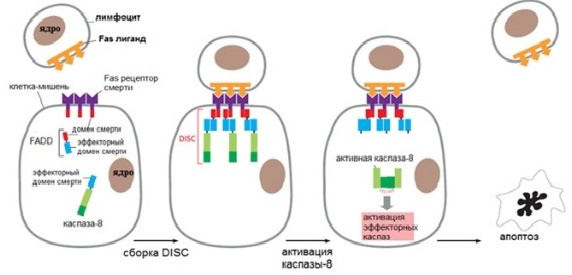
Внешний путь апоптоза
Этот путь запускается при связывании лиганда с рецептором смерти, находящимся на плазматической мембране различных клеток. Рецепторы смерти (death receptors — DR) бывают нескольких видов: TNF-R1, FAS (CD95), DR3, TRAIL-R1, TRAIL-R2 и др. Все они трансмембранные белки, содержащие внеклеточную часть — лиганд-связывающий домен — и внутриклеточную часть — домен смерти.
Существует ингибиторный белок, ограничивающий внешний путь. Этот белок называется FLIP. Он похож на инициаторную каспазу, но не обладает ее функцией. FLIP с каспазой-8 образует DISC, однако каспаза-8 не становится активной и апоптотический сигнал блокируется. Этот тормозный механизм помогает предотвратить нежелательную активацию внешнего пути.
Рисунок 2 | Внешний путь апоптоза
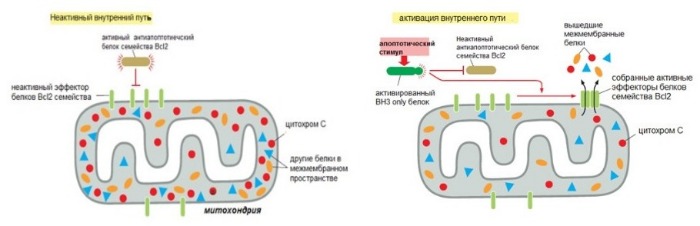
Внутренний путь апоптоза зависит от митохондрий
Этот путь может быть запущен в ответ на повреждение ДНК, активацию онкогенов, избыток Ca 2+ в клетке, отсутствие факторов роста (пептидный или стероидный гормон, стимулирующий рост и дифференцировку клетки), неправильно сложенные белки.
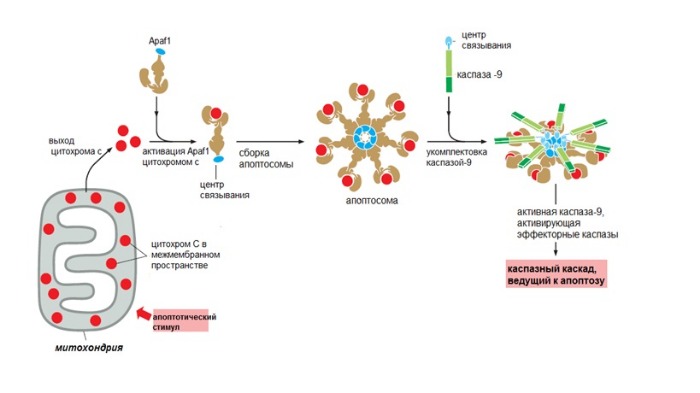
Активация пути ведет к повышению проницаемости наружной мембраны митохондрий. Из-за этого в цитоплазму выходят цитохром c и другие митохондриальные белки, которые инициируют апоптоз.
В норме они находятся в межмембранном пространстве этих органелл. Ключевой белок во внутреннем пути — цитохром с (компонент электрон-транспортной цепи). Выйдя в цитоплазму, он приобретает новые функции и присоединяется к фактору апоптотической протеазы 1 (apoptotic protease activating factor-1 — Apaf1).
Так образуется колесоподобная структура — апоптосома. Апоптосома активирует инициаторные каспазы-9, в свою очередь активирующие эффекторные каспазы, что дает начало апоптозу.
Апоптоз-регулируемый процесс
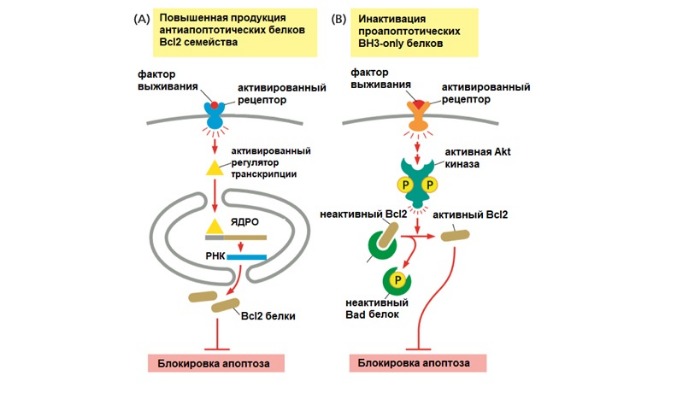
За внутренний путь апоптоза отвечают белки семейства Bcl2. Они контролируют выход проапоптотических белков из митохондрий (например, цитохром c). Название дано в честь гена белка Bcl2, который сверхэкспрессирован в некоторых лимфомах В-клеток (B cell lymphoma). В это семейство входят более 20 белков, которые могут быть разделены в три группы на основании их функций и количестве гомологичных доменов (Bcl2 Homology).
Первая группа — проапоптотические белки, которые увеличивают выход митохондриальных белков и запуск апоптоза.
Вторая группа — антиапоптотические белки, которые подавляют апоптоз, блокируя выход митохондриальных белков. Оба вида могут связываться друг с другом в различных комбинациях, подавляя свои функции. Баланс между активностью двух видов белков определяет, выживет ли клетка или погибнет по внутреннему пути апоптоза.
Антиапоптотическая группа представлена белками Bcl2 и BclXL, которые имеют четыре BH домена (BH1-4). Эти белки находятся на наружной мембране митохондрий и сохраняют ее непроницаемость. Таким образом это предотвращает утечку цитохрома c и других белков.
Проапоптотические белки — Bax и Bak. У них есть три BH домена (BH1-3). После своей активации Bax и Bak повышают проницаемость внешней мембраны митохондрий. Возможно, это происходит путем образования канала, что позволяет белкам выходить из межмембранного пространства в цитоплазму. Bak даже в отсуствие апоптотического сигнала связан с наружной мембраной митохондрий, а Bах локализован в цитозоле и транспортируется к митохондрии только после апоптотического сигнала.
Третья группа содержит (тоже проапототические) белки Bad, Bim, Bid, Puma и Noxa. Они имеют один BH домен (BH3), третий из четырех доменов BH, поэтому и получили название BH3 only proteins. Белки BH3-only играют ключевую роль в регулировании и стимулировании апоптоза и, таким образом, служат привлекательной целью терапевтического вмешательства. Следует отметить, что BH3 домен является единственным общим доменом для всех членов семейства Bcl2. Он опосредует взаимодействия между проапоптотическими и антиапоптотические белками.
Как происходит регуляция?
Факторы роста и другие сигналы выживания стимулируют выработку антиапоптотических белков. Они ингибируют апоптоз путем связывания проапоптотических белков на митохондриальной мембране. BH3-only белки, напротив, нейтрализуют активность антиапоптотических белков, таким образом способствуя собиранию проапоптотических белков Вах и Вак на поверхности митохондрии. Это приводит к выходу митохондриальных белков наружу.
Знаменитый белок р53 часто называют «стражем генома», потому что он в ответ на повреждение ДНК запускает апоптоз. Если повреждения не могут быть исправлены, белок р53 (опухолевый супрессор) накапливается в клетке и активирует транскрипцию генов, кодирующих BH3-only белки Puma и Noxa. Также p53 действует на митохондрии и взаимодействует с антиапоптотическим белком Bcl-xL.
Белок ВН3-only Bid связует оба пути апоптоза. В норме он неактивен. Но при активации внешнего пути каспаза-8 переводит белок Bid в активную форму. Bid перемещается к наружной мембране митохондрии и ингибирует антиапоптотические белки, тем самым увеличивая сигнал смерти.
Рисунок 4 | Схема регуляции внутреннего пути апоптоза
Другие способы регуляции
Клетка использует надежные механизмы от ненужной активации каспаз. Например, защитником служит семейство белков-ингибиторов апоптоза (inhibitors of apoptosis — IAPs). У человека они представлены следующими видами: cIAP1 (BIRC2), cIAP2 (BIRC3), X-связанный IAP (XIAP) и др.
И еще о факторах выживания
Межклеточные сигналы регулируют деятельность клеток, в том числе и апоптоз. Необходим контроль, гарантирующий, что отдельные клетки ведут себя во благо всего организма, в противном случае их нужно удалить. Например, сигнальные белки, такие как Fas-лиганд, активируют рецепторы смерти и тем самым инициируют внешний путь апоптоза. Напротив, существуют факторы выживания — внеклеточные сигнальные молекулы, которые ингибируют апоптоз. Некоторые клетки требуют непрерывной сигнализации от других клеток, чтобы выживать. И это, по-видимому, помогает обеспечить жизнь только нужных клеток.
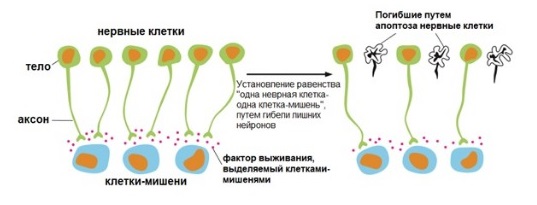
Гибель нервной ткани
Рисунок 6 | Роль факторов выживания в гибели лишних нервных клеток
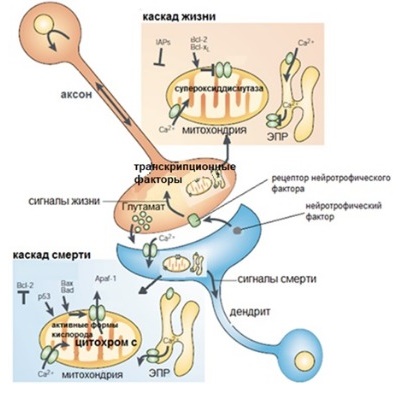
Каскады жизни и смерти
Каскад жизни
Факторы выживания для нейронов называются нейротрофическими факторами. Активация рецепторов нейротрофических факторов на пресинаптической мембране аксона приводит к увеличению факторов транскрипции, которые отвечают за образование антиапоптотических белков (Bcl-2, Bcl-xL), супероксиддисмутазы (подавляет повреждение клетки в результате окисления) и белков-ингибиторов апоптоза (IAP).
Каскад смерти
Рисунок 7 | Каскады жизни и смерти
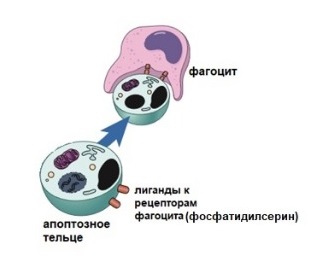
Как убрать апоптотическую клетку?
Апоптоз — очень аккуратный процесс клеточной смерти. Апоптотическая клетка и ее фрагменты не разрываются и не выделяют свое содержимое, а вместо этого остаются нетронутыми. Они съедаются без следов, поэтому воспалительного ответа нет. Апоптотическую клетку поглощают фагоциты. Процесс поглощения зависит от наличия химических изменений на поверхности мембраны клетки.
К таким изменениям относится наличие фосфатидилсерина, который служит сигналом для фагоцитарных клеток. Этот фосфолипид обычно расположен только на внутренней поверхности плазматической мембраны, а при апоптозе переворачивается на наружную поверхность. Макрофаги не фагоцитируют здоровые клетки, хотя у здоровых клеток на их поверхности есть некоторый фосфатидилсерин.
Но здоровые клетки имеют еще и такие сигнальные белки на их поверхности, которые блокируют фагоцитоз. Таким образом, помимо наличия сигналов, таких как фосфатидилсерин, которые стимулируют фагоцитоз, апоптотические клетки должны инактивировать сигналы типа «не ешь меня», блокирующие фагоцитоз.
Рисунок 8 | Фагоциты удаляют апоптотическую клетку или ее части
Уклонение от апоптоза
Нарушение механизма клеточной смерти ключевой признак онкологического заболевания. Опухолевые клетки могут использовать различные механизмы для подавления апоптоза и приобретения устойчивости к апоптотическим агентам. Например, может наблюдается повышенная экспрессия антиапоптотических белков (Bcl-2) или мутации в генах проапоптотических белков (Вах).
Дефекты апоптоза могут позволить эпителиальным клеткам выживать во взвешенном состоянии без прикрепления к внеклеточному матриксу, что способствует метастазированию. Они также способствуют устойчивости перед цитолитическими Т-клетками и натуральными киллерами (NK), атакующими опухоли. Эти дефекты играют важную роль в устойчивости к лечению химиотерапией и лучевой терапией, увеличивая порог смерти клеток и требуя более высоких доз агентов, убивающих опухоль.
Успешное удаление раковых клеток с помощью нехирургических средств в конечном итоге достигается путем индукции апоптоза. Все цитотоксические противораковые средства, которые в настоящее время используются в клинических целях, вызывают апоптотическую гибель злокачественных клеток.
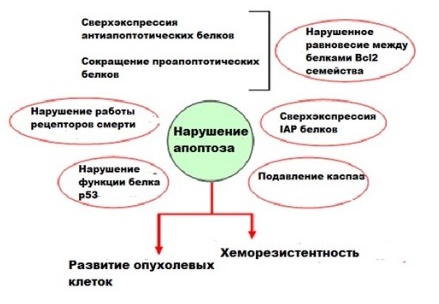
Рисунок 9 | Схематическое представление различных способов, из-за которых апоптотические пути могут быть нарушены
Терапия онкологических заболеваний и апоптоз
Ингибирование апоптоза лежит в основе развития всех опухолей. А значит, наиболее очевидной стратегией лечения является нацеленность на причины, которые подавляют гибель клеток. Для преодоления антиапоптотического эффекта белков Bcl-2 и Bcl-xL в опухолевых заболеваниях существует три стратегии:
Стратегия первая
Некоторые стероиды и ретиноиды активируют транскрипционные факторы, которые регулируют синтез мРНК. Они представляют собой потенциально «лекарственные» модуляторы транскрипции гена Bcl-2 и Bcl-xL. Например, экспрессия Bcl-2 зависит от эстрогена в молочной железе.
Следовательно, антиэстрогены, такие как тамоксифен, ингибируют экспрессию Bcl-2 в клеточных линиях рака молочной железы, способствуя развитию чувствительности к цитотоксическим противоопухолевым препаратам, таким как доксорубицин.
Стратегия вторая
Антисмысловые олигонуклеотиды — цель на мРНК. Антисмысловые олигонуклеотиды (Antisense oligonucleotides) представляют собой короткие последовательности одноцепочечной ДНК, которые могут связываться с мРНК, что сопровождается ее разрушением.
Модификация искусственных нуклеотидов делает нуклеотидную цепь устойчивой к расщеплению нуклеазами и повышают период полувыведения в организме. В данном случае использовалось добавление фосфоротиоата (PS) в основную цепь (замена одного из кислородных остатков фосфатной цепи на серу)
Стратегия третья
BH3 миметики — это вещества, связывающиеся с рецепторами белков, на которые действуют сами BH3. Они необходимы для активации апоптоза. Эти белки нейтрализуют антиапоптотическое белки Bcl2 или активируют Bak и Bax. Разработаны BH3-имитирующие молекулы, выполняющие те же функции, что и BH3 белки.
Например, вещество ABT-737, которое ингибирует Bcl2-белки. BH3-белки, взаимодействуют с длинной гидрофобной канавкой в белке Bcl2, тем самым инактивируя последние. Препарат ABT-737 был спроектирован с помощью кристаллической структуры этой канавки.
Р53 в качестве лекарственной цели
Ген белка р53 отключен из-за мутаций примерно у 50% всех злокачественных опухолей. Повышение производства белка р53 в клетке может быть методом противораковой терапии. В нормальных клетках белок p53 обычно поддерживается на низком уровне, поскольку он подвержен ингибированию белком MDM2. В ответ на повреждения ДНК p53 видоизменяется.
Это позволяет ему избежать контроля MDM2 и начать накапливаться в клетке. Содержание гена MDM2 увеличено в некоторых типах опухолей, поэтому активного белка р53 становится меньше. Взаимодействие между p53 и MDM2 является мишенью в противораковой терапии. С этой целью были разработаны препараты, которые блокируют белок-белковые взаимодействия. Среди них Nutlin-3, ингибирующий взаимодействие p53/MDM2.
Большая часть того, что известно об апоптозе, стала понятна только недавно. Основная идея разработки терапевтических препаратов для лечения рака основана на том факте, что поврежденные клетки обычно встают на путь апоптоза, поддерживая нормальное для ткани количество клеток. Однако это явление сильно нарушается в раковых клетках. Обнаружение ключевых участников апоптоза и их взаимодействие с другими значимыми участниками создает условия для поиска новых методов терапии рака.