Кларитромицин и азитромицин в чем разница отличие
Кларитромицин и азитромицин в чем разница отличие
Макролиды, линкосамиды и стрептограмины (MLS-антибиотики) представляют собой химически неродственные антибиотики, обладающие сходным механизмом действия и антимикробной активностью с подобным профилем резистентности. Они обратимо связываются с рибосомной субъединицей 50S, блокируя транслокацию. MLS-антибиотики принято рассматривать как бактериостатические антибиотики, они бактерицидны против специфических изолятов. Основной механизм приобретенной резистентности состоит в специфической мутации рибосомной РНК субъединицы 50S. Резистентность к одному из членов класса MLS не обязательно сопровождается резистентностью к другим.
Макролиды имеют макроциклическое лактоновое кольцо. Прототипом макролида служит эритромицин, представленный различными солями. В последние годы в США введены в клиническую практику новые макролиды, в том числе кларитромицин, азитромицин и диритромицин. В Европе и Азии доступны другие макролиды. Их обычно принимают перорально, хотя существуют лекарственные формы эритромицина и азитромицина, предназначенные для в/в введения, а для лечения аспе vulgaris используют лосьон с эритромицином. Макролиды метаболизируются в печени и не проникают в СМЖ в количествах, достаточных для создания терапевтических концентраций.
Эритромицин активен против стрептококков, стафилококков, Bordetella pertussis, Corynebacterium diphtheriae, Campylobacter jejuni, Mycoplasma pneumoniae, Ureaplasma urealyticum, Legionella и Chlamydia. Эритромицин и диритромицин обладают ограниченной активностью против Н. influenzae, однако кларитромицин и азитромицин значительно эффективнее против этого микроорганизма. Макролиды не действуют на Enterobacteriaceae, P. aeruginosa или Mycoplasma hominis.
Макролиды используют прежде всего для лечения инфекций дыхательных путей. Кроме того, макролиды можно применять вместо пенициллина при стрептококковом фарингите, особенно у пациентов с аллергией к пенициллину.
Макролиды являются лекарствами выбора в терапии пневмонии, т.к. они активны против пневмококков, С. pneumoniae, M. pneumoniae и Legionella. В случаях, когда инфекция может быть вызвана Haemophilus influenzae, предпочтительнее применять кларитромицин или азитромицин.
Эритромицин — лекарство выбора для лечения коклюша, болезни легионеров, инфекции, вызываемой Chlamydia trachomatis (во время беременности, когда тетрациклины противопоказаны), и так же эффективно, как и пенициллин, устраняет состояние носительства при дифтерии. Эритромицин с таким же успехом, как и тетрациклин, используют при лечении инфекций, вызываемых М. pneumoniae, применяют при энтерите, возбудителем которого является С. jejuni, и может быть использован вместо бета-лактамов при умеренно выраженных инфекциях кожи и мягких тканей (S. pyogenes и S. aureus).
Кларитромицин и азитромицин
Кларитромицин и азитромицин более активны против некоторых патогенов, чем эритромицин. Кларитромицин и азитромицин (но не диритро-мицин) активнее эритромицина по отношению к Н. influenzae и больше подходят как средство эмпирической терапии инфекций дыхательных путей, если возможным патогеном является Н. influenzae.
И кларитромицин, и азитромицин активны против комплекса Mycobacterium avium — важного патогена у больных СПИДом. Кларитромицин полезен для борьбы с большинством других, нетуберкулезных микобактерий. Он также очень активен против Helicobacter pylori и является компонентом комплекса препаратов, обычно применяемых для политерапии язвы двенадцатиперстной кишки, вызываемой Н. pylori. Азитромицин действует на Chlamydia trachomatis и является единственным лекарственным препаратом, с помощью которого можно излечить вызываемый этим патогеном уретрит и цервицит при однократном применении.
Почему азитромицин остается препаратом выбора при внебольничных инфекциях нижних дыхательных путей
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире.
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире. В России ежегодно около 1,5 млн человек переносят пневмонию. В связи с этим остается актуальной проблема рационального выбора антибактериального средства для лечения инфекций нижних дыхательных путей. Выбор препарата для антибактериальной терапии должен основываться на его спектре действия, охватывающем выделенный или предполагаемый возбудитель, чувствительный к данному антибиотику, фармакокинетических свойствах антибактериального средства, обеспечивающих его проникновение в терапевтической концентрации в соответствующие ткани, клетки и жидкости организма, данных о безопасности антибиотика (побочных эффектах, противопоказаниях и возможном нежелательном взаимодействии с другими лекарствами), характеристиках лекарственной формы, способе введения и режиме дозирования, обеспечивающих высокий комплаенс терапии, фармакоэкономических аспектах лечения [4, 6, 8].
Инфекции нижних дыхательных путей и принципы выбора антибиотика
При неспецифических внебольничных инфекциях выбор антибактериального препарата в большинстве случаев основывается на статистических данных о наиболее частых их возбудителях, а также сведениях о подтвержденной в контролируемых клинических исследованиях эффективности тех или иных антибиотиков при инфекциях известной этиологии. Вынужденно эмпирический подход к лечению связан с отсутствием возможности микробиологического исследования в амбулаторных лечебных учреждениях, длительностью бактериологической идентификации возбудителя и определения его чувствительности к антибиотикам (3–5 дней, а в случае «атипичных» патогенов и больше), невозможностью в ряде случаев получить биологический материал для посева или бактериоскопии (например, около 30% больных пневмониями имеют непродуктивный кашель, что не позволяет исследовать мокроту), трудностями в разграничении истинных возбудителей и сапрофитов (обычно микроорганизмов ротоглотки, попадающих в исследуемый материал). Сложности выбора лекарственного средства в амбулаторных условиях определяются также отсутствием полноценного наблюдения за течением заболевания и, следовательно, своевременной коррекции лечения при его неэффективности. Антибиотики по-разному проникают в различные ткани и биологические жидкости. Лишь некоторые из них хорошо проникают в клетку (макролиды, тетрациклины, фторхинолоны, в меньшей степени — клиндамицин и сульфаниламиды). Поэтому, даже если препарат in vitro проявляет высокую активность в отношении данного возбудителя, но не достигает в месте его локализации уровня, превышающего минимальную подавляющую концентрацию (МПК) для данного микроорганизма, клинического эффекта он не окажет, хотя микробная резистентность к нему будет вырабатываться. Не менее важным аспектом антибактериальной терапии является ее безопасность, особенно для амбулаторного больного, лишенного повседневного медицинского наблюдения. В амбулаторных условиях следует отдавать предпочтение пероральному приему антибиотиков. В педиатрической практике имеют значение органолептические свойства препарата. Для повышения исполняемости пациентом врачебных назначений режим дозирования антибиотика должен быть максимально простым, т. е. предпочтительнее препараты с минимальной кратностью приема и коротким курсом лечения.
Возбудители неспецифических внебольничных инфекций нижних дыхательных путей
Острые респираторные вирусные инфекции (ОРВИ), протекающие с синдромом бронхита, в ряде случаев, чаще в детском возрасте, могут осложняться присоединением бактериальной флоры с развитием острого бронхита. Возбудителями острого бактериального бронхита в детском возрасте являются пневмококк, микоплазма или хламидия, реже гемофильная палочка, моракселла или стафилококк. Острый бактериальный бронхиолит у детей вызывают моракселла, микоплазма и возбудитель коклюша. Острый гнойный трахеобронхит у взрослых в 50% случаев вызывает гемофильная палочка, в остальных случаях пневмококк, реже моракселла (5–8% случаев) или внутриклеточные микроорганизмы (5% случаев).
Среди бактериальных возбудителей обострений хронического бронхита главную роль играют Haеmophilus influenzae (30–70% случаев), Streptococcus pneumoniae и Moraxella catarrhalis. Для курильщиков наиболее характерна ассоциация H. influenzae и M. catarrhalis. В отягощенных клинических ситуациях (возраст старше 65 лет, многолетнее течение болезни — более 10 лет, частые обострения — более 4 раз в год, сопутствующие заболевания, выраженные нарушения бронхиальной проходимости — объем форсированного выдоха за первую секунду (ОФВ1)
С. В. Лукьянов, доктор медицинских наук, профессор ФГУ «Консультативно-методический центр лицензирования» Росздравнадзора, Москва
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.
Макролиды (эритромицин, кларитромицин, азитромицин)
Содержание
Макролиды (эритромицин, кларитромицин и азитромицин) [ править | править код ]
Историческая справка [ править | править код ]
Химические свойства [ править | править код ]
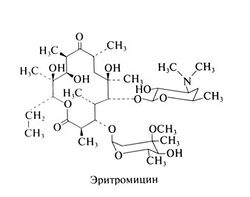
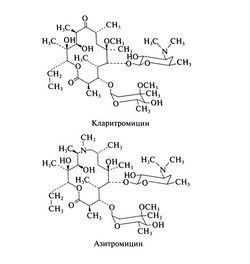
Макролиды получили свое название благодаря макроциклическому лактонному кольцу (14-членному у эритромицина и кларитромицина и 15-членному у азитромицина), с которым соединен по крайней мере один остаток дезоксисахара. Кларитромицин отличается от эритромицина метальной группой, замещающей водород гидроксильной группы в положении 6, а у азитромицина в состав лактонного кольца входит дополнительный атом азота с присоединенной к нему метильной группой. Благодаря этим структурным отличиям азитромицин и кларитромицин более стабильны в кислой среде, лучше проникают в ткани и обладают более широким спектром действия. Химические формулы макролидов следующие:
Антимикробная активность [ править | править код ]
Эритромицин обычно оказывает бактериостатический эффект, но в высоких концентрациях на высокочувствительные микроорганизмы может действовать бактерицидно. In vitro эритромицин наиболее активен в отношении аэробных грамположительных кокков и палочек (Steigbigel, 2000). МПК для чувствительных штаммов Streptococcus pyogenes и Streptococcus pneumoniae колеблется от 0,015 до 1 мкг/мл. Однако число устойчивых к эритромицину штаммов стрептококков растет. Механизм устойчивости одинаков для всех макролидов, поэтому такие штаммы перекрестно устойчивы и к другим препаратам этой группы. Вследствие широкого применения макролидов доля устойчивых к ним штаммов Streptococcus pyogenes может достигать 40% (Seppala et al., 1997; Esposito et al., 1998). У Streptococcus pneumoniae распространенность устойчивости к макролидам особенно велика среди пенициллиноустойчивых штаммов и составляет 60% по сравнению с 5% среди пенициллиночувствительных штаммов (Thomsberry et al., 1997; Thomsberry et al., 1999). МПК эритромицина для зеленящих стрептококков составляет 0,06—3,1 мкг/мл.
К эритромицину чувствительны некоторые стафилококки, но МПК для них колеблется в широких пределах (для Staphylococcus epidermidis — от 8 до более чем 32 мкг/мл, для Staphylococcus aureus — от 0,12 до более чем 128 мкг/мл). Больничные штаммы Staphylococcus aureus часто устойчивы к макролидам; кроме того, Staphylococcus aureus может приобрести устойчивость в ходе лечения. Устойчивые к макролидам штаммы Staphylococcus aureus проявляют перекрестную устойчивость к клиндамицину (Fass, 1993). К эритромицину чувствительны многие грамположительные палочки: МПК для Clostridium perfringens составляет 1 мкг/мл, для Corynebacterium diphtheriae — 0,2—3 мкг/мл, для Listeria monocytogenes — 0,25—4 мкг/мл.
На большинство энтеробактерий эритромицин не действует, но проявляет активность в отношении других грамотрицательных микроорганизмов. In vitro он умеренно активен в отношении Haemophilus influenzae (МПК 1—32 мкг/мл) и Neisseria meningitidis (МПК 0,4—1,6 мкг/мл), высокоактивен в отношении большинства штаммов Neisseria gonorrhoeae (МПК0,12—2 мкг/мл; Ste-igbigel, 2000). Кроме того, он действует на Pasteurella mul-tocida, Borrelia spp. и Bordetella pertussis. Штаммы Bacteroides fragilis часто устойчивы к эритромицину (МПК 2—32 мкг/мл), a Campylobacter jejuni — чувствительны (МПК 0,5—4 мкг/мл). Эритромицин эффективен при инфекциях, вызванных Mycoplasma pneumoniae (МПК 0,004—0,02 мкг/мл) и Legionella pneumophila (МПК 0,01—2 мкг/мл). Для большинства штаммов Chlamydia trachomatis МПК составляет 0,06—2 мкг/мл. In vitro к эритромицину чувствительны и некоторые атипичные микобактерии, включая Mycobacterium scrofulaceum. Чувствительность Mycobacterium kansasii и Mycobacterium avium-intracellulare колеблется (Molavi and Weinstein, 1971). Mycobacterium fortuitum устойчива к эритромицину.
Кларитромицин немного активнее эритромицина в отношении чувствительных к последнему штаммов стрептококков и стафилококков, умеренно активен в отношении Haemophilus influenzae и Neisseria gonorrhoeae. Кроме того, кларитромицин хорошо действует на Moraxella catarrhalis, Chlamydia spp., Legionella pneumophila, Borrelia burgdorferi, Mycoplasma pneumoniae, Mycobacterium leprae (Chan et al., 1994).
Азитромицин в целом менее активен, чем эритромицин, в отношении грамположительных бактерий (стрептококки, энтерококки), но немного сильнее, чем эритромицин и кларитромицин, действует на Haemophilus influenzae и Campylobacter spp. (Peters et al., 1992). Азитромицин высокоактивен в отношении Moraxella catarrhalis, Pasteurella multocida. Chlamydia spp., Mycoplasma pneumoniae. Legionella pneumophila, Borrelia burgdorferi, Fuso-bacterium spp. и Neisseria gonorrhoeae.
Микроорганизм считается чувствительным к новым макролидам (кларитромицину и азитромицину), если МПК для него не превышает 2 мкг/мл. Исключение составляет Haemophilus influenzae: МПК для чувствительных к кларитромицину штаммов не превышает 8 мкг/мл, а МПК для чувствительных к азитромицину штаммов —4 мкг/мл.
Азитромицин и кларитромицин активнее эритромицина в отношении Mycobacterium avium-intracellulare. Новые макролиды действуют также на некоторых простейших (Toxoplasma gondii, Cryptosporidium spp., Plasmodium spp.).
Механизм действия [ править | править код ]
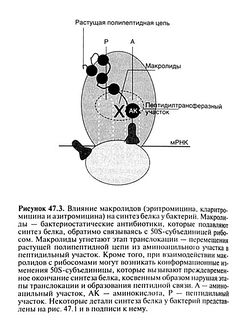
Макролиды — бактериостатические антибиотики, подавляющие синтез белка путем обратимого связывания с 505-субъединицей рибосом (рис. 47.3; Brisson-Noel et al., 1988). Макролиды действуют на ту же мишень, что и хлорамфеникол, конкурентно ингибируя его связывание с рибосомами (рис. 47.2). Изменение 50S-субъединицы рибосом вследствие мутации, нарушающее связывание макролидов с мишенью, приводит к развитию лекарственной устойчивости. В отличие от хлорамфеникола, препятствующего образованию пептидной связи, макролиды действуют на этапе транслокации — переноса вновь синтезированной молекулы пептидил-тРНК изаминоацильногоучастка рибосомы в пептидильный участок.
Грамположительные бактерии накапливают почти в 100 раз больше эритромицина, чем грамотрицательные.
В щелочной среде антимикробная активность препарата гораздо выше, вероятно потому, что в неионизированной форме, преобладающей при высоком pH, он значительнолучше проникает в бактериальные клетки (Sabath etal., 1968; Vogel et al., 1971).
Приобретенная устойчивость к макролидам обусловлена тремя основными механизмами:
Второй механизм, опосредуемый генами егт, обусловливает устойчивость не только к макролидам, но и к линкозамидам и стрептограминам (фенотип MLSB). Все эти препараты действуют наоднуиту же мишень, метилирование которой приводит к формированию устойчивости. Существует еще один механизм устойчивости к макролидам, обнаруженный у Bacillussubtilis, Campylobacter spp. и грамположительных кокков. Он обусловлен хромосомными мутациями, изменяющими строение белка 508-субъединицы рибосом.
Фармакокинетика [ править | править код ]
Всасывание [ править | править код ]
Эритромицин в виде основания всасывается в ЖКТ в достаточной мере, но не полностью; всасывание происходит в верхних отделах тонкой кишки. В кислой среде препарат разрушается, поэтому его выпускают в виде таблеток в кислотоустойчивой оболочке, растворяющейся в двенадцатиперстной кишке, или в виде капсул, содержащих покрытые такой оболочкой гранулы. При приеме пищи pH содержимого кишечника снижается, и всасывание препарата замедляется. После приема внутрь в дозе 250 мг максимальная сывороточная концентрация эритромицина достигается через 4 ч и составляет всего лишь 0,3—0,5 мкг/мл, а после приема внутрь в дозе 500 мг — 0,3—1,9 мкг/мл. Эфиры эритромицина — стеарат, эстолат и этилсукцинат — более устойчивы в кислой среде и лучше всасываются, в особенности эритромицина эстолат (прием пищи почти не влияет на его биодоступность). После приема внутрь эритромицина эстолата максимальная сывороточная концентрация достигается через 2 ч; при дозе 250 мг она составляет примерно 1,5 мкг/мл, а при дозе 500 мг —4 мкг/мл. При этом на долю неактивного эфира приходится 65—80%, то есть фактическая концентрация активного препарата примерно такая же, как и при приеме внутрь эритромицина в виде основания. Другой эфир, эритромицина этилсукцинат, тоже хорошо всасывается. После приема внутрь в дозе 500 мг максимальная сывороточная концентрация эритромицина этилсукцината достигается через 1—2 ч и составляет 1,5 мкг/мл (концентрация активного препарата — 0,5 мкг/мл).
Для в/в введения эритромицин выпускают в виде лак-тобионата и глюкогептоната. Сывороточная концентрация препарата при в/в введении выше, чем при приеме внутрь. Спустя 1 ч после введения в дозе 500—1000 мг она составляет около 10 мкг/мл.
Кларитромицин быстро всасывается после приема внутрь, но в значительной степени метаболизируется при первом прохождении через печень, поэтому его биодоступность составляет лишь 50—55%. Максимальная концентрация достигается примерно через 2 ч. Обычные (не длительного действия) препараты кларитромицина можно принимать как во время еды, так и между приемами пищи. Препарат длительного действия принимают во время еды (1 г 1 раз в сутки), чтобы увеличить биодоступность. При приеме в дозе 500 мг каждые 12 ч максимальная сывороточная концентрация в стационарном состоянии составляет 2—3 мкг/мл и достигается через 2 ч после приема (Fraschini et al., 1993). При приеме таблеток длительного действия (1 г 1 раз в сутки) эта концентрация достигается через 2—4 ч.
Азитромицин быстро всасывается после приема внутрь и проникает во все ткани и биологические жидкости, за исключением СМЖ. При одновременном приеме анта-цидных средств, содержащих гидроксид алюминия и магния, максимальная сывороточная концентрация препарата уменьшается, но биодоступность не снижается. Азитромицин не следует принимать во время еды. После приема насыщающей дозы (500 мг) максимальная сывороточная концентрация препарата составляет око-ло0,4мкг/мл. Если в дальнейшем препарат принимать в поддерживающей дозе 250 мг 1 раз в сутки в течение 4 сут, максимальная сывороточная концентрация в стационарном состоянии составит 0,24 мкг/мл. Азитромицин выпускают и для в/в введения. К концу часовой инфузии в дозе 500 мг сывороточная концентрация препарата равна 3—4 мкг/мл.
Распределение [ править | править код ]
Эритромицин легко проникает в межклеточную жидкость и проявляет антибактериальную активность во всех тканях и биологических жидкостях, за исключением головного мозга и СМЖ. В секрете предстательной железы концентрация эритромицина достигает примерно 40% сывороточной. Концентрация препарата в отделяемом из среднего уха (50% сывороточной) может оказаться недостаточной для лечения среднего отита, вызванного Haemophilus influenzae. Эритромицин на 70—80% связывается с белками плазмы, а эритромицина эстолат — на 96%. Эритромицин проникает через плаценту; его сывороточная концентрация у плода составляет примерно 5—20% сывороточной концентрации у матери. В значительном количестве (50% сывороточной концентрации) препарат обнаруживается в молоке.
Кларитромицин быстро метаболизируется при первом прохождении через печень с образованием активного метаболита, 14-гидроксикларитромицина. Оба вещества распределяются по всему организму, достигая высоких концентраций внутри клеток. Концентрации кларитромицина и его активного метаболита в тканях обычно выше, чем в сыворотке, а концентрации в отделяемом из среднего уха превышают сывороточные на 50%. Степень связывания кларитромицина с белками плазмы составляет 40—70% и зависит от сывороточной концентрации препарата.
Фармакокинетические свойства азитромицина уникальны. Он распределяется по всему организму, в высоких концентрациях присутствует в клетках (в том числе в фагоцитах). В результате концентрация препарата в тканях и биологических жидкостях оказывается намного выше, чем в сыворотке. In vivo азитромицин накапливается в фибробластах, из которых, вероятно, легко поступает в фагоциты (McDonald and Pruul, 1991). Степень связывания азитромицина с белками плазмы невелика и, по-видимому, уменьшается с ростом сывороточной концентрации (при низких концентрациях этот показатель составляет 51%).
Элиминация [ править | править код ]
В активной форме с мочой выводится лишь 2—5% принятого внутрь эритромицина; при в/в введении этот показатель увеличивается до 12—15%. Препарат накапливается в печени и в активной форме выводится с желчью, где его содержание при очень высокой сывороточной концентрации может достигать 250 мкг/мл. Т1/2 составляет примерно 1,6 ч. По некоторым данным, при анурии выведение эритромицина замедляется, но у больных с почечной недостаточностью дозу препарата обычно не снижают. При перитонеальном диализе и гемодиализе препарат выводится незначительно.
В элиминации кларитромицина участвуют почки и печень. В печени он метаболизируется с образованием нескольких метаболитов. Самый важный из них, 14-гидро-ксикларитромицин, обладает антимикробной активностью. При использовании высоких доз кларитромицина его фармакокинетика становится нелинейной, по-видимому, за счет насыщения реакций метаболизма (Chu et al., 1992). Основные пути метаболизма — стереоспеци-фическое гидроксилирование в положении 14 и окислительное N-деметилирование. In vivo при стереоспецифи-ческом гидроксилировании образуются R- и S-изомеры, причем R-изомер обладает более высокой биологической активностью и образуется в большем количестве. Т|/2 кларитромицина и 14-гидроксикларитромицина составляют соответственно 3—7 и 5—9 ч. При увеличении дозы Т1/2 растет. В неизмененном виде с мочой выводится от 20 до 40% кларитромицина, в зависимости от дозы и лекарственной формы (таблетки или суспензия для приема внутрь). Еще 10—15% приходится на долю 14-гидроксикларитромицина. При почечной и печеночной недостаточности фармакокинетика кларитромицина меняется. Тем не менее дозу снижают только при тяжелой ХПН (СКФ меньше 30 мл/мин).
Фармакокинетика азитромицина до конца не изучена. Основной путь элиминации — экскреция с желчью; часть препарата превращается в печени в неактивные метаболиты. В неизмененном виде с мочой выводится лишь 12% азитромицина. Длительный Т1/2 (40—68 ч) обусловлен накоплением и связыванием азитромицина в тканях.
Применение [ править | править код ]
В зависимости от возбудителя и тяжести инфекции доза эритромицина для приема внутрь у взрослых обычно составляет 1—2 г/сут в несколько приемов (как правило, препарат принимают каждые 6 ч). Даже в дозе 8 г/сут внутрь в течение 3 мес эритромицин переносится хорошо. По возможности эритромицин и эритромицина стеарат не следует принимать непосредственно перед едой и сразу после нее (это не касается эритромицина эстолата и эритромицина этилсукцината). У детей суточная доза для приема внутрь составляет 30—50 мг/кг в 4 приема; при тяжелых инфекциях ее можно удвоить. В/м введение не рекомендуется, так как инъекции болезненны. Препараты для в/в введения (эритромицина глюкогептонат или эритромицина лакгобионат) используют при тяжелых инфекциях, таких, как болезнь легионеров. Обычная доза — 0,5—1 г в/в каждые 6 ч. При лечении эритромицина глюкогептонатом в дозе 1 г в/в каждые 6 ч в течение 4 нед выраженных побочных эффектов не наблюдалось, за исключением тромбофлебита в месте венепункции.
Кларитромицин выпускают в виде таблеток, порошка для приготовления суспензии для приема внутрь и порошка для приготовления инъекционного раствора. Препарат обычно назначают 2 раза в сутки. При легких и среднетяжелых инфекциях у детей старше 12 лет и взрослых разовая доза составляет 250 мг. Если инфекция тяжелая (например, пневмония) или вызвана микроорганизмом, в отношении которого кларитромицин не очень активен (например, Haemophilus influenzae), разовую дозу увеличивают до 500 мг. В клинических испытаниях детям младше 12 лет назначали 7,5 мг/кг 2 раза в сутки. Таблетки длительного действия, содержащие 500 мг кларитромицина, принимают по 2 штуки 1 раз в сутки.
Азитромицин выпускают в виде таблеток, суспензии для приема внутрь и порошка для приготовления инъекционного раствора. Внутрь препарат дают за 1 ч до еды или через 2 ч после еды. При лечении внебольничной пневмонии, фарингита, инфекций кожи и подкожной клетчатки в амбулаторных условиях в первые сутки дают насыщающую дозу, 500 мг, а со 2-х по 5-е сутки — поддерживающую, 250 мг/сут. Для лечения и профилактики инфекции, вызванной Mycobacterium avium-intracellula-ге, у больных СПИДом применяют более высокие дозы. При этом влечебных целях азитромицин назначают в дозе 500 мг/сут в комбинации с одним или несколькими другими препаратами. Для первичной профилактики этой инфекции азитромицин принимают в дозе 1200 мг I раз в неделю. При неосложненном негонококковом уретрите (предположительно вызванном Chlamydia trachomatis) назначают 1 г азитромицина однократно. В дозе 2 г однократно препарат эффективен при гонорее, нос этой целью его широко не применяют (Centers for Disease Control and Prevention, 1998).
Детям азитромицин назначают в виде суспензии для приема внутрь. При остром среднем отите и пневмонии в первые сутки дают 10 мг/кг (не более 500 мг), а в последующие 4 сут — по 5 мг/кг/сут (не более 250 мг/сут). При ангине и фарингите азитромицин принимают в дозе 12 мг/кг/сут (не более 500 мг/сут) в течение 5 сут.
Микоплазменные инфекции. Эритромицин (500 мг внутрь 4 раза в сутки) снижает продолжительность лихорадки, а при мико-плазменной пневмонии способствует более быстрой нормализации рентгенологической картины (Rasch and Mogabgab, 1965). В случае непереносимости приема внутрь эритромицин вводят в/в. При микоплазменных инфекциях эффективны также другие макролиды и тетрациклины.
Болезнь легионеров. Эритромицин, который ранее был препаратом выбора при пневмонии, вызванной Legionella pneumophila Legionella micdadei и другими представителями Legionella spp,’ сейчас вытеснен азитромицином и фторхинолонами. Азитромицин высокоактивен в отношении легионелл in vitro, накапливается в тканях в больших концентрациях, чем эритромицин удобен в применении (назначается 1 раз в сутки) и лучше переносится (Stout etal., 1998; Gareyand Amsden 1999; Yu, 2000).Доза составляет 500 мг внутрь или в/в в течение 10—14 сут.
Хламидийные инфекции. Все макролиды эффективны при хла-мидийных инфекциях. Азитромицин рекомендуют использовать вместо доксициклина при неосложненном уретрите, эндоцервиците, проктите и эпидидимите (Centers for Disease Control and Prevention, 1998). Основное преимущество азитромицина-однократный прием, обеспечивающий уверенность в соблюдении предписаний врача. При хламидийных инфекциях мочевых путей и половых органов у беременных препаратом выбора служит эритромицин (500 мг 4 раза в сутки в течение 7 сут). Вместо него можно использовать азитромицин, 1 г внутрь однократно (Centers for Disease Control and Prevention, 1998). Грудным детям с хламилийной пневмонией и хламидийным конъюнктивитом назначают эритромицин (50 мг/кг/сут в 4 приемав течение 10—14 сут), поскольку тетрациклины им противопоказаны. При пневмонии, вызванной Chlamydia pneumoniae, эффективны макролиды, фторхинолоны и тетрациклины. Препараты назначают в дозах, обычно используемых для лечения внебольничной пневмонии. Сравнительные испытания не проводились. Окончательно не решен и вопрос о продолжительности лечения. Как правило, рекомендуется двухнедельный курс (Bartlett et al., 1993). Однако на практике возбудителя определяют редко и сроки терапии устанавливают эмпирически, ориентируясь на клиническую эффективность.
Дифтерия. Эритромицин позволяет искоренить Corynebacteri-um diphtheriae как у больных, так и у носителей. У взрослых при лечении эритромицина эстолатом (250 мг 4 раза в сутки в течение 7 сут) носительство удается устранить в 90% случаев. Другие макролиды тоже могут оказаться эффективными, но опыт их использования невелик, и их применение с этой целью не одобрено ФЛА. Антибиотики (в том числе и эритромицин) не влияют на течение дифтерии и не снижают риск осложнений; больным вводят противодифтерийную сыворотку.
Коклюш. Эритромицин — препарат выбора для лечения коклюша и для профилактики этого заболевания у членов семьи и других лиц, тесно контактировавших с больным. Семидневный прием эритромицина эстолата (40 мг/кг/сут, но не более 1 г/сут) не уступает по эффективности рекомендуемому обычно двухнедельному курсу лечения (Halperin et al., 1997). Кларитромицин и азитромицин, по-видимому, столь же эффективны, как и эритромицин, но опыт их применения невелик (Aoyamaetal., 19%; Васе et al., 1999). Гели лечение начато в катаральном периоде, эритромицин сокращает продолжительность заболевания. Лечение, начатое с наступлением периода спазматического кашля, почти не влияет на течение болезни, но позволяет искоренить возбудителя из носоглотки. Если на фоне антибактериальной терапии состояние больного не улучшается, показан посев материала из носоглотки, поскольку имеется сообщение об устойчивости Bordetella pertussis к эритромицину (Centers for Disease Control, 1994).
Стрептококковые инфекции. Макролиды эффективны при ангине, фарингите, скарлатине, роже и флегмоне, вызванных Streptococcus pyogenes, а также при пневмококковой пневмонии. Эти препараты назначают при тяжелой аллергии к пенициллинам. К сожалению, все чаще встречаются штаммы, устойчивые к макролидам. Как уже отмечалось, пенициллиноустойчивые штаммы Streptococcus pneumoniae нередко устойчивы и к макролидам.
Стафилококковые инфекции. Эритромицин — препарат резерва ши лечения легких инфекций, вызванных как пенициллиночувствительными, так и пенициллиноустойчивыми штаммами Staphylococcus aureus. Однако многие штаммы Staphylococcus aureus, в том числе внебольничные, устойчивы к макролидам, поэтому последние назначают только в том случае, если чувствительность возбудителя подтверждена iv vitro.
Инфекции, вызванные Campylobacter spp. При гастроэнтерите, вызванном Campylobacter jejuni, эритромицин (250—500 мг внутрь 4 раза в сутки в течение 7 сут) ускоряет исчезновение возбудителя из кала и уменьшает продолжительность заболевания (Salazar-Lindo et al., 1986). У взрослых на смену эритромицину пришли фторхинолоны, высокоактивные в отношении Campylobacter spp. и других возбудителей кишечных инфекций. Но детям по-прежнему назначают эритромицин.
Инфекция, вызванная Helicobacter pylori. При язвенной болезни на фоне инфекции, вызванной Helicobacter pylori, применяют кларитромицин (500 мг) в комбинации с омепразолом (20 мг) и амоксициллином (1 г). Препараты принимают 2 раза в сутки в течение 10—14 сут (Peterson et al., 2000). Были предложены множество других схем лечения, в том числе 7-дневных (Misiewicz et al., 1997; Hunt et al., 1999). Наиболее эффективные из них, как правило, включают 3 препарата, одним из которых является кларитромицин.
Столбняк. Эритромицин (500 мг внутрь каждые 6 ч в течение 10 сут) применяют для искоренения Clostridium tetani у больных с аллергией к пенициллинам. Однако антибактериальная терапия при столбняке играет лишь вспомогательную роль; основу лечения составляют хирургическая обработка раны, поддержание жизненно важных функций, введение противостолбнячной сыворотки и устранение судорог.
Сифилис. Прежде эритромицин применяли при раннем сифилисе у больных с аллергией к пенициллинам. Теперь вместо эритромицина назначают тетрациклины (Centers for Disease Control and Prevention, 1998). Беременным с аллергией к пенициллинам рекомендуется провести десенсибилизацию. Микобактериальные инфекции. Кларитромицин и азитромицин — препараты выбора для профилактики и лечения диссеминированной инфекции, вызванной Mycobacterium avium-in-tracellulare, у больных СП ИДом, а также для лечения вызванного этим возбудителем поражения легких у больных без ВИЧ-ин-фекции (American Thoracic Society, 1997; Kovacs and Masur, 2000). Больным СПИДом с числом лимфоцитов CD4 меньше 50 мкл’1 для первичной профилактики диссеминированной инфекции, вызванной Mycobacterium avium-intracellulare, назначают азитромицин в дозе 1200 мг 1 раз в неделю или кларитромицин в дозе 500 мг 2 раза в сутки. Для лечения и вторичной профилактики этой инфекции у больных СПИДом монотерапия непригодна. В этих случаях методом выбора служит комбинированное лечение кларитромицином (500 мг 2 раза в сутки) и этамбутолом (15 мг/кг 1 раз в сутки); иногда в дополнение к этим двум препаратам назначают рифабутин. Вместо кларитромицина можно использовать азитромицин (500 мг 1 раз в сутки), но по эффективности последний немного уступает кларитромицину (Ward et al., 1998). В сочетании с миноциклином кларитромицин применяют при лепроматозной проказе (Ji et al., 1993).
Прочие инфекции. Кларитромицином и азитромицином лечат возникшие на фоне СПИДатоксоплазменный энцефалит (Saba et al., 1993) и хронический понос, вызванный Cryptosporidium spp. (Rehg, 1991). Однако в клинических испытаниях эффективность макролидов при этих заболеваниях не доказана. Профилактика ревматизма и инфекционного эндокардита. Эритромицин применяют для вторичной профилактики ревматизма у больных с аллергией к пенициллинам. Раньше таким больным назначали эритромицин и для профилактики инфекционного эндокардита при стоматологических вмешательствах и вмешательствах на дыхательных путях. Сегодня вместо эритромицина с этой целью используют клиндамицин. Клиндамицин можно заменить азитромицином (500 мг однократно) или кларитромицином (Dajani et al., 1997).
Побочные эффекты [ править | править код ]
Эритромицин редко вызывает тяжелые побочные эффекты. Аллергические реакции включают лихорадку, эозинофилию и сыпь, которые могут наблюдаться по отдельности или в сочетании друг с другом. После отмены препарата симптомы быстро исчезают. Самый тяжелый побочный эффект — холестатиче-ский гепатит. Его вызывает в основном эритромицина эстолат, очень редко — эритромицина этилсукцинат или эритромицина стеарат (Ginsburg and Eichenwald, 1976). Заболевание начинается примерно через 10—20 сут после начала лечения с тошноты, рвоты и схваткообразной боли в животе. Боль при этом нередко такая же, как при | остром холецистите, что может послужить поводом для ненужного хирургического вмешательства. Вскоре появляется желтуха, иногда сопровождаемая лихорадкой, лейкоцитозом, эозинофилией и повышением активности аминотрансфераз. При биопсии печени обнаруживают холестаз, перипортальную инфильтрацию нейтрофи-лами, лимфоцитами и эозинофилами, а иногда и некроз гепатоцитов. Проявления гепатита редко сохраняются дольше нескольких дней после отмены препарата. Возможно, холестатический гепатит возникает в результате аллергической реакции на эритромицина эстолат (Tolman et al., 1974). Возможно небольшое повышение активности печеночных ферментов в сыворотке (McCormack et al., 1977).
При приеме внутрь, особенно в больших дозах, эритромицин часто вызывает боль в эпигастрии, иногда довольно сильную. При в/в введении тоже возможны желудочно-кишечные нарушения — схваткообразная боль в животе, тошнота, рвота, понос. Показано, что эритромицин усиливает моторику ЖКТ, связываясь с рецепторами мотилина (Smith et al., 2000). Желудочно-кишечные нарушения дозозависимы и чаще встречаются у детей и молодых людей (Seifert etal., 1989). Более длительная ин-фузия (в течение 1 ч) и предварительное назначение гликопирро-ния бромида смягчают эти симптомы (Bowler et al., 1992). В/в введение препарата в дозе 1 г, даже при разведении в большом объеме жидкости, часто сопровождается тромбофлебитом. При медленном введении риск этого осложнения снижается.
Имеются сообщения о том, что эритромицин вызывает нарушения сердечного ритма, в том числе удлинение интервала QT и, на его фоне, желудочковую тахикардию. В большинстве случаев эти нарушения возникали у больных с заболеваниями сердца либо наблюдались при назначении эритромицина одновременно с такими препаратами, как цизаприд и терфенадин (Вгап-driss et al., 1994).
Применение эритромицина в больших дозах (эритромицина глюкогептонат или эритромицина лактобионат, 4 г/сут в/в, либо большие дозы эритромицина эстолата внутрь) может сопровождаться преходящим нарушением слуха (Karmody and Weinstein, 1977).
Лекарственные взаимодействия [ править | править код ]
Эритромицин и кларитромицин взаимодействуют с другими лекарственными средствами (Periti et al., 1992). Эритромицин усиливает действие астемизола, карбамазепина, глюкокортикоидов, циклоспорина, дигоксина, алкалоидов спорыньи, терфенадина, теофиллина, триазолама, вальпроевой кислоты и варфарина, вероятно, путем ингибирования микросомальных ферментов печени, участвующих в метаболизме этих лекарственных средств (Ludden, 1985; Martell et al., 1986; Honig et al., 1992). Кларитромицин, близкий по строению к эритромицину, взаимодействует с теми же препаратами. Азитромицин, по-видимому, не вступает в лекарственные взаимодействия, так как, в отличие от эритромицина и кларитромицина, имеет в своем составе 15-членное лактонное кольцо. Тем не менее назначать азитромицин одновременно с перечисленными выше препаратами следует с осторожностью.