как принимать инсулин до еды или после еды
Инсулин
длительного и короткого действия
Для лечения диабета применяются различные формы инсулина. Для больных с впервые выявленным диабетом первого типа инсулин становится частью повседневной жизни, поскольку он критически важен для регулирования уровня сахара (глюкозы) в крови. Больным диабетом 2 типа, у которых исключительно высокий уровень инсулинорезистентности, или тем, для которых оказались неэффективны таблетки, снижающие уровень глюкозы, также понадобится вводить инсулин.
Виды инсулина обычно разделяют на четыре основные группы:
Наиболее распространенные типы инсулина — инсулин короткого действия и инсулин длительного действия — являются основными при лечении диабета. И инсулин короткого действия, и инсулин длительного действия можно также разделить на нижеследующие группы:
Инсулин короткого действия
Инсулин короткого действия, также известный как нейтральный или регулярный инсулин, обычно принимают перед едой, поскольку для попадания в кровь ему требуется 30 минут. В зависимости от Вашей реакции на инсулин терапевт и (или) Ваша команда по лечению диабета порекомендует Вам, за сколько времени до еды его необходимо принимать.
Инсулин короткого действия: основные факты
Инсулин короткого действия, как и в целом введение инсулина, используется в целях поддержания стабильного уровня сахара (глюкозы) в крови. Инсулин краткосрочного действия специально используется во время приема пищи, потому что скорость достижения им кровотока обеспечивает преобразование глюкозы, получаемой Вами из пищи, в энергию, используемую Вашими клетками. Поскольку время его введения зависит от времени приема пищи, зачастую его вводят с помощью шприц-ручек с инсулином, идеально подходящих для выполнения инъекций на ходу.
Инсулин длительного действия
Инсулин длительного действия: основные факты
Инсулин длительного действия вводится с целью обеспечить непрерывный поток инсулина на протяжении всего дня. То есть он имитирует функцию поджелудочной железы здорового человека, помогая контролировать уровень сахара в крови в периоды отсутствия пищи. Поскольку у него отсутствует период максимальной активности и он продолжает функционировать на протяжении всего дня, важно вводить его каждый день в одно и то же время. Это поможет Вам избегать потенциальных задержек поступления инсулина и предотвратить двойную активность инсулина короткого и длительного действия.
Инсулин длительного действия и ночная гипогликемия
Роль инсулина короткого и длительного действия при использовании базально-болюсного режима
Базально-болюсный режим предполагает, что больной вводит инсулин длительного действия для поддержания уровня сахара (глюкозы) в крови в периоды отсутствия пищи и инсулин короткого действия (регулярный) перед едой для предотвращения скачков уровня сахара в крови после еды. Этот метод часто используется для больных диабетом 1 и 2 типов благодаря гибкости и возможности успешного контроля диабета на протяжении продолжительного времени.
Если Вы желаете обсудить какие-либо аспекты вышеизложенных вопросов со специалистами Medtronic, свяжитесь с нами.
1 Leicestershire diabetes. (February, 2016). Getting started on insulin. Retrieved 6 February, 2016, from http://www.leicestershirediabetes.org.uk/396.html?print
2 Stephen a brunton,. (n.p.). Nocturnal Hypoglycemia: Answering the Challenge With Long-acting Insulin Analogs. Retrieved 6 February, 2016, from http://www.medscape.com/viewarticle/555414
©2017 Medtronic International Trading Sarl. Все права защищены. Контент сайта не может быть использован без разрешения компании Medtronic. MiniMed, Bolus Wizard, SMART GUARD, Enlite и Carelink являются зарегистрированными торговыми марками Medtronic, Inc.
Выбор режима инсулинотерапии при сахарном диабете 2 типа
В последние годы показания к проведению инсулинотерапии у больных сахарным диабетом (СД) 2 типа значительно расширились. По данным Британского проспективного исследования диабета (UKPDS), ежегодно 5–10% больных со впервые диагностированным
В последние годы показания к проведению инсулинотерапии у больных сахарным диабетом (СД) 2 типа значительно расширились. По данным Британского проспективного исследования диабета (UKPDS), ежегодно 5–10% больных со впервые диагностированным СД 2 типа требуется терапия инсулином [12], а спустя 10–12 лет — уже около 80% пациентов нуждаются в постоянной инсулинотерапии. С течением времени у больных СД 2 типа ухудшается гликемический контроль, обусловленный нарастающим снижением остаточной секреции β-клеток. Периферическая чувствительность к инсулину остается относительно сохранной, что определяет необходимость выбора оптимальной терапии на каждом этапе развития заболевания [4, 6, 10]. Монотерапия пероральными сахароснижающими препаратами (ПССП) обычно эффективна в первые 5–6 лет заболевания, в дальнейшем возникает необходимость использования комбинации из двух и более препаратов с различным механизмом действия, корригирующих как дефицит инсулина, так и инсулинорезистентность. В то же время лечение с помощью диеты, физических нагрузок, приема препаратов сульфонилмочевины или метформина не оказывает существенного влияния на прогрессирующее снижение секреторной функции β-клеток. По данным UKPDS, у 40% больных к моменту постановки диагноза СД 2 типа уже имеется выраженное снижение секреторной функции β-клеток. Длительность периода от дебюта СД 2 типа до назначения постоянной инсулинотерапии зависит в первую очередь от снижения функциональной активности β-клеток и усугубления инсулинорезистентности. Состояние хронической гипергликемии значительно сокращает продолжительность этого периода. У больных СД 2 типа имеется целый ряд параметров, усиливающих инсулинорезистентность: сопутствующие заболевания, применение лекарственных препаратов с отрицательным метаболическим действием, низкая физическая активность, повышение массы тела, депрессия и частые стрессы. Наряду с глюкозо- и липотоксичностью они ускоряют снижение функциональной активности β-клеток у больных СД 2 типа.
При прогрессирующем снижении остаточной секреции β-клеток, неэффективности терапии ПССП назначается инсулин, препараты которого на российском рынке представлены и зарубежными, и отечественными производителями (актрапид, протофан, хумулин, биосулин и др.), как в виде монотерапии, так и в комбинации с таблетированными сахароснижающими препаратами. В инсулинотерапии, по скромным подсчетам, нуждаются около 40% больных сахарным диабетом 2 типа, однако реально получают инсулин менее 10% больных. Анализ клинической практики лечения СД 2 типа свидетельствует о позднем начале инсулинотерапии, а также о неудовлетворительной метаболической компенсации диабета, даже на фоне инсулинотерапии (низкие дозы инсулина). Это может случиться либо по вине врача — из-за опасения прибавки веса и развития гипогликемии, либо из-за негативного отношения пациента к данному виду терапии — при отсутствии регулярного самоконтроля гликемии. Обычно инсулинотерапию назначают больным, имеющим длительное, более 10–15 лет, течение сахарного диабета и выраженные сосудистые осложнения.
Основным преимуществом инсулинотерапии как метода лечения СД 2 типа является воздействие на основные патофизиологические дефекты, присущие этому заболеванию [6, 8, 10]. В первую очередь это касается компенсации недостатка эндогенной секреции инсулина на фоне прогрессирующего снижения функции β-клеток.
Показания к инсулинотерапии у больных СД 2 типа
В последнее время врачи осознали необходимость проведения инсулинотерапии для ликвидации глюкозотоксичности и восстановления секреторной функции β-клеток при умеренной гипергликемии. На первых этапах заболевания дисфункция β-клеток носит обратимый характер и эндогенная секреция инсулина восстанавливается при снижении гликемии. Ранняя инсулинотерапия у больных СД 2 типа хотя и не является традиционной, но представляется одним из возможных вариантов медикаментозного лечения при плохом метаболическом контроле на этапе диетотерапии и физических нагрузок, минуя этап ПССП. Данный вариант наиболее оправдан у пациентов, которые предпочитают терапию инсулином использованию других сахароснижающих препаратов, пациентам с дефицитом массы тела, а также при вероятности латентного аутоиммунного диабета взрослых (LADA).
Успешное снижение гепатической продукции глюкозы при СД 2 типа требует ингибирования двух процессов: глюконеогенеза и гликогенолиза. Поскольку введение инсулина способно снизить глюконеогенез и гликогенолиз в печени и улучшить периферическую чувствительность к инсулину, появляется возможность оптимальной коррекции основных патогенетических механизмов СД 2 типа. Положительными эффектами инсулинотерапии больных сахарным диабетом 2 типа являются:
Лечение больных СД 2 типа в первую очередь направлено на достижение и длительное поддержание целевых уровней HbA1c, гликемии как натощак, так и после приема пищи, что приводит к снижению риска развития и прогрессирования сосудистых осложнений.
До начала инсулинотерапии СД 2 типа необходимо обучить больных методам самоконтроля, пересмотреть принципы диетотерапии, проинформировать пациентов о возможности развития гипогликемии и методах ее купирования [1, 4, 15]. Терапия инсулином, в зависимости от показаний, может назначаться больным СД 2 типа как на короткий, так и на длительный период времени. Кратковременная инсулинотерапия обычно используется при острых макрососудистых заболеваниях (инфаркт миокарда, инсульт, АКШ), операциях, инфекциях, обострении хронических заболеваний в связи с резким повышением потребности в инсулине в эти периоды, как правило, возникающей при отмене таблетированных сахароснижающих препаратов [7, 9, 15]. В острых ситуациях применение инсулина быстро устраняет симптомы гипергликемии и неблагоприятные последствия глюкозотоксичности.
В настоящее время отсутствуют четкие рекомендации относительно выбора начальной дозы инсулина. В основном подбор производится на основании оценки клинического состояния, с учетом суточного профиля глюкозы, массы тела больного. Потребность в инсулине зависит от инсулинсекреторной способности β-клеток, сниженной на фоне глюкозотоксичности, степени инсулинорезистентности. Пациентам с СД 2 типа и ожирением, имеющим инсулинорезистентность различной степени выраженности, для достижения метаболического контроля может потребоваться 1 и более ЕД инсулина на 1 кг массы тела в сутки. Наиболее часто назначается болюсная инсулинотерапия, когда инсулин короткого действия (или аналог человеческого инсулина) применяется несколько раз в день, возможна комбинация инсулина короткого и промежуточного действия (перед сном или два раза в день) или аналога пролонгированного инсулина (перед сном). Количество инъекций и суточная доза инсулина зависят от уровня гликемии, пищевого режима и общего состояния больного.
Временная долгосрочная инсулинотерапия (2–3 мес) назначается в следующих ситуациях [9, 13]:
В таких случаях назначаются инсулин короткого действия (2–3 раза) и пролонгированный инсулин перед сном или два раза в день под контролем гликемии, а ПССП обычно отменяются.
После устранения глюкозотоксичности, при стойкой нормализации показателей гликемии, снижении уровня HbA1c, положительной динамике в общем, соматическом статусе больного и сохранной эндогенной секреции инсулина на фоне временной инсулинотерапии, под контролем гликемии постепенно назначаются ПССП, а суточная доза инсулина медленно уменьшается. Другим вариантом является комбинированная терапия инсулином и ПССП.
При сниженной эндогенной секреции инсулина назначается монотерапия инсулином.
В лечении СД 2 типа существуют несколько вариантов терапии, как комбинированной с таблетированными препаратами, так и монотерапии инсулином. Выбор, соответственно, делается на основании клинического опыта врача, с учетом особенностей соматического статуса пациента, сопутствующих заболеваний и их медикаментозной терапии. Чаще всего при СД 2 типа применяется комбинированная терапия инсулином и таблетированными сахароснижающими препаратами, когда пероральная монотерапия не позволяет добиться адекватного контроля гликемии. Вариантами комбинированной терапии являются следующие сочетания: производные сульфонилмочевины и инсулин, меглитиниды и инсулин, бигуаниды и инсулин, тиазолидиндионы и инсулин [2, 11, 14].
К преимуществам комбинированной терапии относится лучшая мотивация пациента, быстрое устранение глюкозотоксичности, улучшение чувствительности периферических тканей к инсулину и повышение эндогенной секреции инсулина.
Положительным эффектом комбинированной терапии СД является не только достижение контроля гликемии, но и снижение суточной дозы таблетированных препаратов, возможность использования небольших доз инсулина и, соответственно, меньшая прибавка в весе [7]. Режим инсулинотерапии при комбинированном лечении может включать, в дополнение к прежней, пероральной терапии, одну инъекцию инсулина промежуточного действия перед сном, эффективно подавляющую избыточную продукцию глюкозы печенью и нормализующую гликемию натощак. По нашим, а также литературным данным, средняя потребность в инсулине при комбинированной терапии составляет 0,2–0,5 ЕД/кг массы тела у больных с нормальным весом и достигает 1 ЕД/кг массы тела и более — при избыточном весе. Необходимо соблюдать определенные этапы в проведении инсулинотерапии у больных СД 2 типа [8]. На первом этапе назначается стартовая доза в виде однократной инъекции инсулина промежуточного действия 0,2–0,3 ЕД/кг массы тела (у пожилых 0,15 ЕД/кг массы тела), в среднем 8–12 МЕ перед сном, при необходимости возможно введение инсулина перед завтраком. Следующим этапом является титрация дозы инсулина, проводимая каждые 3–4 дня, для достижения индивидуальных параметров метаболического контроля. Рекомендуется при гликемии натощак более 10,0 ммоль/л увеличить дозу на 6–8 МЕ инсулина, при гликемии более 8,0 ммоль/л — на 4–6 МЕ, а при гликемии более 6,5 ммоль/л — на 2 МЕ. Продолжительность периода титрования обычно составляет 6–12 нед, в это время регулярно оценивается динамика веса, при отрицательной динамике уменьшается калорийность рациона и, по возможности, увеличиваются физические нагрузки. Если однократное введение инсулина не обеспечивает адекватного гликемического контроля, можно рекомендовать двукратное введение пролонгированного инсулина или готовые смеси инсулинов в режиме двух- или трехкратного введения [14]. На следующем этапе определяется тактика дальнейшего лечения, отмена инсулинотерапии и монотерапия ПССП или продолжение комбинированной терапии. При неудовлетворительном метаболическом контроле, увеличении суточной дозы инсулина более 30–40 ЕД показана монотерапия инсулином.
Монотерапия инсулином у больных СД 2 типа проводится как в режиме традиционной инсулинотерапии, так и интенсифицированной инсулинотерапии (базис-болюсной). Значительный прогресс диабетологии связан с широким арсеналом различных видов инсулина, и практикующие врачи имеют возможность выбирать лечение, идя навстречу потребностям и возможностям пациента. В лечении СД 2 типа применимы любые режимы инсулинотерапии, позволяющие успешно контролировать гипергликемию и избежать нежелательной гипогликемии.
Возможные варианты режимов инсулинотерапии
Наиболее важная составляющая инсулинотерапии — это применение адекватных доз инсулина, обеспечивающих достижение и длительное поддержание целевых уровней гликемии, а не выбор того или иного варианта режима терапии.
Преимуществом инсулина по сравнению с ПССП является то, что ранняя инсулинотерапия у больных СД 2 типа лучше сохраняет эндогенную секрецию инсулина и обеспечивает более полный метаболический контроль (таблица).
Самым эффективным прандиальным регулятором является инсулин короткого действия. Подкожное введение препаратов инсулина короткого действия перед приемом пищи позволяет предупредить резкий подъем уровня глюкозы после еды.
Значительное снижение эндогенной секреции инсулина на протяжении СД 2 типа при неэффективности других, раннее применяемых режимов инсулинотерапии, требует необходимости базис-болюсной инсулинотерапии. Режим интенсивной инсулинотерапии возможен только у пациентов с сохранным интеллектом, без выраженных когнитивных нарушений, после соответствующего обучения и при условии регулярного мониторирования гликемии в течение суток, в том числе обязательного мониторирования в 3 ч ночи [14]. Интенсифицированная инсулинотерапия не показана больным, перенесшим инфаркт миокарда, острое нарушение мозгового кровообращения, а также лицам с нестабильной формой стенокардии [7, 9].
Выше мы уже упоминали о пересмотре показаний к инсулинотерапии при СД 2 типа, точнее говоря, о необходимости их расширения. Как правило, необходимость в инсулинотерапии прямо пропорциональна длительности диабета; по некоторым данным, через 10–12 лет после дебюта заболевания в подобном лечении нуждаются почти 80% больных. Многие пациенты, нуждающиеся в инсулинотерапии, но не являющиеся кандидатами на проведение интенсивной инсулинотерапии, могут достичь хорошей компенсации благодаря двухразовой базис-болюсной схеме.
В подобных случаях следует отдавать предпочтение готовой смеси инсулина в пропорции 30 : 70. Использование подобной готовой смеси инсулина обеспечивает рациональную и «физиологическую» пропорцию инсулина короткого действия (1 : 3) и средней продолжительности действия (2 : 3), которая покрывает потребность как в «болюсном», так и «базисном» инсулине у больных СД 2 типа.
Использование готовой смеси в пропорции 30 : 70, вводимой с помощью щприц-ручки, представляется рациональным, особенно для пожилых пациентов с СД 2 типа. Такой инсулин обладает преимуществом перед базисным инсулином, так как лечения только базальным инсулином, при отсутствии короткого, недостаточно для эффективного контроля гликемии после приема пищи. Терапия готовыми смесями в пропорции 30 : 70 начинается с суточной дозы 0,4–0,6 ЕД/кг массы тела, обычно разделенной поровну на 2 инъекции — перед завтраком и ужином, у части пациентов 2 : 3 суточной дозы назначается перед завтраком и 1 : 3 — перед ужином. Далее доза инсулина при необходимости постепенно увеличивается каждые 2–4 дня на 4–6 ЕД, до достижения целевых уровней контроля.
Побочные эффекты инсулинотерапии включают прибавку в весе, что также характерно для всех сахароснижающих препаратов, за исключением метформина, и гипогликемии. Повышение массы тела, наблюдаемое у больных СД 2 типа, находящихся на инсулинотерапии, обусловлено в первую очередь устранением последствий хронической гипергликемии: глюкозурии, дегидратации, энергозатрат. Среди других причин — восстановление положительного азотистого баланса, а также повышение аппетита. В начале терапии потребность в более высокой дозе инсулина у части больных обусловлена выраженной инсулинорезистентностью. Методы профилактики увеличения массы тела у больных СД 2 типа, находящихся на инсулинотерапии, включают обучение пациентов, ведение пищевого дневника, снижение калорийности рациона, ограничение употребления поваренной соли и повышение физической активности.
Значительным преимуществом в плане ограничения увеличения массы тела у больных СД типа 2 с избыточным весом обладает комбинированная терапия инсулином и метформином, для которой характерны не только дополнительное снижение гликемии натощак, но и уменьшение потребности в экзогенном инсулине (17–30%), а также низкий риск гипогликемий, липопротективный эффект.
Тяжелые гипогликемии отмечаются значительно реже у больных СД 2 типа, находящихся на инсулинотерапии, в сравнении с пациентами на интенсивной инсулинотерапии при СД 1 типа. Они гораздо чаще возникают и в ряде случаев имеют рецидивирующее течение при лечении СД 2 типа некоторыми производными сульфонилмочевины длительного действия, нежели при терапии инсулином.
Главным критерием адекватности дозы инсулина у больных СД 2 типа является уровень гликемии. В начале инсулинотерапии для достижения компенсации СД могут потребоваться бoльшие дозы инсулина, что в основном обусловлено снижением чувствительности к инсулину вследствие хронической гипергликемии и инсулинорезистентностью. При достижении нормогликемии потребность в инсулине уменьшается.
Основными параметрами метаболического контроля СД 2 типа являются показатели гликемии натощак и после приема пищи, уровень HbA1c. Согласно Федеральной целевой программе «Сахарный диабет», основной целью инсулинотерапии при СД 2 типа является достижение следующих параметров: гликемии натощак— ≤6,5 ммоль/л, гликемии через 2 ч после еды —
А. М. Мкртумян, доктор медицинских наук, профессор
Е. В. Бирюкова, кандидат медицинских наук, доцент
Н. В. Маркина
МГМСУ, Москва
Современная инсулинотерапия сахарного диабета 1 типа у детей и подростков
Сахарный диабет 1 типа (СД 1 типа), называвшийся до недавнего времени инсулинозависимым, а еще раньше — ювенильным сахарным диабетом, поражает в основном людей молодого возраста и детей. В последние годы наблюдается
Сахарный диабет 1 типа (СД 1 типа), называвшийся до недавнего времени инсулинозависимым, а еще раньше — ювенильным сахарным диабетом, поражает в основном людей молодого возраста и детей. В последние годы наблюдается всплеск заболеваемости сахарным диабетом 1 типа, наиболее выраженный у детей и подростков. За 25 лет заболеваемость СД 1 типа среди детей московской популяции выросла в два раза. В настоящее время в Москве насчитывается около 1200 детей с СД в возрасте до 15 лет.
СД 1 типа относится к аутоиммунным заболеваниям, при которых в результате процессов аутоагрессии против β-клеток островков поджелудочной железы происходит их разрушение. После гибели более 85% β-клеток развивается абсолютная инсулиновая недостаточность, в результате которой появляются гипергликемия и другие метаболические нарушения. С начала промышленного выпуска препаратов инсулина после успешных опытов Бантинга и Беста на панкреатэктомированных собаках и по настоящее время инсулин — основное и единственное средство лечения СД 1 типа. Прошло более 80 лет с начала клинического применения инсулина. Инсулинотерапия за это время претерпела большие изменения, связанные с улучшением качества инсулина и совершенствованием схем введения препарата.
Лечение СД 1 типа состоит из нескольких компонентов:
Основная цель современной инсулинотерапии — поддержание состояния углеводного обмена, близкого к тому, которое имеется у здорового человека. Постоянная гипергликемия вызывает развитие и прогрессирование специфических осложнений: диабетической нефро-, ретино- и нейропатии, что приводит к повышенной инвалидизации и преждевременной смертности пациентов. В связи с этим, учитывая важную роль адекватной инсулинотерапии в профилактике сосудистых осложнений, при разработке новых препаратов и схем лечения СД необходимо стремиться к сохранению углеводного обмена и поддержанию его в пределах показателей, соответствующих нормальным, в течение длительного времени.
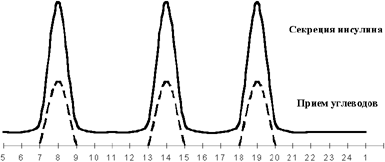 |
| Рисунок 1. Физиологическая секреция инсулина в норме. |
В физиологических условиях секреция инсулина происходит в два этапа (см. рисунок 1): поджелудочная железа секретирует инсулин постоянно (базальная инсулинемия), а в ответ на соответствующие стимулы (посталиментарная гипергликемия, или гипергликемия, вызванная действием контринсулярных гормонов) повышает секрецию инсулина. При этом нормогликемия в здоровом организме обеспечивается быстрой адекватной секрецией инсулина, а также коротким периодом полужизни (около 4 мин) циркулирующего в крови инсулина. Печень принимает активное участие в поддержании гомеостаза глюкозы, депонируя ее в виде гликогена после еды и выделяя вновь в кровь из депо путем активизации процесса гликогенолиза в перерывах между приемами пищи. При этом очень важно, что инсулин из поджелудочной железы поступает в систему воротной вены и далее — в печень — главный орган-мишень, где он наполовину инактивируется, участвуя в превращении глюкозы в гликоген. Остающиеся 50% инсулина через большой круг кровообращения попадают к периферическим органам и тканям. Именно более высокий уровень инсулина в портальной системе, по сравнению с периферической циркуляцией, обеспечивает активное депонирование глюкозы в печени на фоне других инсулинзависимых органов.
У больных диабетом введенный экзогенный инсулин из подкожного депо медленно всасывается в общий кровоток, где концентрация его длительно остается нефизиологично высокой. В результате у пациентов с сахарным диабетом наблюдаются более высокая, чем у здоровых, посталиментарная гипергликемия и склонность к гипогликемии в более поздние часы. Поэтому больные сахарным диабетом должны приспосабливать свой режим жизни к профилю действия вводимого инсулина. Неизбежное возникновение стрессовых ситуаций требует дополнительной коррекции дозы экзогенного инсулина. Кроме того, из общего кровотока инсулин одновременно поступает в печень и другие органы-мишени. В результате гликоген депонируется в первую очередь в мышечной ткани, а запасы в печени его постепенно снижаются. Это является одной из причин развития гипогликемий, так как мышечный гликоген не участвует в поддержании нормогликемии. Добиться физиологического соотношения концентрации гормона в портальной системе и на периферии при современных методах введения экзогенного инсулина невозможно, и это одна из наиболее сложных проблем заместительной инсулинотерапии.
Тем не менее с совершенствованием методов инсулинотерапии появилась возможность максимально приблизить показатели углеводного обмена к таковым у здоровых людей у ряда больных СД 1 типа. И процент таких больных постепенно увеличивается по мере совершенствования методов компенсации заболевания. В последнее время убедительно доказано, что только хорошая компенсация сахарного диабета может служить надежным средством профилактики специфических осложнений. В связи с этим Всемирной организацией здравоохранения были разработаны новые целевые уровни показателей углеводного обмена, к которым врачи-практики вместе со своими больными должны стремиться. Оценка степени компенсации СД 1 типа основывается на клинических (нормальное физическое и половое развитие, отсутствие осложнений) и лабораторных показателях углеводного (гликемия, глюкозурия, гликированный гемоглобин) и жирового (холестерин, триглицериды, липопротеины) обмена. Соглашение по основным принципам лечения детей и подростков с СД 1 типа (ISPAD Consensus for the Management of Type 1 Diabetes Mellitus in Children and Adolescens, 2000) рекомендует следующие критерии эффективности инсулинотерапии:
У детей в возрасте до шести лет с учетом отрицательного влияния гипогликемий на развитие мозга эти показатели должны быть на верхней границе или несколько выше. В отношении гликированного гемоглобина рекомендуется, чтобы концентрация его была приближена к норме насколько это возможно, однако риск развития тяжелых гипогликемий при этом должен быть сведен к абсолютному минимуму.
Инсулины, применяемые в детской практике
Современные препараты инсулина в зависимости от происхождения разделяют на две группы — животные и человеческие (полусинтетический и биосинтетический инсулины). На протяжении 80 лет для лечения СД применяли говяжий и свиной инсулины, которые по составу отличаются от человеческого на три и одну аминокислоты соответственно. При этом иммуногенность максимально выражена у говяжьих инсулинов, минимальная, естественно, — у человеческих. Человеческие инсулины стали применяться два последних десятилетия и буквально произвели революцию в методах лечения больных диабетом.
При получении человеческого инсулина полусинтетическим методом производится замена аминокислоты аланина в 30-й позиции В-цепи свиного инсулина на треонин, находящийся в этом положении в человеческом инсулине. В полусинтетическом инсулине присутствуют в небольшом количестве примеси соматостатина, глюкагона, панкреатических полипептидов, имевшиеся в свином инсулине, который является субстратом для производства данного вида человеческого инсулина. Биосинтетический инсулин не имеет этих примесей и обладает меньшей иммуногенностью. При его производстве в клетку пекарских дрожжей или E.coli генно-инженерным способом вводится рекомбинантная ДНК, содержащая ген человеческого инсулина. В результате дрожжи либо бактерии начинают синтезировать человеческий инсулин. Человеческие генно-инженерные инсулины представляют собой более прогрессивную форму и должны рассматриваться как препараты первого ряда при выборе способа лечения. В России у детей и подростков в последние годы рекомендованы к применению только человеческие генно-инженерные инсулины.
Современные генно-инженерные инсулины различаются по длительности действия:
Их фармакокинетические характеристики представлены в таблице 1.
Последнее десятилетие открыло новую эру в инсулинотерапии: речь идет о получении аналогов человеческих инсулинов с новыми фармакокинетическими свойствами. К ним относятся инсулины ультракороткого действия (хумалог и новоРапид) и продленные беспиковые аналоги человеческого инсулина (детемир и лантус).
Особое место в лечении сахарного диабета в детском и подростковом возрасте занимают инсулины ультракороткого действия — хумалог и новоРапид. Получают беспиковые аналоги инсулина путем замены аминокислот, отвечающих за процессы самоассоциации молекул инсулина, что приводит к ускорению процессов их всасывания из подкожного депо. Так, хумалог был получен путем взаимного изменения положения аминокислот пролин и лизин в 28-й и 29-й положениях в В-цепи, новоРапид — путем замены аминокислоты пролин в том же 28-м положении на аспарагин. Это не изменило биологической активности инсулинов, но привело к полезному изменению его фармакокинетических свойств. При подкожном введении хумалог и новоРапид имеют более быстрое начало и пик действия, параллельные уровню посталиментарной гипергликемии, и меньшую продолжительность, что дает возможность вводить эти препараты непосредственно перед приемом пищи, избегая (при желании) частых перекусов. При использовании аналогов человеческих инсулинов повышаются возможности в компенсации углеводного обмена, что выражается в уменьшении показателей гликированного гемоглобина, и снижается частота тяжелых гипогликемий.
Самым последним достижением в области инсулинотерапии стало введение в клиническую практику инсулина лантус, который является первым беспиковым аналогом человеческого инсулина 24-часового действия. Получен путем замены аминокислоты аспарагин на глицин в 21-м положении А-цепи и добавления двух аминокислот аргинина к концевой аминокислоте в Б-цепи. Результатом явилось изменение рН раствора инсулина после введения его в подкожно-жировую клетчатку с 4,0 до 7,4, что вызывает образование микропреципитатов, замедляющих скорость всасывания инсулина и обеспечивающих его постоянный и стабильный уровень в крови в течение 24 ч.
Лантус может вводиться в любое время суток, у подростков — предпочтительнее в вечерние часы. Начальная его доза составляет 80% от суммарной суточной дозы пролонгированного инсулина. Дальнейшая титровка дозы проводится по показателям сахара крови натощак и в ночные часы. Уровень гликемии после завтрака, в дневные и вечерние часы регулируется инсулином короткого или ультракороткого действия. Назначение лантуса позволяет избежать дополнительных инъекций короткого инсулина в ранние утренние часы у большинства подростков с феноменом «утренней зари», вызывает достоверное снижение утренней гликемии, а также уменьшает лабильность углеводного обмена у многих больных.
Инсулин детемир также является беспиковым аналогом продленного действия, пролонгирующий эффект которого был достигнут благодаря присоединению цепочки из 14 остатков жирных кислот в 29-й позиции В-цепи. Детемир вводится дважды в сутки.
В состав смешанных инсулинов входит инсулин средней продолжительности и короткого действия в различных соотношениях — от 90 к 10 до 50 к 50. Смешанные инсулины более удобны, поскольку их применение позволяет уменьшить количество инъекций, проводимых с помощью шприц-ручек. Однако в детской практике они не нашли широкого применения в связи с необходимостью у многих больных достаточно часто изменять дозу короткого инсулина в зависимости от показателей гликемии. Тем не менее при стабильном течении сахарного диабета (особенно в первые годы заболевания) с помощью смешанного инсулина возможно достижение хорошей компенсации.
Режимы инсулинотерапии
Имеющиеся общие рекомендации по режиму инсулинотерапии являются только основой для разработки индивидуального режима, который должен учитывать физиологические потребности и сложившийся образ жизни каждого ребенка.
Наибольшее распространение в настоящее время получила интенсифицированная (или базисно-болюсная) схема, которая заключается во введении короткого инсулина перед каждым основным приемом пищи и пролонгированного инсулина от одного до трех раз в сутки (см. рисунок 2). Наиболее часто пролонгированный инсулин вводится дважды — в вечерние и утренние часы. При этом предпринимаются попытки имитировать с помощью продленного инсулина базальную секрецию, а с помощью инсулина короткого действия посталиментарную секрецию.
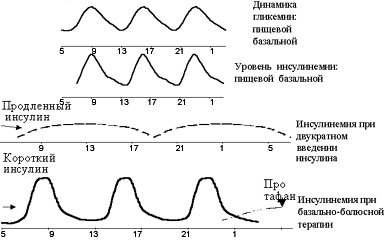 |
| Рисунок 2. Графическое обоснование базисно-болюсного принципа инсулинотерапии. |
Введение третьей инъекции пролонгированного инсулина получило название оптимизации базальной инсулинотерапии. Вопрос о необходимости и времени введения третьей инъекции решается на основании показаний гликемического профиля. Если гликемия повышается перед ужином при ее нормальных показателях через 1,5-2 ч после обеда, вводится дополнительная инъекция продленного инсулина перед обедом (см. рисунки 3, 4). Как правило, такая ситуация возникает при позднем (в 19.00-20.00) ужине. При раннем ужине (в 18.00) и введении второй инъекции пролонгированного инсулина перед сном гипергликемия нередко наблюдается в 23.00. В этой ситуации хороший эффект дает назначение дополнительной инъекции продленного инсулина перед ужином.
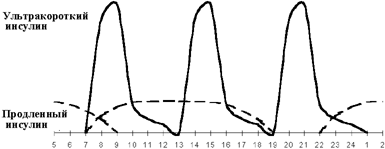 |
| Рисунок 3. Интенсифицированная инсулинотерапия. |
Такая схема позволяет в какой-то степени приблизиться к физиологической секреции инсулина у здоровых людей. Кроме того, она дает возможность расширить режим жизни и питания больного сахарным диабетом. Психологическим недостатком ее является необходимость частых инъекций и частого контроля гликемии, однако это нивелируется в настоящее время благодаря современным технологическим достижениям (удобные шприц-ручки с атравматичными иглами и глюкометры с автоматами для безболезненного прокалывания пальца). Учащение эпизодов гипогликемических реакций, которое вменяют иногда «в вину» интенсифицированной инсулинотерапии, является не столько следствием применяемой схемы, сколько результатом стремления врачей достичь нормогликемии. При решении данного вопроса всегда следует искать компромисс, стремясь поддержать тот минимальный уровень гликемии, который не вызывает частых гипогликемических реакций. Этот уровень гликемии для каждого ребенка достаточно индивидуален.
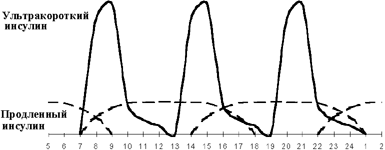 |
| Рисунок 4. Оптимизация интенсифицированной инсулинотерапии. |
У детей первых двух лет жизни интенсифицированная схема применяется реже.
Традиционная схема инсулинотерапии заключается во введении инсулина короткого и пролонгированного действия два раза в сутки — перед завтраком и ужином. Применение ее возможно у ряда детей в первые один-два года заболевания, редко при большей длительности сахарного диабета (см. рисунок 5).
 |
| Рисунок 5. Традиционная схема инсулинотерапии. |
Если небольшая доза короткого инсулина вводится перед обедом, такая схема может быть искусственно продлена на некоторое время путем увеличения дозы продленного инсулина перед завтраком и небольшого перераспределения в питании (перенос одной-двух хлебных единиц с обеда на второй завтрак).
 |
| Рисунок 6. Нетрадиционные схемы инсулинотерапии. |
Кроме того, существует ряд нетрадиционных схем (см. рисунок 6):
Эти схемы иногда используются у больных с небольшим сроком заболевания сахарным диабетом при частичной сохранности функции β-клеток.
В любом случае выбор схемы инсулинотерапии определяется не столько желанием врача или семьи больного, сколько оптимальным профилем введения инсулина, который обеспечивает компенсацию углеводного обмена.
Доза инсулина
В детском возрасте потребность в инсулине, рассчитанная на 1 кг веса, нередко выше, чем у взрослых, что обусловлено большей скоростью аутоиммунных процессов, а также активным ростом ребенка и высоким уровнем контринсулярных гормонов в период полового созревания. Доза инсулина изменяется в зависимости от возраста и длительности заболевания.
В первые один-два года с момента начала заболевания потребность в инсулине составляет в среднем 0,5-0,6 ЕД/кг массы тела. В 40–50% в первые месяцы наблюдается частичная ремиссия заболевания, когда после достижения компенсации углеводного обмена потребность в инсулине снижается до минимальной — 0,1-0,2 ЕД/кг массы, а у некоторых детей даже при полной отмене инсулина при соблюдении диеты удается поддерживать нормогликемию. (Наступление ремиссии тем более вероятно, чем раньше установлен диагноз диабета и начата инсулинотерапия, чем выше качество вводимого инсулина и чем лучшей компенсации углеводного обмена удается достичь.)
Через пять лет от момента заболевания диабетом у большинства больных β-клетки полностью прекращают функционировать. При этом потребность в инсулине обычно повышается до 1 ЕД/кг массы. В период полового созревания она вырастает еще больше, достигая у многих подростков 1,5, иногда 2 ЕД/кг. В последующем доза инсулина снижается в среднем до 1 ЕД/кг. После длительной декомпенсации сахарного диабета потребность в инсулине может достигать 2-2,5, иногда 3 ЕД/кг с последующем снижением дозы, в отдельных случаях вплоть до исходной.
Соотношение пролонгированного и короткого инсулина сдвигается: от преобладания пролонгированного инсулина у детей первых лет жизни к преобладанию короткого инсулина у подростков (см. таблицу 2).
Как и у взрослых, у детей на одну хлебную единицу в утренние часы требуется несколько больше инсулина, чем в обед и в ужин.
Следует подчеркнуть, что это лишь общие закономерности, у каждого ребенка потребность в инсулине и соотношение инсулинов различной длительности имеют свои индивидуальные особенности.
Осложнения инсулинотерапии
Перспективы совершенствования инсулинотерапии в России
Внедрение аналогов человеческих инсулинов расширяет возможности достижения компенсации, улучшения течения заболевания у детей и подростков с сахарным диабетом.
Инсулиновые помпы, в течение ряда лет применяемые за рубежом, сегодня появились и на отечественном рынке, однако применение их ограничено из-за высокой стоимости.
В настоящее время за рубежом ведутся исследования, посвященные эффективности и безопасности применения ингаляционных видов инсулина, с которыми связана надежда на возможность отказа от постоянных введений короткого инсулина перед приемами пищи.
Вопрос о клиническом использовании трансплантации островковых клеток останется открытым до тех пор, пока не будут найдены средства защиты пересаженных клеток от того же аутоиммунного процесса, который поражает собственные β-клетки. В настоящее время трансплантация β-клеток за рубежом осуществляется только у больных с развившейся хронической почечной недостаточностью, одновременно с трансплантацией почки и назначением иммунодепрессантов. Все остальные работы по трансплантации носят исследовательский характер и производятся на добровольцах. Однако канадским исследователям удалось получить первые обнадеживающие результаты.
В. А. Петеркова, доктор медицинских наук, профессор
Т. Л. Кураева, доктор медицинских наук
Е. В. Титович, кандидат медицинских наук
Институт детской эндокринологии ГУ ЭНЦ РАМН, Москва
