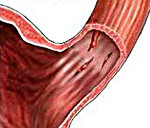
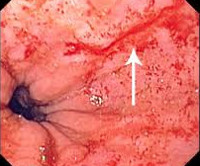
Что такое желудочно пищеводный разрывно геморрагический синдром
Желудочно-пищеводный разрывно-геморрагический синдром
Рубрика МКБ-10: K22.6
Содержание
Определение и общие сведения [ править ]
Кровотечения из верхних отделов ЖКТ представляют собой сложную проблему экстренной хирургии. Заболевания, которые приводят к этому грозному осложнению, весьма разнообразны. Острая кровопотеря реально угрожает жизни больных, а их судьба зависит от того, насколько быстро будет поставлен правильный диагноз и насколько быстрой и адекватной окажется лечебная помощь.
Примерно по 10% приходится на долю желудочно-кишечных кровотечений, обусловленных синдромом Маллори-Вейсса и ПГ (портальная гипертензия).
Этиология и патогенез [ править ]
Клинические проявления [ править ]
Для синдрома Маллори-Вейсса характерна рвота малоизмененной кровью при выявлении в анамнезе эпизода повышения давления в желудке (рвота, надсадный кашель, поднятие тяжестей и т. п.).
Желудочно-пищеводный разрывно-геморрагический синдром: Диагностика [ править ]
Данные анамнеза для оценки объёма перенесённой кровопотери имеют относительное значение. Диагностическую ценность представляют в основном определение длительности кровотечения и выявление клинических признаков острой кровопотери (слабость, головокружение, сердцебиение и др.). Тем не менее наличие в анамнезе коллапса, как правило, указывает на тяжёлую степень перенесённой кровопотери.
Алгоритм действий хирурга при подозрении на кровотечение Всем больным с кровотечением из верхних отделов ЖКТ выполняют: измерение АД и ЧСС; установку желудочного зонда; пальцевое исследование прямой кишки; общий анализ крови; определение группы крови, резус-фактора; проведение ЭГДС; ЭКГ. В зависимости от выраженности симптоматики и тяжести состояния всех пациентов разделяются на две основные группы.
Критерии отнесения к группе «тяжёлое кровотечение»:
• возраст старше 60 лет;
• неоднократная рвота малоизменённой кровью, или «кофейной гущей», и/или повторная мелена;
• коллапс, потеря сознания;
• тахикардия (ЧСС >100 в минуту);
• гипотензия (систолическое АД Дифференциальный диагноз [ править ]
Желудочно-пищеводный разрывно-геморрагический синдром: Лечение [ править ]
Современный подход к лечению кровотечений из верхних отделов ЖКТ должен быть комплексным и включать в себя различные методы эндоскопического гемостаза в сочетании с адекватной инфузионно-трансфузионной терапией, направленной на восполнение кровопотери, объёма ОЦК и стабилизацию гемодинамики.
Эндоскопический гемостаз показан при синдроме Маллори-Вейсса в случаях продолжающегося кровотечения.
Методы эндоскопического гемостаза:
• инъекционный (воздействие гемостатическими и сосудосуживающими средствами, например раствором адреналина);
• диатермокоагуляция (моно- и биполярная);
• клипирование (в том числе «триклип»);
• использование клеевых композиций;
Инъекционный метод в качестве монотерапии неэффективен. Методом выбора является комбинированный эндоскопический гемостаз: инъекционный метод + диатермокоагуляция (либо аргоно-плазменная коагуляция) или клипирование + клеевые композиции. Выбор метода эндоскопического гемостаза определяется возможностями лечебного учреждения и квалификацией врача-эндоскописта. Различают следующий характер гемостаза при эндоскопии: окончательный; временный; стойкий; нестойкий.
Проведение гемотрансфузии показано при уровне гемоглобина менее 90 г/л. При дефиците факторов свёртывания крови показано переливание свежезамороженной плазмы. В случае гипоксии необходима кислородотерапия. Для временного поддержания доставки О2 тканям можно использовать перфторан, внелёгочную оксигенацию. ИВЛ может оказаться необходимой при нестабильной гемодинамике, гипоксии и нарушении сознания.
Вазопрессоры показаны при недостаточной эффективности инфузионно-трансфузионной терапии. Использование их с дофамином улучшает почечный и мезентериальный кровоток. Рекомендовано применение антиоксидантов (реамберин, мексидол, орготеин, аллопуринол). Введение серотонина рекомендовано для улучшения периферического кровообращения и местного гемостаза. Критерием восстановления микроциркуляции следует считать восстановление гемодинамики и почасового диуреза.
Хирургическое лечение синдрома Маллори-Вейсса показано больным, у которых при эзофагогастроскопии обнаруживают массивное кровотечение и гемостатическая терапия, в том числе попытки повторного эндоскопического гемостаза, не дают положительного результата. В большинстве случаев хирургическое вмешательство сводится к ушиванию разрыва 8-образными швами из нерассасывающегося материала. При наличии множественных разрывов, резком воспалительном процессе и обширной гематоме иногда одного ушивания бывает недостаточно для надёжной остановки кровотечения. В таком случае рекомендуют дополнительно перевязывать левую желудочную артерию. В ряде случаев возможно выполнение селективной ангиографии и эмболизации сосудов кардии.
Профилактика [ править ]
Прочее [ править ]
Возможности современных консервативных и оперативных методов диагностики и лечения позволяют эффективно останавливать любое язвенное кровотечение и добиваться надёжной профилактики его рецидива. После оценки ближайших результатов оперативного лечения пациент, находящийся на диспансерном наблюдении, должен через 2-3 мес быть передан врачу-гастроэнтерологу. Прогноз рецидива заболевания зависит не только от успеха и своевременности проведённого оперативного вмешательства, но и от преемственности медицинской помощи на всех этапах спланированного курса консервативного лечения, включающего антисекреторную и эрадикационную терапию.
Что такое желудочно пищеводный разрывно геморрагический синдром
КЛИНИЧЕСКИЙ СЛУЧАЙ РАЗВИТИЯ СИНДРОМА
МЭЛЛОРИ-ВЕЙССА НА ФОНЕ ОСТРОЙ
Стяжкина С.Н., Шубина К.М., Камалова Н.Р.
ФГБОУ ВО «Ижевская государственная медицинская академия»
Синдром Мэллори – Вейсса занимает до 26,6% среди причин кровотечений из верхних отделов пищеварительного тракта, а по данным патологоанатомических исследований в 1,16% является причиной смерти [1, с. 26].
СМВ часто возникает на фоне тяжелых сопутствующих заболеваниях печени, диафрагмы, сердца, сосудов, злоупотребления алкоголем (в клинических условиях до 58% с развитием синдрома взаимного отягощения), а при летальных исходах указанные заболевания до 90% выявляются в стадии декомпенсации [1, с. 26].
В этиологии и патогенезе синдрома Мэллори – Вейсса много неясных вопросов, вместе с тем, большинство специалистов признают, что основной реализующей причиной острых разрывов слизистой оболочки пищеводно- желудочного перехода является внезапное повышение внутрибрюшного и внутрижелудочного давления с возникновением дисфункции кардиального и пилорического жомов, возникающей последующей рвотой [2, с. 207].
Показаний для оперативного лечения нет.
С 11 февраля 2018 общее состояние на фоне произведённой терапии улучшилось. Рвота и тяжесть в эпигастральной области исчезли.
14 февраля 2018 отменена гемостатическая терапия по причине отсутствия данных о кровотечении.
Пациент выписался спустя 6 суток в связи с улучшением состояния здоровья. Прогноз на жизнь и трудоспособность благоприятный. Отсутствие рецидивов при соблюдении рекомендаций: отказ от приема алкогольных напитков, предупреждение развития частой и длительной рвоты, причиной которой зачастую служит алкогольная интоксикация, ранняя диагностика и своевременное лечение заболеваний желудочно-кишечного тракта, которые могут сопровождаться тошнотой и рвотой.
1. Тимербулатов Ш. В., Тимербулатов В. М., Мустафин Т.И., Ямалов Р.А. Этиопатогенетические аспекты синдрома Мэллори – Вейсса // Клиническая медицина. 2010.- с. 24-27.
2. Гарелик П.В., Полынский А. А., Дубровщик О. И. Синдром Меллори – Вейсса и эрозивно – геморрагический гастрит как причина острых кровотечений из верхних отделов желудочно – кишечного тракта // журнал ГрГМУ 2009 № 2.- с.206-209.
3. Е. Ф. Чередников, Ю. В. Малеев, А. В. Черных, Т. Е. Литовкина, Е. Е. Чередников, А. Н. Шевцов СОВРЕМЕННЫЕ ВЗГЛЯДЫ НА ЭТИОЛОГИЮ И ПАТОГЕНЕЗ РАЗРЫВНО – ГЕМОРРАГИЧЕСКОГО СИНДРОМА (СИНДРОМА МЕЛЛОРИ – ВЕЙССА) // Журнал анатомии и гистопатологии. – 2016. – Т. 5, №1.- с.86- 98.
Сведения об авторах:
THE CLINICAL CASE OF THE DEVELOPMENT OF MALLORY-WEISS SYNDROME ON THE BACKGROUND OF ACUTE ALCOHOL INTOXICATION
Styazhkina S.N., Shubina K.M. Kamalova N.R.
1. Timerbulatov Sh. V., Timerbulatov V. M., Mustafin T. I., Yamalov R. A. Etiopathogenetic aspects of Mallory – Weiss syndrome // Clinical medicine. 2010.- p. 24-27.
2. Garelik P. V., Polynsky A. A., Dubrovnik O. I. mellory – Weiss Syndrome and erosive – hemorrhagic gastritis as a cause of acute bleeding from the upper gastrointestinal tract // journal of Grgmu 2009 №2.- p. 206-209.
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10
Общие сведения
Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.
Причины синдрома Меллори-Вейса
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
Систематизация клинических форм синдрома Меллори-Вейса основана на протяженности и глубине дефектов оболочек поврежденных органов, от размеров которых напрямую зависит тяжесть патологии. Разрывы бывают малыми (до 1 см) — наиболее частый вариант повреждения, выявляемый у 88-90% пациентов, средними (1-3 см), большими (более 3 см). С учетом глубины деструкции стенки пораженного отдела ЖКТ специалисты в сфере гастроэнтерологии и общей хирургии различают 4 стадии гастроэзофагеального разрывного синдрома:
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
Острые желудочно-кишечные кровотечения (клиника, диагностика, терапия)
Синдром желудочно-кишечного кровотечения осложняет течение многих заболеваний пищеварительного тракта и может послужить причиной летального исхода. Все кровотечения разделяются в первую очередь на кровотечения из верхних, нижних отделов желудочно-кишеч
Различают скрытые, как правило, хронические, желудочно-кишечные кровотечения и явные (массивные) геморрагии.
При остром кровотечении степень кровопотери может быть различной.
В случае массивной кровопотери падает объем циркулирующей крови, отмечается несоответствие его сосудистому руслу, снижение артериального давления, учащение пульса, уменьшение минутного объема кровообращения, что вызывает рост общего периферического сосудистого сопротивления за счет компенсационного, генерализованного спазма сосудов. Данный компенсаторный механизм кратковременен, и при продолжающейся кровопотере в организме могут наступить необратимые гипоксические явления. В первую очередь страдает функция печени, в которой могут возникать очаги некроза [3].
В развитии любого кровотечения различают два периода: латентный, с момента поступления крови в пищеварительный тракт, и генерализованный, проявляющийся такими явными признаками кровопотери, как шум в ушах, головокружение, слабость, холодный пот, сердцебиение, падение АД, обморок. Продолжительность первого периода зависит от темпов и объема кровотечения и колеблется от нескольких минут до суток.
Кровотечения из верхних отделов ЖКТ
Основные причины кровотечений из верхних отделов желудочно-кишечного тракта представлены в таблице 1.
Таблица 1. Причины развития кровотечений из верхних отделов ЖКТ.
Выявлено, что 44% от всех госпитализаций по поводу кровотечения из верхних отделов ЖКТ приходится на пациентов старше 60 лет [1], причем показатели летальности у пожилых людей также значительно выше. Однако следует отметить, что приблизительно 80% эпизодов кровотечений из верхних отделов ЖКТ проходят самостоятельно или требуют немассивной терапии [9].
Анализ причин летальных исходов при кровотечениях из верхних отделов ЖКТ показывает, что более высокие показатели смертности (от 50 до 70%) связаны со случаями рецидивирующего кровотечения из варикозно-расширенных вен пищевода и желудка [10]. В целом же, именно рецидивирующие кровотечения в прогностическом отношении наиболее опасны. К факторам риска повторного кровотечения относятся эндоскопически выявляемые признаки угрозы повторного кровотечения (струйное продолжающееся кровотечение, просачивание крови, затромбированный сосуд и видимый не кровоточащий сосуд). Данные визуальные признаки чаще всего сопровождают эрозивно-язвенные поражения ЖКТ. Считается, что указанные признаки кровотечения имеют большее значение для язвы желудка, чем для дуоденальной язвы.
Среди других признаков, которые могут вызывать или влиять на исход кровотечения, следует отметить такие факторы, как размер язвы (гигантские язвы), сопутствующая патология (почечная недостаточность, цирроз печени, острая коронарная недостаточность, хроническая недостаточность кровообращения, опухолевые, эндокринные, системные заболевания).
В целом же на первом месте по причинам кровотечений (см. таблицу 1) находится эрозивно-язвенное поражение желудка и двенадцати-перстной кишки. И это несмотря на несомненные успехи в лечении язвенной болезни, достигнутые за последние годы. По-видимому, причин несколько, и основные из них — бессимптомное течение язвы и неконтролируемый прием нестероидных противовоспалительных средств (НПВП), включая аспирин, алкоголь, а также сочетание этих факторов. Так, именно прием НПВП у больных язвенной болезнью может давать стертую картину заболевания, с одной стороны, и фатальное кровотечение с другой. Немаловажное значение в этиологии желудочно-кишечного кровотечения его рецидивов у пациентов с язвенной болезнью имеет инфицирование больных Helicobacter pylori (НР), особенно в случаях неполноценной эрадикации НР, а также кислотно-пептический фактор.
Явный период кровотечения из верхних отделов ЖКТ, как правило, начинается со рвоты кровью (ярко-красная кровь, темные сгустки или рвота «кофейной гущей») или появления мелены (черный, дегтеобразный, мажущийся стул со специфическим, зловонным запахом), однако следует отметить, что при массивном кровотечении из верхних отделов ЖКТ в кале также может появиться обильная алая кровь.
Одновременно у больного отмечаются беспокойство или заторможенность, бледность, снижение АД, тахикардия, а в ряде случаев у пациентов с серьезной кровопотерей может регистрироваться и брадикардия, связанная с вагусным влиянием. Критическая гемодинамическая ситуация возникает при потере крови на уровне 40% от полного объема циркулирующей крови. В данный период наличие кровотечения как синдрома не представляет сомнений, однако значительно труднее бывает определить его конкретный источник.
Основным методом диагностики кровотечений из верхнего отдела ЖКТ является эндоскопическая визуализация места кровотечения при ЭГДС; другие методы (назогастральный зонд, уровень остаточного азота крови) — вспомогательные. Как правило, эндоскопическая диагностика язвенных кровотечений, особенно желудочной локализации, не представляет сложности. Иначе обстоит дело с гастропатиями, как источниками геморрагических осложнений. Эндоскопически гастропатии определяются наличием большого количества подслизистых кровоизлияний, эритем и эрозий. Эрозия — дефект слизистой оболочки, который не распространяется на ее мышечную пластинку. Фактически большинство эндоскопистов определяют эрозию как область кровоизлияний или неглубоких дефектов в слизистой оболочке с ядром некроза не более 3—5 мм в диаметре. Гастропатии часто бывают индуцированы приемом НПВП, алкоголя и возникают в результате стрессовых воздействий.
Кровотечение из расширенных вен пищевода и желудка чаще отмечается из больших узлов или распространенных варикозно-измененных вен. Оценивая ситуацию, эндоскописты часто ориентируются на цвет узлов. Красный и синий цвет одного узла считается фактором риска для кровотечения. Белое пятно на варикозном узле может быть фибриновой пробкой и рассматриваться как диагностический фактор предыдущего кровотечения, но при этом не указывает на возможность повторного кровотечения [11]. Изолированный желудочный варикоз в фундальном отделе может быть результатом тромбоза селезеночной вены, выявляющегося при помощи ангиографии. Варикоз в ДПК кровоточит редко.
При синдроме Мэллори–Вейса источник кровотечения — разрыв слизистой около гастроэзофагеального перехода, вызываемый интенсивной рвотой, которая сопровождает пролапс оболочки желудка. У пациентов с данным синдромом прослеживается связь с хроническим употреблением алкоголя и портальной гипертензией.
Ведение больных с наличием кровотечения из верхних отделов ЖКТ, чаще связанных с эрозивно-язвенным поражением желудка и ДПК, осуществляется в три этапа [12].
На первом этапе в комплекс необходимых мероприятий входят: обеспечение проходимости дыхательных путей (положение на боку, введение назогастрального зонда), а также внутривенного доступа, определение группы крови, резус-фактора и биологической совместимости. Кроме того, у больного берут анализ крови на гемоглобин и гематокрит, определяют количество форменных элементов, состояние свертывающей системы крови, уровни мочевины, электролитов, глюкозы; проводят функциональные пробы печени; осуществляют мониторинг газов артериальной крови. При значительной кровопотере необходимо восстановление ОЦК (переливание физиологического раствора, а при наличии признаков задержки натрия в организме — 5-процентного раствора декстрозы). Если появляются признаки падения ОЦК, нужно провести переливание в течение часа: 500 мл — 1 л коллоидного раствора с последующей гемотрансфузией эритромассы или цельной крови (при большом объеме кровопотери второе предпочтительнее). Во время проведения инфузионной терапии необходимо внимательно следить, чтобы диурез был выше 30 мл/ч, и остерегаться перегрузки объемом. Одновременно следует предпринимать меры по прекращению кровотечения. Если провести эндоскопию по каким-либо причинам невозможно, можно попытаться остановить кровотечение терапевтическими методами: промывание желудка ледяной водой и введение антисекреторных средств, обладающих кроме влияния на секрецию способностью уменьшать кровоток в слизистой оболочке. Особенно показано применение блокаторов кислотной продукции при эрозивно-язвенных кровотечениях. По последним данным, применение блокаторов Н2-гистаминовых рецепторов и ингибиторов протонной помпы (ИПП) может уменьшать вероятность оперативного вмешательства и летального исхода на 20 и 30%, соответственно [13, 14]. Особенно эффективны современные ИПП, характеризующиеся быстрым воздействием. Обычно пациентам внутривенно вводят 40 мг омепразола (лосек) или 50 мг ранитидина (зантак и др.). Хороший эффект дает и применение фамотидина (квамател в дозе 20 мг от двух до четырех раз в сутки, в зависимости от степени кровопотери и выраженности эндоскопических изменений [15]. Одновременно с блокаторами кислотной продукции целесообразно назначение цитопротективных средств: сукральфата (вентер), лучше в виде эмульсии по 2,0 г через каждые 4 ч, препаратов висмута (де-нол, вентрисол и др.).
Диагностическая и лечебная эндоскопия (аргоноплазменная коагуляция, электрокоагуляция, лазерная фотокоагуляция, диатермокоагуляция, клипирование, химическая коагуляция с дегидратацией и др.) значительно улучшает результаты терапии кровотечения из верхних отделов ЖКТ [12]. По имеющимся данным, при кровотечениях, вызванных эрозиями, хороший эффект (80—90%) дает интраартериальная инфузия вазопрессина во время ангиографии и катетеризации, меньше выражен эффект после внутривенных вливаний вазопрессина [16]. При язвенных кровотечениях действие вазопрессина малозаметно, возможно, из-за большего калибра кровоточащих сосудов [17]. В остальном лечение кровотечений при гастропатиях не отличается от вышеописанного.
Что касается кровотечения из расширенных вен пищевода и желудка, то здесь препаратом выбора является синтетический аналог соматостатина (октреотид), вытеснивший в настоящее время вазопрессин. Октреотид (сандостатин) вводят в дозе 25—50 мкг/ч в виде продолжительных инфузий в течение пяти дней. Дает эффект также комбинированное применение метоклопрамида и внутривенных инфузий нитроглицерина [18]. Основные же формы лечения данного вида кровотечения — это срочная склеротерапия или наложение лигатур [19].
Кровотечение при дуодените почти всегда останавливается спонтанно, в связи с чем лечебная эндоскопия требуется редко, а ангиодисплазии лечатся в основном с помощью лазерной эндоскопической коагулирующей терапии [20, 21].
Следует отметить, что для полноценной терапии больного с кровотечением из верхних отделов ЖКТ недостаточно остановить кровотечение и стабилизировать состояние пациента, необходимо назначить рациональное лечение основного заболевания, вызвавшего кровопотерю. Так, для лечения эрозивно-язвенных процессов, ассоциированных с НР, совершенно очевидна необходимость назначения полноценной эрадикационной терапии, учитывающей не только резистентность НР к метронидазолу, но и полирезистентность к другим антибактериальным средствам. По результатам наших исследований, речь может идти о недельной тройной терапии коллоидным субцитратом висмута (240 мг два раза в день), тетрациклином (750 мг два раза в день) и фуразолидоном (200 мг два раза в день). Возможна и недельная, а при устойчивости к метронидазолу — 14-дневная квадротерапия: омепразол (20 мг два раза в день), коллоидный субцитрат висмута (240 мг два раза в день), тетрациклин (500 мг четыре раза в день) и метронидазол (500 мг два раза в день). Эрадикация НР при данном лечении достигает 85,7—92% [22, 23].
Для профилактики кровотечений, вызванных приемом НПВП при ассоциации с НР, больным, продолжающим принимать противовоспалительные средства по показаниям, следует проводить подобную эрадикационную терапию с обязательным включением в схему ИПП (лосек, париет) по 20 мг два раза в день, с переводом в дальнейшем на поддерживающий курс ИПП в половинной суточной дозе. Возможен прием мизопростола (200 мкг четыре раза в день). Мизопростол также эффективен для предотвращения стрессовых эрозий, хотя и вызывает у ряда пациентов диарею.
Кровотечения из нижних отделов ЖКТ
Наиболее частыми причинами кровотечений из нижнего отдела ЖКТ по А. А. Шептулину (2000) являются:
Средний возраст пациентов с кровотечениями из нижних отделов ЖКТ выше, чем у больных с кровотечениями из верхних отделов ЖКТ. В последние несколько десятилетий показатели смертности от острого кровотечения из нижних отделов ЖКТ несколько снизились, что связывают, в первую очередь, с совершенствованием диагностики кровотечений, благодаря применению колоноскопии и ангиографии, которые позволяют подобрать оптимальный алгоритм хирургического или ангиографического лечения.
Как и при кровотечениях из верхних отделов ЖКТ, 80% всех эпизодов кровотечений из нижних отделов останавливаются самостоятельно, а у 25% пациентов с прекратившимся кровотечением наблюдаются рецидивы. В отличие от кровотечений из верхних отделов ЖКТ, большинство кровотечений из нижних отделов ЖКТ скрытые или незначительные, непостоянные и не требуют госпитализации.
Из всех вышеперечисленных причин кровотечений из нижних отделов ЖТК наиболее распространены (30%) геморрагии из кавернозных гемангиом и ангиодисплазий слизистой оболочки тонкой и толстой кишки (артериовенозные мальформации I, II и III типов). На втором месте — дивертикулез (17%), а в 5—10% случаев у больных при кровотечении из нижних отделов ЖКТ причину кровотечения установить не удается [4].
При дивертикулезе кровоточащий дивертикул чаще обнаруживается в левых отделах толстой кишки [24]. Чаще кровотечения возникают при сопутствующем дивертикулите и травматизации кровеносных сосудов. Степень кровопотери может быть опасна для пожилых людей.
Опухолевые процессы редко дают острое кровотечение, в основном они становятся причиной хронической, скрытой кровопотери и железодефицита. Скрытое кровотечение также чаще сопровождает язвенный колит и болезнь Крона, так как при данной патологии крупные сосуды, как правило, не повреждаются.
Кровотечение при геморрое чаще бывает необильным, однако в ряде случаев могут наблюдаться и массивные кровопотери, требующие неотложных оперативных мероприятий.
Дивертикулярное кровотечение часто манифестирует как острое, безболезненное и проявляется наличием ярко-красной неизмененной крови (гематохезии) в кале, хотя может наблюдаться и мелена, если источник кровотечения располагается в тонкой кишке. Причем чем светлее кровь, тем дистальнее располагается очаг кровотечения. Подобная картина часто отмечается и при ангиодисплазиях. Дифференциальный диагноз в этих случаях обычно проводится на основании колоноскопии или ангиографии. При неопластических процессах клиника кровотечения, как правило, представлена слабыми, интермиттирующими кровотечениями и стулом с положительной реакцией на скрытую кровь. При внутреннем геморрое болевой синдром чаще всего отсутствует, а кровотечение может быть в виде струйки алой крови либо проявляться наличием на туалетной бумаге или вокруг стула крови, но не смешанной с калом, который сохраняет свой обычный цвет. В целом, когда при наличии признаков кровотечения содержимое кишечника сохраняет свой обычный цвет, это свидетельствует о низком расположении источника кровотечения (в ректосигмоидном секторе). Кровотечение при геморрое часто отмечается при натуживании или при прохождении твердых каловых масс. Подобная картина характерна и для пациентов с кровотечением из анальных трещин, однако в этом случае оно часто сопровождаются резким болевым синдромом. Кроме того, те же симптомы могут сопровождать ректальные полипы и карциному прямой кишки. В этой связи пациентам с данными симптомами обязательно должны быть проведены аноскопия и ректороманоскопия.
Кровотечения, источником которых является Меккелев дивертикул, чаще наблюдаются в детском возрасте. Это безболезненные кровотечения, которые могут быть представлены меленой или яркой алой кровью, классически описанной как стул в виде «смородинового желе». Здесь также все зависит от уровня расположения дивертикула. Диагноз ставится на основании радиоизотопных исследований, которые, однако, нередко дают как ложнонегативные, так и ложнопозитивные результаты [25].
Воспалительные заболевания кишечника характеризует болевой синдром, который, как правило, предшествует кровотечению. Кровь у данных пациентов обычно смешивается со стулом, что изменяет его цвет, так как источник кровотечения чаще расположен выше ректосигмоидного отдела толстой кишки. Одновременно обнаружены и другие признаки заболевания, такие, как диарея, тенезмы и др. Инфекционный колит, вызванный патогенной кишечной флорой, также часто может быть представлен кровавой диареей, однако в этом случае существенная кровопотеря отмечается редко. Диагноз в данном случае ставится на основании сигмоскопии с биопсией и посевом кала.
Если поражение кишки носит ишемический характер, наблюдается коликообразная боль в брюшной полости, чаще слева, сопровождаемая в дальнейшем (в пределах суток) кровавой диареей. Для данного вида кровотечения характерна минимальная кровопотеря, реже отмечается массивное кровотечение. Диагностика обычно проводится рентгенологически и колоноскопически с биопсией.
Большое значение в диагностике кровотечений из нижних отделов ЖКТ имеют сведения, полученные при сборе анамнеза и обьективном обследовании больного. Существенную роль играет отягощенная наследственность, перенесенная и имеющаяся хроническая патология (онкологические заболевания у пациента и родственников, в том числе семейный поллипоз толстой кишки, гепатит, цирроз печени, урогенитальная патология), а также условия жизни и работы, контакт с животными и проч.
Осмотр больного часто позволяет сделать целый ряд выводов, например, наличие множественных телеангиэктазий на коже и слизистых предполагает, что они имеются и в кишечной стенке. Кроме того, важно учитывать симптомы имеющейся постгеморрагической железодефицитной анемии, абдоминальных болей, диареи, анорексии, потери веса или наличия пальпируемых образований в брюшной полости. Неоценимое значение в диагностике кровотечений из нижних отделов ЖКТ имеет колоноскопия, а в случаях прогрессирующей кровопотери пациентам показана ангиография.
Однако несмотря на то, что в настоящее время существует богатый арсенал технических средств, не стоит забывать также и о простых, но достаточно информативных методах исследования, доступных в любых условиях, — пальцевом ректальном исследовании, которое может дать ответ на многие вопросы, особенно при патологии прямой кишки. Не случайно в списке диагностических мероприятий при кровотечении из нижних отделов ЖКТ данная процедура стоит на первом месте. Кроме вышеназванных мероприятий (аноскопия, ректороманоскопия, колоноскопия с биопсией, ангиография) не следует забывать и о необходимости исследования кала на скрытую кровь с бензидином (после тщательной подготовки больного). В ряде случаев в постановке правильного диагноза помогают радиоизотопные исследования, компьютерная томография и ЯМР-диагностика.
В 80% случаев острые кровотечения из нижних отделов ЖКТ останавливаются самостоятельно или в ходе лечебных мероприятияй, направленных на терапию основного заболевания. Наиболее эффективной терапией дивертикулярного и ангиодиспластического кровотечений являются: селективная катетеризация с внутриартериальным введением вазопрессина; чрескатетерная эмболизация кишечных артерий; эндоскопическая электро- и лазерокоагуляция; склеротерапия. При геморрое могут применяться такие методы, как местная (в свечах) сосудосуживающая терапия; внутрь назначают 10-процентный раствор хлорида кальция (по одной столовой ложке четыре-пять раз в день). При массивном кровотечении может применяться тампонада прямой кишки. При повторных кровотечениях показано оперативное лечение. При внутреннем геморрое в некоторых случаях назначается склерозирующая терапия варикоцидом, этаксисклероном и другими средствами. Большое значение в профилактике геморроидальных повторных кровотечений придается лечению у данных больных хронического обстипационного синдрома.
Учитывая тот факт, что кровотечения из нижних отделов ЖКТ, значительно чаще имеют скрытый характер и сопровождаются хронической железодефицитной анемией, следует в каждом случае проводить диагностику оккультных кровопотерь и их своевременную терапевтическую коррекцию. Наличие у большинства пациентов с хронической кровопотерей сочетанной патологии органов ЖКТ (хронический атрофический гастрит, дисбактериоз кишечника), неполноценного питания с дефицитом витаминов, а в ряде случаев и злоупотребления алкоголем, создает необходимость назначения комплексной терапии, которую предпочтительнее проводить с помощью комбинированных лекарственных средств. В данном случае, препаратом выбора является препарат Ферро-Фольгамма(, в состав которого входит 100 мг железа сульфата безводного или 37 мг железа, фолиевая кислота (5 мг), цианокобаламин (10 мкг) и аскорбиновая кислота (100 мг). Удачное сочетание указанных ингредиентов в одной лекарственной форме создает условия наиболее эффективного всасывания железа и коррекции патологических процессов. Кроме того, присутствие в препарате рапсового масла, как носителя, защищает слизистую желудка от раздражающего действия железа, что имеет большое значение при его сопутствующем поражении.
Дозы и продолжительность лечения подбираются индивидуально по лабораторным и клиническим показателям. Обычно препарат назначают по 1 капсуле два-три раза в день.
В любом случае терапия больных с желудочно-кишечными кровотечениями должна быть комплексной и учитывать индивидуальные особенности пациентов и сопутствующей патологии.
По вопросам литературы обращайтесь в редакцию
И. В. Маев, доктор медицинских наук, профессор
А. А. Самсонов, доктор медицинских наук
Г. А. Бусарова, кандидат медицинских наук
Н. Р. Агапова
МГМСУ, Москва