Что такое нки диагноз
Что такое нки диагноз
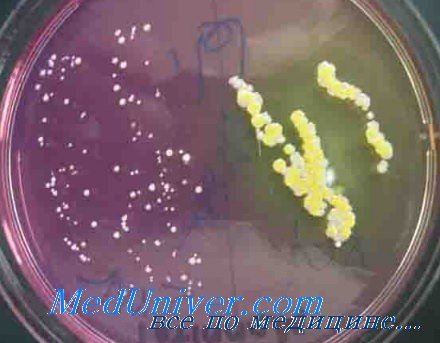
S. aureus — основной возбудитель поверхностных и глубоких абсцессов и послеоперационных РИ как в виде моноинфекции, так и в сочетании с другими возбудителями. Циркуляция MRSA делает золотистый стафилококк наиболее значимым возбудителем НКИ.
В последние годы 17-22% всех нозокомиальных инфекций (НКИ) в отечественных клиниках были обусловлены S. aureus. Носителями данного возбудителя оказались 11,3% персонала клиники, причем наиболее часто S. aureus колонизировал слизистую оболочку преддверия носа.
При проведении локального микробиологического мониторинга в отечественных больницах в 2003-2005 гг. у пациентов с поверхностными раневыми инфекциями в 44% случаев были выделены штаммы S. aureus, в том числе у 10% больных с инфекцией мочевых путей и у 36% больных с инфекцией дыхательных путей. Представляет интерес частота выделения S. aureus в различных микробных ассоциациях, при этом установлено, что моновариант S. aureus встречался только в 37,8% случаев.
В отечественных клиниках S. aureus был причиной более половины всех осложнений после операций на молочной железе, 11,2% урологических операций и 12,5% операций в области кожи и подкожной клетчатки.
Наряду с этим отмечается увеличение количества полирезистентных штаммов стафилококков и энтеробактерий. Доля MRSA в 2006 г. составила 62%, а продуцентов БЛРС среди штаммов кишечной палочки и клебсиелл-29%.
Частота инфекций, вызванных антибиотикорезистентными бактериями возрастает во всем мире с каждым днем. Такие инфекции повышают заболеваемость и смертность, а следовательно, и расходы на здравоохранение. Существует множество причин, объясняющих эту тенденцию, но главным фактором повышения числа антибиотикоустойчивых бактерий служит возрастание применения антимикробных препаратов, в особенности антибиотиков широкого спектра действия. Многие исследования показали, что приблизительно в 50% случаев применение антибиотиков нерационально.
Несмотря на то, что многочисленные многоцентровые исследования, проведенные в Европе, США, Канаде, показали, что ведущими возбудителями ИОХВ и РИ остаются штаммы золотистого стафилококка (частота выделения превышает 40%), кишечной палочки (> 10%), синегнойной палочки (> 12%) и энтерококков (> 4-6%), все больше специалистов сообщают о госпитальных грибковых инфекциях.
Все чаще и чаще в биоматериалах пациентов в стационарах обнаруживают не Candida albicans, а более вирулентные и антибиотикорезистентные виды Candida non-albicans. По обобщенным данным США, Канады, Европы, Индии, Тайваня (всего 26 стран мира) сделан вывод о возрастающей роли грибов Candida поп-albicans в развитии кандидемии и других заболеваний. Среди 14 368 штаммов грибов рода Candida, выделенных от больных с системными микозами в 40 больничных лабораториях, получены следующие виды: С. albicans — 69%, С. glabrata — 10%, С. tropicalis — 4,2%, С. parapsilosis — 3,6%, С. krusei— 1,7%.
Еще в 1993 г. французскими учеными описано 96 пациентов с аспергиллезом. Все эти больные относились к группам риска: трансплантация костного мозга и внутренних органов, СПИД, другие виды иммунодефицита. Среди всех больных после трансплантационных операций в 5-10% случаев возникал легочный аспергиллез, а смертность среди них составляла 62-82%.
Известно, что плесневыми грибами A. fumigatus, A. flavus, Penicillium spp. и другими могут быть загрязнены кондиционеры, воздух, вода, стены, пол, окна, цветы, занавески, мягкие игрушки и другие предметы в помещениях, стационаров что служит опасным фактором развития НКИ. При вдыхании контаминированного воздуха споры грибов попадают в легкие, а из них могут проникать в мозг, печень, селезенку, почки, щитовидную железу, сердце, кровеносные сосуды, кости, суставы, синусы, гениталии, кожу и другие органы. В результате может развиться инвазивный аспергиллез, летальность при котором составляет 60-70%.
В другом исследовании вспышек аспергиллеза в стационарах Санкт-Петербурга обнаружили концентрацию грибов A. fumigatus и A. flavus в воздухе больниц до нескольких сотен спор в 1 м3 воздуха. В кардиологических стационарах после операций по протезированию клапанов констатировали циркуляцию зигомицет в воздухе.
В Екатеринбурге проводили микологический мониторинг воздуха нозокомиальных помещений в соответствии с требованиями СанПиН 2.1.3. 1375-03 и благодаря противогрибковой дезинфекции снизили концентрацию грибов в воздухе с 150-240 до 70 КОЕ/м3.
Таким образом, достаточно актуальной остается проблема распространения грибов в окружающей среде и контаминация ими медицинских работников.
Около 40% здоровых лиц из обслуживающего персонала в хирургических отделениях имеют колонизацию кожи рук грибами Candida. Через загрязненные руки может быть передана кандидозная инфекция, способствующая развитию системных микозов вплоть до кандидемии. При обследовании сотрудников различных ОРИТ в 1-54% случаев и более на коже рук обслуживающего персонала выделялись штаммы грибов Candida, идентичные таковым у пациентов.
Следует отметить, что в настоящее время имеются серьезные разработки по дезинфекции рук персонала, однако важно добиться обязательного выполнения этих правил.
Следует отметить, что количественные параметры контаминации биологического материала микроорганизмами не всегда принимаются во внимание в связи с трудностью соблюдения оптимальных условий взятия материала и усложнением проведения анализа и идентификации выделенных культур микроорганизмов. Вместе с тем количественная характеристика принципиально важна, т. к. дает представление об интенсивности эпидемического процесса.
Изучение эпидемиологической ситуации и мониторинг локальной структуры антибиотикорезистентности возбудителей НКИ необходимо проводить в условиях конкретного стационара. Эти данные нельзя экстраполировать на другие лечебные учреждения и отделения, поэтому мониторинг антибиотикорезистентности возбудителей при разных формах НКИ — важный аспект деятельности лаборатории клинической микробиологии в каждой конкретной клинике.
При этом желателен компьютерный мониторинг возбудителей нозокомиальных инфекций (НКИ) с использованием адекватных методов статистической обработки результатов лабораторных исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Терапия, направленная на лечение НКИ COVID-19 как инфекционного заболевания



Назначение пациентам ОРИТ противоинфекционного лечения – противовирусной, антибактериальной и иммунозаместительной терапии – является по общему правилу прерогативой врачей-инфекционистов или клинических фармакологов. В случае НКИ COVID-19 ситуация значительно осложняется тем, что специфической противовирусной терапии, как и иммунопрофилактики, направленной именно против SARS-CoV-2, в настоящее время нет, а опыт применения препаратов, способных подавлять репродукцию вируса или вторичные инфекционные процессы, пока крайне ограничен. Тем не менее, мы посчитали полезным отразить в настоящих методических рекомендациях имеющиеся доказательные данные с тем, чтобы облегчить коллегам выбор и обоснование тактики в спорных и затруднительных случаях.
109. У пациентов с НКИ COVID-19 в критическом состоянии нет достаточных доказательств для рекомендаций рутинно использовать:
— стандартные внутривенные иммуноглобулины (УДД – 2, УУР – С) 120
— плазму реконвалесцентов (УДД – 3, УУР – С) 129
— лопинавир/ритонавир (УДД – 2, УУР – С) 144
— противовирусные препараты (ремдесивир и др.) (УДД – 5, УУР – С) 138
— рекомбинантные интерфероны, отдельно или в комбинации с противовирусными препаратами (УДД – 5, УУР – С) 146
— хлорохина или гидроксихлорохина сульфата (УДД – 5, УУР – С) 154
— тоцилизумаба (УДД – 5, УУР – С) 157
— нафамостата (УДД – 2, УУР – С) 162
— нитазоксанида (УДД – 5, УУР – С) [162]
— арбидола (УДД – 4, УУР – В)
— анакинры (УДД – 5, УУР – С) [79]
Комментарий. На сегодняшний момент не существует терапии НКИ COVID-19, одобренной FDA, вследствие ограниченного набора доказательств.
Тем не менее, назначение этих препаратов может быть рассмотрено у пациентов высокого риска (возраст старше 65 лет, иммуносупрессия, активная фаза злокачественных опухолей, структурные изменения легких, хронические заболевания почек, гипертензия, ишемическая болезнь сердца, диабет, ИМТ > 40) с учетом механизма действия, показаний и противопоказаний. В авторитетном журнале JAMA [163] приведен обзор и расставлены акценты относительно дозировок, форм выпуска и побочных эффектов препаратов.
Основные характеристики препаратов, рассматриваемых для лечения НКИ COVID-19 [163]:
Действие: Блокада проникновения вируса за счет ингибирования гликозилирования рецепторов хозяина, протеолизиса, эндосомальной ацидификации. Дополнительный иммуномодулирующий эффект достигается путем ингибирования продукции цитокинов, аутофагии и лизосомальной активности в клетках хозяина.
При заболеваниях почек: при клиренсе креатинина
Применение: производитель не рекомендует измельчать таблетки, однако есть информация о том, что они могут быть измельчены в воде или добавлены в раствор для перорального применения.
Противопоказания: известна повышенная чувствительность к гидроксихлорохину, производному 4-аминохинолина, пероральному компоненту препарата.
Токсическое действие: сходны с хлорохином.
Специальные указания: может быть использован при беременности, если польза перевешивает риск, необходим мониторинг интервала QT (особенно при использовании совместно с азитромицином).
Что такое нки диагноз
Диагноз анаэробной инфекции, как правило, на первом этапе ставят по клиническим проявлениям. Что касается определения токсина С. difficile, результат может быть неспецифичеп, но тест весьма подходит как скрининг. При инфекции, обусловленной С. tetani (столбняк), микроскопия и посев часто дают отрицательные результаты (> 50%). При актиномикозе и нокардиозе очень важна предварительная микроскопия, поскольку в этих случаях (обнаружение морфологически сходных микроорганизмов) необходимо использовать специальные среды и длительную инкубацию, причем в случае актиномикоза инкубация посевов требует анаэробной атмосферы.
Структура лидирующих возбудителей в том или ином стационаре зависит от его профиля, принятых методов диагностики и лечения основного заболевания, применяемых схем антимикробной профилактики и терапии послеоперационных осложнений, а также от качества инфекционного контроля в клинике. Согласно кооперированным зарубежным данным, спектр возбудителей в клиниках Северной Америки, Европы, Азии, Австралии и даже Африки в основном сходный.
Наши данные по составу возбудителей также не отличаются от данных крупных международных исследований. Но частота их выделения, состав лидирующих возбудителей зависят от различных факторов, в т. ч. от профиля конкретного лечебного учреждения. Все связанные с НКИ проблемы наиболее ярко представлены в отделениях реанимации. При сравнении собственных результатов н данных Системы государственного надзора за нозокомнальными инфекциями США (NNIS) за 2003 г. очевидны значительные различия в частоте выделения всех основных возбудителей послеоперационных РИ, кроме E. coli и Enterococcus spp..
Частота выделения основных возбудителей нозокомиальных инфекций (НКИ) различна. Так, S.aureus, лидирующий в клиниках США, в РОНЦ выделяется более чем в 4 раза реже, остальные возбудители, напротив, чаще. Различия обусловлены многими факторами, в т. ч. и различным уровнем инфекционного контроля, отличной политикой антибиотикопрофилактики и антибиотикотерапии.
S. aureus занимает 1-е место в структуре возбудителей послеоперационных инфекционных осложнений в 50% рассматриваемых Н.В. Дмитриевой отделений РОНЦ, особенно в отделениях опухолей молочной железы (32,6%) и нейрохирургии (25,9%).
Е. coli лидирует как возбудитель в сравнении с S. aureus только в пяти отделениях: проктологии (22,7%), гинекологии (21,4%), рентген-хирургических методов диагностики и лечения (15,5%), отделениях радиохирургии (14,1%) и абдоминальной хирургии (11,9%). Значительную роль как возбудитель инфекций Е. coli играет в таких отделениях, как отделение опухолей женской репродуктивной системы (13,8%), урология (12,5%), диагностическое (10,8%), опухолей печени и поджелудочной железы (10,7%), опухолей верхних дыхательных и пищеварительных путей (8,7%).
Доля P. aeruginosa в отделениях реанимации в целом составила 18,5% (426 или 2297), что достоверно выше частоты инфекций, обусловленных Candida spp. (12,0%, 276 из 2297), A. baumannii (10,8%, 249 из 2297), К. pneumoniae (9,2%, 212 из 2297) и E.faecium (9,1 %, 210 из 2297), значение которых в данных отделениях также высоко. Следует отметить, что в ОРИТ № 1 (основное отделение реанимации для пациентов после хирургических операций) P. aeruginosa имеет первостепенное значение и составляет 19,6% (384 из 1958 штаммов), на 2-м месте A. baumannii (12,4%, 243 из 1958), затем идет Candida spp. (11,4%, 223 из 1958). В то же время в ОРИТ № 4 (отделение кардиореанимации) на 1-м месте стоит Candida spp. (15,6%, 53 из 339 штаммов), а уже затем P. aeruginosa (12,4%, 42 из 339). В обоих отделениях реанимации значение стафилококков как возбудителей инфекционных осложнений невелико.
Помимо отделений реанимации P. aeruginosa имеет либо основное, либо весьма существенное значение для всех остальных отделений. Так, в отделениях торакоабдоминальной хирургии и опухолей верхних дыхательных и пищеварительных путей это лидирующий возбудитель (14,5 и 16,3% соответственно). Отделения проктологии, урологии, нейрохирургии, радиохирургии, рентген-хирургических методов диагностики и лечения, опухолей головы и шеи, опухолей молочной железы также имеют значительную долю инфекций, обусловленных синегнойной палочкой.
A. baumannii занимает 1-е место (12,4%) в структуре возбудителей НКИ в отделении опухолей печени и поджелудочной железы, но статистически значимых различий по сравнению с Е. coli не наблюдается (10,7%). Частота выделения P. aeruginosa, К. pneumoniae, Е. faecalis и E.faecium ниже и примерно одинакова (около 8% для каждого возбудителя). Кроме отделения опухолей печени и поджелудочной железы A. baumannii составляет также значительную долю (12,5%) возбудителей в отделении опухолей головы и шеи после P. aeruginosa (13,2%) и лидирующего в этом отделении S. aureus (18,8%), хотя статистически значимой разницы в частоте их выявления в данном отделении не наблюдается.
Candida spp. — лидирующий возбудитель в ОРИТ № 4 (15,6%), а в четырех других отделениях стоит на 2-м месте по частоте выделения: ОРИТ № 1 (11,4%), торакоабдоми-нальной хирургии (11,2%), абдоминальной хирургии (10,7%) и опухолей верхних дыхательных и пищеварительных путей (8,7%).
E. faecalis занимает 1-е место в структуре возбудителей послеоперационных инспекционных осложнений только одного отделения — урологического (15%), на 2-м месте в этом отделении Е. coli (12,5%) и P. aeruginosa (11,8%), хотя статистически значимых различий в частоте их выделения не отмечается.
Группа коагулазонегативных стафилококков (КГС) в основном представлена двумя клинически значимыми видами: S. epidermidis и S. haemolyticus. В отделении реконструктивной и сосудистой хирургии S. epidermidis (19,5%) наравне с S. aureus (19,1 %) — наиболее значимые возбудители, статистически значимо реже встречается E.faecalis (11,4%). В трех отделениях S. epidermidis занимает 2-е место после 5. aureus: отделение опухолей молочной железы (23,9%), отделение опухолей женской репродуктивной системы (18,2%) и отделение общей онкологии (14,1 %).
К. pneumoniae составляет в целом по клинике 7,4%. Только в одном отделении (нейрохирургия) этот вид энтеробактерий имеет существенное значением занимает 2-е место, составляя 16,7%.
S. maltophilia, несмотря на то что нечасто выделяется из биоматериалов пациентов хирургических отделений и составляет только 3,7%, имеет большое значение как возбудитель НКИ. С каждым годом доля этого вида грамотрицательных неферментирующих палочек в общей структуре возбудителей растет во всех странах. Кроме того, при инфекции, обусловленной S. maltophilia, весьма ограничен выбор антимикробных препаратов (триметоприм/сульфаметоксазол [Бисептол] и тикарпиллип/клавулаповая кислота [Тиментин]).
Таким образом, несмотря на то что в целом по клинике лидирующим возбудителем следует считать P. aeruginosa, отделения отличаются но спектру возбудителей и микроорганизмам, имеющих основное значение. Принципиально важно понимать, что эмпирическая антимикробная терапия должна быть конкретизирована и адаптирована к условиям определенного стационара. Следует отметить, что применение антибиотика с уровнем резистентности 10-20% является достоверно высоким, поэтому рекомендуется избегать их назначения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
КТ диагностика при Новой Коронавирусной Инфекции
Коронавирусная инфекция (КИ) представляет собой семейство вирусов, включающее на май 2020 года 43 вида РНК-содержащих вирусов, (в т.ч. COVID-19 (НКИ)). Основные источники НКИ — это больной человек и животные. Возможные механизмы передачи: воздушно-капельный, воздушно-пылевой, фекально-оральный, контактный. Одни из маркеров НКИ являются специфические антитела. Результатом заболевания КИ (в частности COVID-19 ) является инфекция, протекающая как в лёгкой форме ОРВИ (острая респираторная вирусная инфекция), так и в тяжёлой форме. Большинство людей выздоравливают, при том, что специфических лечебных мероприятий не требуется. В тяжелых случаях осложнения могут включать пневмонию или дыхательную недостаточность, вплоть до летального исхода.
Но, при всех преимуществах компьютерной томографии, является ли данный метод панацей в диагностики при НКИ?
Во-первых, поражение легких — это не уникальный и не первоначальный признак НКИ. При исследовании органов грудной клетки (ОГК) в первые дни инфицирования НКИ результат может “Норма”, или недостаточным для постановки диагноза пневмония. Стандартное период выполнения КТ-исследования ОКГ — на 5-7 день с момента заболевания (проявления симптомов). Как уже упоминалось выше, компьютерная томография выполняется для оценки степени тяжести поражения легочной ткани, предвестником чего является иные клинические симптомы такие как: слабость, потливость, повышение температуры тела выше 38°C, отдышка, снижение уровня кислорода в крови. Обязательным условием перед назначением КТ-исследования ОГК является физикальное обследование пациента (визуальный и инструментальный осмотр больного с учетом анамнеза обратившегося). Нельзя забывать, что метод компьютерной томографии в т.ч. на современной низко-дозовой аппаратуре сопровождается лучевой нагрузкой, которая является вредным фактором для человека и безосновно применятся не должна. Так же, затруднится и без того ограниченный доступ к кабинетам КТ, если допустить нецелесообразную загрузку КТ-аппаратов. Соответственно, КТ-обследование ОГК — показана не для всех пациентов с НКИ, а преимущественно для людей с тяжелой и средне-тяжелой формы течения заболевания, что подтверждается клиническими проявлениями, а это непреобладающая группа пациентов. А наличие таких широкодоступных методов, как полимеразная цепная реакция (ПЦР) для диагностики НКИ, существенно упрощает диагностику большей части населения без излишнего привлечения высокотехнологичной медицинской помощи.
Вывод, компьютерная томография ОГК — это профессиональный высокотехнологичный метод диагностики легких, требуемый четкого и обоснованного показания. А наш долг — это объективная оценка нашего состояния, своевременное обращение в медицинские учреждения и четкое следование рекомендациям лечащего врача.
Заведующий отделением лучевой диагностики — Лазарев М.С.
Менингококковые инфекции
Менингококковая инфекция — инфекционное заболевание, вызываемое бактерией Neisseria meningitidis. Существует 12 серогрупп (разновидностей) этой бактерии, из них 6 (A, B, C, W, Y и X) вызывают большинство тяжелых форм менингококковой инфекции. Особенность инфекции в том, что у менингококка, как и у гемофильной палочки типа b и пневмококков, имеется полисахаридная капсула, окружающая бактерию и защищающая ее от атак иммунной системы. Маленькие дети (в возрасте от 0 до 5 лет) еще, как правило, не имеют сформированного защитного иммунитета против этой инфекции. (1)
Причины и источники. Инкубационный период
Возбудитель менингококковой инфекции передается только от человека к человеку. Инфекция распространяется воздушно-капельным путем и проникает в организм через слизистую носа, полости рта и глотки. Мельчайшие капли выделений из дыхательных путей, полости рта или носоглотки носителя или больного человека при тесном контакте — поцелуях, чихании, кашле, — попадают на слизистую здорового человека. Там бактерии могут на некоторое время оставаться и размножаться, не вызывая признаков заболевания и не влияя на самочувствие, вызывая бессимптомное носительство (иногда наблюдаются симптомы насморка [назофарингита]). По имеющимся данным, считается, что в любой момент времени около 10-20% населения являются носителями менингококков. Но иногда, по не вполне понятным причинам, подавляя защитные силы организма, инфекция проникает через слизистую оболочку в кровь. Используя питательные вещества, находящиеся в крови, менингококки могут быстро размножаться, вызывая заражение крови (сепсис), и распространяться через кровь в оболочки головного мозга или другие внутренние органы (например, легкие, суставы, сердце, подкожно-жировую клетчатку и др.). (1) (2)
Время между моментом попадания бактерии в организм и до появления первых признаков болезни называется инкубационным периодом. Для менингококковой инфекции он составляет в среднем 4 дня, но может и меняться от 2 до 10 дней. (2)
Формы заболевания
Под формами заболевания подразумевается то, какой характер носит болезнь, как она протекает, какие органы и системы она поражает. В случаях менингококковой инфекции существуют следующие формы:
Локализованные формы. Развиваются в случае, если защитные силы организма справляются с инфекцией, и она не попадает в кровь.
Бессимптомное носительство: бактерия Neisseria meningitidis остается на слизистой, размножается и периодически выделяется во внешнюю среду. Сам человек не болеет, но является заразным для окружающих.
Острый назофарингит: воспаление ограничивается слизистой носа, носоглотки.
Генерализованные формы — менингит, менингоэнцефалит, сепсис (заражение крови). Развиваются, если возбудитель преодолевает местную иммунную защиту на слизистых оболочках носоглотки и попадает в кровь. С током крови бактерии разносятся по организму, проникают в кожу, почки, надпочечники, легкие, ткани сердца, оболочки головного мозга. Размножение и гибель менингококков приводит к выбросу эндотоксина — ядовитого продукта распада бактерий. Он разрушает стенки сосудов, отчего образуются кровоизлияния, которые выглядят сначала как с ыпь (экзантема) — красноватые точки на коже или энантема — так ие же высыпания на слизистых полости рта, носоглотки, иногда глаз, а затем принимают типичный вид геморрагической (от темно-красной до черной) сыпи размером от точек до обширных некрозов (отмирания) участков кожи. Этот же бактериальный токсин приводит к развитию отека мозга и мозговых strсимптомов, кровоизлияниям во внутренние органы.
Смешанные (сочетание, например, менингита и сепсиса) и редкие формы: развитие воспаления в суставах — полиартрит, в легких — пневмония и т. д. (1) (2) (3)
Симптомы менингококковой инфекции
Носительство. Протекает без жалоб, длится в среднем 10-15 дней, возбудитель обнаруживается только при лабораторном обследовании.
Острый назофарингит. Симптомы менингококкового острого назофарингита могут напоминать ОРВИ — повышение температуры, слабость, головная боль, сонливость, выделение слизи и небольшая заложенность носа. Может закончиться выздоровлением, переходом в носительство или стать причиной развития менингита и других тяжелых форм менингококковой инфекции. В любом случае, даже при минимальных подозрениях или риске заражения менингококком нужно вызывать врача, поскольку самостоятельно определить, действительно ли это менингококковый назофарингит или другая инфекция невозможно: необходимо проведение осмотра и лабораторные анализы.
Менингококцемия (сепсис, заражение крови). Развивается быстро, часто на фоне назофарингита. Температура может резко подняться, с ломотой в мышцах, сильной головной болью, помутнением сознания. В течение 1-2 суток появляется типичная сыпь при менингококковой инфекции — сначала розоватая, затем геморрагическая: неровные высыпания, темно-красного цвета, немного приподнимающиеся над кожей. Как правило, сыпь локализуется на ягодицах, ногах, нижней части туловища. Элементы сыпи очень разные, от «булавочного укола» и красно-коричневых «звездочек» до больших кровоизлияний, которые в тяжелых случаях приводят к отмиранию тканей — некрозу. Неблагоприятным признаком считается раннее появле ние сыпи на лице. (1)
Могут быстро — иногда в первый день, но чаще на 2-3 день после появления признаков болезни, — развиться симптомы, которые говорят о том, что инфекционно-воспалительный процесс затронул оболочки головного мозга, вызывал их раздражение. Такие симптомы называют менингеальными, к ним относят: ригидность затылочных мышц (невозможно прижать подбородок к груди), симптомы Кернига (врач не может разогнуть у больного ногу в колене), Брудзинского (одновременное сгибание головы и подтягивание ног к животу) и другие. Возможно появление типичной сыпи. (1) (3)
Менингеальная симптоматика может говорить о тяжести заболевания, но самостоятельно, без врача, определить ее не следует: нужна комплексная проверка и опыт в оценке симптомов.
Менингоэнцефалит. Воспаление затрагивает мозговые оболочки, головной, иногда спинной мозг. Признаки сходны с симптомами менингита, также развивается сыпь. При менингоэнцефалите могут появиться геморрагическая экзантема и энантема. Экзантемой называют разнообразную сыпь на коже, которая может быть при самых разных инфекциях, аллергиях, это общее описание высыпаний. Энантема — это сыпь разного характера, появляющаяся на слизистых оболочках. В самом начале менингоэнцефалита может быть трудно определить тип сыпи. Она может начинаться как розеола — небольшого, от 1 до 10 мм в диаметре, округлого покраснения, который светлеет при или исчезает при нажатии на него. Затем может переходить в геморрагическую сыпь в виде точек, пятен, звездочек разного размера, не исчезающих при нажатии на них. (1) (3)
Менингококковый сепсис (менигококкцемия) — тяжелая форма заболевания. Состояние больных очень тяжелое: сильная головная боль, рвота, температура может быть как очень высокой — 41° C, так и быть ниже 36,6° C. Связано это с очень быстрым нарушением работы сосудов, падением артериального давления. Быстро появляется пятнисто-папуле зная сыпь: распространяясь по коже и слизистым, она часто сливается с образованием пузырей с кровянистым содержимым. Смертность при данной форме очень высокая — до 60%. (1) (3)
Диагностика менингококковой инфекции
Поставить точный диагноз можно только после лабораторного исследования: если врач заподозрит менингококковую инфекцию, то он назначает анализ крови, спинномозговой жидкости, отделяемого слизистых и сыпи.
По данным источника (1) даже при своевременной и правильной постановке диагноза, правильно назначенном лечении, «высок риск летального исхода. У 10-20% выживших людей бактериальный менингит может приводить к повреждению мозга, потере слуха или трудностям в обучении. В тяжёлых случаях возможна гангрена пальцев кистей, стоп, ушных раковин». Поэтому при развитии хотя бы одного из симптомов, напоминающих по описанию симптомы менингококковой инфекции, сепсиса и любых других форм, рекомендуется вызвать «скорую помощь».
Предварительный диагноз, а затем его уточнение возможно только после клинического осмотра, с обязательным забором с помощью спинномозговой пункции ликвора — спинномозговой жидкости, а также мазков с поверхности слизистой носоглотки, сыпи. Согласно источнику (1), «менингококковая инфекция потенциально смертельна, и всегда должна рассматриваться как медицинская чрезвычайная ситуация. Пациента необходимо госпитализировать в больницу».
Лечение
Лечение зависит от формы заболевания. Госпитализация требуется при любой форме, но если при выявлении бессимптомного носительства менингококковой инфекции и назофарингите могут назначить антибиотики, витаминно-минеральные препараты, то другие формы заболевания требуют экстренного вмешательства и интенсивного лечения. (1) (3)
В зависимости от формы заболевания, особенностей течения, возраста больного и других причин, могут быть назначены антибиотики, возможно, потребуется их комбинация, коррекция дозы. Также могут потребоваться препараты для снижения температуры, снятия судорог, улучшения циркуляции крови и для дезинтоксикации, поддержания работы сердечно-сосудистой системы, головного мозга, снижения риска возможных осложнений. Могут потребоваться и другие мероприятия по поддержанию жизненно важных функций, вплоть до вентиляции легких. Чтобы лечение было максимально эффективным «важно идентифицировать серогруппу менингококка и провести тестирование микроорганизма на чувствительность к антибиотикам».(3)
Группы риска
Вызываемая менингококком инфекция одинаково опасна для всех людей, кроме получивших прививку от менингококковой инфекции. По данным ВОЗ (2), 10-20% населения в любой момент считаются бессимптомными носителями менингококковой бактерии N. meningitidis. Выделяют следующие группы повышенного риска по развитию менингококковой инфекции (1) (2) (3):
Дети младшего и дошкольного возраста. В отсутствие вакцинации защитный иммунитет против менингококков у детей до 5 лет, как правило, еще не сформирован. Имеет значение и то, что дети часто берут в рот игрушки и предметы окружающей среды, делятся едой друг с другом, пьют из общей посуды. Это повышает риск передачи инфекции, если в коллективе имеется ребенок или взрослый бессимптомный носитель менингококков без признаков заболевания.
Подростки и молодые люди с большим количеством социальных контактов, проживанием и общением в скученных условиях (вечеринки, дискотеки, общежития, казармы). Как указано выше, около 10-20% людей считаются возможными бессимптомными носителями менингококковой инфекции. Чем больше и интенсивнее контакты — тем выше риск заразиться.
По этой же причине в группу риска входят призывники и новобранцы.
Лица, перенесшие удаление селезенки, с ВИЧ-инфекцией, с некоторыми генетическими нарушениями. Это лица с иммунодефицитом — сниженными возможностями организма сопротивляться инфекциям.
Лица с кохлеарными имплантатами. При нарушениях слуха и ношении кохлеарного имплантата возможно повреждение внутренних структур уха, снижение местного иммунитета, что может представлять определенный риск заражения.
Путешественники в районы, где высок уровень заболеваемости, страны так называемого «менингитного пояса» в Африке, а также в Саудовскую Аравию для совершения хаджа. Длительный сухой период, ветер, пыль с иссушенной почвы, холодные ночи, распространенность инфекций верхних дыхательных путей снижают защитные возможности слизистой носоглотки. Низкие показатели социально-экономического развития (кроме ОАЭ и Саудовской Аравии), скученность, перемещение большого числа населения из-за традиционного кочевого образа жизни, а в Саудовской Аравии — из-за паломничества, повышают риск того, что на относительно малых территориях соберется большое количество людей, среди которых могут оказаться и бессимптомные носители менингококковой инфекции, и больные, что может привести к возникновению вспышек инфекции.
Профилактика
Короткий инкубационный период, сложность ранней диагностики, быстрое развитие симптомов, распространенность носительства, особенности детского иммунитета, высокий уровень летальности и инвалидизации, а также высокая распространенность инфекции в некоторых странах мира требуют проведения профилактических мер у детей и отдельных взрослых из групп риска.
При вспышках менингококковой инфекции (ограниченных или при эпидемиях) силами медицинских работников могут проводиться так называемые мероприятия в очаге. К ним относится установление карантина, выявление и изоляция носителей, соблюдение санитарно-эпидемиологического режима, другие мероприятия. (3)
Наиболее эффективной мерой является активная иммунизация, то есть профилактическая прививка. В России она включена в Календарь профилактических прививок по эпидемическим показаниям (4). В нем указано, что вакцинации подлежат «дети и взрослые в очагах менингококковой инфекции, вызванной менингококками серогрупп A или C. Вакцинация проводится в эндемичных регионах, а также в случае эпидемии, вызванной менингококками серогрупп A или C». Вакцинации подлежат также лица, подлежащие призыву на военную службу. (4)
В перечень вакцин, которые могут использоваться в России для вакцинации от менингококковой инфекции входят:
Менингококковые полисахаридные вакцины:
моновалентная (против серогруппы A) — полисахаридная сухая;
четырехвалентная (против серогрупп A, C, Y и W).
Менингококковые конъюгированные вакцины:
моновалентная (против серогруппы C).
четырехвалентная (против серогрупп A, C, Y и W). (5) (6)
Согласно позиции Всемирной организации здравоохранения, «конъюгированные вакцины предпочтительнее, чем полисахаридные, поскольку могут формировать популяционный иммунитет, а также обладают более высокой иммуногенностью, особенно у детей младше 2 лет». (7)
Считаешь материал полезным? Поделись с друзьями!