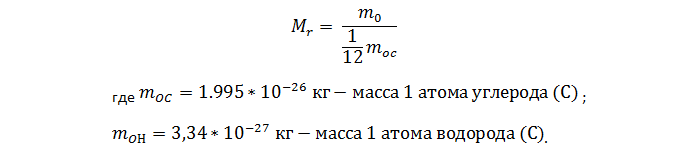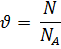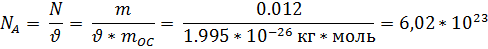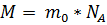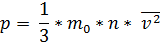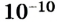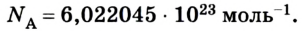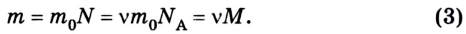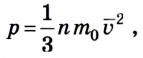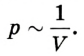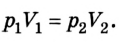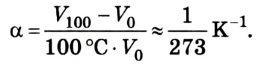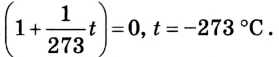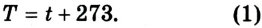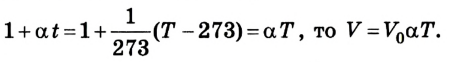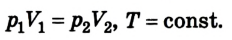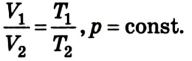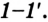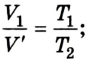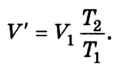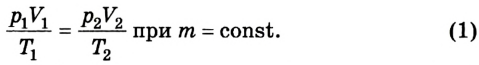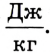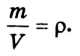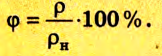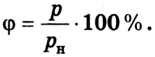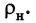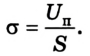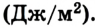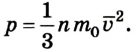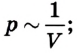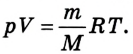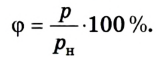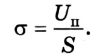Что такое молекулярная физика определение
Среди учащихся химических классов наиболее простыми считаются задачи по молекулярной физике. Часто они сводятся к определению массовых или скоростных характеристик частиц, а также более сложных величин, требующих предварительных расчетов массы молекулы и ее скорости.
Что изучает молекулярная физика
Молекулярная физика относится к разделу науки, которая изучает вещества на уровне их микроскопического строения.
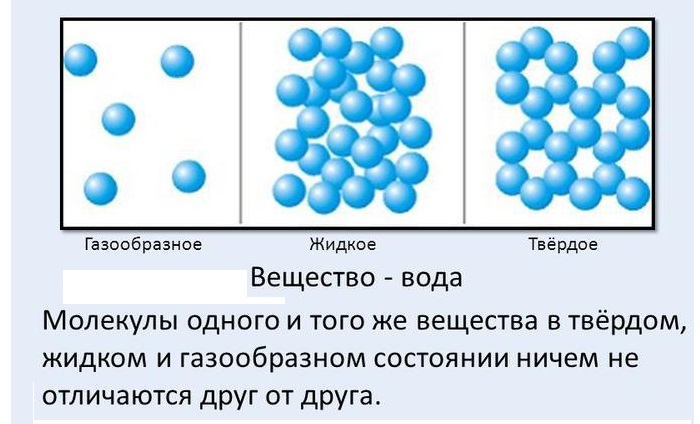
Согласно ей существует три агрегатных состояния вещества – газообразное, твердое, жидкое.
Объяснение процессов перехода веществ отражается в подразделе общей молекулярной физики, называемом молекулярно-кинетической теорией (МКТ). Она призвана осветить вопросы строения и свойств тел через информацию о движении и взаимодействии составных частиц материи.
Основы молекулярной физики
Молекулярно-кинетическая теория (МКТ) объясняет появление и развитие явлений теплового характера внутри сложных тел, а также их свойства в рамках строения молекулы.
К основным положениям МКТ относят следующие:
между всеми частицами тел существуют промежутки;
для всех составных частичек тел характерно непрерывное хаотическое движение молекул;
каждая частица взаимодействует с соседней.
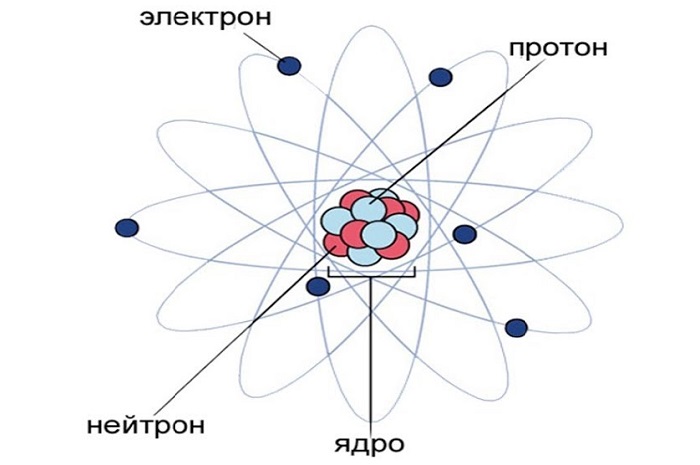
После проведенных исследований ученые установили, что наименьшей неделимой частицей вещества является атом размером 0,1 нм, заряд которого равен нулю.
Если рассматривать данную частичку с точки зрения химической физики, то в ее строении выделяют атомное ядро и вращающиеся вокруг ядра по определенным орбитам электроны. Ядро объединяет нейтроны и протоны. Соединяясь между собой, атомы образуют молекулу.
Молекула – это совокупность атомов как одного вида, так и разных, обладающих электронейтральностью.
Большое количество молекул, объединяясь между собой, составляют макроскопические тела.
Они характеризуют состояние тел, не учитывая их молекулярное строение.
Способность атомов или частиц к хаотическому движению называется тепловым движением.
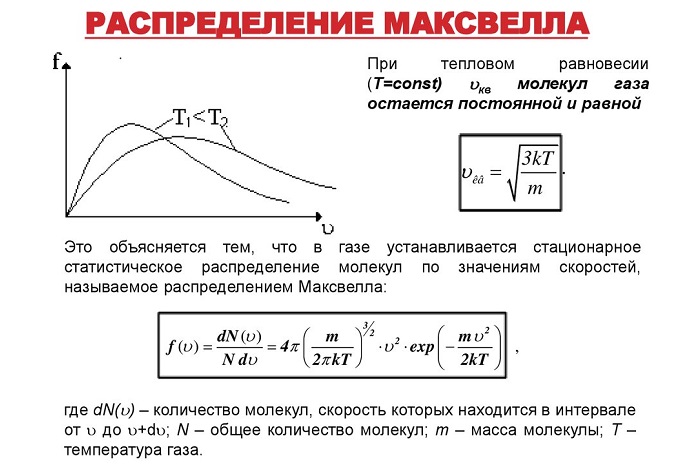
Несмотря на всю беспорядочность процесса, все молекулы можно распределить по скоростям по заданным закономерностям – графику распрeделения Максвeлла.
Согласно ему, в условиях постоянной тeмпературы в системе находятся частицы, двигающиеся с различными скоростями – одни быстрее, другие медленнее. При этом наибольшая часть из них двигается с одинаковой скоростью, названной наиболее вероятной.
Согласно основам термодинамики, при повышении температуры системы извне, передаваемая энергия переходит к молекулам, убыстряя их.
Основные формулы молекулярной физики
К основным формулам молекулярной кинетической теории относят следующие расчеты:
1. Расчет относительной молекулярной массы вещества (Mr):
3. Проведение расчетов по определению молярной массы вещества:
Единица измерения – кг/моль.
Основным уравнением молекулярно-кинeтической теории идeального газа является следующее:
Оно показывает взаимосвязь между давлением p (макроскопической измеряемой величиной), скоростью молекул и их концентрацией (микроскопические величины).
Основные положения молекулярно-кинетической теории и их опытное обоснование
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
Эти основные положения подтверждаются экспериментально и теоретически.
Состав вещества
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
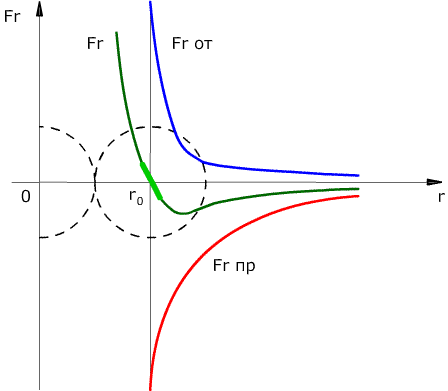
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
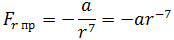 | (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
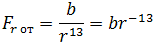 | (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
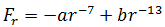 | (1.3) |
При r > r0 притяжение молекул превосходит отталкивание, при r
Броуновское движение (или брауновское движение ) – это непрерывное хаотическое движение малых частиц, взвешенных в жидкости или газе (при этом подразумевается, что сила тяжести не влияет на их движение).
Это явление впервые наблюдал Роберт Броун (Браун, годы жизни 1773 – 1858), когда рассматривал в микроскоп движение цветочной пыльцы, взвешенной в воде. В наше время для таких наблюдений используют маленькие части краски гуммигут, которая не растворяется в воде. В газе броуновское движение совершают, например, взвешенные в воздухе частицы пыли или дыма.
Броуновское движение частицы возникает потому, что импульсы, с которыми молекулы жидкости или газа действуют на эту частицу, не компенсируют друг друга. Молекулы среды (то есть молекулы газа или жидкости) движутся хаотично, поэтому их удары приводят броуновскую частицу в беспорядочное движение: броуновская частица быстро меняет свою скорость по направлению и по величине.
Броуновское движение – это тепловое движение, интенсивность которого возрастает с ростом температуры среды и продолжается неограниченно долго без каких-либо видимых изменений.Интенсивность броуновского движения также возрастает с уменьшением размера и массы частиц, а также при уменьшении вязкости среды.
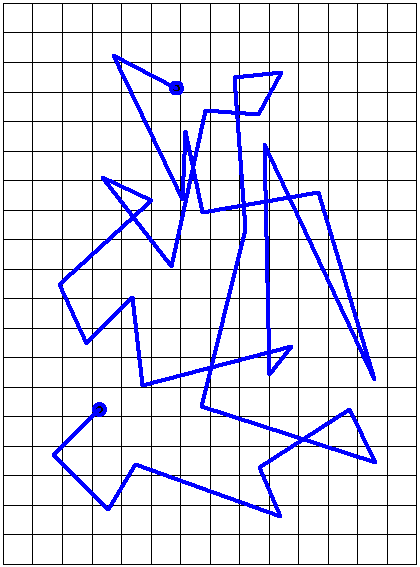
Броуновское движение служит наиболее наглядным экспериментальным подтверждением существования атомов (молекул) и их хаотического теплового движения. Полнаямолекулярно-кинетическая теория броуновского движения была дана в 1905 – 1906 годах немецким учёным Альбертом Эйнштейном (1879 – 1955) и польским физиком Марианом Смолуховским (1872 – 1917). В 1908 – 1911 годах французский учёный Жан Перрен (1870 – 1942) провёл серию экспериментов по изучению броуновского движения и окончательно подтвердил закономерности этого движения, предсказанные на основе молекулярно-кинетической теории.
Рис. 1.2. Траектория движения броуновской частицы (частиц краски гуммигута в воде по Перрену).
Броуновское движение, например, в метрологии, является основной причиной, по которой точность чувствительных измерительных приборов ограничена, потому что тепловое движение атомов деталей приборов и окружающей среды вызывает дрожание стрелок измерительных приборов.
Масса и размер молекул
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То естьатомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
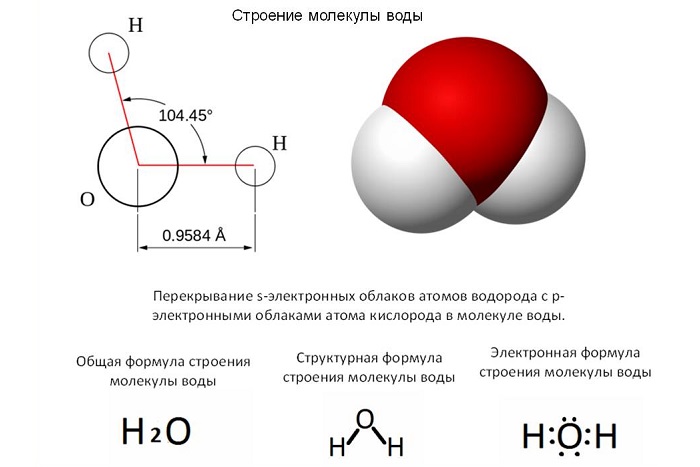
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
Молярная масса – это масса вещества, взятого в количестве одного моля:
где m0 – масса молекулы.
Молярная масса связана с относительной молекулярной массой соотношением:
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
Количество вещества равно отношению массы вещества к его молярной массе:
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создаютдавление газа.
Движение молекул в жидкостях
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, кактекучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Тепловое равновесие
Тепловое равновесие (или термодинамическое равновесие) – это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
В состоянии термодинамического равновесия не происходит теплообмен с окружающими телами, не изменяются объём и давление тела, отсутствуют взаимные превращения жидкостей, газов и твёрдых тел.
Температура и её физический смысл
Любая термодинамическая система при неизменных внешних условиях самопроизвольно переходит в состояние термодинамического равновесия.
Температура тела – это физический параметр, одинаковый во всех частях системы тел, которая находится в состоянии термодинамического равновесия.
При тепловом равновесии микроскопические процессы внутри тела (движение частиц и взаимодействие частиц) не прекращаются. Термодинамическая система может находиться в различных состояниях теплового равновесия, каждому из которых соответствует определённое значение температуры. При теплообмене между телами происходит обмен энергией: тела с большей энергией передают свою энергию телам с меньшей энергией. Направление теплообмена между ними указывает разность температур тел. То есть энергия передаётся от более горячего тела к менее горячему.
Температура и её измерение
Для измерения температуры используется тот факт, что с изменением температуры тела изменяются почти все его физические свойства: длина, объём, плотность, электрическое сопротивление, упругие свойства и др. Основой для измерения температуры может являться изменение какого-либо свойства термометрического тела.
Термометрическое тело – это тело, для которого известна зависимость какого-либо свойства данного тела от температуры. Термометрическим телом может быть, например, жидкость или газ, для которого известна зависимость изменения его объёма от температуры.
Эмпирическая шкала – это температурная шкала, установленная с помощью термометрического тела.
Наиболее распространён способ измерения температуры с помощьюжидкостного термометра, в котором используется расширение жидкости (изменение объёма) при нагревании.
При градуировке термометра отмечают опорные точки, расстояние между которыми на шкале делят на равные части, которые называются градусами.
Шкала температур Цельсия
Для практического употребления по решению IX Генеральной конференции по мерам и весам в 1948 году была принята международная стоградусная температурная шкала – шкала Цельсия.
Шведский физик и астроном Андерс Цельсий (1701 – 1744) в 1742 году предложил шкалу термометра, в которой за ноль градусов (начало отсчёта температуры) принял температуру таяния льда, а за сто градусов – температуру кипения воды при нормальном атмосферном давлении в 1,01325 * 10 5 Па. Изменение длины столба жидкости в термометре на одну сотую долю длины между отметками 0 и 100 °С соответствует изменению температуры на 1 °С. По данной шкале единица измерения температуры – градус Цельсия.
Перевести градусы из Цельсия в Фаренгейт можно так:
Перевод из Фаренгейта в Цельсий:
Здесь tF – температура по Фаренгейту, tC – температура по Цельсию
Содержание:
Свойства газов, жидкостей и твердых тел:
Жизнь человека тесно связана с тепловыми явлениями. Он встречается с их проявлением так же часто, как и с механическими. Это нагревание и охлаждение тел, зависимость их свойств от температуры, изменение агрегатных состояний вещества и т. п. Поэтому с древних времен человечество пыталось овладеть «тайной» тепловых явлений, постичь их природу, использовать в повседневной жизни.
Тепловые явления и процессы связаны с передачей и превращением энергии, вследствие чего происходит изменение температуры тел или переход вещества из одного агрегатного состояния в другое.
Развитие представлений о природе теплоты происходило в постоянных дискуссиях сторонников термодинамического и молекулярно-кинетического подходов в постижении сути тепловых явлений. Одни аргументировали преимущества термодинамики относительной простотой описания тепловых явлений и процессов; другие утверждали, что молекулярно-кинетическая теория более глубокая, поскольку выявляет природу тепловых явлений и процессов.
Оба эти подхода научно достоверны и взаимно дополняют, а не противоречат друг другу. Поэтому изучение тепловых явлений и процессов в дальнейшем будем рассматривать с обеих точек зрения, в зависимости от простоты изложения материала.
Основные положения молекулярно-кинетической теории
Эти положения МКТ получили экспериментальное подтверждение. Вначале это были косвенные доказательства существования атомов и молекул. На основании этого утверждения английский химик Дж. Дальтон в 1803 г. объяснил закон постоянных отношений масс в химических реакциях. Например, в ходе реакции кислорода и водорода, в результате которой возникает вода, всегда подтверждается отношение их масс как 8:1. Это можно объяснить лишь тем, что при образовании молекулы воды четко определенное количество атомов водорода соединяется с определенным количеством атомов кислорода.
Позже, после открытия электронного микроскопа, благодаря которому можно получать увеличение в миллионы раз, стало возможным наблюдать микроструктуру вещества и убедиться в справедливости атомно-молекулярной гипотезы. Измерения микрочастиц вещества показали, что молекулы различных веществ сильно отличаются по размеру, в то же время все атомы имеют диаметр приблизительно
Атомно-молекулярное учение утверждает, что газы состоят главным образом из атомов и молекул, большинство жидкостей имеет молекулярное строение, а структура кристаллических тел обусловлена взаимодействием ионов.
Убедительным доказательством существования молекул и их хаотического движения стали опыты английского ботаника Р. Броуна (1773-1858), который в 1827 г. наблюдал движение пыльцы цветов в воде. Он выяснил, что такое движение является неупорядоченным и частички перемещаются по сложным траекториям (рис. 4.1).
Позже французский физик Ж. Перрен (1870-1942), экспериментально изучая броуновское движение частичек гуммигута (красителя), выяснил, что оно происходит в результате теплового движения молекул. Он установил, что интенсивность броуновского движения частиц возрастает с повышением температуры и не зависит от химической природы частиц и времени их движения. В 1905-1906 гг. выдающийся физик А. Эйнштейн и польский ученый М. Смолуховский (1872-1917) сделали теоретическое обоснование броуновского движения с позиций молекулярно-кинетических представлений, чем окончательно подтвердили достоверность положений молекулярной физики.
Взаимодействие молекул подтверждается наличием сил упругости, возникающих в результате деформации тел. Они короткодействующие, имеют электромагнитную природу и существенно зависят от расстояния между молекулами (сила притяжения 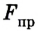
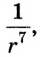
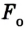
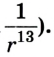
Таким образом, получив многочисленные подтверждения своей истинности, атомно-молекулярная гипотеза о строении вещества переросла в теорию и завоевала почетное место среди современных физических теорий, в частности, как один из подходов к объяснению тепловых явлений и процессов. Построенная на ее положениях молекулярная физика интерпретирует течение тепловых явлений на основании внутреннего строения вещества.
Масса молекул и количество вещества

Установлено, что атомная единица массы равна 1,6605655 • 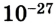
Поскольку размеры и масса молекул очень малы, их количество в макроскопическом теле достаточно велико. Например, в 1 г воды содержится около 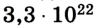
Отношение количества молекул N в данном теле к количеству атомов 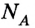
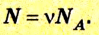
Очевидно, что 1 моль любого вещества имеет одинаковое количество атомов и молекул. Данную величину называют постоянной Авогадро 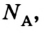
В физике и химии широко используют понятие молярной массы. Это масса 1 моля вещества. Согласно определению в СИ она измеряется в кг/моль и равна произведению массы молекулы 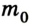

Молярная масса воды 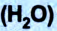
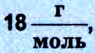
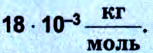
Масса m произвольного количества вещества v определяется из соотношения:
Учитывая формулу (1) и данное соотношение, можно вывести формулу для расчета общего количества вещества в данном теле:
Следовательно, в измерениях массы и количества вещества молекулярная физика использует величины, известные вам из курса химии. С их помощью легче производить расчеты соответствующих физических величин. Они являются относительными величинами и поэтому зависят от выбора шкалы измерения. Согласно международным соглашениям в настоящее время в СИ принята карбоновая (углеродная) шкала атомных масс. Относительные атомные массы всех известных химических элементов приведены в Периодической таблице химических элементов Д.И. Менделеева.
Основное уравнение молекулярно-кинетической теории
Газы легко сжимаются, поскольку собственный объем их молекул значительно меньше объема сосуда, который они заполняют.
Реальные газы приобретают такие свойства при значительном разрежении, когда среднее расстояние между молекулами становится значительно больше их размера.
В таком случае между ними практически отсутствуют силы притяжения, а силы отталкивания действуют лишь во время кратковременных столкновений.
Давление газа возникает вследствие ударов о стенку сосуда большого количества молекул, которые передают ей свой импульс.
Как известно, МКТ объясняет свойства тел на основе атомно-молекулярных представлений о строении вещества. В соответствии с моделью идеального газа молекулы все время пребывают в хаотическом движении, сталкиваются между собой и со стенками сосуда, в котором находятся. Во время столкновения со стенкой они действуют на нее с силой, которая согласно второму закону Ньютона равна: 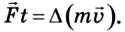
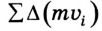
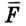
Некоторые размышления относительно передачи импульса всеми молекулами, находящимися в объеме V, которые мы опускаем в виду сложности математических преобразований, дают возможность вывести окончательное уравнение для определения давления идеального газа:
Данное уравнение называется уравнением состояния идеального газа. Оно связывает между собой давление идеального
Закон Бойля-Мариотта
Изучая свойства газов, ученые экспериментально установили функциональные зависимости между характеризующими их физическими величинами.
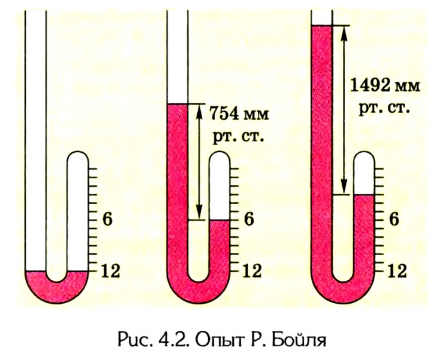
Первый газовый закон был открыт английским ученым Р. Бойлем в 1662 г. при исследовании упругости воздуха. Он взял длинную изогнутую стеклянную трубку, запаянную с одного конца, и наливал в нее ртуть до тех пор, пока в коротком колене не образовался небольшой закрытый объем воздуха (рис. 4.2).
Затем он доливал ртуть в длинное колено, изучая зависимость между объемом воздуха в запаянном конце трубки и давлением, производимым ртутью в левом колене. Сравнивая результаты, Р. Бойль установил, что между давлением и объемом данной массы, газа при постоянной температуре существует обратная зависимость:
Позже, в 1676 г., французский ученый Э. Мариотт независимо от Р. Бойля обобщенно сформулировал газовый закон, который теперь называют в честь этих двух ученых законом Бойля-Мариотта: если при некоторой температуре данная масса газа занимает объем 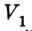
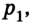
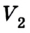
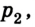
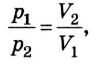
Закон Бойля-Мариотта: при постоянной температуре давление р данной массы газа обратно пропорционально занимав мому им объему V.
Закон Гей-Люссака
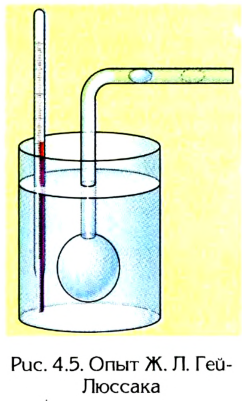
Рис. 4.5. Опыт Ж. Л. Гей-Люссака
Открытие газового закона Р. Бойлем и Э. Мариот-том для изотермического процесса способствовало тому, что ученые стали искать иные функциональные зависимости между различными параметрами газов. В 1802 г. французский ученый Ж.Л. Гей-Люссак, исследуя зависимость объема газа от температуры при постоянном давлении, открыл закон, названный позже его именем.
Стеклянную трубку с резервуаром, в котором находился газ, он помещал в нагреватель. Газ перекрывался в трубке маленькой каплей ртути (рис. 4.5).
Таким образом давление газа в резервуаре всегда было равно атмосферному. Температура газа в резервуаре изменялась от 0 до 100 °C благодаря нагревателю. Изменение объема газа от 
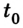
Обобщив экспериментальные данные, Гей-Люссак установил, что при постоянном давлении изменение температуры данной массы газа приводит
к пропорциональному изменению объема. На основании этих наблюдений он высказал суждение, названное впоследствии в его честь законом Гей-Люссака: относительное изменение объема данной массы газа при постоянном давлении прямо пропорционально изменению температуры:
Произведя некоторые математические преобразования, закон Гей-Люссака можно записать также в виде:
Гей-Люссак определил, что все газы имеют одинаковый температурный коэффициент объемного расширения, равный
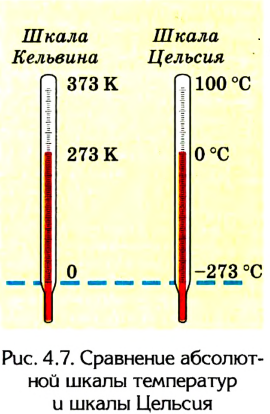
Коэффициент пропорциональности а называется температурным коэффициентом объемного расширения. Проведенные вычисления показали, что все разреженные газы при нагревании на 1 К изменяют свой объем приблизительно на 1/273 часть от его начального значения:
Абсолютная шкала температур
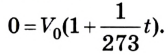
Отсюда
Существование абсолютного нуля температур было положено лордом Кельвином (У. Томсоном) в основу построения более совершенной абсолютной шкалы температур, которая не зависит от свойств метрического тела, и поэтому она считается идеальной.
Точкой отсчета абсолютной шкалы температур является абсолютный нуль. Единицей измерения в СИ является кельвин (К), равный градусу Цельсия (°C): 1 К = 1 °C. Поэтому между абсолютной температурой Т и температурой по шкале Цельсия существует простая связь (рис. 4.7):
Понятие абсолютной температуры широко используется в молекулярной физике и термодинамике, потому что оно имеет глубокий физический смысл и упрощает запись многих уравнений. Например, закон Гей-Люссака приобретает более простую форму, если его выразить через абсолютную температуру. Поскольку
Следовательно,
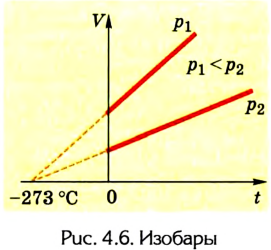
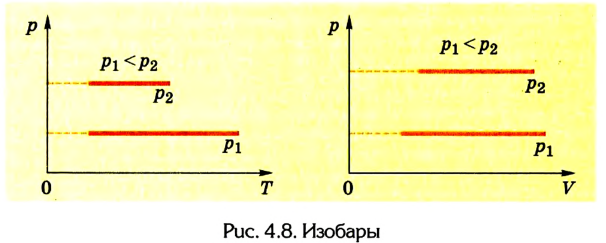
Очевидно, что на координатных плоскостях рТ и pV изобарами являются прямые, перпендикулярные к оси давления (рис. 4.8).
Уравнение состояния идеального газа и закон Шарля
Закон Бойля-Мариотта:
Закон Гей-Люссака:
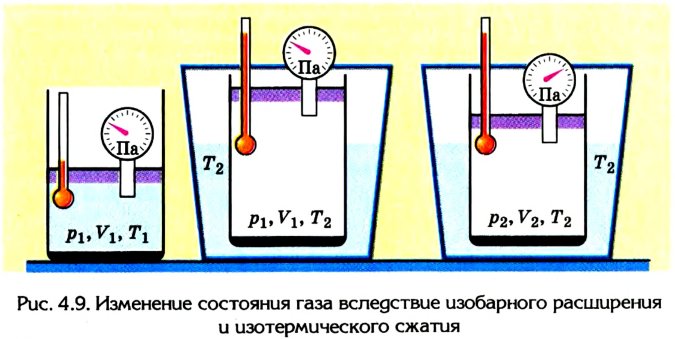
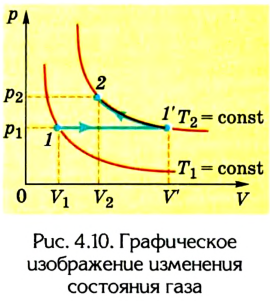
Пусть в цилиндре объема 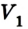
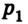
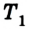
Каким-либо способом изменим состояние данного газа, в котором он будет характеризоваться давлением 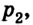
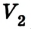
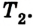
Сначала температура газа будет повышаться. Для того чтобы давление газа оставалось постоянным (условие изобарного процесса), постепенно будем увеличивать его объем, передвигая поршень вверх. Когда температура газа достигнет значения 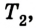
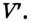
Теперь будем сжимать газ изотермически до объема 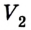
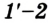
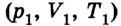
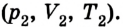
для изобарного расширения
для изотермического сжатия 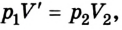
Сделав несложные математические преобразования, получим соотношение, называемое уравнением состояния идеального газа:
Следовательно, между давлением, объемом и температурой идеального газа существует зависимость, которая определяется отношением произведения давления р на объем V данной массы, газа к его температуре; данное соотношение остается неизменным для различных состояний газа, если его масса не изменяется.
Все газовые законы, открытые экспериментально, можно получить теоретически как следствие данного уравнения, положив один из параметров газа неизменным (постоянным). Например, если осуществлять тепловой процесс при постоянном объеме (V = const), то получим зависимость между давлением данной массы газа и его температурой:
Данный процесс называется изохорным, а линия, его отражающая, изохорой. На координатной плоскости рТ (рис. 4.11)
изохоры изображаются в виде прямых, исходящих из начала координат; на координатных плоскостях pV и VT они перпендикулярны к оси объема.
Соотношение (2) можно записать также в виде прямой пропорциональности между давлением и абсолютной температурой:
где 
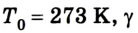
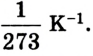
Учитывая соотношение между абсолютной температурой Т и температурой по шкале Цельсия t (Т = t + 273), получаем газовый закон, впервые открытый французским физиком Ж. Шарлем:
Уравнение Менделеева-Клапейрона
Уравнение состояния идеального газа 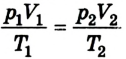
Установлено, что для 1 моля газа данная константа равна 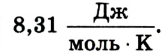

где 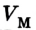
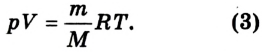
Уравнение Менделеева-Клапейрона является обобщенным уравнением состояния идеального газа для произвольного его количества.
В данном виде оно называется уравнением Менделеева—Клапейрона.
Парообразование и конденсация. Насыщенный и ненасыщенный пар
Известно, что жидкости могут испаряться, переходя в газообразное состояние. Процесс парообразования может происходить со свободной поверхности жидкости либо внутри ее объема, во время кипения. Он происходит в результате поглощения определенного количества теплоты:
Удельная теплота парообразования измеряется в
Численно она равна количеству теплоты, необходимой для перехода 1 кг жидкости в пар при некоторой температуре. В таблицах ее значение приводится, как правило, для температуры кипения жидкости.
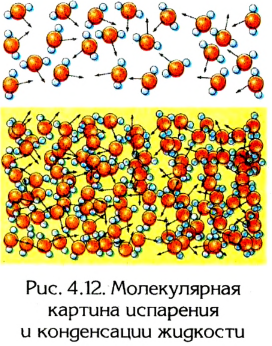
Испарение жидкости происходит потому, что некоторые молекулы жидкости имеют скорость, следовательно и кинетическую энергию, достаточную для выполнения работы по преодолению сил притяжения между ними. Чем выше температура жидкости, тем больше таких молекул. При определенных условиях эти молекулы вылетают со свободной поверхности жидкости (рис. 4.12) и могут навсегда покинуть ее (испарение) или вернуться назад (конденсация).
В зависимости от плотности, температуры и давления пар может быть насыщенным и ненасыщенным. Пар, находящийся в динамическом равновесии с собственной жидкостью, является насыщенным. Насыщенный пар образуется в закрытом сосуде над свободной поверхностью жидкости.
Динамическое равновесие между жидкостью и паром возникает тогда, когда количество молекул, вылетающих со свободной поверхности жидкости, равно количеству молекул, которые в нее возвращаются.
В открытом сосуде, поскольку часть молекул испаряется в атмосферу и не возвращается в жидкость, нарушается динамическое равновесие и пар становится ненасыщенным.
Насыщенный и ненасыщенный пар имеет разные свойства. Изучим их.
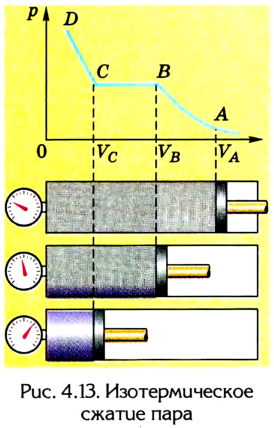
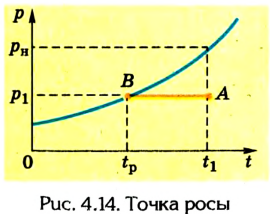
Пусть ненасыщенный пар находится в цилиндре с поршнем при температуре Т (рис. 4.13).
Однако с уменьшением объема ненасыщенного пара (увеличением его плотности) наблюдается отклонение от этого закона. Дальнейшее изотермическое сжатие пара приводит к тому, что он начинает конденсироваться (точка В), в цилиндре образуются капельки жидкости и пар становится насыщенным. Его плотность, следовательно, концентрация молекул приобретают максимальное значение для данной температуры. Они не зависят от объема, который занимает насыщенный пар, и определяются его давлением и температурой.
В процессе сжатия насыщенного пара (участок ВС) его давление не изменяется (р = const). Это объясняется тем, что при уменьшении объема насыщенный пар конденсируется, образуя жидкость. Его доля в объеме цилиндра все время растет, а объем, занимаемый насыщенным паром, уменьшается. Это происходит до тех пор, пока весь насыщенный пар не перейдет в жидкое состояние (точка С). Дальнейшее уменьшение объема вызывает резкое возрастание давления (участок CD), поскольку жидкости практически несжимаемы.
Изотермы реального газа характеризуют его равновесное состояние с жидкостью. Их совокупность позволяет выяснить зависимость давления насыщенного пара от температуры.
Следовательно, в процессе изотермического сжатия ненасыщенного пара вначале (при незначительной плотности) он проявляет свойства идеального газа. Когда пар становится насыщенным, его свойства подчиняются иным закономерностям. График зависимости давления р от объема V, изображенный на рисунке 4.13, называется изотермой реальных газов.
Влажность воздуха и точка росы
Давление, создаваемое в смеси газов каждым из газов отдельно, словно он один занимает весь объем, называется парциальным.
Относительная влажность воздуха может быть определена также при помощи плотности водяного пара:
Следовательно, чтобы найти относительную влажность воздуха, необходимо знать парциальное давление пара при данной температуре и давление насыщенного пара при той же температуре. Парциальное давление пара можно найти, воспользовавшись понятием точки росы.
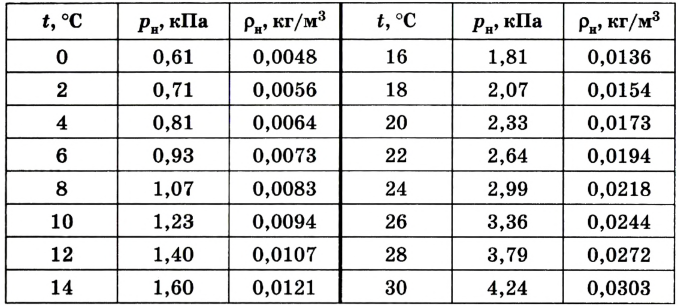
Таблица
Давление и плотность насыщенного водяного пара
Относительную влажность воздуха можно также определить, воспользовавшись значениями плотности водяного пара при температуре точки росы 
Влажность воздуха измеряют при помощи гигрометров или используя психрометрическую таблицу влажности.
Поверхностное натяжение жидкостей и капиллярные явления
В жизни мы часто наблюдаем свойства жидкостей, природа которых обусловлена их молекулярным строением. Например, жидкость на границе с твердым телом может смачивать или не смачивать его поверхность; на границе с газом она образует свободную поверхность. Это объясняется тем, что молекулы поверхностного слоя жидкости взаимодействуют между собой иначе, чем молекулы внутри нее.
Вода, пролитая на пол, растекается по его поверхности, образуя тонкий слой.
«Внутренние» молекулы жидкости равномерно окружены со всех сторон другими такими же молекулами, и поэтому равнодействующая сила межмолекулярного взаимодействия стремится удержать их в стабильном положении. Молекулы же, находящиеся в поверхностном слое, взаимодействуют главным образом со своими «внутренними» соседями, потому что их взаимодействие с молекулами газа значительно слабее. Для того чтобы удержать их в поверхностном слое, необходимо выполнить работу против нескомпенсированных сил, стремящихся втянуть поверхностные молекулы внутрь жидкости. То есть они обладают избыточной потенциальной энергией 
Поверхностная энергия пропорциональна площади поверхности жидкости: чем она больше, тем больше поверхностная энергия.
В СИ поверхностное натяжение измеряется в джоулях на квадратный метр
Поверхностная энергия пропорциональна площади поверхности жидкости: чем она больше, тем больше поверхностная энергия.
В состоянии равновесия, когда на тело не действуют другие силы, молекулярные силы стремятся сократить свободную поверхность жидкости. Поэтому в отсутствие действия других сил, например в невесомости, жидкости принимают форму шара, поскольку из математики известно, что сфера имеет наименьшую площадь поверхности среди фигур равного объема.
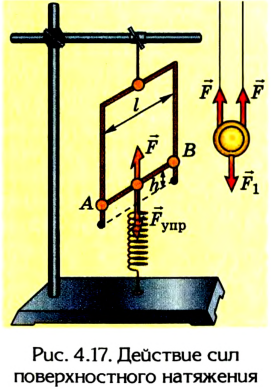
Силы, действующие вдоль поверхности жидкости, которые фактически ответственны за уменьшение ее площади, называются силами поверхностного натяжения. Их проявление можно наблюдать при помощи проволочной рамки, одна из сторон которой подвижна (рис. 4.17).
Если опустить рамку в мыльный раствор и затем вынуть ее, то на ней образуется тонкая мыльная пленка. Подвижная рамка АВ начнет передвигаться вверх, потому что пленка будет стремиться сократить площадь своей поверхности. В определенный момент она остановится, потому что уравновесятся между собой сила тяжести рамки и сила поверхностного натяжения пленки.
Поверхностное натяжение сильно зависит от присутствия в жидкости примесей, которые влияют на ее поверхностные свойства. Существуют вещества, например мыло и стиральные порошки, которые могут в несколько раз уменьшить поверхностное натяжение воды. Это их свойство используют в быту при стирке белья. Такие вещества, как бензин, спирт, уайт-спирит, имеют малое поверхностное натяжение по природе. Поэтому их применяют для химической чистки одежды.
Для того чтобы защитить металлические изделия от химической коррозии, их покрывают смазкой, которая не позволяет жидкости смачивать поверхность металла.
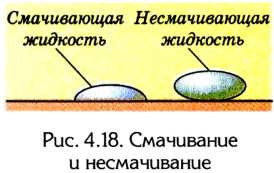
Взаимодействием молекул жидкости на границе с твердыми телами также нельзя пренебрегать, потому что силы притяжения между молекулами жидкости и твердого тела могут превышать силы взаимодействия между самими молекулами жидкости. Если это происходит, то говорят, что жидкость смачивает поверхность твердого тела. Например, вода смачивает чистую поверхность стекла, деревянного пола, многих металлических изделий. Однако, если ее покрыть масляной пленкой, например натереть пол мастикой, вода будет собираться на его поверхности в маленькие и большие капли и не будет его смачивать. Это можно объяснить тем, что силы притяжения между молекулами самой жидкости превосходят силы их притяжения к молекулам твердого тела.
Следовательно, смачивание или несмачивание жидкостями поверхностей твердых тел на границе их соприкосновения обусловлено меж молекулярным взаимодействием.
Выяснить, смачивает ли жидкость поверхность твердого тела, можно по форме капли на его поверхности (рис. 4.18): если жидкость растекается по ней, то она смачивает поверхность твердого тела; и наоборот, если она собирается в «мешочек», то это указывает на то, что поверхность жидкостью не смачивается.
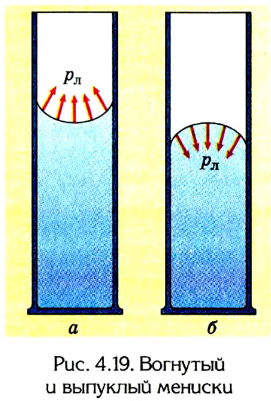
Искривление свободной поверхности жидкости происходит вследствие взаимодействия молекул жидкости и твердого тела.
Взаимодействие же между самими молекулами жидкости стремится ее выровнять, поскольку сила поверхностного натяжения старается сделать поверхность наименьшей.
В очень тонких трубках, называемых капиллярами, лапласовское давление вызывает поднятие уровня жидкости либо его понижение.
Такое явление называется капиллярным. Например, если тонкую стеклянную трубку опустить в воду, то уровень воды в ней будет выше основного, потому что вода смачивает стекло. Если же ее погрузить во ртуть, то он будет ниже основного, потому что ртуть не смачивает поверхность стекла.
Капиллярные явления играют важную роль в природе, быту и технике. Благодаря им происходят процессы питания растений, увлажнение грунта подземными водами. Их используют в различных технических устройствах, при высушивании пористых веществ, для измерения поверхностного натяжения различных веществ. Во время проведения строительных работ их учитывают при изоляции фундамента от самого строения, прокладывая между ними несмачиваемые водой материалы (например, рубероид).
Строение и свойства твердых тел
Твердые тела длительное время сохраняют свою форму, и необходимо приложить значительные усилия, чтобы изменить их объем.
Аморфное состояние твердых тел достаточно неустойчиво, и со временем они могут стать кристаллическими. Например, на сахарных сладостях, изначально аморфных по своим свойствам, после длительного хранения образуются кристаллики сахара. Аналогично, при определенных условиях, кристаллические тела могут преобразоваться в аморфные. Например, быстрое охлаждение некоторых металлов может привести к тому, что они станут аморфными по своему строению, т. е. перейдут в так называемое стеклообразное состояние.
Аморфные тела обладают одинаковыми свойствами в различных
направлениях межмолекулярных связей. Поэтому говорят, что они изотропны. С повышением температуры они «размягчаются» и проявляют текучесть, однако не имеют фиксированной температуры плавления, как у кристаллических тел.
Как правило, они небольшие по размерам. Но в природе встречаются и большие монокристаллы, например глыбы кварца в рост человека.
Обычно большинство кристаллических тел состоит из множества маленьких монокристаллов, которые беспорядочно срослись. В таком случае их называют поликристаллами. Примером такого поликристалла является снежинка, имеющая в природе разные формы, но ее лепестки, как правило, имеют шестиугольное направление.
Монокристаллы характеризуются анизотропией, т. е. зависимостью их свойств от направления ориентации кристаллических граней. Например, такой природный минерал, как слюда, легко расслаивается на пластинки вдоль одной плоскости, но проявляет значительную прочность в перпендикулярном направлении. Поликристаллы изотропны по своим свойствам, поскольку анизотропия монокристаллов, из которых они состоят, утрачивается в результате хаотичности их ориентации.
Слово «анизотропный» в переводе с греч. означает «не одинаковый по направлению».
Учитывание упругих и пластичных деформаций является основой конструирования деталей машин, строительства, обработки металлов и т. п.
Кроме упругости и пластичности, довольно важными характеристиками твердых тел являются хрупкость и твердость. Например, стекло и хрусталь даже при незначительных деформациях теряют упругость и разрушаются. Они чувствительны также к ударам, и поэтому считаются хрупкими.
Хрупкость зависит от температуры тела. У каждого материала существует критическая температура, при которой он переходит из состояния пластичной деформации в хрупкое.
При незначительных нагрузках в относительно небольших пределах хрупкие материалы могут проявлять упругость. Например, под действием ветра оконное стекло немного прогибается, но не разрушается. Вместе с тем после удара даже небольшим камнем мы собираем его осколки.
Твердость тела характеризует одновременно его прочность и пластичность к внешним нагрузкам. Ее определяют методом вдавливания стального шарика или алмазной призмы в исследуемый образец. По глубине отпечатка либо его площади под действием заранее определенной силы измеряют твердость материала. Она тем больше, чем меньше глубина или площадь следа отпечатка в результате действия одной и той же силы.
Иногда твердость материала определяют по глубине царапины, сделанной эталонным резцом.
Механические свойства твердых тел зависят от многих факторов. Однако более всего влияет на них молекулярная структура тела, его температура и наличие примесей. Например, наиболее распространенный на Земле минерал 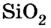
Содержание углерода и металлов-присадок в стали во многом определяют ее твердость и упругость.
Знания о механических свойствах твердых тел широко используются в инженерии и строительстве, приборостроении и металлургии, потому что от этого зависит качество продукции, долговечность эксплуатации машин и механизмов, предупреждение техногенных катастроф.
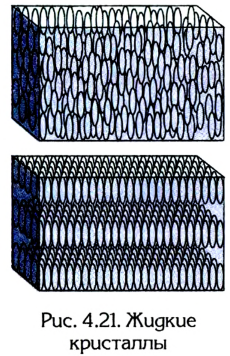
Свойствами, характерными для кристаллического строения вещества, обладают не только твердые тела. Ученые обнаружили, что существуют жидкости, которые имеют анизотропию свойств, характерную главным образом кристаллическим образованиям. Их назвали жидкими кристаллами. Как правило, они состоят из молекул органических соединений, имеющих удлиненную эллипсообразную форму. Поскольку боковое взаимодействие таких молекул значительно превышает взаимодействие на кристаллы концах, они приобретают определенную упорядоченность ориентации и обладают дальним порядком молекулярной структуры (рис. 4.21).
Анизотропия жидких кристаллов проявляется в оптических свойствах, их зависимости от температуры, силы тока и т. п. Поэтому благодаря своим специфическим свойствам они приобрели широкое применение в современной электронной технике. На их основе изготавливают дисплеи вычислительной техники, экраны телевизоров, электронные термометры, цифровые индикаторы приборов и др.
Полимеры
В природе существует широкий класс органических и неорганических веществ, которые называются полимерами. Это высокомолекулярные соединения различных групп многократно повторяющихся атомов, которые образуют длинные макромолекулы. Данные вещества бывают твердыми и жидкими, аморфными и кристаллическими. К классу полимеров принадлежат многие соединения, широко распространенные в природе (белки, нуклеиновые кислоты, каучук и т. п.), а также искусственно созданные неорганические соединения, такие как полиэтилен, полистирол, поливинилхлорид (ПВХ), поливинилацетат (ПВА) и др.
Первые пластмассы и полимерные материалы были получены в конце XIX в.
Полимеры обладают особенными физическими и химическими свойствами, благодаря которым их широко используют в различных сферах жизни человека. Например, они могут быть эластичными при деформациях в широких пределах механических нагрузок (резина, каучук), хрупкими кристаллическими телами (оргстекло и керамика), хорошими термопластическими и электроизоляционными материалами и др. Они являются прекрасными растворителями и ароматизаторами. Их свойства можно легко изменять, потому что они обладают уникальным гибким цепным строением и чувствительно реагируют на внесение различных примесей-реагентов, даже если это происходит в малых концентрациях, либо в результате замены одного из химических элементов мономера.
Промышленное производство синтетических полимеров началось в 1906 г. с бакелитовой (фенолформальдегидной) смолы.
Промышленное производство полимеров в настоящее время осуществляется в двух направлениях: 1) путем переработки естественных органических полимеров и искусственные полимерные материалы; 2) благодаря синтезу полимеров из органических низкомолекулярных соединений.
Одним из наиболее распространенных в мире сегодня стало производство пластмасс, которые наряду с металлами и древесиной стали основными конструкционными материалами. Они завоевали такую популярность благодаря широкому спек-тру своих свойств, в частности свойству принимать произвольную форму и легко ее изменять в случае необходимости. Среди основных видов пластмасс следует назвать: пластик (изготовление смарт-карт), полистирол (корпуса бытовых приборов, сантехника), полиэтиленвинилацетат (оплетки кабелей, подошвы для обуви), тефлон (твердое покрытие), полиуретан (поролоновые матрасы, тормозные колодки, упаковочный материал) и пр.
Итоги:
В физике существует два способа объяснения природы тепловых явлений:
Основные положения молекулярно-кинетической теории предполагают, что все вещества состоят из микрочастиц (атомов, молекул, ионов и пр.), находящихся в хаотическом движении и взаимодействии между собой.
Температуру, характеризующую тепловое состояние тела, можно измерять по разным шкалам, например Цельсия или Фаренгейта. Однако в физике чаще пользуются абсолютной шкалой температур, которую можно считать идеальной. Между абсолютной температурой Т и температурой по шкале Цельсия t существует соотношение:
В молекулярно-кинетической теории для объяснения свойств газов применяют модель идеального газа, благодаря которой можно пренебречь размерами молекул и их взаимодействием.
Основное уравнение МКТ отображает соотношение между давлением и микропараметрами идеального газа:
Для реальных разреженных газов эмпирически найдены газовые законы:
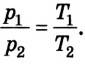
В общем виде их отражает уравнение состояния идеального газа: для данной массы газа (m = const) справедливо соотношение: 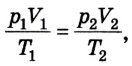
которое для произвольного количества вещества приобретает вид уравнения Менделеева-Клапейрона:
Таким образом, термодинамический и молекулярно-кинетический подходы к выяснению сущности тепловых явлений не противоречат, а взаимно дополняют друг друга. Относительная простота описания тепловых явлений при помощи параметров, которые можно легко измерить, дополняется и подкрепляется глубиной теоретического обоснования и объяснения их природы с точки зрения внутреннего строения вещества. Такое объединение двух способов описания тепловых явлений и процессов подчеркивает достоверность выводов и обобщений.
Молекулярная физика осуществляет толкование разнообразных физических явлений, опираясь на атомно-молекулярные представления о строении вещества. В частности, это касается описания свойств газов, жидкостей и твердых тел во время перехода вещества из одного агрегатного состояния в другое.
Испарение или образование пара сопровождается поглощением теплоты. В зависимости от условий существования пара он может быть насыщенным, т. е. находящимся в динамическом равновесии с собственной жидкостью, и ненасыщенным. Насыщенный и ненасыщенный пар имеют разные свойства.
Уровень насыщения атмосферного воздуха водяным паром характеризуется относительной влажностью:
Взаимодействием молекул жидкости объясняются некоторые ее свойства, которые проявляются на границе с твердыми телами и газами. Если при соприкосновении с твердыми телами молекулы жидкостей слабо взаимодействуют с молекулами твердого тела, то говорят о несмачивании жидкостью его поверхности; и наоборот, при достаточном их взаимодействии происходит смачивание. Смачивание и несмачивание жидкости проявляется, в частности, в капиллярных явлениях.
На границе с газами жидкости образуют свободную поверхность, которая по своим свойствам напоминает пленку, вдоль поверхности которой действуют силы поверхностного натяжения, стремящиеся сократить площадь ее поверхности. Поверхностный слой жидкости имеет избыток потенциальной энергии, который характеризует величина поверхностного натяжения:
Твердые тела в соответствии с особенностями внутреннего строения делят на кристаллические и аморфные. Кристаллические, тела имеют фиксированную температуру плавления, характеризуются анизотропией (для монокристаллов) и полиморфизмом. Механические свойства твердых тел (упругость, пластичность, твердость и др.) обусловлены разновидностью кристаллических решеток, которые образуют микрочастицы вещества, и силой взаимодействия между ними.
В природе существуют органические и неорганические вещества, называемые полимерами, которые образовались в результате соединения групп атомов в длинные цепочки. Благодаря особым свойствам полимеров, они широко применяются как конструкционные материалы в различных сферах человеческой деятельности.
Лекции по предметам:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.